introduktion
Posterior reversible encephalopathy syndrome (PRES), først beskrevet af Hinchey et al. i 1996 repræsenterer en neurologisk lidelse med varieret klinisk præsentation og typiske billeddannelsesresultater af parieto-occipital overvejende mønster af vasogent ødem (1, 2). Der er adskillige dokumenterede årsager til PRES, med tilfælde, der først er beskrevet i indstillingen af forhøjet arterielt tryk., Eksempler på kliniske scenarier, hvor PRES kan ses, inkluderer: hypertensiv nødsituation, (præ) eklampsi, nyresygdom, autoimmune lidelser og cytotoksiske medicin, blandt andre (3, 4) (tabel 1). PRES kan forekomme i enhver aldersgruppe og har en højere forekomst hos kvindelige patienter (7, 8). Selvom den nuværende litteratur er relativt sparsom sammenlignet med voksne populationer, skal der især nævnes PRES hos den pædiatriske patient., Pædiatriske patienter har en lignende klinisk præsentation som den voksne befolkning, hvor hypertension, anfald og ændret mental status er almindelige sygdoms manifestationer (9). På trods af de fleste tilfælde af pædiatrisk PRES, der rapporteres hos onkologiske patienter, især post-stamcelletransplantationspatienter (10, 11), en undersøgelse af Gupta et al. (12) fandt, at nyresygdom måske var den mest almindelige årsag til PRES hos den pædiatriske patient. I deres undersøgelse havde pædiatriske patienter en tendens til at have mere atypiske billeddannelsesfund (62, 5%), inklusive frontal lobeinddragelse (56%).,
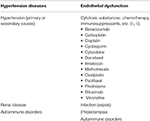
Tabel 1. Større sygdomstilstande forbundet med PRES.
Kliniske manifestationer er akut til subakut og spænder fra hovedpine og synsforstyrrelser til ændrede niveauer af bevidsthed og beslaglæggelse, i mere alvorlige tilfælde (1). Behandlingen er generelt rettet mod at målrette den underliggende årsag med generelt reversible symptomer og billeddannelsesfund i de fleste tilfælde (8)., Selvom resultaterne generelt er gunstige med korrekt styring, har dårlige kliniske resultater været forbundet med allerede eksisterende diabetes mellitus og involvering af corpus callosum; imidlertid mangler andre pålidelige billeddannelsesbiomarkører til prognosticering i øjeblikket (13). Neuroradiologisk billeddannelse spiller en grundlæggende rolle i diagnosen PRES med de typiske billeddannelsesfunktioner, der bedst værdsættes på magnetisk resonansafbildning (MRI) (2).
Patofysiologi
den præcise patofysiologiske mekanisme(r) bag PRES er endnu ikke fuldt ud belyst og forbliver kontroversiel (3)., Der er i øjeblikket to store foreslåede mekanismer til patofysiologi af PRES (Figur 1). Den første teori foreslår øget arterielt tryk som den primære faktor (8). Hurtige stigninger i blodtrykket til sidst overvinde autoregulatoriske kapaciteter af cerebral vaskulatur forårsager vaskulær lækage og resulterende vasogen ødem (14). Der er eventuel blod-hjerne-barriere (BBB) dysfunktion med proteiner, der passerer gennem det stramme kryds (15)., De områder, der er leveret af den posteriore cirkulation (vertebrale arterier, basilaris arterie, og posterior cerebrale arterier) er på ekstraordinær risiko i forhold til den anteriore cirkulation (interne carotis arterier, midt cerebrale arterier, og anterior cerebrale arterier) på grund af den manglende sympatisk tone af basilar arterie vaskulaturen (8)., En relateret teori foreslået af nogle postulerer, at ekstrem hypertension resulterer i vasospasme og lokal iskæmi, der forårsager BBB-nedbrydning og resulterende vasogent ødem, som det blev observeret hos patienter, der blev behandlet med immunsuppressive midler cyclosporin A og FK-506 (16). Forstyrrelsen i BBB forårsager de typiske fund af vasogent ødem vs. cytotoksisk ødem (som kan ses ved indstillingen af akut infarkt og repræsenterer øget intracellulært vandindhold på grund af tab af den sædvanlige osmotiske gradient i indstillingen af celledød (17).,
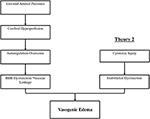
Figur 1. To hovedteorier om præs ‘ patofysiologi. Teori 1 er den hypertensive og cerebrale hyperperfusionsteori og teori 2 er endotel dysfunktionsteorien.
Den anden store teori omhandler det faktum, at op til 30% af patienter med PRES ikke viser forhøjet arterielt tryk, der er nødvendige for at overskride autoregulatory kontrol af cerebrale kar (18, 19)., Denne teori foreslår, at endotel dysfunktion er den primære skyldige, som kan være forårsaget af forskellige endogene eller eksogene toksiner (20). Denne teori kan forklare resultaterne af PRES set hos patienter, der fik immunsuppressive lægemidler og / eller kemoterapi, og også de patienter med sepsis (21, 22). I denne model forårsager cirkulerende toksiner vaskulær skade med resulterende udvikling af vasogent ødem. Endotelskaden forårsager yderligere frigivelse af vasokonstriktive og immunogene midler, hvilket kan forårsage vasospasme og/eller øget vaskulær permeabilitet., I sidste ende er endotel dysfunktion, der giver mulighed for vaskulær lækage og vasogen ødem, den drivende faktor bag PRES, uanset den primære cerebrale vaskulatur abnormitet (i tilfælde af arteriel hypertension) eller sekundær til cirkulerende toksiner. Et resum.af disse to teorier samt en liste over tidligere rapporterede kemoterapeutika og andre immunsuppressiva er vist i figur 2.
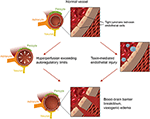
Figur 2. Illustration af de to store teorier om den underliggende patofysiologi af PRES., Anerkendelse: med tilladelse fra Caroline O ” Driscoll, MA (hun illustrerede dette alene og er ansat på vores universitet).
kliniske manifestationer afhænger af hjernens involverede region(er); præsentationen kan således være bred. For eksempel kan primær involvering af de occipitale lobes resultere i synsforstyrrelser/hallucinationer. Fokale neurologiske underskud svarende til placeringen af fokale læsioner forekommer hos ~5-15% af patienterne med PRES (23)., Sjældent kan rygmarvsinddragelse resultere i kliniske tegn og symptomer på myelopati eller lammelse (24).
billeddannelse
Som navnet antyder, manifesterer PRES typisk på billeddannelsesundersøgelser som posterior-overvejende vasogent ødem med hvidt stof. De parietale og occipitale lobes er næsten universelt involveret, og fund er typisk symmetriske og bilaterale (1). Involvering af frontalloberne, især ved siden af den overlegne frontale sulci, ses også ofte., Vasogent ødem, selvom det kan involvere det cerebrale grå Stof, værdsættes ofte lettere i det subkortiske hvide stof. CT-undersøgelse er ofte den indledende billeddannelsestest ved indstilling af akutte neurologiske symptomer og kan demonstrere hypoattenuering af hvidt stof i berørte regioner (25) (figur 3: CT af PRES). Samlet set er fund bedst afbildet af MR, der udviser øget følsomhed og bedre anatomisk karakterisering sammenlignet med CT (26). Derudover kan MR hjælpe med at skelne andre patologiske tilstande, der kan manifestere klinisk på samme måde som PRES., Det T2-vægtede og T2 FLAIR (væske-svækkede inversion recovery) sekvenser, i særdeleshed, er mest nyttige til at detektere vasogenic ødem på MR-scanning (Figur 4: HR. af PRES; Figur 5: HR. af PRES Koronale).
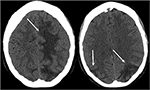
Figur 3. Patient med systemisk lupus erythematosus og hurtigt progressiv glomerulonephritis præsentere med anfald. Ikke-kontrast CT billeder af hovedet demonstrerer vasogent ødem i de bilaterale parietale og occipitale lobes, venstre større end højre, samt forlængelse i venstre frontal lobe.,
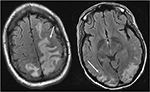
Figur 4. Patient med systemisk lupus erythematosus og hurtigt progressiv glomerulonephritis præsentere med anfald. T2-FLAIR billeder af hovedet demonstrerer vasogent ødem i de bilaterale parietale og occipitale lobes, venstre større end højre, samt forlængelse i venstre frontal lobe. Bemærk at med det vasogene mønster af ødem er der sparsom af signalabnormitet i Corte..
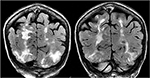
Figur 5., Patient med en historie med primær myelofibrose og knoglemarvstransplantation på Tacrolimus, der præsenteres med første gangs anfald. Koronale T2-FLAIR-sekvenser demonstrerer omfattende signalabnormalitet i de bilaterale occipitale og parietale lobes, som det er typisk med PRES.
differentialdiagnosen for PRES er bred og inkluderer enheder med lignende sammenflydende T2-hvidstofhyperintensitet., Som eksempler kan nævnes: iskæmi/myokardieinfarkt (især posteriore cirkulation), demyeliniserende sygdomme, smitsomme etiologies (meningitis, encephalitis), progressiv multifokal leukoencefalopati (PML), vaskulitis, og forskellige metaboliske lidelser (27). En klinisk relateret enhed kaldet reversibel cerebral vasokonstriktionssyndrom (RCVS) menes at være forårsaget af ændringer i cerebral vaskulær tone, hvilket resulterer i vasokonstriktion., RCVS manifesterer sig som tilbagevendende tordenskrald hovedpine, kramper, slagtilfælde, og ikke-ikkeaneurismal subaraknoidal blødning (28), som kunne forveksles med PRES på et klinisk grundlag. Denne enhed forekommer typisk i postpartum-perioden eller efter eksponering for adrenerge eller serotonergiske medicin. RCVS kan typisk diagnosticeres med angiografiske undersøgelser, der demonstrerer multifokale indsnævringsområder, der involverer cerebrale arterier (29). Denne diagnose kan forveksles med det faktum, at RCVS og PRES ofte forekommer samtidigt, hvilket neuroradiologen skal være opmærksom på for at undgå fejldiagnose (30).,
PRES kan typisk skelnes fra akut iskæmi, fordi sidstnævnte altid demonstrerer cytotoksisk ødem og diffusionsbegrænsning. Begrænset udbredelse i akut iskæmi kan være let fundet på diffusion-vægtet imaging (DWI) og tilsyneladende diffusion coefficient (ADC), som er en hyperintense signal på DWI med tilsvarende nedsat signal på ADC (på grund af den relativt nedsat bevægelse af intracellulære vand molekyler)., Vasogent ødem i indstillingen af PRES kan på den anden side vise hyperintensesignal på D .i, der ikke ledsages af et tilsvarende nedsat signal på ADC (31). Derudover har akut iskæmi en tendens til at være ensidig og inden for et entydigt vaskulært område. Mens vurderingen for diffusion begrænsning for at differentiere PRES fra iskæmisk abnormitet generelt er pålidelige, der er sjældne tilfælde af PRES, der kan være forbundet med områder af diffusion begrænsning overlejret af områder af mere klassisk set isoleret vasogenic ødem.,
“avancerede” billeddannelsesteknikker i PRES er for nylig blevet beskrevet som et hjælpeværktøj i vanskelige eller tvetydige tilfælde. Disse avancerede imaging teknikker omfatter: CT/MR perfusion, MR-Spektroskopi (MRS), Modtagelighed weighted imaging (SWI), og nuklearmedicinske teknikker, herunder single-photon emission tomografi (SPECT) og positron emissions tomografi (PET) med varierende radiotracers. Selvom en fuld diskussion er uden for denne gennemgang, en række billeddannelsesresultater kan ses på disse avancerede teknikker for at hjælpe med at foreslå en diagnose af PRES., Hyperperfusion kan ses i CT / MR perfusionsstudier påvist ved øget cerebral blodgennemstrømning og blodvolumen med reduceret tid til perfusion og gennemsnitlig transittid (32), selvom der er rapporteret tilfælde af hypoperfusion (33). På MRS er der generelt en reduktion i forholdet mellem N-Acetylaspartat (NAA)/kreatin (Cr) og NAA/cholin (Chol), hvilket antyder en forstyrrelse af normale synapser og neuroa .onal funktion (34). SII kan hjælpe med at identificere tilstedeværelsen af blødning i PRES, med højere følsomhed end GRE-billeddannelse (35)., SPECT / PET imaging viser typisk enten hyperperfusion eller hypoperfusion (svarende til CT / MR perfusion undersøgelser) med lav metabolisme af FDG-PET (36).
Derudover, PRES kan skelnes fra andre tilstande, såsom autoimmune encephalitis i fastsættelsen af akut dissemineret encephalomyelitis (ADEM) ved det tidligere”s diffuse bilaterale men asymmetriske vasogenic ødem (37)., PML kan have et lignende udseende sammenlignet med PRES, der har en parieto-occipital overvægt, men kan skelnes ved dets mere ensidige eller asymmetriske involvering såvel som forkærlighed for subkortisk hvidt stof (38).
atypiske billeddannelsesfunktioner
atypiske træk ved PRES inkluderer områder med kontrastforbedring, blødning eller diffusionsbegrænsning (39)., Selv om den parietale og occipital lapper er generelt involveret, atypiske områder af involvering kan ses herunder: hjernestammen, lillehjernen, corpus callosum, og andre hjerne-områder, med flere fælles områder, herunder frontal-lapper (set i op til 68%), og lavere end tindingelapperne (op til 40%) (23, 40) (Figur 6: Cerebellum; Figur 7: Hjernestammen).
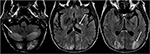
Figur 6. Patient med levertransplantation 6 uger tidligere. Patienten blev startet på Tacrolimus efter levertransplantation., T2-FLAIR billeder af hjernen viser signal abnormitet i occipital lobes. Der er også omfattende signalabnormalitet, der ses i de bilaterale cerebellære halvkugler og inden for thalami. Disse fund blev hurtigt løst efter stop af Tacrolimus.
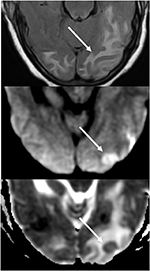
Figur 7. Patient med ukontrolleret hypertension præsenterer med ændring af mental status. T2-FLAIR (top) billede demonstrerer ødem i de occipitale lobes., DWI (i midten) og ADC-kort (nederst) billeder, der viser en lille pil med begrænset udbredelse, med hyperintense signal på DWI og tilsvarende hypointensity på ADC-kort.
Derudover, at en tidlig konstatering af PRES, der kan ligge forud for den typiske parieto-occipital ødem omfatter mild sulcal FLAIR hyperintensity og leptomeningeal ekstraudstyr på post-kontrast T1-vægtede billeder, som beskrevet af Nakagawa et al. (41). Ben .iada-Boudour et al., (42) beskrev en samtidig udvikling af cytotoksisk ødem, hvilket resulterede i begrænset diffusion (figur 8: Diffusionsbegrænsning). Iboende i navnet på sygdomsprocessen er resultaterne relateret til PRES normalt reversible med normalisering af kliniske og billeddannelsesresultater, når det ophidsende problem er behandlet. I nogle tilfælde kan områder med begrænset diffusion i sidste ende resultere i permanent skade på hjerneparenchymen (figur 9: laminær nekrose)., Blødning ses mindre almindeligt i PRES, der forekommer i 5-30% af tilfældene, men bør anerkendes for ikke at forveksle dette fund for en anden patologisk enhed i den passende kliniske indstilling af PRES (39). Billeddiagnostiske fund i blødning kan omfatte: focal hæmatom, petekkier gyral blødning, og/eller subaraknoidal blødning (43) (Figur 10: Blødning).
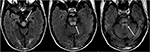
Figur 8. Patient med levertransplantation i anamnesen to uger tidligere på Tacrolimus., T2-FLAIR billeder viser signal abnormitet i mellemhovedet, pons, og overlegen cerebellar stilke.
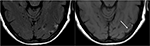
Figur 9. T2-FLAIR (til venstre) billede hos en patient med ukontrolleret hypertension og tidligere billeddannelse, der indikerer PRES (se figur 6), Nu kontrolleret og 6 uger senere, demonstrerer opløsning af det tidligere set ødem. Små områder af gliose på grund af skade ses i venstre temporale lobe. Aksial ikke-kontrast T1 viser krøllet kortikal laminær nekrose relateret til den forudgående skade relateret til PRES., Mens PRES generelt er fuldt reversibel, kan det resultere i permanent skade i nogle situationer.
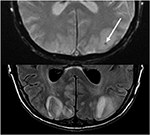
Figur 10. Tidligere levertransplantation på Tacrolimus. T2 gradient tilbagekaldt echo (top) demonstrerer et brændvidde af blødning inden for det vasogene ødem i venstre occipital lob. T2-FLAIR demonstrerer det mere typiske fund relateret til PRES med signalabnormalitet i de bilaterale occipitale lobes.,
behandling
behandling af PRES er typisk rettet mod at kontrollere den primære ætiologi, der forårsager PRES (44). For eksempel i tilfælde af forhøjet arterielt tryk er behandlingen rettet mod at korrigere det forhøjede blodtryk i et kontrolleret miljø, svarende til fremgangsmåden for hypertensive haster/ nødsituation (45). Typisk søges en ikke-hurtig reduktion i blodtrykket for at undgå risikoen for at forårsage iskæmisk cerebral sygdom som følge af drastisk blodtrykssænkning (46)., Lejlighedsvis anvendes antikonvulsive lægemidler som supplerende terapi, selvom det optimale middel(er), timing og behandlingens længde forbliver kontroversielt (4) (Figur 11: før og efter).
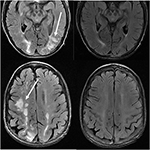
Figur 11. Patient med tidligere primær myelofibrose og knoglemarvstransplantation på Tacrolimus. A .ial T2-FLAIR billeder viser de områder af signal abnormitet i parietale og occipital lapper, og højre frontal lap (venstre billeder)., Tacrolimus blev stoppet, og opfølgningsbillederne (højre billeder) blev opnået 6 uger efter de første billeder.
I tilfælde af (pre)eklampsi, behandling er rettet mod rettidig levering af fosteret, samt blodtryk ledelse og magnesium sulfat til beslaglæggelse profylakse (47). Ved indstilling af PRES induceret af kemoterapeutiske eller andre immunsuppressionsmidler har aftagende eller absolut seponering af lægemidlet vist både klinisk og radiologisk forbedring (48) (Figur 12: eklampsi)., Hypomagnesæmi er et almindeligt fund i PRES og en mulig etiologisk faktor. Derfor har forfattere foreslået, at magnesiumtilskud kan være et nyttigt supplement i PRES management (49).
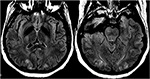
Figur 12. Patient med eklampsi og præsentation med anfald. Aksiale T2-FLAIR-billeder demonstrerer symmetrisk signalabnormalitet i de bilaterale occipitale lobes.,
Konklusion
PRES er en unik enhed, der med karakteristiske kliniske og neuroradiological resultater, ud over utallige veldokumenterede årsager. Selvom den præcise patofysiologiske mekanisme (r) bag PRES endnu ikke er belyst (og faktisk kan skyldes en kombination af indbyrdes forbundne processer), er den almindeligt accepterede mekanisme dysfunktion af blod-hjerne-barrieren, hvilket resulterer i vasogent ødem med overvejende posterior cirkulation., Billeddannelsesfunktioner evalueres bedst på væskefølsomme MR-sekvenser, der afslører parieto-occipital dominerende hvidstof T2-hyperintensiteter, skønt mange atypiske billeddannelsesfunktioner kan ses og bør huskes, når man vurderer udfordrende tilfælde. Forskellige avancerede billeddannelsesværktøjer er tilgængelige til at hjælpe i vanskelige eller tvetydige tilfælde. Behandlingen er rettet mod at styre den underliggende årsag med særlig opmærksomhed på blodtryksovervågning og mulig anfaldsprofylakse.,
Forfatterbidrag
interessekonflikt
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
1. Bartynski WS. Posterior reversibelt encephalopati-syndrom, del 1: Grundlæggende billeddannelse og kliniske træk. Am J Neuroradiol. (2008) 29:1036–42. doi: 10.3174/ajnr.,A0928
CrossRef Full Text | Google Scholar
3. Bartynski WS. Posterior reversible encephalopathy syndrome, Part 2: controversies surrounding pathophysiology of vasogenic edema. Am J Neuroradiol. (2008) 29:1043–9. doi: 10.3174/ajnr.A0929
CrossRef Full Text | Google Scholar
5. Singer S, Grommes C, Reiner AS, Rosenblum MK, DeAngelis LM. Posterior reversible encephalopathy syndrome in patients with cancer., Oncologist. (2015) 20:806–11. doi: 10.1634/theoncologist.2014-0149
PubMed Abstract | CrossRef Full Text | Google Scholar
6. How J, Blattner M, Fowler S, Wang-Gillam A, Schindler SE. Chemotherapy-associated posterior reversible encephalopathy syndrome: a case report and review of the literature. Neurologist. (2016) 21:112–7. doi: 10.1097/NRL.,0000000000000105
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Habetz K, Ramakrishnaiah R, Raina SK, Fitzgerald RT, Hinduja A. Posterior reversible encephalopathy syndrome: a comparative study of pediatric versus adult patients. Pediatr Neurol. (2016) 65:45–51. doi: 10.1016/j.pediatrneurol.2016.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Fugate JE, Rabinstein AA., Posterior reversible encephalopathy syndrome: clinical and radiological manifestations, pathophysiology, and outstanding questions. Lancet Neurol. (2015) 14:914–25. doi: 10.1016/S1474-4422(15)00111-8
CrossRef Full Text | Google Scholar
9. Zama, D, Gasperini P, Berger M, Petris M, De Pasquale MD, et al. A survey on hematology-oncology pediatric AIEOP centres: the challenge of posterior reversible encephalopathy syndrome. Eur J Haematol. (2018) 100:75–82. doi: 10.1111/ejh.,12984
CrossRef Full Text | Google Scholar
12. Gupta V, Bhatia V, Khandelwal N, Singh P, Singhi P. Imaging findings in pediatric posterior reversible encephalopathy syndrome (PRES): 5 years of experience from a tertiary care center in India. J Child Neurol. (2016) 31:1166–73. doi: 10.1177/0883073816643409
PubMed Abstract | CrossRef Full Text | Google Scholar
13., Hinduja A, Habet. K, Raina s, Ramakrishnaiah R, Fit .gerald RT.forudsigere af dårligt resultat hos patienter med posterior reversibelt encephalopati syndrom. Int J Neurosci. (2017) 127:134–44. doi: 10.3109/00207454.2016.1152966
PubMed Abstract | CrossRef Fuld Tekst | Google Scholar
15. Macken .ie et, Strandgaard s, Graham DI, Jones JV, Harper am, Farrar JK. Effekter af akut induceret hypertension hos katte på pial arteriolær kaliber, lokal cerebral blodgennemstrømning og blodhjernebarrieren. Circ Res., (1976) 39:33–41. doi: 10.1161/01.RES.39.1.33
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bartynski WS, Zeigler Z, Spearman MP, Lin L, Shadduck RK, Lister J. Etiology of cortical and white matter lesions in Cyclosporin-A and FK-506 neurotoxicity. Am J Neuroradiol. (2001) 22:1901–14.
PubMed Abstract | Google Scholar
21. Bartynski WS, Boardman JF, Zeigler ZR, Shadduck RK, Lister J., Posterior reversible encephalopathy syndrome in infection, sepsis, and shock. Am J Neuroradiol. (2006) 27:2179–90.
PubMed Abstract | Google Scholar
22. Mayama M, Uno K, Tano S, Yoshihara M, Ukai M, Kishigami Y, et al. Incidence of posterior reversible encephalopathy syndrome in eclamptic and patients with preeclampsia with neurologic symptoms. Am J Obstet Gynecol. (2016) 215:239.e1–e5. doi: 10.1016/j.ajog.2016.02.,039
PubMed Abstract | CrossRef Full Text | Google Scholar
23. McKinney AM, Short J, Truwit CL, McKinney ZJ, Kozak OS, SantaCruz KS, et al. Posterior reversible encephalopathy syndrome: incidence of atypical regions of involvement and imaging findings. Am J Roentgenol. (2007) 189:904–12. doi: 10.2214/AJR.07.2024
PubMed Abstract | CrossRef Full Text | Google Scholar
24., de Havenon A, Joos Z, Longenecker L, Shah L, Ansari S, Digre K. Posterior reversible encephalopathy syndrome with spinal cord involvement. Neurology. (2014) 83:2002–6. doi: 10.1212/WNL.0000000000001026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Dandoy CE, Linscott LL, Davies SM, Leach JL, Myers KC, El-Bietar J, et al., Clinical utility of computed tomography and magnetic resonance imaging for diagnosis of posterior reversible encephalopathy syndrome after stem cell transplantation in children and adolescents. Biol Blood Marrow Transplant. (2015) 21:2028–32. doi: 10.1016/j.bbmt.2015.07.023
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Noda K, Fukae J, Fujishima K, Mori K, Urabe T, Hattori N, et al., Reversible cerebral vasoconstriction syndrome presenting as subarachnoid hemorrhage, reversible posterior leukoencephalopathy, and cerebral infarction. Intern Med. (2011) 50:1227–33. doi: 10.2169/internalmedicine.50.4812
CrossRef Full Text | Google Scholar
31. Doelken M, Lanz S, Rennert J, Alibek S, Richter G, Doerfler A, et al. Differentiation of cytotoxic and vasogenic edema in a patient with reversible posterior leukoencephalopathy syndrome using diffusion-weighted MRI. Diagn Interv Radiol., (2007) 13:125–8.
Google Scholar
32. Wartenberg KE, Parra A. CT and CT-perfusion findings of reversible leukoencephalopathy during triple-H therapy for symptomatic subarachnoid hemorrhage-related vasospasm. J Neuroimaging. (2006) 16:170–5. doi: 10.1111/j.1552-6569.2006.00031.x
CrossRef Full Text | Google Scholar
33. Vanacker P, Matias G, Hagmann P, Michel P., Cerebral hypoperfusion in posterior reversible encephalopathy syndrome is different from transient ischemic attack on CT perfusion. J Neuroimaging. (2015) 25:643–6. doi: 10.1111/jon.12158
CrossRef Full Text | Google Scholar
34. Lee SY, Kim SH, Lee SH, Baek HJ, Shon HS, Kim SS. Serial MR spectroscopy in relapsing reversible posterior leukoencephalopathy syndrome. Neurologist. (2009) 15:338–41. doi: 10.1097/NRL.,0b013e3181914af6
PubMed Abstract | CrossRef Full Text | Google Scholar
35. McKinney AM, Sarikaya B, Gustafson C, Truwit CL. Detection of microhemorrhage in posterior reversible encephalopathy syndrome using susceptibility-weighted imaging. Am J Neuroradiol. (2012) 33:896–903. doi: 10.3174/ajnr.A2886
PubMed Abstract | CrossRef Full Text | Google Scholar
38., Berger JR, Aksamit AJ, Clifford DB, Davis L, Koralnik IJ, Sejvar JJ et al. PML diagnostiske kriterier: konsensuserklæring fra aan neuroinfectious disease sektion. Neurologisk. (2013) 80:1430-8. doi: 10.1212/WNL.0b013e31828c2fa1
PubMed Abstract | CrossRef Fuld Tekst | Google Scholar
39. Aracki-Trenkić Og Stojanov D, Trenkić M, Radovanovic Z, Ignjatovic J, Ristic S, et al., Atypical presentation of posterior reversible encephalopathy syndrome: clinical and radiological characteristics in eclamptic patients. Bosn J Basic Med Sci. (2016) 16:180–6. doi: 10.17305/bjbms.2016.1201
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Bartynski WS, Boardman JF. Distinct imaging patterns and lesion distribution in posterior reversible encephalopathy syndrome. Am J Neuroradiol. (2007) 28:1320–7. doi: 10.3174/ajnr.,A0549
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Brickman AM, Reitz C, Luchsinger JA, Manly JJ, Schupf N, Muraskin J, et al. Long-term blood pressure fluctuation and cerebrovascular disease in an elderly cohort. Arch Neurol. (2010) 67:564–9. doi: 10.1001/archneurol.2010.70
PubMed Abstract | CrossRef Full Text | Google Scholar
47., Cozzolino M, Bianchi C, Mariani G, Marchi L, Fambrini M, Mecacci F. Therapy and differential diagnosis of posterior reversible encephalopathy syndrome (PRES) during pregnancy and postpartum. Arch Gynecol Obstet. (2015) 292:1217–23. doi: 10.1007/s00404-015-3800-4
PubMed Abstract | CrossRef Full Text | Google Scholar
48. Masetti R, Cordelli DM, Zama D, Vendemini F, Biagi C, Franzoni E, et al. PRES in children undergoing hematopoietic stem cell or solid organ transplantation. Pediatrics., (2015) 135:890–901. doi: 10.1542/peds.2014-2325
CrossRef Full Text | Google Scholar