April 13, 2017, med NCI-Team
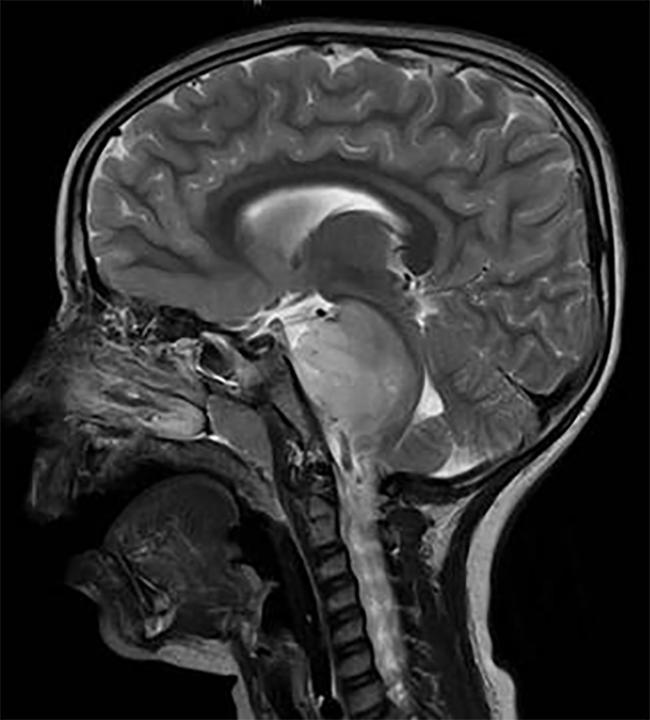
Hjerne scanning af et barn med en DIPG tumor, der ligger i hjernestammen.
To separate undersøgelser har identificeret potentielle terapeutiske mål i et ubrugeligt pediatric hjerne tumor, diffuse iboende pontine gliom (DIPG). Blokering af disse mål med undersøgelseslægemidler bremset tumorvækst i dyremodeller af DIPG.
DIPG, en tumor, der er placeret i hjernestammen, er næsten ensartet dødelig.,
“Som en pædiatrisk neurooncologist, at det”er en af de mest ødelæggende tumorer vi se,” sagde Pratiti Bandopadhayay, M. B. B. S., Ph. D., af Dana-Farber/Boston Children”s Kræft-og blodsygdomme Center, som ikke var involveret i de undersøgelser. “Vi har overhovedet ingen helbredende behandlinger for disse tumorer.”
mens størstedelen af DIPG-tumorer bærer en specifik genetisk mutation, var det tidligere uklart, hvilken rolle, hvis nogen, det mutante protein spiller i tumorudvikling, og om dets funktion kunne målrettes af terapier.,
for begge nye undersøgelser undersøgte forskerteamene biologien af humane DIPG-celler med denne mutation og identificerede egenskaber, der kan gøre dem sårbare over for behandling. Sammenlignet med kontrol behandlinger, de fandt, lægemidler kendt som PRC2 og BET-hæmmere skrumpede DIPG tumorer i musemodeller og forlænget musene liv.
resultaterne af begge undersøgelser, en fra en forskningsgruppe ved North .estern University og en anden fra en gruppe ved Københavns Universitet i Danmark, blev offentliggjort 27.februar i Nature Medicine.,
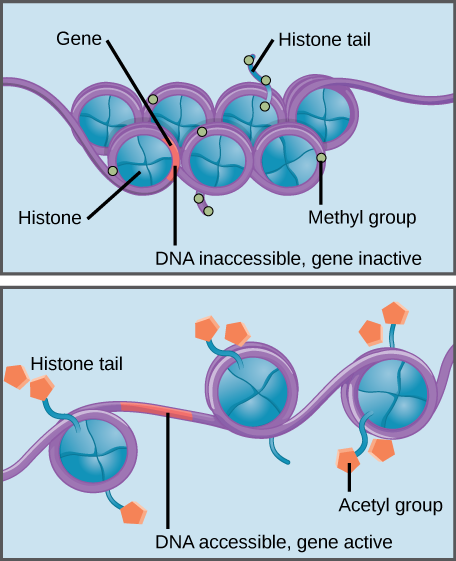
Histon metylering styrker histon–DNA interaktion, hvorved der er forbundet gener utilgængelige for at gen-ekspression (inaktive). Histonacetylering svækker interaktionen, hvilket gør tilknyttede gener tilgængelige for genekspression (aktiv).
identificering af et mål
for omkring 5 år siden, forskere, der arbejder på St., Jude–Washington University Pediatric Cancer Genom Projekt opdagede, at næsten 80% af DIPG tumorer har en bestemt mutation i genet for et protein kaldet histon H3.
at en så høj procentdel af tumorer har den samme mutation kom som en overraskelse for DIPG-forskningsmiljøet, sagde Ali Shilatifard, ph.d., fra North .estern University Feinberg School of Medicine, ledende efterforsker for en af undersøgelserne.
histoner er en familie af proteiner, der hjælper med at pakke DNA i kompakte strukturer., Korte dele af DNA vind omkring histon proteiner som tråd på en spole, og tusindvis af DNA–indpakket histoner (kaldet nukleosomer) udgør hvert kromosom.specifikke modifikationer af histoner kan fremme eller forhindre genekspression. For eksempel svækker bindingen af kemiske forbindelser kaldet acetylgrupper til histoner deres interaktion med DNA, hvilket fremmer genekspression. På den anden side gør tilsætningen af methylgrupper til histoner normalt DNA mere tæt omkring histoner, hvilket forhindrer genekspression.,at identificere tilstedeværelsen af en histon H3-mutation hos patienter med DIPG var det første skridt, sagde Dr. Bandopadhayay. “Men for at være i stand til at behandle tumorer med den ændring, er du nødt til at forstå, hvad mutationen gør,” tilføjede hun.
i en tidligere undersøgelse brugte Dr. Shilatifard og hans kolleger frugtfluer til at studere funktionen af det mutante histon H3-gen. Sammenlignet med fluer, der havde normale histon H3-proteiner, havde fluer med den mutante version flere histoner, der var besat med acetylgrupper (acetyleret)., Til gengæld blev disse acetylerede histoner bundet af molekyler kaldet bromodomainholdige (BRD) proteiner, som regulerer genekspression.
for deres nuværende undersøgelse, som delvis blev finansieret af NCI, ønskede de nordvestlige forskere at afgøre, om mutanthistonen havde den samme funktion i humane celler. Faktisk fandt de, at humane tyktarmskræft eller nyrekræftceller ændret for at udtrykke det muterede histon H3-gen havde flere acetylerede histoner end celler, der udtrykte det normale histon H3-gen.den første forfatter, Andrea Piunti, Ph. D.,, undersøgte derefter alle de mutante H3-histoner placeret i hele genomerne af DIPG-tumorceller fra tre patienter. Hans analyse afslørede, at mange nukleosomer, der indeholdt mutanthistoner, var acetylerede og bundet af BRD-proteiner.
yderligere eksperimenter viste, at BRD-proteiner kan spille en direkte rolle i DIPG-tumorvækst. Behandling af humane DIPG-celler med undersøgelsesmidler, der blokerer BRD-proteiner, kaldet BET-hæmmere, bremset DIPG-cellevækst sammenlignet med en kontrolbehandling., Og i undersøgelser af mus med menneskelige DIPG celler implanteret i deres hjerne stængler, dem behandlet med BET-hæmmere havde mindre tumorer og levede længere end mus behandlet med kontrol behandling.
disse eksperimenter “antyder, at BET-hæmmere giver en potentiel terapeutisk tilgang til DIPG,” sagde Dr. Shilatifard. Prækliniske undersøgelser har vist, at flere forskellige kræftformer—inklusive leukæmi og glioblastom—også er følsomme over for BET-hæmmere, tilføjede han.,
et yderligere mål
den nordvestlige gruppe”s analyse af humane DIPG-tumorceller med mutant histon H3 afslørede også, at ud over mere histon H3-acetylering blev mange histoner dekoreret med methylgrupper (methyleret). Desuden fandt de, at et en .ym kaldet PRC2—som binder methylgrupper til histon H3—proteiner-var til stede nær mange af disse histoner.
disse resultater fik de nordvestlige forskere til at se nærmere på PRC2-aktivitet., De fandt, at blokering af PRC2-aktivitet—enten genetisk eller med en PRC2-hæmmer kaldet ta .emetostat-reduceret DIPG-cellevækst.
“uventet viser disse resultater en rolle for PRC2-funktionen i opretholdelsen af DIPG-vækst,” skrev den nordvestlige gruppe.Copenhagen-gruppen fandt også beviser, der understøtter PRC2 ” s rolle i fremme af DIPG-tumorvækst. De observerede, at ta .emetostat og en anden PRC2-hæmmer reducerede væksten af musehjerneceller eller humane DIPG-celler med mutante histoner, hvorimod kontrolbehandlingen ikke gjorde det.,
og når de implanterede musehjerneceller med mutante histoner i hjernen hos normale mus eller mus, hvor PRC2 var genetisk blokeret, levede de, der manglede PRC2-aktivitet, længere.
i modsætning hertil fandt en separat undersøgelse foretaget af en forskningsgruppe i Tyskland, at celler fra forskellige patienter med DIPG ikke var følsomme over for TA .emetostat, selvom deres tumorer havde histon H3-mutationen.
Et Skridt Fremad
Årtier af kliniske forsøg har vist, at DIPG tumorer er ufølsomme over for traditionel kemoterapi, forklarede Dr. Bandopadhayay., Og selvom stråling kan lindre symptomer, er det ikke helbredende, og de fleste børn med DIPG dør inden for 2 år efter diagnosen.
i 2015 slog et internationalt konsortium af DIPG-forskere sammen for at studere alle tilgængelige DIPG-celleprøver. Deres undersøgelse afslørede, at DIPG-celler indsamlet fra flere forskellige patienter blev dræbt af et histon-modificerende lægemiddel kaldet panobinostat (Farydak)). Panobinostat blokerer en .ymer, der tilføjer acetylgrupper til histoner., Nu tester forskere, der er en del af det NCI-støttede pædiatriske Hjernetumorkonsortium, sikkerheden og den bedste dosis panobinostat til børn med DIPG i et klinisk fase i-forsøg.
resultater fra begge undersøgelser peger nu på potentielt lovende nye behandlingsstrategier, sagde Dr. Shilatifard.
“Vi ønsker at flytte BET-hæmmere ind i en fase i undersøgelse, behandling af DIPG, og vores kolleger på Ann & Robert H. Lurie Børn”s Hospital of Chicago er at skubbe fremad med disse undersøgelser,” sagde han.,
derudover tester flere igangværende kliniske undersøgelser ta .emetostat, PRC2-hæmmeren, hos både voksne og pædiatriske patienter med forskellige kræftformer. Ingen nuværende undersøgelse undersøger dog specifikt ta .emetostat hos børn med DIPG.
Der er stadig mange ubesvarede spørgsmål, sagde Dr. Bandopadhayay, herunder om disse undersøgelseslægemidler har evnen til at krydse blod–hjernebarrieren og nå menneskelige hjernetumorer.
Dr., Bandopadhayay og hendes kolleger lærer også mere om DIPG-biologi ved at studere tumorceller opnået fra biopsier, ud over dem, der er opnået fra obduktioner. Indhentning biopsiprøver er blevet gjort muligt først for nylig ved større forbedringer i neurokirurgiske teknikker, forklarede hun.
“det er en spændende tid,”sagde hun. “Der er en masse arbejde i gang lige nu. Det ultimative mål er at være i stand til at behandle disse børn, så de har en chance for helbredelse med minimale bivirkninger.”