le 13 avril 2017, par le personnel du NCI
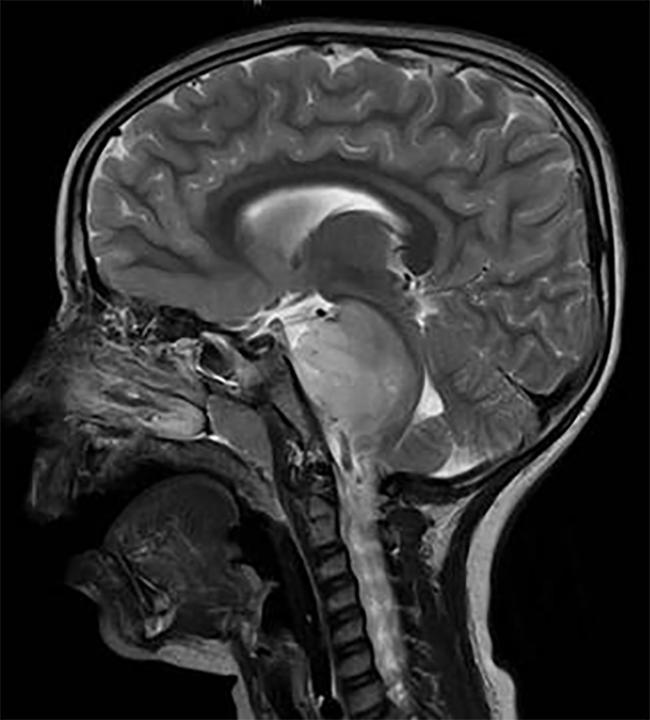
analyse du cerveau d’un enfant avec tumeur DIPG, située dans le tronc cérébral.
deux études distinctes ont identifié des cibles thérapeutiques potentielles dans une tumeur cérébrale pédiatrique inopérable, le gliome Pontin intrinsèque diffus (DIPG). Le blocage de ces cibles avec des médicaments expérimentaux a ralenti la croissance tumorale dans les modèles animaux de DIPG.
DIPG, une tumeur située dans le tronc cérébral, est presque uniformément fatale.,
« en tant que neurooncologue pédiatrique, c’est l’une des tumeurs les plus dévastatrices que nous voyons », a déclaré Pratiti Bandopadhayay, M. B. B. S., Ph.D., du Dana-Farber / Boston Children’s Cancer and Blood Disorders Center, qui n’a pas participé aux études. « Nous n’avons aucun traitement curatif pour ces tumeurs. »
alors que la majorité des tumeurs DIPG portent une mutation génétique spécifique, il était auparavant difficile de savoir quel rôle, le cas échéant, la protéine mutante joue dans le développement tumoral, et si sa fonction pourrait être ciblée par des thérapies.,
pour les deux nouvelles études, les équipes de recherche ont étudié la biologie des cellules DIPG humaines avec cette mutation et ont identifié des caractéristiques qui pourraient les rendre vulnérables au traitement. Par rapport aux traitements de contrôle, ils ont trouvé, les médicaments connus sous le nom de PRC2 et inhibiteurs de BET ont diminué les tumeurs DIPG dans les modèles de souris et ont allongé la vie des souris.
les résultats des deux études, l’une d’un groupe de recherche de L’Université Northwestern et l’autre d’un groupe de L’Université de Copenhague au Danemark, ont été publiés le 27 février dans Nature Medicine.,
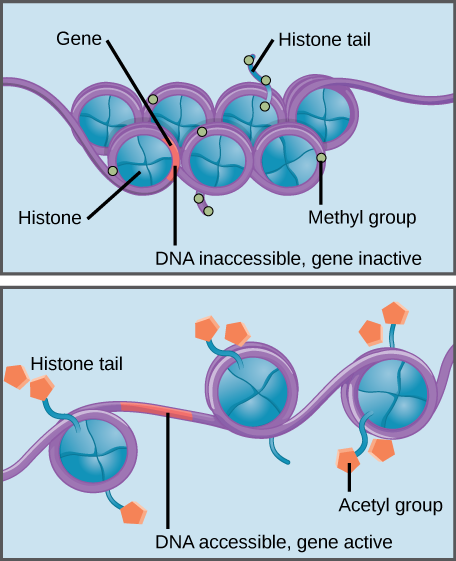
la méthylation des Histones renforce l’ADN–histones interaction, prise de gènes associés à inaccessibles à l’expression des gènes (inactif). L’acétylation des histones affaiblit l’interaction, rendant les gènes associés accessibles pour l’expression des gènes (actifs).
identifier une cible
Il y a environ 5 ans, des chercheurs travaillant sur le St., Jude-Washington University Pediatric Cancer Genome Project a découvert que près de 80% des tumeurs DIPG ont une mutation spécifique dans le gène d’une protéine appelée histone H3.
Qu’un pourcentage aussi élevé de tumeurs aient cette même mutation a surpris la communauté de recherche du DIPG, a déclaré Ali Shilatifard, Ph.D., de la Northwestern University Feinberg School of Medicine, chercheur principal pour l’une des études.
les Histones sont une famille de protéines qui aident à emballer L’ADN en structures compactes., De courtes sections d’ADN s’enroulent autour des protéines d’histone comme du fil sur une bobine, et des milliers d’histones enveloppées d’ADN (appelées nucléosomes) composent chaque chromosome.
des modifications spécifiques des histones peuvent favoriser ou empêcher l’expression des gènes. Par exemple, la fixation de composés chimiques appelés groupes acétyle aux histones affaiblit leur interaction avec L’ADN, favorisant ainsi l’expression des gènes. D’autre part, l’ajout de groupes méthyle aux histones rend généralement L’ADN plus étroitement enroulé autour des histones, empêchant ainsi l’expression des gènes.,
identifier la présence d’une mutation de l’histone H3 chez les patients atteints de DIPG était la première étape, a déclaré le Dr Bandopadhayay. « Mais pour pouvoir traiter les tumeurs avec cette altération, vous devez comprendre ce que fait la mutation », a-t-elle ajouté.
dans une étude antérieure, le Dr Shilatifard et ses collègues ont utilisé des mouches des fruits pour étudier la fonction du gène mutant de l’histone H3. Par rapport aux mouches qui avaient des protéines histones H3 normales, les mouches avec la version mutante avaient plus d’histones qui étaient parsemées de groupes acétyle (acétylé)., À leur tour, ces histones acétylées ont été liées par des molécules appelées protéines contenant des bromodomaines (BRD), qui régulent l’expression des gènes.
pour leur étude actuelle, financée en partie par le NCI, les chercheurs de Northwestern ont voulu déterminer si l’histone mutante avait la même fonction dans les cellules humaines. En effet, ils ont constaté que les cellules cancéreuses du côlon humain ou du rein altérées pour exprimer le gène h3 de l’histone mutée avaient plus d’histones acétylées que les cellules qui exprimaient le gène h3 de l’histone normale.
le premier auteur, Andrea Piunti, Ph. D.,, a ensuite examiné toutes les histones mutantes H3 situées dans les génomes des cellules tumorales DIPG de trois patients. Son analyse a révélé que de nombreux nucléosomes contenant des histones mutantes étaient acétylés et liés par des protéines BRD.
d’autres expériences ont montré que les protéines BRD peuvent jouer un rôle direct dans la croissance tumorale du DIPG. Le traitement des cellules DIPG humaines avec des médicaments expérimentaux qui bloquent les protéines BRD, appelés inhibiteurs de BET, a ralenti la croissance des cellules DIPG par rapport à un traitement témoin., Et dans des études sur des souris avec des cellules DIPG humaines implantées dans leurs tiges cérébrales, celles traitées avec des inhibiteurs de BET avaient des tumeurs plus petites et vivaient plus longtemps que les souris traitées avec le traitement de contrôle.
ces expériences « suggèrent que les inhibiteurs de BET fournissent une approche thérapeutique potentielle pour le DIPG », a déclaré le Dr Shilatifard. Des études précliniques ont montré que plusieurs types de cancer différents – y compris la leucémie et le glioblastome—sont également sensibles aux inhibiteurs de BET, a-t-il ajouté.,
une cible supplémentaire
l »analyse par le groupe Northwestern de cellules tumorales DIPG humaines avec histone mutante H3 a également révélé qu » en plus d » une plus grande acétylation des histones h3, de nombreuses histones étaient décorées de groupes méthyle (méthylé). En outre, ils ont constaté qu’une enzyme appelée PRC2—qui attache des groupes méthyle aux protéines histones H3—était présente près de bon nombre de ces histones.
Ces résultats ont incité les chercheurs du Nord-Ouest à approfondir l’activité de la PRC2., Ils ont constaté que le blocage de L’activité de la PRC2-soit génétiquement, soit avec un inhibiteur de la PRC2 appelé tazémétostat-réduisait la croissance des cellules DIPG.
« de façon inattendue, ces résultats démontrent un rôle de la fonction PRC2 dans le maintien de la croissance du DIPG », a écrit le Northwestern group.
Le Groupe de Copenhague a également trouvé des preuves soutenant le rôle de PRC2 dans la promotion de la croissance tumorale DIPG. Ils ont observé que le tazémétostat et un autre inhibiteur de la PRC2 réduisaient la croissance des cellules cérébrales de souris ou des cellules DIPG humaines avec des histones mutantes, contrairement au traitement témoin.,
et quand ils ont implanté des cellules cérébrales de souris avec des histones mutantes dans le cerveau de souris normales ou de souris chez lesquelles PRC2 était génétiquement bloqué, ceux qui n’avaient pas D’activité PRC2 vivaient plus longtemps.
en revanche, une étude distincte menée par un groupe de recherche en Allemagne a révélé que les cellules de différents patients atteints de DIPG n’étaient pas sensibles au tazémétostat, même si leurs tumeurs présentaient la mutation histone H3.
un pas en avant
des décennies d’essais cliniques ont montré que les tumeurs DIPG sont insensibles à la chimiothérapie traditionnelle, a expliqué le Dr Bandopadhayay., Et bien que les radiations puissent atténuer les symptômes, elles ne sont pas curatives et la plupart des enfants atteints de DIPG meurent dans les 2 ans suivant le diagnostic.
En 2015, un consortium international de chercheurs du DIPG s’est réuni pour étudier tous les échantillons de cellules DIPG disponibles. Leur étude a révélé que les cellules DIPG recueillies chez plusieurs patients différents ont été tuées par un médicament modifiant les histones appelé panobinostat (Farydak®). Le Panobinostat bloque les enzymes qui ajoutent des groupes acétyle aux histones., Maintenant, les chercheurs, qui font partie du Consortium sur les tumeurs cérébrales pédiatriques soutenu par le NCI, testent l’innocuité et la meilleure dose de panobinostat pour les enfants atteints de DIPG dans un essai clinique de phase I.
maintenant, les résultats des deux études indiquent de nouvelles stratégies de traitement potentiellement prometteuses, a déclaré le Dr Shilatifard.
« nous voulons déplacer les inhibiteurs de BET dans une étude de phase I pour le traitement du DIPG, et nos collègues de L’Ann& Robert H. Lurie Children’s Hospital de Chicago font avancer ces études », a-t-il déclaré.,
en outre, plusieurs études cliniques en cours testent le tazémétostat, l’inhibiteur de la PRC2, chez des patients adultes et pédiatriques atteints de divers cancers. Cependant, aucune étude actuelle n’étudie spécifiquement le tazémétostat chez les enfants atteints de DIPG.
Il y a encore beaucoup de questions sans réponse, a déclaré le Dr Bandopadhayay, y compris si ces médicaments expérimentaux ont la capacité de traverser la barrière hémato–encéphalique et d’atteindre des tumeurs cérébrales humaines.
le Dr, Bandopadhayay et ses collègues en apprennent également davantage sur la biologie du DIPG en étudiant les cellules tumorales obtenues à partir de biopsies, en plus de celles obtenues à partir d’autopsies. L’obtention d’échantillons de biopsie n’a été rendue possible que récemment par des améliorations majeures des techniques neurochirurgicales, a-t-elle expliqué.
« c’est une période passionnante », a-t-elle déclaré. « Il y a beaucoup de travail en cours en ce moment. Le but ultime est de pouvoir traiter ces enfants afin qu’ils aient une chance de guérir avec un minimum d’effets secondaires. »