Introducción
los estafilococos coagulasa negativos (CoNS), miembros del grupo de estafilococos, se caracterizan como cocos grampositivos, presentados como células individuales o con disposición irregular, y son inmóviles, anaerobios facultativos, y carecen de la enzima coagulasa.,1 los contras son parte de la microbiota humana, considerados patógenos oportunistas, causantes de infecciones principalmente en bebés prematuros, y pacientes inmunocomprometidos y protésicos.2
el aumento de la resistencia antimicrobiana en los últimos años ha tenido un gran impacto en las infecciones hospitalarias causadas por contras. La oxacilina es una penicilina semisintética utilizada en la prueba de susceptibilidad para la detección de resistencia a la meticilina y el tratamiento de infecciones estafilocócicas. Sin embargo, se han observado tasas del 66% al 95% de resistencia a la oxacilina en aislados clínicos de CoNS.,2 La resistencia a la oxacilina a menudo está mediada por el gen mecA, que codifica una proteína suplementaria de unión a la penicilina (PBP2a) con baja afinidad a las penicilinas semisintéticas.3 el gen mecA se encuentra en un elemento genético móvil conocido como cromosoma de casete estafilocócico mec (SCCmec) que contiene el complejo mec, compuesto por el gen mecA y sus genes reguladores mecI y mecRI, el complejo ccr, responsable de la integración y escisión del SCCmec, y la región J, que no es esencial para la formación de SCCmec, pero puede llevar genes de resistencia No β-lactámicos.,4 hasta la fecha, se han descrito 13 tipos de SCCmec, basados en la combinación de tipos de complejos génicos ccr y clases de complejos génicos mec. Los subtipos fueron definidos por polimorfismos de la región J en la misma combinación de complejos mec y ccr.5
la aparición de aislados resistentes a la oxacilina ha llevado al uso final de antimicrobianos alternativos para el tratamiento de infecciones CoNS, como el glicopéptido vancomicina. Mientras tanto, en las últimas décadas se han notificado descripciones de susceptibilidad reducida y resistencia a la vancomicina.,6 la susceptibilidad reducida a la vancomicina puede estar relacionada con modificaciones metabólicas como la aceleración en la síntesis de peptidoglicanos, lo que resulta en un engrosamiento de la pared celular. En este proceso, la vancomicina no es capaz de inhibir la síntesis de peptidoglicanos, ya que se agota debido a la mayor disponibilidad de sitios de D-alanil-D-alanina.,7
dado el aumento de infecciones hospitalarias causadas por CoNS, este estudio tuvo como objetivo caracterizar las cepas resistentes a la oxacilina y determinar la susceptibilidad antimicrobiana de una colección de 20 años de hemocultivos aislados CoNS de pacientes internados en el Hospital de las Clínicas de Botucatu.
Material y metódicos
se aislaron trescientas cepas de CoNS de hemocultivos de pacientes hospitalizados del Hospital de Clínicas de Botucatu – Universidad Estadual Paulista (UNESP)., Los aislados fueron recolectados entre 1990 y 2009 y mantenidos en el laboratorio de colección de cultivos del Departamento de Microbiología e Inmunología del Instituto de Biociencias de Botucatu – UNESP. Los criterios de selección consideraron una prevalencia media de eventos del 35%, con un margen de error del 5% y un intervalo de confianza del 95%.
las cepas fueron aisladas según Koneman et al.8 aislamientos de agar sanguíneo fueron sometidos a tinción de Gram para observación de la morfología de la colonia y se realizó la prueba de catalasa para confirmación del género Staphylococcus., Las cepas estafilocócicas se sometieron a la prueba de coagulasa para la diferenciación de los grupos coagulasa-negativo y coagulasa-positivo. Los aislados coagulasa negativos fueron sometidos a pruebas bioquímicas para la identificación fenotípica de especies. La identificación genotípica se realizó utilizando cebadores dibujados sobre secuencias conservadas adyacentes a genes 16S y 23S, por ITS-PCR (internal transcribed spacer–polymerase chain reaction), descrita por Couto et al.9 la eficiencia de amplificación fue monitoreada por electroforesis en agarosa metafórica al 3% y teñida con SYBR Safe., The following lineages of international reference were used: S. auricularis ATCC 33753, S. capitis subsp. capitis ATCC 27843, S. capitis subsp. urealyticus ATCC 49325, S. caprae ATCC 35538, S. cohnii ATCC 49330, S. cohnii subsp. cohnii ATCC 29974, S. epidermidis ATCC 12228, S. epidermidis ATCC 35983, S. hemolyticus ATCC 29970, S. hominis ATCC 27844, S. hominis subsp. novobiosepticus ATCC 700237, S. lentus ATCC 700403, S. lugdunensis ATCC 700328, S. saprophyticus ATCC 15305, S. schleiferi subsp. schleiferi ATCC 43808, S. sciuri subsp. sciuri ATCC 29062, S. simulans ATCC 27851, S., xylosus ATCC 29979, and S. warneri ATCC 10209.
extracción de ADN
se utilizó el kit Illustra (GE Healthcare) para la extracción de ADN. Los pasos incluyeron una digestión inicial de células estafilocócicas con lisozima (10 mg / mL) y proteinasa K (20 mg/mL). A continuación, se agregaron 500µL del tampón de extracción a la mezcla, que se centrifugó a 10,000 x g durante 4 minutos. El sobrenadante se transfirió a una columna y se centrifugó a 5.000 g durante 1 min. Se descartó el fluido y se añadieron 500µL de tampón de extracción a la columna., Después de la centrifugación y el descarte del fluido recogido, se agregaron 500µL de tampón de lavado a la columna, que se sometió a centrifugación a 20,000 g durante 3min. A continuación se transfirió la columna a un tubo de 1,5 mL y se realizó la elución con 200µL de agua Miliq calentada a 70°C.
se realizó la detección del gen mecA
PCR para la detección del gen mecA. Las reacciones se realizaron utilizando un protocolo descrito por Murakami et al.10 la eficiencia de amplificación fue monitoreada por electroforesis en gel de agarosa al 2% teñido con SYBR Safe.,
determinación de SCCmec
el tipo SCCmec se determinó en cepas mecA-positivas. Las reacciones se realizaron utilizando un protocolo descrito por Oliveira et al.11 y modificado por Machado et al.12
se realizó PCR Multiplex en 50µl de volumen de reacción con 1x tampón enzimático, 1.,25 U Taq polymerase DNA, 200 μM dNTP Mix, and the following primers: 10pmol of RIF2 F2 (TTCGAGTTGCTGATGAAGAAGG) and CIF2 R2 (ATTTACCACAAGGACTACCAGC), 6pmol of KDP F1 (AATCATCTGCCATTGGTGATGC) and KDP R1 (CGAATGAAGTGAAAGAAAGTGG), 5pmol of DCS F2 (CATCCTATGATAGCTTGGTC) and DSC R1 (CTAAATCATAGCCATGACCG), 5pmol of RIF4 F3 (GTGATTGTTCGAGATATGTGG), and RIF4 R9 (CGCTTTATCTGTATCTATCGC). For each reaction, 10μL DNA was added. The cycle sequencing reactions were performed at 92°C for 3min, followed by 30 cycles of 92°C for 1min, 56°C for 1min, and 72°C for 1min and 30s., La eficiencia de amplificación fue monitoreada por electroforesis en gel de agarosa al 2% teñido con SYBR Safe.
determinación de la concentración mínima inhibitoria (CMI) mediante la prueba E
se probó la susceptibilidad in vitro de las cepas CoNS para los siguientes antimicrobianos: oxacilina, vancomicina, daptomicina, Linezolid, Quinupristina/Dalfopristina y tigeciclina. La CMI de estos fármacos se determinó mediante la prueba E. Los criterios utilizados para la clasificación de susceptibilidad fueron: oxacilina
µg / mL (susceptible) para CoNS, excepto S., lugdunensis (susceptible ≤2μg/mL and resistant ≥4μg/mL); Vancomycin μg/mL (susceptible), 8–16μg/mL (intermediate resistant), and >32μg/mL (resistant); Linezolid ≤4μg/mL (susceptible); Daptomycin ≤1μg/mL; Quinupristin/Dalfopristin ≤1μg/mL (susceptible), 2μg/mL (intermediate), and ≥4μg/mL (resistant); Tigecycline ≤0.5μg/mL.,13test de cribado para la detección de sensibilidad reducida a vancomicina
con el fin de detectar sensibilidad reducida a vancomicina, se utilizó una prueba de cribado de agar preparada con Agar brain Heart Infusion (BHI) y 4 µg/mL, 6 µg/mL, 8 µg/mL y 16 µg/mL de vancomicina. Se utilizó como control negativo la cepa de referencia S. aureus ATCC 29213, susceptible a vancomicina, y como control positivo la cepa E. faecalis ATCC 51299, resistente a vancomicina. Puntos de un 2.,Se añadió 0 inóculo de McFarland a la placa de Agar y se incubó a 35°C durante 24h, y se consideró como resultado positivo el crecimiento de al menos una colonia.
análisis del espesor de la pared celular
Las cepas CoNS que presentaron susceptibilidad reducida a vancomicina fueron sometidas a la microscopía electrónica de transmisión para el análisis del espesor de la pared celular. Las cepas se cultivaron en caldo BHI y se incubaron a 37° C durante 24h. en un microtubo, se centrifugaron 1000µL de caldo de cultivo CoNS durante un minuto a 12.000 rpm. Después de desechar el sobrenadante, las cepas se fijaron en una solución de Karnovsky (2.,5% de glutaraldehído en tampón de fosfato 0,1 M) durante cuatro horas. Las muestras se retiraron del fijador y se lavaron tres veces durante cinco minutos en agua destilada. A continuación, las muestras se sumergieron en tetróxido de osmio al 0,5% durante 40 minutos, antes de lavarse tres veces durante 10 minutos en agua destilada. Las muestras fueron deshidratadas usando concentraciones crecientes de alcohol: dos veces por 10min en 7.,Alcohol del 5%; dos veces para 10min en alcohol del 15%; dos veces para 10min en alcohol del 30%; dos veces para 10min en alcohol del 50%; tres veces para 15min en alcohol del 70%; dos veces para 15min en alcohol del 90%; dos veces para 10min en alcohol del 100%. Después de la deshidratación se montaron los talones y se metalizaron las muestras. Los análisis se realizaron en una microscopía electrónica de la empresa Tecnai Spirit Fei y las imágenes se obtuvieron con un aumento de 30.000×.,
Resultadosidentificación de aislados
La Tabla 1 presenta la fuente de los aislados de las especies CoNS, así como los datos demográficos de los pacientes con bacteremia.
detección del gen mecA y caracterización del SCCmec determinación de la concentración mínima inhibitoria (CMI)
la MICs de los antimicrobianos utilizados para el tratamiento de las infecciones CoNS fue determinada por el test E. Se encontró resistencia a la oxacilina en 206 (68,7%) cepas CoNS y 25 fueron resistentes a la tigeciclina (8,3%). Se detectó resistencia a la tigeciclina en 4,5% de S. epidermidis, 13,8% de S. hemolyticus, 13% de S., hominis, y 11,1% de S. lugdunensis. Para quinupristina/dalfopristina, uno de S. epidermidis aislar presentó resistencia intermedia con un MICRÓFONO de 2 µg/mL, y una S. epidermidis y uno S. hemolyticus con Micrófonos de 3µg/mL. La sensibilidad y especificidad de la CMI de oxacilina por la prueba E en comparación con la presencia de mecA fueron, respectivamente, 87,4% y 82,3%.
con respecto a las especies CoNS, la distribución de parámetros de las MIC50 y MIC90 reveló altas tasas de resistencia a la oxacilina en S. hemolyticus., Esta fue la única especie CoNS para la cual la concentración mínima para inhibir el 50% de los aislados fue >256µg/mL, reflejando la alta tasa de resistencia de S. hemolyticus a la oxacilina (Tabla 3).
se comparó el rango de CMI de cada antimicrobiano con el tipo SCCmec. Los aislados tipificados como SCCmecI presentaron mayores CMI de tigeciclina y los clasificados como SCCmecII presentaron mayores CMI de oxacilina. Las cepas de SCCmecIV mostraron los valores más altos de CMI para vancomicina, linezolid, daptomicina y quinupristina / dalfopristina (Tabla 4).
Determination of the MIC range according to SCCmec.
| MIC range (μg/ml) | ||||
|---|---|---|---|---|
| Antimicrobial | SCCmec I | SCCmec II | SCCmec III | SCCmec IV |
| Oxacillin | 0.094≥256 | 6≥256 | 0.,125≥256 | 0.125≥256 |
| Vancomycin | 0.25–2 | 0.38–2 | 0.125–2 | 0.75–2 |
| Linezolid | 0.064–1 | 0.19–0.5 | 0.047–0.75 | 0.064–1 |
| Daptomycin | 0.016–025 | 0.016–0.094 | 0.019–0.5 | 0.047–0.75 |
| Quinupristin/Dalfopristin | 0.025–1.5 | 0.094–0.5 | 0.064–1 | 0.125–2 |
| Tigecycline | 0.016–2 | 0.023–0.75 | 0.016–0.75 | 0.,032-1 |
MIC, la Concentración Inhibitoria Mínima.
Una evaluación se realizó a la oxacilina y vancomicina Micrófonos durante un período de 20 años, dividido en tres períodos de tiempo de acuerdo a la distribución de oxacilina y vancomicina MIC rangos. Para la oxacilina, en el primer período (1990-2001), se observaron valores más altos de CMI, pero aún indicando susceptibilidad., En los otros períodos (2002-2006 y 2007-2009), se observó una disminución en los valores de CMI, aún indicando susceptibilidad, así como un aumento en las tasas de resistencia. Con respecto a la vancomicina, el mismo estudio demostró diferencias significativas en los tres períodos entre las cepas con Cim de 0.047 µg/mL a 0,38 µg/mL y de 0,5 µg/mL 2,0 µg/mL (Fig. 1).
determinación de la susceptibilidad reducida a vancomicina
se observó un crecimiento de 214 (71,3%) cepas en la placa BHI con 4 µg/mL de vancomicina, 89 (29,7%) en la placa con 6 µg/mL de vancomicina y 8 (2).,6%) aislados en la placa de vancomicina de 8 µg/mL. Ninguno de los aislados creció en el medio con 16µg / mL de vancomicina. No hubo diferencias significativas en la CMI entre las cepas que no presentaron crecimiento en la placa complementada con vancomicina y las que crecieron en la placa de vancomicina de 4µg/mL. Entre los que mostraron crecimiento en el medio con 6µg/mL de vancomicina, el rango de CMI fue de 0,5–2µg/mL. Entre los que crecieron con 8µg/mL de vancomicina, el rango de CMI fue de 0,75–24µg/mL. Las cepas cultivadas con 8µg / mL de vancomicina fueron cuatro S. epidermidis, una S. hemolyticus, dos s. hominis y una S., capitis, todos resistentes a oxacilina, siendo S. epidermidis y S. capitis portadores de SCCmec III, S. hominis de SCCmec I, y S. hemolyticus con SCCmec no tipificado.
análisis del espesor de la pared celular de cepas con susceptibilidad reducida a vancomicina
el espesor de la pared celular bajo división celular se midió en ocho cepas (los valores se presentan en nanómetros, media±de). Las cuatro cepas de S. epidermidis presentaron valores medios de 21.66±1.4, 20.12±0.9, 24.24±1.3, y 14,20±1,3 nm. El aislado de S. hemolyticus mostró un espesor de pared celular de 24,88±1,7 nm. Para la S., aislado de capitis, el espesor de la pared celular fue de 19,33±1,8, y para los dos aislados de S. hominis los valores fueron de 17,68±2,1 y 24,92±1,5. Para la comparación, las cepas de referencia utilizadas S. epidermidis ATCC 12228 y S. hemolyticus ATCC29970 mostraron espesores de pared celular de, respectivamente, 14,61±1,2 y 14,73±0,7 nm. La comparación de las cepas estudiadas con los controles mostró valores más altos, variando de 17nm a 24,92 nm, con la excepción de un aislado de S. epidermidis, que presentó un valor menor en comparación con los controles (Fig. 2).,
cons evolución de la bacteremia
la posible evolución de la bacteremia a otras infecciones, como sepsis, neumonía, infección del tracto urinario, meningitis, peritonitis, enterocolitis necrotizante, onfalitis y absceso cerebral, fue seguida en 52 pacientes ingresados en las salas neonatales. De estos, en 25 (46,3%) pacientes se confirmó que los mismos contras aislados del hemocultivo eran el agente etiológico de la infección. En seis (11,1%), CoNS fue el posible agente de infección, y en 23 (42,6%) CoNS no se relacionó con la infección del paciente (Fig. 3).,
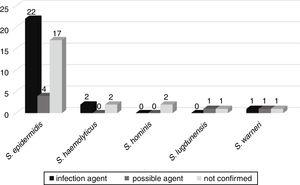
correlación de CoNS aislados de hemocultivos como posibles agentes etiológicos de infecciones causadas en pacientes de unidad neonatal.
El gen mecA se detectó en el 33 (61.1%) de estas Contras, con 20 (60.6%) Contras asociados con infecciones más graves o posibles agentes de estas infecciones.
discusión
los CoNS son considerados una de las principales causas de bacteremia., La importancia de estas bacterias ha aumentado en el entorno hospitalario durante los últimos años, principalmente debido a la resistencia a los antimicrobianos. En el presente trabajo, se estudiaron 300 cepas de CoNS aisladas de hemocultivos de pacientes internados en el Hospital de Clínicas de Botucatu, durante un período de 20 años. Estos aislados fueron caracterizados en cuanto a su susceptibilidad antimicrobiana.
la detección mecA determinó la resistencia a la oxacilina en el 78,5% de los CoNS, y el valor de la MIC50 (2µg/mL) fue indicativo de resistencia a este fármaco, confirmando la baja susceptibilidad de estas bacterias a los agentes β–lactámicos., Trabajos previos han demostrado que desde la década de 1970 los aislados CoNS han presentado mayores tasas de resistencia a la oxacilina que S. aureus.14,15 las tasas de resistencia a β-lactámicos han mostrado oscilar entre 65% y 95% en hospitales de Brasil y de otros países.2,16,17 las tasas más altas de resistencia a la oxacilina se encontraron en S. epidermidis, seguido de S. hemolyticus, S. hominis y S. capitis. Resultados similares fueron descritos en estudios previos, que mostraron resistencia a la oxacilina en el 97% de S. epidermidis entre 1999 y 2001 en una unidad de cuidados intensivos neonatales (UCIN) 18,en el 96% de S., hemolyticus aislado en Brasil19 y en el 100% de S. hominis aislado en una UCIN de España.20 con respecto a S. capitis, se encontraron resultados discrepantes en los estudios realizados por Caierão et al.21
aunque con menor frecuencia, se detectó el gen mecA en S. warneri y S. lugdunensis. S. warneri ha sido descrito con tasas de 33,3% de resistencia a la oxacilina en Ucins22, y la primera descripción de mecA en S. lugdunensis fue en el estudio realizado por Kawaguchi et al.23 a pesar de las bajas tasas de resistencia24,determinación de la susceptibilidad antimicrobiana de S., lugdunensis es importante, no solo por sus implicaciones clínicas, ya que esta especie es la más agresiva de las contras, sino también por el establecimiento de un tratamiento temprano con antimicrobianos adecuados y buenos resultados clínicos.25
la caracterización del SCCmec mostró la presencia de tipos I-IV en los aislados, siendo el SCCmecIII el más frecuentemente detectado en las cepas estudiadas, principalmente en S. epidermidis, la única especie portadora de tipo IV., El SCCmec tipo III es el más grande de todos ellos, codifica para varios genes asociados a la resistencia y es el CoNS más comúnmente aislado de especímenes hospitalarios. S. epidermidis es el principal colonizador de la piel humana y el más comúnmente detectado en sitios de infección. La presión selectiva en el entorno hospitalario conduce a la diseminación de cepas de SCCmec III, que se asocian a infecciones graves.26 El SCCmec tipo IV se ha relacionado con Staphylococcus spp asociado a la comunidad., y fue descrito por primera vez en una cepa de S. epidermidis, hecho que implica su transferencia desde S., epidermidis a S. aureus. Una transferencia de costo reducido de SCCmec IV debido a su pequeño tamaño probablemente conduciría a una mayor incidencia de infecciones causadas por portadores de SCCmec IV.12,27 SCCmecII presentó asociación con S. hemolyticus, similar a los hallazgos de Machado et al., 12 cuyo trabajo solo detectó el tipo II en esta especie.
la alternativa para el tratamiento de los estafilococos resistentes a la oxacilina es la vancomicina, un glicopéptido utilizado por primera vez en 1958 en infecciones invasivas. Sin embargo,hay descripciones de resistencia y susceptibilidad reducida a este medicamento6, aunque inestable.,28 los resultados del trabajo actual mostraron que, con excepción de la oxacilina, la vancomicina fue el fármaco con los valores más altos de MIC50 y MIC90. A pesar de la susceptibilidad total de la colección, los valores de CMI fueron los más altos en el período de 20 años, y se detectó susceptibilidad reducida en algunas cepas de S. epidermidis, S. hemolyticus, S. hominis y S. capitis. En los estudios realizados por Natoli et al., 29 se detectó susceptibilidad reducida a vancomicina con una frecuencia de 5,4% entre aislados de CoNS, en especies de S. epidermidis y S. hemolyticus., Según los mismos autores, las colonias de estafilococos cultivadas con vancomicina agar pueden conducir a la heteroresistencia a los glicopéptidos, que puede ser un precursor de la resistencia a los glicopéptidos, causando infecciones complicadas y el fracaso del tratamiento. Esto debe tenerse en cuenta en las decisiones terapéuticas.30
el aumento de la proporción de CoNS resistentes a la oxacilina y la disminución de su susceptibilidad a la vancomicina enfatizan la importancia de los estudios que involucran otras opciones terapéuticas., La tigeciclina, una glicilciclina semisintética de amplio espectro grampositiva y negativa, es considerada un fármaco con excelente actividad contra los contras susceptibles y resistentes a la oxacillina14, 29, a pesar de que nuestros datos muestran tasas de 8,3% de resistencia, con mayor frecuencia en S. hemolyticus, seguido de S. hominis, S. lugdunensis y S. epidermidis. Se describieron resultados similares de la MIC90 para tigeciclina, sin diferencia entre los CoNS resistentes a la oxacilina y los CoNS susceptibles.31 en los estudios realizados por Natoli et al.29 la tigeciclina demostró una buena actividad contra los contras., Según esos autores, la tigeciclina no está recomendada para el tratamiento de la bacteremia y su uso debe ser limitado para preservar la actividad frente a bacterias gramnegativas multirresistentes. Las mutaciones en los genes ribosómicos S10 y rpsJ y MEPA parecen estar asociadas con la resistencia a la tigeciclina.
La Quinupristina / dalfopristina es una estreptogramina perteneciente al grupo macrólido-lincosamida-estreptogramina., La combinación de quinupristina y dalfopristina es sinérgica y generalmente bactericida cuando estos agentes se comparan por separado, o se comparan con antimicrobianos macrólidos similares.34 en este trabajo, a pesar de presentar una excelente eficacia en la mayoría de los contras estudiados, se detectó resistencia intermedia a este fármaco en dos S. epidermidis y una S. hemolyticus. En el estudio realizado por Mendes et al., 35 quinupristina / dalfopristina demostraron excelente efectividad para CoNS, las cepas fueron totalmente susceptibles, con valores de MIC90 de 0.38 µg / mL para las cepas susceptibles a oxacilina y 0.,75µg / mL para las cepas resistentes a la oxacilina. Además, Venkatesh et al.36 describieron la buena efectividad de la quinupristina / dalfopristina para cepas resistentes y susceptibles a la oxacilina.
La daptomicina, un antimicrobiano estudiado durante décadas, volvió a utilizarse en 2006 para el tratamiento de la bacteremia y la endocarditis causadas por estafilococos.37 en el presente estudio, la daptomicina mostró una excelente eficacia para aislados CoNS, con valores bajos de CIM50. Olivares et al.37 también se verificó la susceptibilidad de todos los CoNS a la daptomicina, con baja variación en los valores de CMI., En un trabajo que estudia 1126 CoNS, conducido por Critchley et al., 38 la daptomicina fue activa en un rango de CMI de 0,015 a 2,0 µg/mL, y la CMI 90 fue de 0,5 µg / mL. Según estos autores, los agentes más activos en estos análisis fueron la daptomicina y la quinupristina/dalfopristina, lo que enfatiza la relevancia de estos antimicrobianos en el tratamiento de infecciones causadas por CoNS.
Linezolid, una oxazolidinona sintética potencialmente activa contra varias bacterias, es otro fármaco que ha demostrado una buena eficacia contra los contras.,39 Linezolid se ha vuelto importante para el tratamiento terapéutico de infecciones crónicas por contras, a pesar de la descripción de resistencia. En Brasil, el primer caso de resistencia a linezolid fue descrito en 2006, en un aislado clínico de MRSA40 y, entre los CoNS, en S. epidermidis, S. hominis y S. hemolyticus.41 en el trabajo realizado por Olivares et al., 37 a pesar de la detección de siete cepas resistentes a linezolid, este fármaco presentó valores efectivos de CMI en cepas CoNS. Por otro lado, un brote de s resistente a linezolid., se han reportado clones de epidermidis que contienen mutaciones en las proteínas ribosómicas L3 y L4, así como el plásmido cfr, recientemente identificado en Francia.42
S. hemolyticus fue la especie que presentó los valores más altos de CMI de oxacilina, siendo necesarias concentraciones superiores a 256µg / mL para inhibir el 50% de los aislados. Al igual que para la oxacilina, esta especie presentó valores más altos de CMI para la tigeciclina y la mayoría de los antimicrobianos probados. Varios trabajos muestran altas tasas de resistencia a los antimicrobianos utilizados para el tratamiento de infecciones causadas por S., hemolyticus, especialmente meticilina y glicopéptidos. Algunos autores describen una alta prevalencia de genes que codifican resistencia a agentes β-lactámicos y aminoglucósidos,así como una proporción significativa de aislados con valores de CMI cercanos al punto de ruptura de resistencia43,44, enfatizando la importancia de S. hemolyticus como patógeno multirresistente.
la Asociación del rango de CMI con los tipos SCCmec demostró mayores CMIS para vancomicina, linezolid, daptomicina y quinupristina/dalfopristina en S. epidermidis portadora de SCCmecIV., Los genes relacionados con la resistencia a estos antimicrobianos están mediados por plásmidos, que se encuentran principalmente en cepas resistentes a la meticilina de origen hospitalario.45 El SCCmec IV es característico de los aislados comunitarios, especialmente debido a su tamaño y bajo costo de adaptación. Los estudios sugieren que la adquisición de genes de resistencia tiene origen ambiental no clínico, dada la alta diversidad de portadores de genes de resistencia en el ambiente natural.46,47 además, el SCCmecIV solo se detectó en S. epidermidis, que como la especie más común en la piel humana es la más influenciada por la presión selectiva., Las CMI más altas en comparación con otros antimicrobianos también pueden estar relacionadas con la presión selectiva, ya que el nivel de exposición a estos fármacos en el ambiente hospitalario sesgaría la selección de susceptibilidad reducida y cepas resistentes, ya que se necesitan varios eventos de mutación, recombinación genética y modificaciones en la fisiología microbiana para generar cambios fenotípicos.,
Se observaron modificaciones metabólicas y fisiológicas relacionadas con la presión selectiva en cepas cultivadas con 8µg/mL de vancomicina agar, ya que el engrosamiento de la pared celular se encontró en la mayoría de los aislados de CoNS debido al aumento de la síntesis de peptidoglicanos. Este mecanismo es más ventajoso para CoNS que la adquisición del van operon, que es un mediador de la resistencia a vancomicina. El Van operon se adquiere por transferencia horizontal de genes y su expresión solo se estimula en presencia de glicopéptido., Este estímulo causa un costo adaptativo muy alto en presencia de vancomicina, siendo desventajoso para los CoNS en un medio de vancomicina.48,49 en cuanto a la adquisición de otros genes de resistencia en CoNS, como el gen mecA, el costo adaptativo inicial es suavizado por mutaciones adicionales compensatorias para los «costos»de resistencia. Recientemente, se ha demostrado que mutaciones puntuales en genes como vraR están asociadas con una susceptibilidad reducida a la vancomicina y engrosamiento de la pared celular en estafilococos.,50
el presente estudio mostró una alta tasa de bacteriemia causada por CoNS en unidades neonatales y pediátricas, involucrando a niños menores de un año de edad, siendo los principales agentes S. epidermidis, S. hemolyticus, S. hominis, S. lugdunensis y S. warneri. Las s. capitis no fueron aisladas en estas unidades, siendo agentes de bacteriemia en adultos ingresados en Medicina Interna, Gastroenterología, neurología y urgencias.,
como el estudio involucró bacteremia causada por estafilococos aislados durante más de 30 años, gran parte de los datos asociados a las historias clínicas de los pacientes no pudieron ser recuperados, por lo que no fue posible asociar el resultado de infección de todos los pacientes, lo cual es una limitación del presente estudio. Los datos obtenidos de pacientes en unidades neonatales indicaron la importancia clínica de la bacteremia CoNS, que puede evolucionar a enfermedades que requieren atención especializada.
El conocimiento de la resistencia antimicrobiana es de gran importancia para el correcto tratamiento de las infecciones causadas por contras., Además, los factores de virulencia de estas bacterias y la inmunidad de los pacientes son factores que contribuyen a la capacidad del microorganismo para causar infecciones más graves.
los resultados de nuestro estudio a lo largo de 20 años mostraron una alta frecuencia de resistencia antimicrobiana en contra, lo que refleja el uso excesivo de estos fármacos., Además de las modificaciones metabólicas y fisiológicas que podrían conducir a una menor susceptibilidad a los antimicrobianos, su condición como bacterias comensales humanas las convierten en transportadoras ideales y en un reservorio eficiente de genes de resistencia, especialmente de los elementos de bajo costo, como el SCCmec.45 los antimicrobianos que ofrezcan los mejores resultados deben utilizarse de manera que se preserve su eficacia y se prevenga la resistencia.,
conflictos de intereses
los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran ser interpretadas como un potencial conflicto de intereses.