Introducción
síndrome de encefalopatía posterior reversible (PRES), descrito por primera vez por Hinchey et al. en 1996, representa un trastorno neurológico con presentación clínica variada y hallazgos típicos de imágenes de patrón predominante parieto-occipital de edema vasogénico (1, 2). Existen numerosas causas documentadas de PRES, con casos descritos por primera vez en el contexto de presiones arteriales elevadas., Ejemplos de escenarios clínicos en los que se puede observar la PRES incluyen: emergencia hipertensiva, (pre)eclampsia, enfermedad renal, trastornos autoinmunes y medicamentos citotóxicos, entre otros (3, 4) (Tabla 1). La PRES puede ocurrir en cualquier grupo de edad y tiene una mayor tasa de ocurrencia en mujeres (7, 8). A pesar de que la literatura actual es relativamente escasa en comparación con las poblaciones adultas, se debe hacer una mención especial de la PRES en el paciente pediátrico., Los pacientes pediátricos tienen una presentación clínica similar a la de la población adulta, siendo la hipertensión, las convulsiones y el estado mental alterado manifestaciones comunes de la enfermedad (9). A pesar de que la mayoría de los casos de PRES pediátricos se notificaron en pacientes oncológicos, especialmente en los pacientes post-trasplante de células madre (10, 11), un estudio de Gupta et al. (12) encontraron que la enfermedad renal era quizás la causa más común de PRES en el paciente pediátrico. En su estudio, los pacientes pediátricos tendieron a presentar hallazgos de imágenes más atípicos (62,5%), incluso compromiso del lóbulo frontal (56%).,
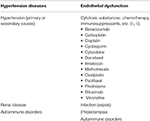
la Tabla 1. Principales estados de enfermedad asociados con PRES.
las manifestaciones clínicas son agudas a subagudas y van desde cefalea y alteraciones visuales hasta niveles alterados de conciencia y convulsiones en casos más graves (1). El tratamiento generalmente está dirigido a atacar la causa subyacente, con síntomas generalmente reversibles y hallazgos de imágenes en la mayoría de los casos (8)., Aunque los desenlaces son generalmente favorables con un manejo adecuado, los desenlaces clínicos precarios se han asociado con diabetes mellitus preexistente y compromiso del cuerpo calloso; sin embargo, actualmente faltan otros biomarcadores de imágenes confiables para el pronóstico (13). La imagen neurorradiológica juega un papel fundamental en el diagnóstico de PRES con las características típicas de imagen mejor apreciadas en la imagen por resonancia magnética (RM) (2).
Fisiopatología
El(Los) mecanismo (s) fisiopatológico (s) preciso (s) detrás de PRES aún no han sido completamente dilucidados y siguen siendo controvertidos (3)., Actualmente hay dos grandes mecanismos propuestos para la fisiopatología del PRES (Figura 1). La primera teoría propone el aumento de la presión arterial como factor primario (8). Los aumentos rápidos de la presión arterial eventualmente superan las capacidades autorreguladoras de la vasculatura cerebral causando fugas vasculares y edema vasogénico resultante (14). Existe una eventual disfunción de la barrera hematoencefálica (BBB) con proteínas que pasan a través de la unión estrecha (15)., Las áreas suministradas por la circulación posterior (arterias vertebrales, arterias basilares y arterias cerebrales posteriores) tienen un riesgo excepcional en comparación con la circulación anterior (arterias carótidas internas, arterias cerebrales medias y arterias cerebrales anteriores) debido a la falta de tono simpático de la vasculatura de la arteria basilar (8)., Una teoría relacionada propuesta por algunos postula que la hipertensión extrema resulta en vasoespasmo e isquemia local que causa ruptura de BBB y edema vasogénico resultante, como se observó en pacientes tratados con agentes inmunosupresores ciclosporina A y FK-506 (16). La alteración en la BBB causa los hallazgos típicos de edema vasogénico vs. edema citotóxico (que se puede observar en el contexto del infarto agudo y representa un aumento del contenido de agua intracelular debido a la pérdida del gradiente osmótico habitual en el contexto de la muerte celular (17).,
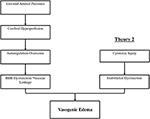
la Figura 1. Two major theories of the pathophysiology of PRES. La teoría 1 es la teoría de la hiperperfusión hipertensiva y cerebral y la teoría 2 es la teoría de la disfunción endotelial.
la segunda teoría mayor aborda el hecho de que hasta el 30% de los pacientes con PRES no exhiben las presiones arteriales elevadas necesarias para superar el control autorregulador de la vasculatura cerebral (18, 19)., Esta teoría propone que la disfunción endotelial es el principal culpable, que puede ser causada por varias toxinas endógenas o exógenas (20). Esta teoría puede explicar los hallazgos de PRES observados en pacientes que reciben medicamentos inmunosupresores y / o quimioterapia y también en pacientes con sepsis (21, 22). En este modelo, las toxinas circulantes causan lesión vascular con el desarrollo resultante de edema vasogénico. El daño endotelial causa una mayor liberación de agentes vasoconstrictivos e inmunogénicos, lo que puede causar vasoespasmo y/o aumento de la permeabilidad vascular., En última instancia, la disfunción endotelial que permite la fuga vascular y el edema vasogénico es el factor impulsor detrás del PRES, independientemente de la anormalidad primaria de la vasculatura cerebral (en el caso de la hipertensión arterial) o secundaria a las toxinas circulantes. Un resumen de estas dos teorías, así como una lista de quimioterapéuticos y otros inmunosupresores previamente reportados, se muestra en la Figura 2.
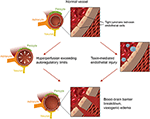
la Figura 2. Illustration of the two major theories of the underlying pathophysiology of PRES., Agradecimiento: cortesía de Caroline O » Driscoll, MA (ilustró esto por su cuenta y es una empleada de nuestra universidad).
las manifestaciones Clínicas dependen de la región(s) del cerebro; por lo tanto, la presentación puede ser amplio. Por ejemplo, la afectación primaria de los lóbulos occipitales puede dar lugar a alteraciones visuales/alucinaciones. Los déficits neurológicos focales correspondientes a la localización de las lesiones focales ocurren en ~5-15% de los pacientes con PRES (23)., En raras ocasiones, la afectación de la médula espinal puede provocar signos y síntomas clínicos de mielopatía o parálisis (24).
Imaging
como su nombre indica, el PRES se manifiesta típicamente En estudios de imagenología como edema vasogénico de materia blanca predominante posterior. Los lóbulos parietal y occipital están casi universalmente involucrados y los hallazgos son típicamente simétricos y bilaterales (1). La afectación de los lóbulos frontales, particularmente adyacentes al surco frontal superior, también se ve comúnmente., El edema vasogénico, aunque puede involucrar la materia gris cerebral, a menudo se aprecia más fácilmente en la materia blanca subcortical. El examen por TC es a menudo la prueba de imagen inicial en el contexto de los síntomas neurológicos agudos y puede demostrar hipoattenuación de la sustancia blanca en las regiones afectadas (25) (Figura 3: TC de PRES). En general, los hallazgos se representan mejor mediante RM, que muestra una mayor sensibilidad y una mejor caracterización anatómica en comparación con la TC (26). Además, la RMN puede ayudar a distinguir otros estados patológicos que pueden manifestarse clínicamente de manera similar a la PRES., Las secuencias T2-weighted y T2 FLAIR (fluid-attenuated inversion recovery), en particular, son más útiles para detectar edema vasogénico en RM (Figura 4: MR de PRES; Figura 5: MR de PRES Coronal).
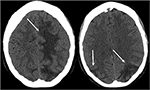
la Figura 3. Paciente con lupus eritematoso sistémico y glomerulonefritis rápidamente progresiva que presenta convulsiones. Las imágenes de TC de cabeza sin contraste muestran edema vasogénico en los lóbulos bilateral parietal y occipital, izquierdo mayor que derecho, así como extensión en el lóbulo frontal izquierdo.,
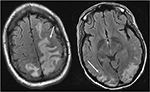
la Figura 4. Paciente con lupus eritematoso sistémico y glomerulonefritis rápidamente progresiva que presenta convulsiones. Las imágenes de T2-FLAIR de la cabeza muestran edema vasogénico en los lóbulos bilateral parietal y occipital, izquierdo mayor que derecho, así como extensión en el lóbulo frontal izquierdo. Tenga en cuenta que con el patrón vasogénico de edema, hay preservación de la anormalidad de la señal en la corteza.
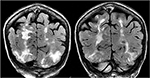
la Figura 5., Paciente con antecedentes de mielofibrosis primaria y trasplante de médula ósea en tratamiento con Tacrolimus que presenta crisis convulsivas por primera vez. Las secuencias coronales T2-FLAIR demuestran una amplia anormalidad de la señal en los lóbulos occipital y parietal bilaterales, como es típico con PRES.
el diagnóstico diferencial para PRES es amplio e incluye entidades con hiperintensidad de materia blanca T2 confluente similar., Los ejemplos incluyen: isquemia / infarto (particularmente circulación posterior), enfermedades desmielinizantes, etiologías infecciosas (meningitis, encefalitis), leucoencefalopatía multifocal progresiva (LMP), vasculitis y varios trastornos metabólicos (27). Se cree que una entidad clínicamente relacionada llamada síndrome de vasoconstricción cerebral reversible (RCVS) es causada por alteraciones en el tono vascular cerebral que resultan en vasoconstricción., Los RCVS se manifiestan como dolores de cabeza con truenos recurrentes, convulsiones, accidentes cerebrovasculares y hemorragia subaracnoidea no aneurismática (28), que podrían confundirse con PRES sobre una base clínica. Esta entidad ocurre típicamente en el período post-parto o después de la exposición a medicamentos adrenérgicos o serotoninérgicos. Los RCVS se pueden diagnosticar típicamente con estudios angiográficos que demuestran áreas multifocales de estrechamiento que involucran las arterias cerebrales (29). Este diagnóstico puede confundirse con el hecho de que los RCVS y los PRES a menudo ocurren concomitantemente, lo que el neurorradiólogo debe tener en cuenta para evitar un diagnóstico erróneo (30).,
el PRES puede distinguirse típicamente de la isquemia aguda porque esta última invariablemente demuestra edema citotóxico y restricción de difusión. La difusión restringida en la isquemia aguda se puede detectar fácilmente en la imagen ponderada por difusión (DWI) y el coeficiente de difusión aparente (ADC) como una señal hiperintensa en DWI con la señal disminuida correspondiente en ADC (debido al movimiento relativamente disminuido de las moléculas de agua intracelular)., El edema vasogénico en el entorno de PRES, por otro lado, puede mostrar una señal hiperintensa en DWI que no está acompañada por una señal disminuida correspondiente en ADC (31). Además, la isquemia aguda tiende a ser unilateral y dentro de un territorio vascular singular. Si bien la evaluación de la restricción de difusión para diferenciar el PRES de la anormalidad isquémica generalmente es confiable, hay casos raros de PRES que pueden estar asociados con áreas de restricción de difusión superpuestas a áreas del edema vasogénico aislado más clásicamente visto.,
las técnicas de imagen»avanzadas» en PRES se han descrito recientemente como una herramienta adjunta en casos difíciles o equívocos. Estas técnicas avanzadas de imagen incluyen: perfusión TC / RM, espectroscopia RM (MRS), imágenes ponderadas de susceptibilidad (SWI) y técnicas de medicina nuclear, incluyendo tomografía por emisión de fotón único (SPECT) y tomografía por emisión de positrones (PET) con radiosondas variables. Aunque una discusión completa está más allá del alcance de esta revisión, se pueden ver una variedad de hallazgos de imágenes en estas técnicas avanzadas para ayudar a sugerir un diagnóstico de PRES., Se puede observar hiperperfusión en estudios de perfusión por TAC/RM demostrada por un aumento del flujo sanguíneo cerebral y del volumen sanguíneo con reducción del tiempo hasta la perfusión y del tiempo medio de tránsito (32), aunque se han notificado casos de hipoperfusión (33). En la MRS, generalmente hay una reducción en la relación N-Acetilaspartato (NAA)/creatina (Cr) y NAA/colina (Chol), lo que sugiere una interrupción de las sinapsis normales y la función neuroaxonal (34). El IRS puede ayudar a identificar la presencia de hemorragia en el PRES, con mayor sensibilidad que las imágenes GRE (35)., Las imágenes de SPECT/PET típicamente demuestran hiperperfusión o hipoperfusión (similar a los estudios de perfusión por TC/RM) con metabolismo bajo por FDG-PET (36).
Además, el PRES puede distinguirse de otras condiciones como la encefalitis autoinmune en el contexto de la encefalomielitis diseminada aguda (ADEM) por el edema vasogénico bilateral difuso pero asimétrico del primero (37)., La LMP puede tener una apariencia similar en comparación con el PRES, con predominio parieto-occipital, pero puede distinguirse por su compromiso más unilateral o asimétrico, así como por la predilección por la sustancia blanca subcortical (38).
características atípicas de imágenes
las características atípicas de PRES incluyen áreas de realce de contraste, hemorragia o restricción de difusión (39)., Aunque los lóbulos parietal y occipital están generalmente comprometidos, se pueden observar áreas atípicas de compromiso, que incluyen: tronco encefálico, cerebelo, cuerpo calloso y otras áreas cerebrales, con áreas más comunes que incluyen los lóbulos frontales (vistos en hasta 68%) y los lóbulos temporales inferiores (hasta 40%) (23, 40) (Figura 6: cerebelo; Figura 7: tronco encefálico).
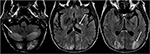
la Figura 6. Paciente con trasplante hepático 6 semanas antes. Se inició el tratamiento con Tacrolimus después del trasplante hepático., Las imágenes de T2-FLAIR del cerebro demuestran anormalidad de la señal en los lóbulos occipitales. También se observa una anomalía de señal extensa en los hemisferios cerebelosos bilaterales y dentro del tálamo. Estos hallazgos se resolvieron rápidamente después de interrumpir el tratamiento con Tacrolimus.
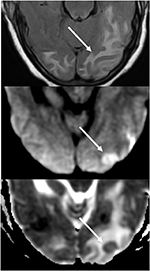
la Figura 7. Paciente con hipertensión no controlada que presenta alteración del estado mental. La imagen de T2-FLAIR (arriba) muestra edema en los lóbulos occipitales., Las imágenes de DWI (medio) y ADC map (inferior) demuestran una pequeña flecha de difusión restringida, con señal hiperintensa en DWI y la hipointensidad correspondiente en el mapa ADC.
Además, un hallazgo temprano de PRES, que puede preceder al edema parieto-occipital típico, incluye hiperintensidad de estilo sulcal leve y realce leptomeníngeo en imágenes ponderadas en T1 post-contraste, según lo descrito por Nakagawa et al. (41). Benziada-Boudour et al., (42) describieron un desarrollo concurrente de edema citotóxico, resultando en difusión restringida (Figura 8: restricción de difusión). Inherente al nombre del proceso de la enfermedad, los hallazgos relacionados con el PRES son generalmente reversibles, con normalización de los hallazgos clínicos y de imagen una vez que se trata el problema incitante. Sin embargo, en algunos casos, las áreas de difusión restringida pueden resultar en lesiones permanentes en el parénquima cerebral (Figura 9: Necrosis Laminar)., La hemorragia es menos común en el PRES, que ocurre en el 5-30% de los casos, pero debe reconocerse para no confundir este hallazgo con otra entidad patológica en el entorno clínico apropiado del PRES (39). Los hallazgos imagenológicos en la hemorragia pueden incluir: hematoma focal, hemorragia giroscópica petequial y / o hemorragia subaracnoidea (43) (Figura 10: hemorragia).
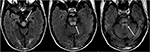
la Figura 8. Paciente con antecedentes de trasplante hepático dos semanas antes en tratamiento con Tacrolimus., Las imágenes de T2-FLAIR muestran anormalidad de la señal dentro del mesencéfalo, el puente y los pedúnculos cerebelosos superiores.
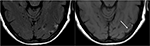
la Figura 9. La imagen de T2-FLAIR (izquierda) en un paciente con hipertensión no controlada e imagen previa que indica PRES (ver Figura 6), ahora controlada y 6 semanas después, demuestra la resolución del edema previamente visto. Se observan pequeñas áreas de gliosis debido a una lesión en el lóbulo temporal izquierdo. La T1 Axial sin contraste muestra necrosis laminar cortical curvilínea relacionada con la lesión previa relacionada con el PRES., Si bien el PRES generalmente es completamente reversible, puede resultar en lesiones permanentes en algunas situaciones.
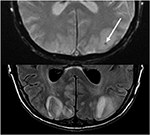
la Figura 10. Paciente con trasplante hepático previo con Tacrolimus. El eco retirado del gradiente T2 (top) demuestra un área focal de hemorragia dentro del edema vasogénico en el lóbulo occipital izquierdo. T2-FLAIR demuestra el hallazgo más típico relacionado con PRES con anormalidad de señal en los lóbulos occipitales bilaterales.,
Tratamiento
el Tratamiento de la PRES es normalmente dirigidas a controlar la etiología principal causante de PRES (44). Por ejemplo, en casos de presión arterial elevada, el tratamiento está dirigido a corregir la presión arterial elevada en un ambiente controlado, similar al abordaje de urgencia/ emergencia hipertensiva (45). Por lo general, se busca una reducción No rápida de la presión arterial para evitar el riesgo de causar enfermedad cerebral isquémica como resultado de una reducción drástica de la presión arterial (46)., Ocasionalmente, los medicamentos anticonvulsivos se usan como terapia adjunta, aunque los agentes óptimos, el momento y la duración del tratamiento siguen siendo controvertidos (4) (Figura 11: Antes y después).
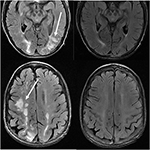
la Figura 11. Paciente con antecedentes de mielofibrosis primaria y trasplante de médula ósea en tratamiento con Tacrolimus. Las imágenes axiales de T2-FLAIR demuestran las áreas de anormalidad de la señal en los lóbulos parietal y occipital, y el lóbulo frontal derecho (imágenes izquierdas)., Se interrumpió el Tacrolimus y se obtuvieron las imágenes de seguimiento (imágenes de la derecha) 6 semanas después de las imágenes iniciales.
en los casos de (pre)eclampsia, el tratamiento está dirigido a la entrega oportuna del feto, así como el manejo de la presión arterial y el sulfato de magnesio para la profilaxis de las convulsiones (47). En el contexto de PRES inducidos por quimioterapéuticos u otros agentes inmunosupresivos, la disminución o interrupción absoluta del fármaco ha mostrado una mejoría tanto clínica como radiológica (48) (Figura 12: Eclampsia)., La hipomagnesemia es un hallazgo común en el PRES y un posible factor etiológico. Por lo tanto, los autores han sugerido que la suplementación con magnesio puede ser un complemento útil en el manejo del PRES (49).
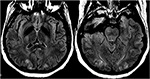
la Figura 12. Paciente con eclampsia y con convulsiones. Las imágenes axiales de T2-FLAIR demuestran anormalidad de la señal simétrica en los lóbulos occipitales bilaterales.,
conclusión
PRES es una entidad única con hallazgos clínicos y neurorradiológicos característicos, además de innumerables causas bien documentadas. Aunque el mecanismo(s) fisiopatológico (s) exacto (s) detrás del PRES aún no se ha dilucidado (y de hecho puede deberse a una combinación de procesos interrelacionados), el mecanismo generalmente aceptado es la disfunción de la barrera hematoencefálica que resulta en edema vasogénico con predominio de la circulación posterior., Las características de imagen se evalúan mejor en secuencias de RM sensibles a los fluidos que revelan hiperintensidad T2 de la sustancia blanca predominante parieto-occipital, aunque se pueden ver muchas características de imagen atípicas y se deben tener en cuenta al evaluar casos difíciles. Varias herramientas avanzadas de imágenes están disponibles para ayudar en casos difíciles o equívocos. El tratamiento está dirigido a controlar la causa subyacente con atención específica a la monitorización de la presión arterial y la posible profilaxis de las convulsiones.,
contribuciones de los autores
conflicto de intereses
los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran ser interpretadas como un potencial conflicto de intereses.
1. Bartynski WS. Síndrome de encefalopatía posterior reversible, Parte 1: imágenes fundamentales y características clínicas. Am J Neuroradiol. (2008) 29:1036–42. doi: 10.3174 / ajnr.,A0928
CrossRef Full Text | Google Scholar
3. Bartynski WS. Posterior reversible encephalopathy syndrome, Part 2: controversies surrounding pathophysiology of vasogenic edema. Am J Neuroradiol. (2008) 29:1043–9. doi: 10.3174/ajnr.A0929
CrossRef Full Text | Google Scholar
5. Singer S, Grommes C, Reiner AS, Rosenblum MK, DeAngelis LM. Posterior reversible encephalopathy syndrome in patients with cancer., Oncologist. (2015) 20:806–11. doi: 10.1634/theoncologist.2014-0149
PubMed Abstract | CrossRef Full Text | Google Scholar
6. How J, Blattner M, Fowler S, Wang-Gillam A, Schindler SE. Chemotherapy-associated posterior reversible encephalopathy syndrome: a case report and review of the literature. Neurologist. (2016) 21:112–7. doi: 10.1097/NRL.,0000000000000105
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Habetz K, Ramakrishnaiah R, Raina SK, Fitzgerald RT, Hinduja A. Posterior reversible encephalopathy syndrome: a comparative study of pediatric versus adult patients. Pediatr Neurol. (2016) 65:45–51. doi: 10.1016/j.pediatrneurol.2016.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Fugate JE, Rabinstein AA., Posterior reversible encephalopathy syndrome: clinical and radiological manifestations, pathophysiology, and outstanding questions. Lancet Neurol. (2015) 14:914–25. doi: 10.1016/S1474-4422(15)00111-8
CrossRef Full Text | Google Scholar
9. Zama, D, Gasperini P, Berger M, Petris M, De Pasquale MD, et al. A survey on hematology-oncology pediatric AIEOP centres: the challenge of posterior reversible encephalopathy syndrome. Eur J Haematol. (2018) 100:75–82. doi: 10.1111/ejh.,12984
CrossRef Full Text | Google Scholar
12. Gupta V, Bhatia V, Khandelwal N, Singh P, Singhi P. Imaging findings in pediatric posterior reversible encephalopathy syndrome (PRES): 5 years of experience from a tertiary care center in India. J Child Neurol. (2016) 31:1166–73. doi: 10.1177/0883073816643409
PubMed Abstract | CrossRef Full Text | Google Scholar
13., Hinduja a, Habetz K, Raina S, Ramakrishnaiah R, Fitzgerald RT. Predictors of poor outcome in patients with posterior reversible encephalopathy syndrome. Int J Neurosci. (2017) 127:134–44. doi: 10.3109/00207454.2016.1152966
PubMed Abstract | CrossRef Texto Completo | Google Scholar
15. MacKenzie ET, Strandgaard S, Graham DI, Jones JV, Harper AM, Farrar JK. Efectos de la hipertensión inducida agudamente en gatos sobre el calibre arteriolar pial, el flujo sanguíneo cerebral local y la barrera hematoencefálica. Circ Res., (1976) 39:33–41. doi: 10.1161/01.RES.39.1.33
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bartynski WS, Zeigler Z, Spearman MP, Lin L, Shadduck RK, Lister J. Etiology of cortical and white matter lesions in Cyclosporin-A and FK-506 neurotoxicity. Am J Neuroradiol. (2001) 22:1901–14.
PubMed Abstract | Google Scholar
21. Bartynski WS, Boardman JF, Zeigler ZR, Shadduck RK, Lister J., Posterior reversible encephalopathy syndrome in infection, sepsis, and shock. Am J Neuroradiol. (2006) 27:2179–90.
PubMed Abstract | Google Scholar
22. Mayama M, Uno K, Tano S, Yoshihara M, Ukai M, Kishigami Y, et al. Incidence of posterior reversible encephalopathy syndrome in eclamptic and patients with preeclampsia with neurologic symptoms. Am J Obstet Gynecol. (2016) 215:239.e1–e5. doi: 10.1016/j.ajog.2016.02.,039
PubMed Abstract | CrossRef Full Text | Google Scholar
23. McKinney AM, Short J, Truwit CL, McKinney ZJ, Kozak OS, SantaCruz KS, et al. Posterior reversible encephalopathy syndrome: incidence of atypical regions of involvement and imaging findings. Am J Roentgenol. (2007) 189:904–12. doi: 10.2214/AJR.07.2024
PubMed Abstract | CrossRef Full Text | Google Scholar
24., de Havenon A, Joos Z, Longenecker L, Shah L, Ansari S, Digre K. Posterior reversible encephalopathy syndrome with spinal cord involvement. Neurology. (2014) 83:2002–6. doi: 10.1212/WNL.0000000000001026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Dandoy CE, Linscott LL, Davies SM, Leach JL, Myers KC, El-Bietar J, et al., Clinical utility of computed tomography and magnetic resonance imaging for diagnosis of posterior reversible encephalopathy syndrome after stem cell transplantation in children and adolescents. Biol Blood Marrow Transplant. (2015) 21:2028–32. doi: 10.1016/j.bbmt.2015.07.023
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Noda K, Fukae J, Fujishima K, Mori K, Urabe T, Hattori N, et al., Reversible cerebral vasoconstriction syndrome presenting as subarachnoid hemorrhage, reversible posterior leukoencephalopathy, and cerebral infarction. Intern Med. (2011) 50:1227–33. doi: 10.2169/internalmedicine.50.4812
CrossRef Full Text | Google Scholar
31. Doelken M, Lanz S, Rennert J, Alibek S, Richter G, Doerfler A, et al. Differentiation of cytotoxic and vasogenic edema in a patient with reversible posterior leukoencephalopathy syndrome using diffusion-weighted MRI. Diagn Interv Radiol., (2007) 13:125–8.
Google Scholar
32. Wartenberg KE, Parra A. CT and CT-perfusion findings of reversible leukoencephalopathy during triple-H therapy for symptomatic subarachnoid hemorrhage-related vasospasm. J Neuroimaging. (2006) 16:170–5. doi: 10.1111/j.1552-6569.2006.00031.x
CrossRef Full Text | Google Scholar
33. Vanacker P, Matias G, Hagmann P, Michel P., Cerebral hypoperfusion in posterior reversible encephalopathy syndrome is different from transient ischemic attack on CT perfusion. J Neuroimaging. (2015) 25:643–6. doi: 10.1111/jon.12158
CrossRef Full Text | Google Scholar
34. Lee SY, Kim SH, Lee SH, Baek HJ, Shon HS, Kim SS. Serial MR spectroscopy in relapsing reversible posterior leukoencephalopathy syndrome. Neurologist. (2009) 15:338–41. doi: 10.1097/NRL.,0b013e3181914af6
PubMed Abstract | CrossRef Full Text | Google Scholar
35. McKinney AM, Sarikaya B, Gustafson C, Truwit CL. Detection of microhemorrhage in posterior reversible encephalopathy syndrome using susceptibility-weighted imaging. Am J Neuroradiol. (2012) 33:896–903. doi: 10.3174/ajnr.A2886
PubMed Abstract | CrossRef Full Text | Google Scholar
38., Berger JR, Aksamit AJ, Clifford DB, Davis L, Koralnik IJ, Sejvar JJ, et al. Criterios diagnóstico de LMP: declaración de consenso de la sección de enfermedades neuroinfecciosas de la AAN. Neurología. (2013) 80:1430-8. doi: 10.1212 / WNL.0b013e31828c2fa1
PubMed Abstract | CrossRef Texto Completo | Google Scholar
39. Aracki-Trenkić And, Stojanov D, Trenkić M, Radovanovic Z, Ignjatovic J, Ristic S, et al., Atypical presentation of posterior reversible encephalopathy syndrome: clinical and radiological characteristics in eclamptic patients. Bosn J Basic Med Sci. (2016) 16:180–6. doi: 10.17305/bjbms.2016.1201
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Bartynski WS, Boardman JF. Distinct imaging patterns and lesion distribution in posterior reversible encephalopathy syndrome. Am J Neuroradiol. (2007) 28:1320–7. doi: 10.3174/ajnr.,A0549
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Brickman AM, Reitz C, Luchsinger JA, Manly JJ, Schupf N, Muraskin J, et al. Long-term blood pressure fluctuation and cerebrovascular disease in an elderly cohort. Arch Neurol. (2010) 67:564–9. doi: 10.1001/archneurol.2010.70
PubMed Abstract | CrossRef Full Text | Google Scholar
47., Cozzolino M, Bianchi C, Mariani G, Marchi L, Fambrini M, Mecacci F. Therapy and differential diagnosis of posterior reversible encephalopathy syndrome (PRES) during pregnancy and postpartum. Arch Gynecol Obstet. (2015) 292:1217–23. doi: 10.1007/s00404-015-3800-4
PubMed Abstract | CrossRef Full Text | Google Scholar
48. Masetti R, Cordelli DM, Zama D, Vendemini F, Biagi C, Franzoni E, et al. PRES in children undergoing hematopoietic stem cell or solid organ transplantation. Pediatrics., (2015) 135:890–901. doi: 10.1542/peds.2014-2325
CrossRef Full Text | Google Scholar