Introducción
a diferencia de los animales que pueden moverse para evitar el entorno adverso, las plantas sésiles exhiben una adaptación altamente desarrollada a las complicadas condiciones ambientales. Para lograr esta profunda adaptabilidad, las comunicaciones entre las células son necesarias. La comunicación de célula a célula en las plantas implica un procesamiento de señalización intracelular robusto y redes de señalización intercelular intrincadas., Hasta ahora hay al menos nueve sustancias de señalización, llamadas hormonas vegetales, incluyendo auxina, brassinosteroid (BR), citoquinina, giberelinas (GA), etileno, ácido jasmónico (JA), strigolactona (SL), ácido abscísico (ABA) y ácido salicílico (SA) descubiertas (Druege et al., 2016; Verma et al., 2016). Los estudios genéticos y fisiológicos han revelado los roles críticos y los mecanismos funcionales de estas hormonas anteriores en el crecimiento y desarrollo de las plantas (Gray, 2004)., Según los estudios anteriores, la auxina, BR, GA, SL y la citoquinina funcionan principalmente durante el crecimiento y desarrollo normal de las plantas, mientras que ABA, etileno, JA y SA juegan un papel importante en la respuesta del crecimiento de las plantas a varios estreses bióticos y abióticos(Pieterse et al., 2009; Santner et al., 2009; Denance et al., 2013). Y también algunas de estas hormonas tienen papeles duales, por ejemplo, ABA también juega un papel importante en el desarrollo de la semilla y la latencia (Seo y Koshiba, 2002)., Aunque cada hormona desempeña un papel predominante en ciertos aspectos, muchas hormonas se han solapado actividades y las interacciones de diferentes hormonas controlan muchos aspectos del desarrollo y el crecimiento en respuesta al desarrollo endógeno y señales exógenas.
auxina y BR son dos clases principales de hormonas promotoras del crecimiento., BR, un grupo de hormonas esteroideas específicas de plantas que podrían interactuar con otras fitohormonas como auxina, citoquinina, etileno, GA, JA y SA y regular una amplia gama de procesos de crecimiento y desarrollo de las plantas, incluida la germinación de semillas, elongación celular, diferenciación vascular, formación y movimiento de estomas, floración y fertilidad masculina (Saini et al., 2015). Curiosamente, cada uno de estos procesos también está controlado por la auxina, lo que sugiere que estas dos hormonas interactúan para controlar el desarrollo de la planta., En esta revisión, describiremos la transducción de señales de auxina y BR con base en el progreso reciente y revisaremos la diafonía entre auxina y BR mediada por el crecimiento y desarrollo de las plantas.
vía de señalización de auxina
la auxina fue reconocida por primera vez como hormona vegetal debido a su papel en el tropismo vegetal a la gravedad o estímulos de luz., Más tarde, la auxina fue identificada químicamente como ácido indol-3-acético y se demostró que desempeña un papel esencial en una gran cantidad de procesos fisiológicos y de desarrollo de las plantas, incluida la embriogénesis, la organogénesis, la diferenciación vascular, el desarrollo de raíces y brotes, el crecimiento trópico y el desarrollo de frutos (Estelle, 2011).
utilizando análisis genéticos en Arabidopsis, el mecanismo molecular subyacente a la transducción de señales auxinas ha sido bien investigado. La respuesta del inhibidor del TRANSPORTE1 (TIR1) fue el primer receptor nuclear identificado de auxina (Ruegger et al., 1998; Dharmasiri et al., 2005)., TIR1 codifica una proteína nuclear perteneciente a la proteína F-box como una subunidad del complejo de proteína ubiquitina ligasa SCF E3 (Gray et al., 1999, 2002; Hellmann et al., 2003; Quint et al., 2005), además de TIR1, hay tres proteínas F-box adicionales, a saber, las proteínas F-BOX (AFBs) que muestran actividad de unión a auxina y median la señalización de auxina en Arabidopsis (Badescu y Napier, 2006). El receptor TIR1 puede interactuar con un grupo de proteínas AUX/IAA (auxina/ácido indol-3-acético) (Dharmasiri et al., 2003)., Las proteínas AUX/IAA son reguladores negativos de la señalización auxina y hay 29 miembros de AUX/IAA codificados en el genoma de Arabidopsis. Las proteínas AUX/IAA podrían interactuar con la clase de reguladores transcripcionales, los factores de respuesta auxina (ARF), para mediar las respuestas transcripcionales a la auxina. Bajo un alto nivel de auxina, las proteínas AUX/IAA interactúan con TIR1 como coreceptor de auxina, y pueden ser ubiquitinadas por el complejo SCFtir1 y, por lo tanto, degradarse a través de la vía ubiquitina–proteasoma (Gray et al., 2001; Lanza et al., 2012)., Tras la destrucción de los represores AUX/IAA, los reguladores transcripcionales de auxina ARF que incluyen 23 membresías pueden ser liberados de la represión AUX/IAA y, por lo tanto, mediar las respuestas de auxina por activación o represión de genes diana (Guilfoyle y Hagen, 2007). Los diferentes conjuntos de proteína F-box y AUX / IAA o ARFs inferen la complejidad durante la transducción de señales de auxina (Goh et al., 2012; Guilfoyle, 2015; Salehin et al., 2015).,
la acción coordinada de los represores transcripcionales Aux/IAA y los factores de transcripción ARF produce redes complejas de regulación génica que también fueron reportadas en Physcomitrella (Lavy et al., 2016). Recientemente, se encontró que la subunidad CULLIN1 (CUL1) del SCF interactúa con TIR1 y, por lo tanto, regula la estabilidad de los sustratos TIR1 y la señalización auxina (Wang et al., 2016). La interacción entre TIR1 y Aux / IAA también está influenciada por la conformación espacial de Aux / IAAs, controlada por una ciclofilina isomerasa LRT2 en arroz (Jing et al., 2015)., El factor de choque térmico 90 (HSP90) y la co-chaperona SGT1, respectivamente, interactúan con TIR1 y, por lo tanto, regulan la estabilidad de TIR1, lo que afecta las interacciones entre TIR1 y Aux/IAA y la señalización auxina (Wang et al., 2016).
Además de la vía canónica de señalización auxina dependiente de TIR1, se ha informado recientemente que la auxina provoca una amplia gama de respuestas de desarrollo a través de un mecanismo de señalización auxina no canónica., En este proceso no canónico de detección de auxinas, ARF3 / ETTIN controla la expresión génica a través de interacciones con factores de transcripción específicos del proceso, lo que enriquece altamente la diversidad del desarrollo vegetal mediada por auxinas (Simonini et al., 2016, 2017).
BR vía de señalización
BRASSINOSTEROID fue descubierto por primera vez en el polen por su capacidad para promover el alargamiento celular. Más tarde se descubrió que la BR juega un papel en una amplia gama de aspectos del crecimiento de las plantas y puede responder a las tensiones bióticas y abióticas., Hoy en día, la vía de transducción de señales BR se clarificó en gran medida mediante combinaciones de diferentes métodos, incluyendo Genética molecular, Bioquímica, proteómica y genómica, etc. La cinasa de superficie celular insensible al BRASINOESTEROIDE 1 (BRI1) fue identificada como el receptor de BR que puede unirse al dominio extracelular de BRI1 y activar su actividad quinasa y así activar una cascada de señales para regular la transcripción (Li y Chory, 1997; Wang et al., 2001; Kinoshita et al., 2005; Kim y Wang, 2010; Clouse, 2011; Hothorn et al., 2011; She et al., 2011; Oh et al., 2012)., Tras la percepción de BR, BRI1 interactúa con el co-receptor BRI1 asociado a la quinasa 1 (BAK1) y su homólogo somático Embryogenesisreceptor quinasas (SERKs) para formar un complejo receptor BR más activo (Li et al., 2002; Nam y Li, 2002; Wang et al., 2005; Tang et al., 2008; Gou et al., 2012). Bri1 activado fosforila dos sustratos de cinasas citoplasmáticas similares a receptores anclados a la membrana plasmática: cinasas de señalización BRASSINOSTEROIDE1 (BSK1) y crecimiento diferencial CONSTITUTIVO1 (CDG1) (Tang et al., 2008; Kim et al.,, 2011), que a su vez fosforila una fosfatasa de tipo PP1 llamada BRI1-SUPRESOR1 (BSU1) para activar la BSU1, lo que lleva a la defosforilación de la BSU1 y la inactivación de la cinasa BRASSINOSTEROID insensible a la gsk32 (BIN2). La actividad quinasa de BIN2 también es inhibida por la histona deacetilasa HDA6, que interactúa y deacetilata en el K189 de BIN2., Cuando los niveles de BR son bajos, BRI1 es quiescente debido a su regulador negativo, el inhibidor de la cinasa BRI1 1 (BKI1) y la proteína fosfatasa 2A (PP2A), mientras que BIN2 fosforila dos factores de transcripción homólogos de BR, BRASSINAZOLE RESISTANT1 (BZR1) y BZR2 (también llamado BES1 para BRI1-EMS-supresor 1) (he et al., 2002; Wang et al., 2002; Yin et al., 2002; Mora-Garcia et al., 2004; Kim et al., 2009, 2011; Kim y Wang, 2010). Cuando los niveles de BR son altos, BIN2 se inactiva, y BZR1 y BZR2 son desfosforilados por PP2A, y se mueven hacia el núcleo para alterar la expresión de miles de genes de respuesta de BR (He et al.,, 2005; Yin et al., 2005; Sun et al., 2010; Tang et al., 2011; Yu et al., 2011).
la sinergia entre la señalización de BR y auxina
las vías de señal de auxina y BR juegan papeles Diversos, Sin embargo, también mostraron interacciones sinérgicas e interdependientes en una amplia gama de procesos de desarrollo. Por ejemplo, tanto la auxina como las señales BR pueden promover la expansión celular e interactuar sinérgicamente para promover el alargamiento de los hipocótilos (Nemhauser et al., 2004)., La respuesta de una de las dos vías para promover la elongación hipocótilo requiere la función de la otra y la interdependencia entre las vías BR y auxina (Nemhauser et al., 2004). La auxina aumentó la longitud del hipocotilo en plantas silvestres, pero no en el mutante bri1-116 insensible, y este fenotipo de bri1-116 insensible a la auxina fue suprimido por el mutante dominante de ganancia de función bzr1-1D, lo que indica que se requiere BR O bzr1 activo para la promoción de la auxina de elongación del hipocotilo., Se ha encontrado que la señalización de BR converge con el supresor del Fitocromo B4-3 (SOB3) para controlar la elongación celular y el crecimiento del hipocotilo a través de la regulación de la auxina inducida por auxina pequeña up RNA19 (Saur19) expresión (Favero et al., 2017). Por otro lado, recientemente se ha encontrado que el factor de transcripción regulado por auxina SMALL ORGAN SIZE 1 (SMOS1) controla la expansión celular a través de la interacción directa con SMOS2/DLT, un miembro de la familia GRAS de co-reguladores transcripcionales que desempeña un papel positivo en la señalización de BR en el arroz (Kim et al., 2009; Tong et al., 2012; Hirano et al., 2017)., Los mutantes relacionados con auxinas como iaa3 y arf6 / arf8 fueron menos sensibles al BR que el tipo salvaje para la elongación del hipocotilo, y abolieron la hipersensibilidad de bzr1-1d a la auxina, lo que sugiere que la promoción de BR y BZR1 de la elongación del hipocotilo requiere ARF6/8. El análisis ChIP-Seq de todo el genoma reveló que ARF6 comparte un gran número de objetivos genómicos (alrededor del 50%) con BZR1 y el factor de transcripción regulado por luz/Temperatura PIF4 mediante análisis CHIP-Seq (Oh et al., 2014)., BZR1 y PIF4 interactúan con ARF6 y activan genes diana compartidos al unirse a genes diana compartidos cooperativamente durante la elongación de hipocótilos(Oh et al., 2014) y muchos de estos genes diana superpuestos codifican proteínas de la pared celular involucradas en la expansión celular.
Brassinosteroid and auxin also play important roles in the maintenance of root apical meristem (RAM) (Durbak et al., 2012). La RAM consiste en un pequeño grupo de células que se dividen raramente conocidas como el centro quiescent (QC), rodeadas por células madre que dan lugar a los diversos tipos de tejido toot., El mantenimiento de la población de células madre radiculares está regulado por la HOMEOBOX 5 relacionada con WUSCHEL (Wox5) (Sarkar et al., 2007). WOX5 está restringido al control de calidad por la señalización auxina y facilita la expresión adecuada de los genes PLT (Aida et al., 2004; Ding y Friml, 2010). Las mutaciones en el gen BRASSINOSTEROID insensible 1 (BRI1) dan lugar a una progresión aberrante del ciclo celular en el carnero y causan un carnero más pequeño (Gonzalez-Garcia et al., 2011; Hacham et al., 2011). Se sabe que la auxina estimula la biosíntesis del BR (Chung et al.,, 2011), pero la actividad del BR no afecta la expresión de los genes PIN (Hacham et al., 2011). Los fenotipos de la punta de la raíz de los mutantes BR no muestran los mismos que los mutantes auxinas (Gonzalez-Garcia et al., 2011), indicando que el BR actúa sobre la RAM independientemente de la auxina.
Las señales de Brassinosteroides y auxinas también se requieren sinérgicamente en la formación de patrones radiales de haces vasculares (Ibanes et al., 2009)., Por las combinaciones de modelos matemáticos y experimentos biológicos, auxina máxima, establecida por el transporte polar asimétrico de auxina, pero no cambios en los niveles de auxina es importante para el posicionamiento de los haces vasculares. Se demostró que la señal BR sirve como una señal promotora para el número de células en el anillo provascular que son consistentes con auxina máxima. Por lo tanto, el establecimiento de la disposición periódica de los haces vasculares en el brote está bajo la acción coordinada de estas dos hormonas vegetales (Ibanes et al., 2009)., Ambas señales también están involucradas en el desarrollo de la raíz de la planta y la interacción de BR y auxina es mediada por BREVIS RADIX (BRX) durante este proceso. BRX es importante para la biosíntesis limitante de velocidad de BR y la aplicación exógena de BR puede rescatar defectos mutantes de brx. Además, la expresión génica sensible a la auxina se ve afectada globalmente en el mutante brx, y la expresión de BRX es fuertemente inducida por la auxina y suprimida por el BR, lo que implica que la biosíntesis de BR y la señalización de auxina están conectadas a través de un bucle de retroalimentación que involucra a BRX durante el desarrollo de la raíz (Mouchel et al., 2006).,
Los Brassinosteroides y la auxina también desempeñan funciones sinérgicas durante el desarrollo lateral de la raíz. Los BRs funcionan principalmente en la iniciación de primordios de la raíz lateral, mientras que la auxina es necesaria tanto para la iniciación como para las etapas de emergencia de la formación de la raíz lateral (Casimiro et al., 2001; Bhalerao et al., 2002; Benkova et al., 2003; Bao et al., 2004). Durante estos procesos, los BRs aumentan la iniciación de LRP al promover el transporte acropetal de auxinas en la raíz, pero no al afectar el nivel endógeno de AIA(Bao et al., 2004)., Todos estos informes sugieren que la diafonía entre BR y auxina juega un papel importante en la regulación del crecimiento y desarrollo de las plantas.
BR regula la señalización auxina
Además de la interdependencia y cooperación de las señales auxina y BR durante el desarrollo de la planta, BR podría mediar la vía de la señal auxina en múltiples niveles. BZR1 interactúa con las proteínas ARF para dirigirse directamente a múltiples componentes de señalización de auxinas y genes involucrados en el metabolismo de las auxinas, como el transporte y la señalización, incluidos AUX/IAA, PINs, TIR1 y ARFs, etc. (Sun et al., 2010)., Se encontró que las proteínas Aux / IAA están involucradas en las respuestas de BR y los mutantes iaa7/axr2-1 e iaa17/axr3-3 mostraron una sensibilidad aberrante de BR y una expresión génica inducida por BR aberrante de una manera dependiente de órganos (Nakamura et al., 2006). El tratamiento exógeno del brassinolide (BL) podría inducir la expresión de genes auxin-responsivos tales como IAA5, IAA19, IAA17, etc., y la expresión de los genes anteriores está regulada hacia abajo en el mutante biosintético BR de-etiolated2 (det2), lo que indica que la biosíntesis funcional de BR es parcialmente necesaria para la expresión génica dependiente de auxinas (Nakamura et al.,, 2003; Kim et al., 2006). Además, BR también afecta el flujo de auxinas al regular la expresión de los exportadores de auxinas como PIN4 y PIN7 (Nakamura et al., 2004). Durante las respuestas de gravitropismo de la planta, BRs podría mejorar la acumulación polar del exportador de auxina PIN2 en la zona de meristemo de la raíz y, por lo tanto, afectar la redistribución de auxina desde la punta de la raíz hacia las zonas de elongación y dar lugar a la diferencia de los niveles de IAA en ambos lados superior e inferior de las raíces para inducir el gravitropismo de la planta., Durante este proceso, la ROP2 activada por BR juega un papel importante en la modulación de la localización funcional de PIN2 a través de la regulación del montaje/reensamblaje de f-actins (Li et al., 2005). Otros estudios mostraron que la disminución de la percepción y/o la concentración de BL podría inducir CYP79B2, el gen que codifica una enzima que convierte el triptófano en indol-3-acetaldoxima y, por lo tanto, afectar la distribución (Kim et al., 2007).
además, se encontró que la señal BR podría regular la salida de señalización auxina por su regulador negativo GSK3 quinasa BIN2., El factor de respuesta auxina ARF2 se identificó como una proteína que interactúa con BIN2 en una pantalla de dos híbridos de levadura y el ensayo de quinasa mostró que BIN2 podría fosforilar ARF2. La fosforilación de ARF2 resulta en la pérdida de su capacidad de unión al ADN y la actividad de represión de los genes diana(Vert et al., 2008). ARF2 es un bzr1 genes diana y su expresión se reduce por el tratamiento con BR (Sun et al., 2010)., Además, BIN2 puede fosforilar ARF7 y ARF19 para suprimir su interacción con AUX / IAAs y, por lo tanto, mejorar la actividad transcripcional en sus genes diana límites laterales de órganos-DOMAIN16 (LBD16) y LBD29 para regular la organogénesis lateral de la raíz (Cho et al., 2014). Sin embargo, el BR juega un papel menor durante este proceso y BIN2 está bajo el control del módulo del factor inhibitorio de diferenciación de elementos TRAQUEARIOS (TDIF)–receptor TDIF (TDR) (Cho et al., 2014). Juntos, BR puede regular las respuestas de auxina a través de influir en diferentes componentes de señalización de auxina.,
Auxin regula la señalización BR
por otro lado, auxin también puede regular la ruta de la señal BR en ciertos aspectos. La expresión de DWARF4, una hidroxilasa crucial para la biosíntesis de BR para controlar el nivel endógeno de BR, es dependiente de auxinas. El tratamiento con auxina podría estimular notablemente la expresión de DWARF4 y la auxina podría inhibir la Unión de BZR1 al promotor de DWARF4. La inducción de DWARF4 por auxina requiere la vía de señalización de auxina, pero no la vía de señalización de BR (Chung et al., 2011; Yoshimitsu et al., 2011)., CPD catalizando la oxidación de C-3 de BR fue activada por BRX, un putativo factor de transcripción que actúa aguas abajo de la señalización auxina (Mouchel et al., 2006). Estudios posteriores en rice indican que la auxina exógena puede mejorar los niveles de expresión de transcripción del gen del receptor BR OsBRI1, lo que sugiere que la auxina mejora la señalización BR a través de la regulación de los receptores BR (Sakamoto et al., 2013). Además, el promotor de OsBRI1 posee un motivo de elemento de respuesta auxina (AuxRE) aguas arriba que está dirigido por factores de transcripción ARF., Por otra parte, los estudios de mutantes indican que tras la mutación de AuxRE, la inducción de la expresión de OsBRI1 por auxina se suprime y también la expresión de OsBRI1 se regula hacia abajo en el mutante arf (Sakamoto et al., 2013). Se ha informado que OsARF19 se une al promotor de OsBRI1 y regula positivamente su expresión que luego activa la señalización BR (Zhang et al., 2015). BES1 puede unirse al promotor del ARN 15 de auxina-UP pequeño (SAUR15) y mediar el gen de respuesta temprana BR en Arabidopsis, y esta unión podría mejorarse con el tratamiento con auxina (Walcher y Nemhauser, 2012)., En conjunto, la auxina también puede afectar las respuestas de BR y el crecimiento y desarrollo de las plantas regulado por BR.
Observaciones Finales y perspectiva futura
durante las últimas casi cuatro décadas, los estudios sobre las interacciones de la vía auxina-BR han atraído cada vez más el interés de los investigadores. El uso de herramientas fisiológicas, moleculares, genéticas y bioquímicas ha profundizado enormemente nuestra comprensión de este tema., En base a los estudios previos, BR y auxina están involucrados sinérgicamente en múltiples procesos de desarrollo de plantas incluyendo: elongación hipocótilo, desarrollo de haces vasculares, desarrollo de raíces y tropismos, etc. La interdependencia y la cooperación entre auxina y BR son complicadas e implican numerosos procesos a nivel molecular, al compartir los mismos genes diana, regulándose mutuamente en múltiples niveles (Figura 1).
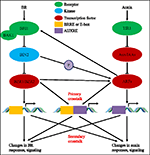
la FIGURA 1. Modelo de auxina brasinoesteroides (BR) de la interferencia., En Arabidopsis, las percepciones de la señal de Br y auxina son reconocidas por los receptores BRI1 y TIR1, respectivamente. BR Se une al dominio extracelular de BRI1 y promover que interactúa con el co-receptor BAK1 para formar un complejo receptor BR más activo, que a su vez conducen a la desfosforilación e inactivación de BIN2. La inactivación de BIN2 conduce a la desfosforilación de dos factores de transcripción homólogos BR BZR1 y bzr2, que se mueven hacia el núcleo para activar la transcripción de genes que contienen BRRE o E-box en su región promotora., BIN2 también puede fosforilar ARF7 y ARF19 para suprimir su interacción con AUX / IAAs y por lo tanto mejorar la actividad transcripcional en sus genes diana. TIR1 recibe la señalización de auxina e interactúa con las proteínas AUX/IAA como co-receptor de auxina. El AUX / IAA luego se degrada a través de la vía ubiquitina-proteasoma, y los reguladores transcripcionales de auxina los factores de respuesta de auxina (ARFs) se liberan de la represión AUX/IAA y activan la transcripción de genes con elementos de respuesta auxina (AUXRE) en su región reguladora., Algunos ARFs pueden también atar al promotor de BRI1 y regula positivamente su expresión que entonces activa la señalización del BR. La diafonía primaria ocurre por la activación de genes que contienen tanto BRRE / e-box como AUXRE en su región promotora, permitiendo que ambas vías de señalización regulen directamente la transcripción. La interferencia secundaria ocurre a través de la expresión de genes que responden a auxina o BR, pero cuyas actividades controlan la expresión de genes que regulan la respuesta y la señalización de otras hormonas.,
la regulación de la fosforilación juega un papel crucial en la vía de señalización del BR, especialmente durante el proceso de percepción, el BR se percibe a través del receptor BRI1 quinasa y co-receptores BAK1 quinasa, y finalmente controla la expresión génica regulada por el BR a través de la influencia de factores de transcripción posteriores como las actividades BES1/BZR1 (he et al., 2005; Yin et al., 2005; Sun et al., 2010; Tang et al., 2011; Yu et al., 2011). Sin embargo, la regulación de la ubiquitinación parece esencial para la señalización de auxinas., Una vez que la auxina se une al receptor TIR1, que actúa como una ubiquitina E3-ligasa, la TIR1 E3-ligasa activada ubiquitina las proteínas AUX/IAA, conduce a la degradación de estos represores y des-reprime los factores de transcripción ARF, y eventualmente causa cambios en el patrón de expresión génica regulada por la auxina y respuestas de crecimiento (Gray et al., 1999, 2002; Hellmann et al., 2003; Quint et al., 2005). Ya que se ha encontrado que la bin2 quinasa, que es bien conocido el funcionamiento en la señalización BR, podría fosforilar y mejorar las actividades de ARFs como ARF2 y ARF7(Vert et al., 2008; Cho et al.,, 2014), será interesante probar si las quinasas como BIN2, que están involucradas en la señalización de BR, también podrían interactuar con otros componentes de señalización de auxinas como el receptor TIR1 o los represores AUX/IAA, e influir en la actividad de la ligasa TIR1 E3 O en las estabilidades de las proteínas AUX/IAA. Por otro lado, el papel de la ubiquitinación en la señalización de BR también debe abordarse, especialmente si la TIR1 E3-ligasa podría interactuar directamente con los componentes de señalización de BR y regular sus estabilidades proteicas.,
Además, utilizando la respuesta de auxina DR5 y otros reporteros de auxina, se ha observado que la auxina regula el crecimiento y desarrollo de las plantas de una manera dependiente de tejidos o células. Las diversas salidas transcripcionales dependiendo del contexto celular y ambiental (Clark et al., 2014; Etchells et al., 2016; Lavy et al., 2016)., Aunque se ha demostrado que la señalización de BR espaciotemporal controla el crecimiento radicular a través de la acción antagonista con auxina (Chaiwanon y Wang, 2015), todavía se desconoce si la señalización de Br tisular o celular, que podría ser visualizada por pBZR1:BZR1-YFP, también es importante para controlar otros procesos además del desarrollo radicular. Además, la generación de un mapa de tejido o bodega detallado de las distribuciones de auxina y BR es actualmente posible utilizando la clasificación celular activada por fluorescencia o la Microdisección láser en combinación con el análisis de expresión génica de alta resolución., Esto eventualmente conduce a abordar si la auxina se cruza con BR en un tejido o de manera celular.
contribuciones de los autores
todos los autores participaron en la redacción de este manuscrito de revisión. Para obtener más información sobre lo que constituye la autoría, consulte nuestras pautas para autores.,
financiación
Este trabajo está respaldado por subvenciones de la Fundación Nacional de Ciencias Naturales de China (proyectos 31500229 y 31770305), la Fundación de Ciencias Naturales De La Provincia de Shandong del Programa de Investigación Básica principal (2017c03), los fondos provinciales de Shandong para jóvenes académicos distinguidos (2014jq201408).
Declaración de conflicto de intereses
los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran ser interpretadas como un potencial conflicto de intereses.
Clouse, S. D. (2011)., Transducción de señales de Brassinosteroid: desde la activación de la cinasa del receptor hasta las redes transcripcionales que regulan el desarrollo de las plantas. Plant Cell 23, 1219-1230. doi: 10.1105 / tpc.111.084475
PubMed Abstract / CrossRef Full Text / Google Scholar
Estelle, M. (2011). Auxin Signaling: From Synthesis to Systems Biology; a Subject Collection from Cold Spring Harbor Perspectives in Biology. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press.
Google Scholar
Guilfoyle, T. J. (2015)., The PB1 domain in auxin response factor and Aux/IAA proteins: a versatile protein interaction module in the auxin response. Plant Cell 27, 33–43. doi: 10.1105/tpc.114.132753
PubMed Abstract | CrossRef Full Text | Google Scholar