13 de abril de 2017, por personal del NCI
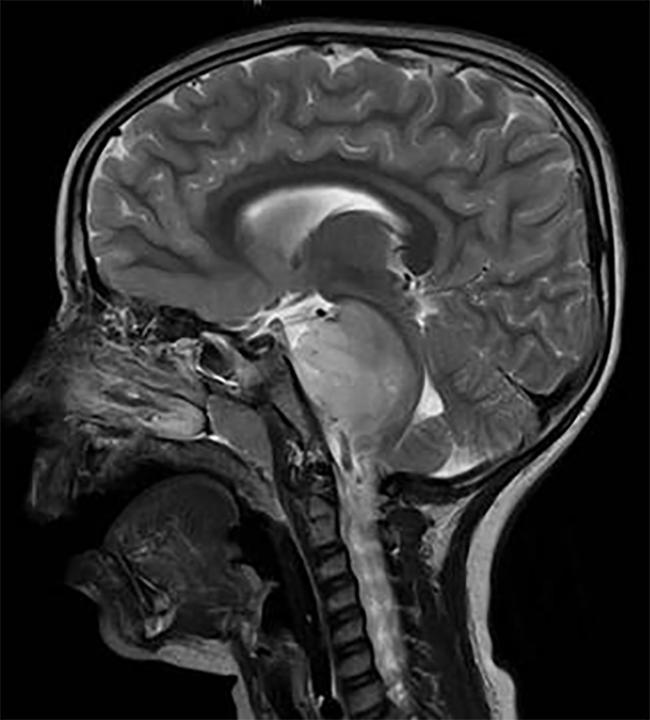
tumor DIPG, localizado en el tronco encefálico.
dos estudios separados han identificado posibles dianas terapéuticas en un tumor cerebral pediátrico inoperable, glioma Pontino intrínseco difuso (DIPG). El bloqueo de estas dianas con fármacos en investigación ralentizó el crecimiento tumoral en modelos animales de DIPG.
DIPG, un tumor que se encuentra en el tronco encefálico, es casi uniformemente mortal.,
«como neurooncólogo pediátrico, es uno de los tumores más devastadores que vemos», dijo Pratiti Bandopadhayay, M. B. B. S., Ph.D., del Dana-Farber/Boston Children’s Cancer and Blood Disorders Center, quien no participó en los estudios. «No tenemos ningún tratamiento curativo para estos tumores.»
mientras que la mayoría de los tumores DIPG portan una mutación genética específica, anteriormente no estaba claro qué papel, si es que alguno, juega la proteína mutada en el desarrollo del tumor, y si su función podría ser dirigida por terapias.,
para ambos nuevos estudios, los equipos de investigación investigaron la biología de las células DIPG humanas con esta mutación e identificaron características que pueden hacerlas vulnerables al tratamiento. En comparación con los tratamientos de control, encontraron que los medicamentos conocidos como prc2 e inhibidores de BET redujeron los tumores DIPG en modelos de ratones y alargaron la vida de los ratones.
los resultados de ambos estudios, uno de un grupo de investigación de la Universidad Northwestern y otro de un grupo de la Universidad de Copenhague en Dinamarca, se publicaron el 27 de febrero en Nature Medicine.,
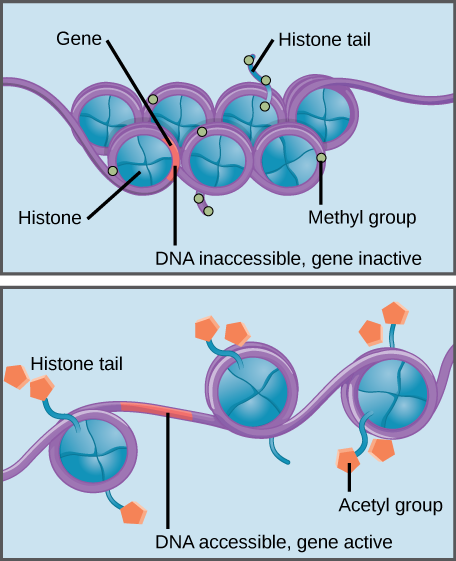
la metilación de histonas fortalece la interacción histona–ADN, haciendo que los genes asociados sean inaccesibles a la expresión génica (inactivos). La acetilación de histonas debilita la interacción, haciendo que los genes asociados sean accesibles para la expresión génica (activos).
Identifying a Target
hace unos 5 años, los investigadores que trabajan en el St., El proyecto del genoma del cáncer pediátrico de la Universidad Jude–Washington descubrió que casi el 80% de los tumores DIPG tienen una mutación específica en el gen de una proteína llamada histona H3.
que un porcentaje tan alto de tumores tengan esta misma mutación fue una sorpresa para la comunidad de investigación del DIPG, dijo Ali Shilatifard, Ph.D., de la Escuela de Medicina Feinberg de la Universidad Northwestern, investigador principal de uno de los estudios.
las histonas son una familia de proteínas que ayudan a empaquetar el ADN en estructuras compactas., Secciones cortas de ADN se enrollan alrededor de las proteínas histónicas como hilos en un carrete, y miles de histonas envueltas en ADN (llamadas nucleosomas) conforman cada cromosoma.
Las modificaciones específicas a las histonas pueden promover o prevenir la expresión génica. Por ejemplo, la Unión de compuestos químicos llamados grupos acetilo a las histonas debilita su interacción con el ADN, promoviendo la expresión génica. Por otro lado, la adición de grupos metilo a las histonas generalmente hace que el ADN se enrolle más firmemente alrededor de las histonas, impidiendo la expresión génica.,
identificar la presencia de una mutación de histona H3 en pacientes con DIPG fue el primer paso, dijo el Dr. Bandopadhayay. «Pero para poder tratar tumores con esa alteración, hay que entender lo que está haciendo la mutación», agregó.
en un estudio anterior, el Dr. Shilatifard y sus colegas usaron moscas de la fruta para estudiar la función del gen mutante histona H3. En comparación con las moscas que tenían proteínas histonas H3 normales, las moscas con la versión mutante tenían más histonas que estaban tachonadas con grupos acetil (acetiladas)., A su vez, estas histonas acetiladas estaban unidas por moléculas llamadas proteínas que contienen bromodominio (BRD), que regulan la expresión génica.
para su estudio actual, que fue financiado en parte por el NCI, los investigadores de Northwestern querían determinar si la histona mutante tenía la misma función en las células humanas. De hecho, encontraron que las células humanas del cáncer de colon o del cáncer de riñón alteradas para expresar el gen mutado de la histona H3 tenían más histonas acetiladas que las células que expresaban el gen normal de la histona H3.
el primer autor, Andrea Piunti, Ph. D.,, luego examinó todas las histonas H3 mutantes ubicadas en los genomas de las células tumorales DIPG de tres pacientes. Su análisis reveló que muchos nucleosomas que contenían histonas mutantes estaban acetilados y unidos por proteínas BRD.
experimentos adicionales mostraron que las proteínas BRD pueden desempeñar un papel directo en el crecimiento tumoral DIPG. El tratamiento de las células DIPG humanas con fármacos en investigación que bloquean las proteínas BRD, llamados inhibidores BET, ralentizó el crecimiento de las células DIPG en comparación con un tratamiento de control., Y en estudios de ratones con células DIPG humanas implantadas en sus tallos cerebrales, los tratados con inhibidores de BET tenían tumores más pequeños y vivían más tiempo que los ratones tratados con el tratamiento de control.
estos experimentos «sugieren que los inhibidores de BET proporcionan un enfoque terapéutico potencial para DIPG», dijo el Dr. Shilatifard. Los estudios preclínicos han demostrado que varios tipos diferentes de cáncer, incluidos la leucemia y el glioblastoma, también son sensibles a los inhibidores de BET, agregó.,
un objetivo adicional
el análisis del grupo Northwestern de células tumorales DIPG humanas con histona H3 mutante también reveló que, además de más acetilación de histona H3, muchas histonas estaban decoradas con grupos metilo (metilados). Además, encontraron que una enzima llamada PRC2—que une grupos metilo a las proteínas histona H3—estaba presente cerca de muchas de estas histonas.
estos resultados llevaron a los investigadores de Northwestern a profundizar en la actividad de PRC2., Encontraron que el bloqueo de la actividad de PRC2, ya sea genéticamente o con un inhibidor de PRC2 llamado tazemetostat, redujo el crecimiento de las células DIPG.
«inesperadamente, estos resultados demuestran un papel para la función PRC2 en el mantenimiento del crecimiento DIPG», escribió el grupo Northwestern.
El grupo de Copenhague también encontró pruebas que respaldan el papel del PRC2 en la promoción del crecimiento tumoral DIPG. Observaron que el tazemetostat y otro inhibidor de PRC2 redujeron el crecimiento de células cerebrales de ratón o células DIPG humanas con histonas mutantes, mientras que el tratamiento de control no lo hizo.,
y cuando implantaron células cerebrales de ratón con histonas mutantes en el cerebro de ratones normales o ratones en los que PRC2 estaba genéticamente bloqueado, aquellos que carecían de actividad PRC2 vivieron más tiempo.
en contraste, sin embargo, un estudio separado realizado por un grupo de investigación en Alemania encontró que las células de diferentes pacientes con DIPG no eran sensibles al tazemetostat, a pesar de que sus tumores tenían la mutación histona H3.
un paso adelante
décadas de ensayos clínicos han demostrado que los tumores DIPG son insensibles a la quimioterapia tradicional, explicó el Dr. Bandopadhayay., Y aunque la radiación puede aliviar los síntomas, no es curativa, y la mayoría de los niños con DIPG mueren dentro de los 2 años del diagnóstico.
en 2015, un consorcio internacional de investigadores de DIPG se unió para estudiar todas las muestras de células DIPG disponibles. Su estudio reveló que las células DIPG recolectadas de varios pacientes diferentes fueron eliminadas por un medicamento modificador de histonas llamado panobinostat (Farydak®). Panobinostat bloquea las enzimas que agregan grupos acetilo a las histonas., Ahora, los investigadores, que forman parte del Consorcio de tumores cerebrales pediátricos apoyado por el NCI, están probando la seguridad y la mejor dosis de panobinostat para niños con DIPG en un ensayo clínico de fase I.
ahora los resultados de ambos estudios apuntan a nuevas estrategias de tratamiento potencialmente prometedoras, dijo el Dr. Shilatifard.
«queremos trasladar los inhibidores de BET a un estudio de fase I para el tratamiento de DIPG, y nuestros colegas del Ann & Robert H. Lurie Children’s Hospital of Chicago están avanzando con esos estudios», dijo.,
además, en varios estudios clínicos en curso se está probando el tazemetostat, el inhibidor de PRC2, en pacientes adultos y pediátricos con diversos tipos de cáncer. Sin embargo, ningún estudio actual está investigando específicamente el tazemetostat en niños con DIPG.
todavía hay muchas preguntas sin respuesta, dijo el Dr. Bandopadhayay, incluyendo si estos medicamentos en investigación tienen la capacidad de cruzar la barrera hematoencefálica y llegar a los tumores cerebrales humanos.
Dr., Bandopadhayay y sus colegas también están aprendiendo más sobre la biología DIPG mediante el estudio de las células tumorales obtenidas de biopsias, además de las obtenidas de autopsias. La obtención de muestras de biopsia solo ha sido posible recientemente gracias a las importantes mejoras en las técnicas neuroquirúrgicas, explicó.
«Es un momento emocionante», dijo. «Hay mucho trabajo en marcha ahora mismo. El objetivo final es ser capaz de tratar a estos niños para que tengan una oportunidad de cura con efectos secundarios mínimos.»