Yleistiedot löydettiin ensimmäisen kerran vuonna 1979. Proteiini tunnistettiin simian virus 40-muuntaa hiiren solut (SV40), jonka immunoprecipitation anti-T-seerumin; tämä proteiini oli nimeltään proteiinia p53 . Samana vuonna, Kress ja muut tutkijat löysivät uuden luokan proteiineja, joiden molekyylipaino vaihtelee 50-60kDa. Tällöin tällainen proteiini tunnistettiin p53: ksi . Proteiini p53 voidaan tunnistaa myös erilaisista muuntuneista solulinjoista immunoprecipitaation avulla., Lane ja Linzer saivat samanlaisen tuloksen myös vuonna 1979. Muita todisteita tunnistaa p53 on, että p53 oli ilmaistu kaikki testattu muuttanut hiiren soluja; nämä testit sisältävät kemiallisesti aiheuttama sarkoomia, muuttuu fibroblastit, ja leukemiat, kun taas normaalit solut, p53 ei ilmaistu. Lisäksi korkean tason p53 oli havaittu eniten muuttunut solut, ei väliä kuinka solut muuttuivat, joko spontaanisti tai ei-spontaanisti ., Se oli paljolti lisääntynyt vakaus p53, kuitenkin F9 alkion carcinoa soluja, se ilmaisi korkea taso p53, tämä johtui määrä käännetty p53-mRNA: ta .
kun proteiini p53 oli löydetty vuonna 1979, siitä tuli suosittu sen analysointi. Kuitenkin, tuolloin, koska se oli äskettäin löydetty proteiini, ja ei ollut entinen nimi, eri toimielinten käyttää eri nimiä ja julkaistuja tutkimuksia, joissa on eri nimet., Jotta voidaan ratkaista tämä ongelma, vuonna 1983 aikana 1. Kansainvälisen p53-työpaja järjestetään Oxted, yhdistynyt KUNINGASKUNTA, tutkijat eri tutkimusryhmät eri maissa on yhdessä keskustella yhteinen nimikkeistö tämä äskettäin löydetty proteiini. Tässä kokouksessa ”p53″ tuli sen nimi ja sitä on käytetty siitä lähtien. Tutkijoiden arveltiin kutsuneen p53-proteiinia siksi, että tämän proteiinin molekyylimassa on 53KDA, joka perustuu sen siirtymiseen SDS-geelissä. Myöhemmin molekyylimassa osoittautui vääräksi, ja oikean molekyylimassan tulisi olla 43.,7kda koska p53 sisältää proliinipitoinen alue, ja tämä alue voi vähentää muuttoliike p53 SDS geeli. Nimi ” p53 ” kuitenkin säilyi .
1980-luvulla, proteiini p53 uskottiin olevan mukana solusyklin, sekä pelaa rooli DNA: n replikaatio. Myöhemmin, vuosina 1982-1994, ihmiset havaitsivat, että jotkut viruskoproteiinit pystyivät sitoutumaan p53: een muodostaen kompleksin. Vuonna 1982 Sarnow ym. todettiin, että adenovirus E1b (58kDa) voi vuorovaikutuksessa 54kDa proteiini, joka on läsnä SV40-muuntaa hiiren solut edellä., Tulosten mukaan immunologiset erityispiirteet T vasta-aineet ja peptidi kartat 54kDa proteiinia, tämä 54kDa proteiini on tunnistettu p53 . Samana vuonna, tutkijat huomasivat, että jos ne pistää p53-vasta-aine osaksi Sveitsin hiiren 3T3-soluissa se estää solujen tultaessa S-vaiheen solusyklin, kuitenkin, alle sama tilanne, p53-vasta-aine ei vaikuta SV40 tai adenoviruksen aiheuttama DNA-synteesiä .,
Myöhemmin, vuonna 1984, tutkijat tutki vaikutus p53-ei muuttunut 3T3 fibroblastien; he analysoivat synteesi määrä proteiinia p53 eri ajankohtina ja totesi, että myöhään G1-vaiheessa synteesi korko ja taso proteiini p53 ja siihen liittyvien mRNA lisätä. Tämä tulos viittaa siihen, että proteiini p53 estää solujen pääsyn jakamalla faasi interphase . Maltzman w ym. teki toisen kokeen samana vuonna. He kohtelivat ei muuttanut hiiri soluun, jossa UV-valo ja UV-mimeettistä kemiallisten syöpää 4NQO, ja ne havaitaan korkean tason p53., Tulos osoitti, että kohonnut ilmaus p53-ei ole vain symboli, joka ilmaisee solun sykli, mutta myös tärkeämpää on komponentti, joka on mukana DNA-synteesiä ja solujen jakautumista . Vuonna 1987, kun opiskelu monimutkainen T-antigeeni simian virus 40 ja DNA-polymeraasien α, Gannon, ja muut tutkijat huomasivat, samanlainen muutos antigeeni, kun pakko p53 ja-polymeraasi α. He havaitsivat myös, että tietty pitoisuus kolme osia, ne voivat muodostaa erityinen trimeric monimutkainen, joka sisältää T-antigeeni, p53-ja DNA-polymeraasi α., Kuten T-antigeeni on mukana viruksen DNA-replikaation ja solujen muuntaminen, tämä tulos osoittaa, että p53 on tärkeä rooli ohjata solun syklin ja DNA: n replikaatio .
kuten koe osoitti edellä, p53 pystyy ikuistamaan soluja. Vuonna 1984 Eliyahu d ym. havaittiin, että p53: lla ja onkogeeni myc: n tuotteella oli joitakin samankaltaisia ominaisuuksia. Molemmat on kyky sitoa muita proteiineja ja ovat mukana solusyklin, ja he molemmat kerääntyä ytimet muuttunut solut ., Bienz, Pennica ja Oren analysoitiin amino happo sarjoissa proteiini p53 ja tuote myc, ja he huomasivat, että kaksi proteiineja osoittavat yhtäläisyyksiä molekyylien rakenne ja sijainti erityisiä veloitetaan jäämiä. Sitten tutkijat ehdottivat, että p53 voi toimia onkogeenina. Tämän hypoteesin perusteella Eliyahu d ym. tein kokeita. Ensisijaisena korko alkion fibroblasteja voidaan transformoida osallistumista sekä myc tuote-ja Ha-ras, ensisijainen vauva rotta munuaisten soluja voidaan myös muuntaa yhteistyötä sekä Ha-ras-ja adenovirus alussa alueella 1A , Eliyahu D et al., päätti käyttää tällaista biologista testausjärjestelmää p53: n onkogeenisen toiminnan tunnistamiseen. He kohtelivat normaali alkion solujen p53 ja aktivoitu Ha-ras. Tulos osoitti, että kohdesolut kohtaavat morfologisia muutoksia ja tuottavat korkeita p53, Eliyahu D et al. ajattelin, että muutos alkion fibroblastien p53-ja Ha-ras selitti, että geeni p53 on onkogeeni ., Vuonna 1985, Jenkins ehdotti, että p53-geeni voi pidentää elinikää soluja, parantaa affectivity muutosta järjestämällä sen koodaus järjestyksessä, joka voisi aiheuttaa tuotannon vakaa proteiineja .
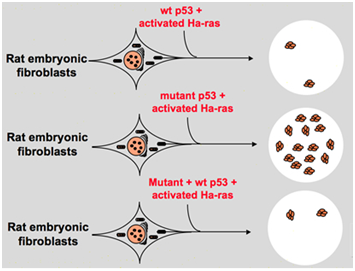
Kuitenkin, 1980-luvun lopulla tutkijat alkoivat ymmärtää, että p53 on kasvain vaimennin geeni sijaan onkogeeni. He havaitsivat, että p53-normaali toiminto ei voi havaita monissa kasvaimia ja totesi, että menettää ilmaus ja funktio villi-tyyppi p53-geeni on tarpeen aikana solu muutosta., Nämä lisäävät mahdollisuutta, että villityypin p53-geeni voi estää neoplastista etenemistä . Sitten he muotoiltu toinen hypoteesi: kloonata geenin p53 käytetty aiemmissa kokeissa sisältää hallitseva negatiivinen mutaatioita, sisällä säilytetty erittäin toimialueen satunnaisesti, joka johtaa päinvastainen kokeen tulokset . Vuonna 1988, Ben ja muut tutkijat havaittu valtava määrä jäsensi p53 hiiren èritromielozom solu linjat-DP20-1 ja CB3, jotka ovat peräisin perna hiiren tartunnan kanssa Ystävä leukemia-virus ., Vuonna 1989 Eliyahu, joka huomautti, että p53 onkogeeni muutti hänen mielensä, ja hän otaksui, että villityypin p53-geeni voi estää solujen transformaatiota. Eliyahu ja muut tutkijat tutkittu vaikutusta villityypin p53-proteiini koodattu plasmidit ja mutantti p53 kyky saada ensisijainen korko alkion fibroblastien muuttumista eri onkogeeni yhdistelmä in vitro. Esimerkiksi mutantti p53 plus ras, ja myc plus ras., Tulos osoitti, että villin tyypin p53 johtaa valtava vähentäminen muuttunut pesäkkeitä aiheuttama mutantti p53 plus ras; mutantti p53 ei osoittanut estoa muuttunut pesäkkeitä aiheuttama myc plus ras, kun myc plus ras-välitteinen transformaatio on hyvin herkkä ilme villi-tyyppi p53. Kuva 1 osoittaa tämän kokeen ytimekkäästi. Se osoitti, että verrattuna mutant p53 -, villi-tyyppi p53 näyttelyitä ilmeisesti estävä vaikutus solun muutosta. Vaikutus liittyy positiivisesti villin tyypin p53: n ilmentymistasoon ja negatiivisesti mutantin p53: n ilmentymistasoon., Tämä kokeilu ehdotti, että villin tyypin p53 voi todellakin olla päinvastainen toiminto verrattuna mutant p53 ja voi estää tuumorigeneesiin . Tällä hetkellä p53 tunnetaan kasvaimen vaimentajageeninä. Arviolta noin puolet kasvaimista on p53: n aiheuttamia. Se on yksi ihmisen useimmin mutatoituneista geeneistä ja maailman useimmin analysoitu geeni .
1980-luvun ensimmäisten vuosien aikana p53: n biokemiallinen reitti ja p53-mutaation vaikutus eivät olleet selviä. Vuonna 1991, Kern ja muut tutkijat huomasivat, että 33-emäsparin DNA-sekvenssi sitoutuu spesifisesti villi-tyyppi p53 in vitro. He havaitsivat myös, että p53-proteiinissa on kaksi mutaatiota, joita esiintyy yleensä ihmisen kasvaimissa, jotka eivät pysty sitoutumaan tähän nimenomaiseen DNA-alueeseen. Niinpä he olettivat, että p53: n toiminta riippuu sen kyvystä sitoa tiettyjä DNA-sekvenssejä, ja tätä kykyä muuttavat ihmisen kasvaimissa havaitut mutaatiot., He myös olettaa, että tämä 33-emäsparin DNA-sekvenssi voi olla vain sekvenssi, joka on kyky sitoa nimenomaan p53-ihmisille; kuitenkin, se voi auttaa ihmisiä ymmärtämään paremmin toimintaa p53 . Myöhemmin, p53 löytyi osansa aikana cell cycle, DNA-korjaus, eriyttäminen, käynnistämällä apoptoosin ja angiogeneesiä. Roter V ym. havaittiin, että p53 up-säätelee solujen erilaistumista. Esimerkiksi B-solujen erilaistumisen aikana havaittiin runsaasti p53-proteiinia useissa keskeisissä vaiheissa. Kohonnut p53 voidaan havaita myös spermatogeneesin aikana., Samaan aikaan vain hyvin alhainen p53-proteiinin määrä voidaan havaita joissakin aikuisten hiirten elimissä .
vuonna 1990 löydettiin silloin tällöin hyödyllinen työkalu. Se on p53: n lämpötilaherkkä mutantti, jota kutsutaan p53val135: ksi. Se voi toimia kuin todellinen villi-tyyppi p53 lämpötila 32,5 ° c, tukahduttaa muutosta, ja se voi toimia myös muita mutatoitunut p53 lämpötilassa 37,5 oC tai yli 48oC, aiheuttivat muutoksen. Lisäksi muuttunut solut, jotka ilmentävät p53val135, sen leviäminen on hallinnassa salliva lämpötila, ja tällaista valvontaa on palautuva., Tämän p53val135-mutantin avulla havaittiin villityypin p53 aiheuttavan solusyklin pysähtymisen joko G1-tai G2/M-nopeudella . Vuonna 1991 Elisheva ym. todettiin, että lämpötila-herkkä p53val135 suorittaa eri toiminnon hiiren myelooinen leukemia solujen rivi. P53val135: n aktivoitumisen jälkeen muutaman päivän ajan kaikki solut kuolivat, ja tällä kuolemalla on joitakin apoptoosin ominaisuuksia . Vuotta myöhemmin vastaavanlaisen tuloksen sai Shaw. Villityyppi p53 siirrettiin ihmisen paksusuolesta kasvaimesta johdettuun solulinjaan EB., Soluja tutkittiin valo-ja elektronimikroskoopeilla, ja niillä havaittiin olevan joitakin apoptoosin ominaisuuksia . Vuonna 1990 Scheffner ym. ja muut tutkijat huomasivat, että E6, joka stimuloi tuhoaminen isäntäsolun sääntely proteiineja on koodattu, jonka onkogeeniset ihmisen papilloomaviruksen tyyppejä 16 ja 18, ja se voi muodostaa monimutkaisia villin tyypin p53 in vitro, mikä puolestaan aiheuttaa hajoaminen proteiinia p53 .
Vuonna 1992, keskeinen proteiini MDM2 löydettiin, koska se sitoo tiukasti p53, ja se estää transactivation välittyy p53., Mdm2: n molekyylimassa on 90kDa, ja se muodostaa kompleksin sekä mutatoituneen että villin tyypin p53: n kanssa . Samana vuonna Livingstone RL et al. tutkittiin, menettikö solu yhden vai molemmat kopiot villityypin p53 alleeleista ja riittikö se aiheuttamaan geenien vahvistumista. Geenivahvistusta havaittiin lähinnä muuntuneissa soluissa, mutta ei normaaleissa fibroblasteissa. Tulos osoitti, että solut menettää yksi kopio p53-alleelit toimivat villi-tyyppi p53, kun solut menettää molemmat kappaleet villi tyyppi p53-alleelia esiintyy korkeamman taajuuden vahvistusta . Toinen kokeilu, jonka on tehnyt Yin y et al., tulos oli samanlainen .
vuonna 1993 tunnistettiin p53-kohdegeeni CDKN1A. Se koodaa proteiinia p21 joka on sykliini riippuvaisen kinaasin estäjä, joka estää sykliini CDK2 ja CDK1 sitoutumalla niihin. Vuonna 1993 Szekely havaitsi, että Epstein-Barr-viruksen ydinantigeeni 5(EBNA-5) on Epstein-Barr-viruksen koodaama, ja se voi tartuttaa ihmisen B-lymfoblastoidisolun. 66 aminohappoa pitkä peptidi on vastuussa muodostumista monimutkainen EBNA-5-p53, kohta mutaatioita p53 ei vaikuta sen sitova kyky EBNA-5., Se kuitenkin estää kompleksimuodostumiaan muiden molekyylien kanssa . Vuonna 1994 Cho työtovereineen kuvasi ensimmäisen kerran kompleksisen p53-DNA: n kiderakenteen. Tätä DNA: ta sitovaa verkkotunnusta kutsuttiin myös ydintunnukseksi. Se sisältää jäämiä 102-292 ja koostuu beta-voileivästä. Ne osoittivat myös ydinalueen yksityiskohtaisen rakenteen . Myös vuonna 1994 Wang XW ym. hepatiitti B-viruksen X-proteiinin (HBX) ja villin tyypin p53-proteiinin yhteisvaikutus ihmisillä., He huomasivat, että HBX voi estää kyky p53 sitoa muihin sekvenssi-spesifisiä DNA-sen jälkeen, kun se on sidottu p53 ja se voi myös estää association of p53 kanssa transkriptio tekijät .
vuonna 1997, Honda R ym. ensimmäinen arveltu, että MDM2 voi laukaista p53 ubiquitylation ja johtaa hajoamista p53, jonka ubikitiinipromoottori-proteasomi-järjestelmä. He huomauttivat, että MDM2 sitoutuu N-terminal domain (NTD) p53 ja toimii ubikitiinipromoottori ligase E3 . Myös vuonna 1997 löydettiin kaksi uutta proteiiniperhettä, p63 ja p73, joilla on huomattava homologia p53: n kanssa., p73, jota kutsutaan myös kasvain proteiinia 73, on koodattu geeni sijaitsee 1p36. Sijainti poistetaan usein neuroblastoomasta ja muista kasvaimista. p73 voi aktivoida p53-kohdegeenejä ja vuorovaikutuksessa p53: n kanssa . Yang ym. todettiin, että p63 geeni sijaitsee 3q27-29 ja se voidaan havaita eri hiiren ja ihmisen soluja. Kuten p73, p63 voi transaktivoida p53 kohdegeenit merkittävästi, se voi myös aiheuttaa apoptoosia. Yksi ominaisuus p63 on, että suurin osa p63 puutteesta N-terminus ., Samana vuonna, Serrano ja työtoverit huomasivat, että ensisijainen hiiren fibroblasteja voidaan muuntaa ras ilman p53 tai p16, ja inaktiivinen p53 tai p16 voi helpottaa immortalization prosessi ihmisen soluja. Nämä havainnot viittaavat siihen, että p53: lla on rooli solujen vanhenemisessa . Sitten vuonna 1997 p53: lla todettiin olevan rooli apoptoosin aloittamisessa. Kun solut tulevat leviämisen vaihe, telomeres lopussa kunkin kromosomin olisi lyhentää sen jälkeen, kun kunkin kierroksen DNA: n replikaatio puutteellisten replikointi yhden lohkon DNA: n lopussa DNA seistä ., Aktivoitu kasvaimen vaimentajageeni p53 rajoittaa solujen jakautumisen määrää. Wynford TD havaitsi, että villityypin p53: n toiminnan menettämisen myötä kaikki fibroblastit pakenevat apoptoosista. Myös p53: n transaktivointitoiminto voidaan kytkeä päälle apoptoosin avulla . Wynford TD ehdotti, että p53: n aktivoitumiseen on kolme mahdollisuutta. Ensimmäinen on translaation jälkeisen modifikaation fosforylaatio, toinen on ylös-säätelee transcritional cofactors, kuten p33ING1, viimeinen on alas-säännellään p53-estäjät, kuten MDM2 .
vuonna 2000, Brodsky MH ym., tutki p53: n transkriptiokohteita Drosophilassa. On näyttöä siitä, Drosophila silmät näyttää vakavia karkea silmä fenotyyppi alle ilmaus ihmisen p53, joka indusoi apoptoosia silmän imaginal levy soluja, aiheuttaen menetys pigmentti soluja, lopulta estää silmän kehitystä Drosophila , joten Drosophila voi olla malli eläinten opiskeluun toiminto p53. Brodsky totesi, että geeni rpr sisältää konsensus p53 sitova sivusto, joka sijaitsee ivy-sääntelyn alueella rpr, ja se myös on aktivaattori apoptoosin., Muita todisteita, Brodsky väitti, että rpr on yksi transkription kohde p53 . Vuonna 2001, Derry ja työtoverit huomasivat, että C. elegans ei ole p53-geenin, mutta todellakin sisältävät geeni cep-1, joka koodaa proteiineja, jotka ovat vastaavassa järjestyksessä proteiinia p53. Tämä C. elegans-geeni koodaa proteiinia CEP-1, joka on kyky aiheuttaa apoptoosin, jonka genotoksinen stressiä ja on välttämätön komponentti aikana meioosin .
vuonna 2002 Tyner ja työkaverit ehdottivat, että p53: lla olisi rooli eliöiden ikääntymisen säätelyssä., Jotta tutkimus toiminto p53, he loivat geenimuunneltuja hiiriä mutatoitunut p53 poistamalla eksonien 1-6 ja ylävirran alueella villin tyypin p53-geenin (p53+/+), nimeltä p53+/m. Se toimii wild-tyyppi p53 ja on parannettu kestävyys spontaani kasvaimia parempi kuin villityypin p53. Kokeessa he tarkkailivat hiiriä, jotka sisälsivät p53+/m, p53+/+ ja p53+/-hiiriä. p53+ / -tarkoittaa hiiriä, jotka menettävät yhden kopion villityypin p53-geenistä., Tulokset osoittivat, että yksikään hiiret p53+/m kehittynyt hengenvaarallisia kasvaimia, kuitenkin, yli 80% hiiret p53+/- ja yli 45% hiiret p53+/+ kehitetty tällaisia kasvaimia. Etsii sisällä kasvaimia, lokalisoitu kasvain vaurioita havaittiin 2 out of 35 p53+/m hiiret, sen sijaan, erilaisia kasvaimia, kuten lymfoomat, ja luusarkoomia löytyi p53+/- ja p53+/+ – hiiret. Tutkimuksessa havaittiin myös, että p53+/m: n mediaani-ikä oli 96 viikkoa, kun taas p53+/m: n mediaani-ikä oli 116-118 viikkoa., Tyner ja työkaverit tutkivat myös mahdollisuutta, että p53+/m: n lyhyempi käyttöikä liittyisi ikääntymiseen. He huomasivat, että 18 kuukauden jälkeen, p53+/m hiiret alkoi laihtua ja tarmokkaasti, kuten p53+/m hiiret, vähentää painoja havaittiin vuotiaana 30-36 kuukautta. p53 + / m hiirillä esiintyy myös lordokyfoosia. Riippuen X-ray analyysi, p53+/m hiiret esillä vähentää luun tiheys ikä 12 kuukautta, ja se tulee vakavia iässä 18 kuukautta. Tämä on osteoporoosin symboli ja osteoporoosi on merkki ikääntymisestä ihmisillä ja hiirillä . Tyner ym., testasi myös stressin sietokykyä, sillä tämä kyky on myös ikääntymisen merkki . He tekivät 3 mm punch-koepaloja vanhojen ja nuorten nukutettujen p53+/m ja p53+/+ – hiirten selkäiholle. Niiden tulokset osoittivat, että paljon vanhoja p53+/m hiiriä kuoli sen jälkeen, kun pistetään standardi annos Avertin, mikä osoittaa, että vanha p53+/m hiiret olivat vähemmän suvaitsevaisia stressiä .
Vuonna 1991 todettiin, että p53-on kyky aiheuttaa apoptoosin, kun taas vuonna 2003; Mihara ja muut tutkijat huomasivat, että p53 on myös apoptoosin rooli mitokondrioita ., Koska osa mitokondrion proteiineista on kyky aktivoimalla solujen apoptoosin joko aktiivinen caspases tai neutraloivat sytosolisen estäjät. Esimerkiksi sytokromi c aiheuttama caspase, saatuaan apoptoosin signaali, sytokromi c vapautuu intermembrane tilaa mitokondrioita, ja sitten puolestaan sitoutuu Apf-1, joka on olemassa ei-aktiiviseksi monomeeri, aiheuttaa sen conformational muuttaa, ja lisää sen sitova affiniteetti dATP/ATP 10-kertainen kuin Apaf-1 sitoutuu dATP/ATP yksin. Sitten monimutkainen Apaf-1 – sytokromi-c sitoutuu dATP/ATP, muodostavat apoptosome., Sen jälkeen caspase rekrytointi domain (KORTTI) sekä Apaf-1 altistuvat apoptosome, rekrytoida procaspase-9, ja sitten autoactivate itse. Lopullinen kompleksi pilkkoo ja aktivoi muita caspases kuten caspase-3, joka puolestaan myöhemmin katkaisevat tärkeitä molekyylejä solun, jolloin kromatiinin tiivistymistä, DNA: n hajanaisuus ja lopulta johtaa apoptoosin . Kuvassa 2 on sytokromi C: n indusoima kaspaasiaktivaatioreitti.
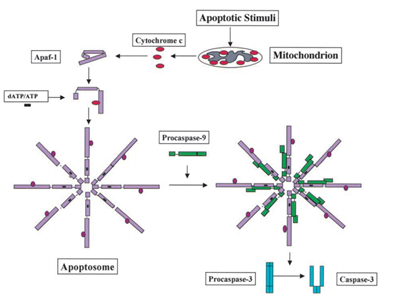
Mihara m ym. tutkijat havaitsivat, että villityypin p53-geeni voidaan siirtää kasvainsolujen mitokondrioiden pinnalle nopeasti. Kokeessa, he huomasivat, että joitakin stressin aiheuttama villi-tyyppi p53-proteiini on kyky translocate mitokondriot thymocytes ihmisen tai hiiren solut jälkeen apoptoosin vuoksi DNA-vaurioita ja hypoksia. Sitten nämä villi-tyyppi p53 proteiineja aiheuttaa permeabilization mitokondrioita ja aiheuttaa sarjan muutoksia, jotka tapahtuvat mitokondrioita, kuten vapauttamalla sytokromi c muodostamalla kompleksi Bcl2 ja BclXL .,
hyvänä kliinisenä tuloksena, jolla on vain vähän sivuvaikutuksia, geeniterapia on suosittua. Vuoden 2005 loppuun mennessä Journal of Gene Medicine-tiedejulkaisun tietokannassa oli 1020 geeniterapiatutkimusta. Näistä tutkimuksissa, 66% geenihoidot tehtiin syöpäpotilailla, ja 58 tutkimuksissa tätä käytetään rAd-p53 -, yhdistelmä-adenovirus koodaus ihmisen p53-geenin. Huhtikuussa 2004 käynnistettiin virallisesti rekombinantti ihmisen adenovirus-p53-injektio (Gendicine). Gendicine käytetään hoitoon pään ja kaulan okasolusyöpä ja se hyväksyttiin Valtion Food and Drug Administration Kiinan Lokak. 16, 2003., Siitä tuli maailman ensimmäinen geeniterapiatuote, jonka Kiinan hallitus on hyväksynyt .
geenin p53 havaittiin säätelevän aineenvaihduntaa vuonna 2005. Jotta siirtää G1 S vaihe, solujen on oltava riittävästi raaka-aineita tuki DNA, soluelimiin ja proteiinisynteesiä. Tämän prosessin sääntelemiseksi tarvitaan joitakin tarkastuspisteitä. Yksi niistä on glukoosista riippuvainen tarkastuspiste G1/S. sitä säätelee AMP-aktivoitu proteiinikinaasi (AMPK). Kun glukoosi on loppunut, AMPK voi fosforyloida proteiini p53: n, joka puolestaan aiheuttaa solupysähdyksen ja välttää solukuoleman., Solut, jotka kohtaavat p53: sta riippuvaisen pidätyksen, pääsevät takaisin solusykliin, kun glukoosi on riittävä .
tiedetään, että p53: n inaktivaatio on tarpeen kasvainten muodostumisen kannalta. Bykov ym. VJ ja Snydel EL ym. huomauttaa, että p53: n virheellinen toiminta voi johtaa olemassa olevan kasvaimen lisääntymiseen . Ventura ja hänen työtoverinsa tekivät joitakin kokeita tämän hypoteesin testaamiseksi. He palauttivat endogeenisen p53: n toiminnan primaarisissa autokhtonisissa kasvaimissa p53: n uudelleenaktivoitumisen seurauksen tutkimiseksi., Tulos osoitti, että p53: n uudelleenaktivoituminen oli syynä autokhtonisten kasvainten regressioon. Se tarkoittaa, että inaktivoitu p53-proteiini voi johtaa kasvaimen kehittymiseen . Xue ja muut tutkijat tekivät myös kokeen testata seurauksena hankinta ja p53 on kasvaimia. He käyttivät reversiibeliä RNA-interferenssiä (RNAi) endogeenisen p53: n ilmentymisen säätelyyn hiirillä, joilla oli maksasyöpä. Kokeessa, doxycycline (Dox) käytetään aktivoida p53, koska ilmaus p53 on täysin tukahdutetaan, kun Dox puuttuu ja nopeasti palautuu, kun Dox on lisätty., Dox-hoidon yhteydessä p53 miRNA suljettiin, mikä puolestaan lisää p53: n ilmentymistä. Tulos osoitti, että DOX-hoidettujen hiirten kasvaimet tulevat havaitsemattomiksi 12 päivän kuluttua, kun taas hoitamattomien hiirien kasvaimet kasvoivat nopeasti. Testatakseen p53: n ohimenevän uudelleenaktivoitumisen seurauksia he hoitivat hiiriä Dox: llä 4 päivän ajan ja lopettivat sen jälkeen. Tulos osoitti, että jopa kahden päivän hoito voi aiheuttaa regressio kasvaimia ja 4 päivän hoito voi aiheuttaa kasvaimia kokonaan taantua., He myös huomauttivat, että kasvaimen regression aikana ohimenevästi uudelleen aktivoitunut p53 voi laukaista solujen vanhenemisen, ei apoptoosia. Samana vuonna Hu havaitsi, että alkion kiinnittymistä p53 -/ naarashiiriin säätelee leukemiaa estävä tekijä (Lif). LIF on erittyvä sytokiini, ja se on tärkeä blastokystin implantaation kannalta. Geenin koodaavan LIF on tunnistettu p53 kohde geeni-ja p53-sitoutumiskohta sijaitsee introni 1 sekä ihmisillä ja hiirillä .