Johdanto
Koagulaasi-negatiiviset stafylokokit (CoNS), jäsenet stafylokokit ryhmä, luonnehditaan Gram-positiivisia kokkeja, esitetään yksittäisiä soluja tai epäsäännöllinen disposition, ja ovat kiinteitä, ei-itiöitä muodostavia, katalaasi-positiivisia, enimmäkseen fakultatiivisesti anaerobeja, ja puuttuu entsyymi koagulaasi.,1 Miinukset ovat osa ihmisen mikrobiston, pidetään opportunistisia taudinaiheuttajia, aiheuttaa infektioita lähinnä keskosilla, ja immuunivaste ja proteesin saaneilla potilailla.2
nousu mikrobilääkeresistenssin viime vuosina on ollut suuri vaikutus sairaalan infektioiden aiheuttamia Haittoja. Oksasilliini on puolisynteettinen penisilliini käytetään herkkyys testi havaitsemiseksi metisilliinille resistenssi ja hoitoon stafylokokki-infektiot. Consin kliinisissä isolaateissa on kuitenkin havaittu esiintyneen 66-95% oksasilliiniresistenssistä.,2 Oksasilliini vastus on usein välittyy mecA-geeni, joka koodaa täydentävää penisilliiniä sitovaa proteiinia (PBP2a) matala affiniteetti puolisynteettisiä penisilliinejä.3 mecA-geeni sijaitsee mobiili geneettinen elementti, joka tunnetaan nimellä Stafylokokki-Kasetti-Kromosomi mec (SCCmec), joka sisältää mec monimutkainen, joka koostuu mecA-geeni ja sen säädin geenit mecI ja mecRI, ccr-monimutkainen, vastuullinen integraatio-ja excision SCCmec, ja J alueella, joka ei ole välttämätöntä SCCmec muodostumista, mutta voi tehdä ei-β–laktaami-resistenssigeenien.,Tähän mennessä on kuvattu 13 SCCmec-tyyppiä, jotka perustuvat ccr-geenikompleksityyppien ja mec-geenikompleksiluokkien yhdistelmään. Alatyypit määriteltiin J-alueen polymorfismeilla samassa mec-ja ccr-kompleksien yhdistelmässä.5
oksasilliiniresistenttien isolaattien ilmaantuminen on johtanut vaihtoehtoisten mikrobilääkkeiden lopulliseen käyttöön CoNS-infektioiden, kuten glykopeptidi vankomysiinin, hoidossa. Vankomysiinin herkkyyden ja vastustuskyvyn heikkenemisestä on viime vuosikymmeninä raportoitu kuvauksia.,6 Alentunut vankomysiini voi liittyä aineenvaihdunnan muutoksia, kuten kiihtyvyys peptidoglykaanin synteesi, jolloin solun seinämän paksuuntumista. Tässä prosessissa, vankomysiini ei voi estää peptidoglykaanin synteesi, koska se on tyhjentynyt johtuen korkeampi saatavuus D-alanyl-D-alaniini sivustoja.,7
Koska nousu sairaala infektioiden aiheuttamia Haittoja, tämän tutkimuksen tarkoituksena on kuvata oksasilliini resistenttejä kantoja ja määrittää mikrobilääkeherkkyyden 20-vuoden kokoelma verta kulttuuri-CoNS isolaatteja Botucatu Hospital das Clínicas vuodeosastoilla.
Materiaalin ja methodsStrains
Kolme-sata Miinusta kantoja eristettiin verestä kulttuurien vuodeosastoilla ja Botucatu Hospital das Clínicas – Paulista Valtion Yliopiston (UNESP)., Isolaatit on kerätty vuosina 1990-2009 ja säilyttää Kulttuuri-Kokoelma Laboratorio, Mikrobiologian ja Immunologian Osasto Botucatu Biosciences Institute – UNESP. Valintaperusteissa katsottiin, että tapahtumien keskimääräinen esiintyvyys oli 35 prosenttia, virhemarginaali 5 prosenttia ja luottamusväli 95 prosenttia.
kannat eristettiin Konemanin et al.8 Veri-agar-isolaateista tehtiin Gram-värjäys havainnointiin pesäkemorfologia ja katalaasi testi suoritettiin vahvistusta suvun Staphylococcus., Stafylokokki-kannat toimitettiin koagulaasi-testi eriyttäminen koagulaasi-negatiivinen ja koagulaasi-positiivisten ryhmiä. Koagulaasinegatiivisille isolaateille tehtiin biokemiallisia testejä lajien fenotyyppiseksi tunnistamiseksi. Genotyyppi-tunnistus suoritettiin käyttämällä alukkeita laadittu yli konservoituneita sekvenssejä vieressä 16S ja 23S geenit, SEN-PCR (sisäinen puhtaaksi spacer–polymeraasiketjureaktio), kuvattu Couto ym.9 vahvistustehokkuutta seurattiin elektroforeesilla 3% metaforalla agaroosi ja värjättiin SYBR-turvallisella., The following lineages of international reference were used: S. auricularis ATCC 33753, S. capitis subsp. capitis ATCC 27843, S. capitis subsp. urealyticus ATCC 49325, S. caprae ATCC 35538, S. cohnii ATCC 49330, S. cohnii subsp. cohnii ATCC 29974, S. epidermidis ATCC 12228, S. epidermidis ATCC 35983, S. hemolyticus ATCC 29970, S. hominis ATCC 27844, S. hominis subsp. novobiosepticus ATCC 700237, S. lentus ATCC 700403, S. lugdunensis ATCC 700328, S. saprophyticus ATCC 15305, S. schleiferi subsp. schleiferi ATCC 43808, S. sciuri subsp. sciuri ATCC 29062, S. simulans ATCC 27851, S., xylosus ATCC 29979, ja S. warneri ATCC 10209.
DNA-uuttoa
Illustra-pakkausta (GE Healthcare) käytettiin DNA-uuttoon. Vaiheet mukana alkuperäinen ruoansulatusta stafylokokki-solujen lysotsyymi (10mg/mL) ja proteinase K: ta (20 mg/mL). Seuraavaksi 500µL louhinta-puskuria lisättiin seokseen, jossa oli sentrifugoidaan 10 000 x g 4min. Supernatantti siirrettiin pylvääseen ja sentrifugoidaan 5 000 g 1min. Neste hävitettiin ja kolonniin lisättiin 500µl uuttopuskuria., Sen jälkeen sentrifugoimalla ja poisheittäminen kerätyt neste, 500µL pesu-puskuria lisättiin sarake, joka toimitettiin sentrifugointi 20000 g 3min. Seuraava sarake siirrettiin 1,5 mL: n putkeen ja eluointi tehtiin käyttäen 200µL lämmennyt MilliQ vettä 70°C.
mecA-geenin havaitseminen
PCR suoritettiin havaitseminen mecA-geeni. Reaktiot suoritettiin Murakamin et al: n kuvaamalla protokollalla.10 vahvistus tehokkuus oli seurata elektroforeesi 2% agaroosia geeli värjätään SYBR Safe.,
SCCmec
SCCmec-tyypin määritys määritettiin mecA-positiivisilla kannoilla. Reaktiot on tehty Oliveira et al.: n kuvaamalla protokollalla.11 ja muokattu Machado et al.12
Multiplex-PCR suoritettiin 50µL reaktion tilavuus 1X entsyymin puskuria, 1.,25 U Taq polymerase DNA, 200 μM dNTP Mix, and the following primers: 10pmol of RIF2 F2 (TTCGAGTTGCTGATGAAGAAGG) and CIF2 R2 (ATTTACCACAAGGACTACCAGC), 6pmol of KDP F1 (AATCATCTGCCATTGGTGATGC) and KDP R1 (CGAATGAAGTGAAAGAAAGTGG), 5pmol of DCS F2 (CATCCTATGATAGCTTGGTC) and DSC R1 (CTAAATCATAGCCATGACCG), 5pmol of RIF4 F3 (GTGATTGTTCGAGATATGTGG), and RIF4 R9 (CGCTTTATCTGTATCTATCGC). For each reaction, 10μL DNA was added. The cycle sequencing reactions were performed at 92°C for 3min, followed by 30 cycles of 92°C for 1min, 56°C for 1min, and 72°C for 1min and 30s., Vahvistus tehokkuus oli seurata elektroforeesi 2% agaroosia geeli värjätään SYBR Safe.
Määrittäminen pienin estävä pitoisuus (MIC) E-testi
in vitro-herkkyydestä Miinukset kantoja testattiin seuraavat mikrobilääkkeet: Oksasilliini, Vankomysiini, Daptomysiini, Linetsolidi, Quinupristin/Dalfopristiini, ja Tigesykliini. Näiden lääkkeiden mikrofoni määritettiin E-testissä. Herkkyysluokituksessa käytettiin seuraavia kriteerejä: oksasilliini
µg / mL (herkkä) CoNS, paitsi S., lugdunensis (herkkä ≤2µg/mL ja kestävä ≥4µg/mL), Vankomysiini µg/mL (altis), 8–16µg/mL (kohtalaisen kestävä), ja >32µg/mL (resistentti); Linezolid ≤4µg/mL (altis); Daptomysiini ≤1µg/mL; Quinupristin/Dalfopristiini ≤1µg/mL (altis), 2µg/mL (intermediate), ja ≥4µg/mL (resistentti); Tigesykliini ≤0,5 µg/mL.,13Screening testi havaitsemiseksi alentunut vankomysiini
jotta voidaan havaita alentunut vankomysiini, seulonta agar testi valmistettu Brain Heart Infusion (BHI) – Agarilla ja 4µg/mL, 6µg/mL, 8µg/mL, ja 16µg/mL vankomysiini käytettiin. Viittaus kantaa S. aureus ATCC 29213, herkkiä vankomysiinille, käytettiin negatiivista kontrollia, ja kanta E. faecalis ATCC 51299, vastustuskykyisiä vankomysiini, kuin positiivinen kontrolli. Pisteitä 2.,0 McFarland rokote lisättiin Agar levy ja inkuboidaan 35°C: ssa 24 h, ja kasvava vähintään yksi siirtokunta oli yksi positiivinen tulos.
Analyysi solun seinämän paksuus
Miinukset kantoja, jotka esitetään vähentynyt herkkyys vankomysiinille on toimitettu siirto elektroninen mikroskopia solun seinämän paksuus analyysi. Kannat viljeltiin vuonna BHI-liemi ja inkuboidaan 37° C: ssa 24 h. Vuonna microtube, 1000µL on CoNS kulttuuri liemi oli sentrifugoidaan yhden minuutin ajan 12000 rpm. Supernatantin poisheittämisen jälkeen kannat vahvistettiin Karnovski-liuoksessa (2.,5% glutaraldehydiä fosfaattipuskurissa 0,1 M) neljän tunnin ajan. Näytteet otettiin kiinnikkeestä ja pestiin kolme kertaa viiden minuutin ajan tislatussa vedessä. Seuraavaksi näytteet upotettiin 0,5% osmiumtetroksidiin 40min ajaksi, ennen kuin ne pestiin kolme kertaa 10min ajan tislattuun veteen. Näytteissä oli nestehukka, jossa käytettiin kasvavia alkoholipitoisuuksia: kaksi kertaa 10 min 7: ssä.,5% alkoholia; kaksi kertaa 10min 15% alkoholia; kaksi kertaa 10min 30% alkoholia; kaksi kertaa 10min 50% alkoholia; kolme kertaa 15min 70% alkoholia; kaksi kertaa 15min 90% alkoholia; kaksi kertaa 10min show 100% alkoholia. Nestehukan jälkeen tyvet asennettiin ja näytteet metalisoitiin. Analyysit tehtiin elektronisella mikroskopialla Tecnai Spirit Fei-yrityksessä ja kuvat saatiin suurennoksella 30000×.,
ResultsIdentification isolaattien
Taulukko 1 esittelee lähde Miinukset lajien eristää, sekä demografiset tiedot potilaat, joilla on bakteremia.
Havaitseminen mecA-geeni ja luonnehdinta SCCmec Määrittäminen pienin estävä pitoisuus (MIC)
Mikrofonit, että mikrobilääkkeitä käytetään hoitoon Miinukset infektioita määritettiin E-testi. Oksasilliini vastus löytyi 206 (68.7%) Miinukset kantoja ja 25 olivat tigesykliini kestävä (8.3%). Vastus tigesykliinille oli havaittu 4,5% S. epidermidis, 13,8% S. hemolyticus, 13% S., homineja ja 11,1% S. lugdunensista. Sillä quinupristin/dalfopristiini, yksi S. epidermidis eristää esitetty keskitason kestävyys, joissa on MIC 2µg/mL, ja yksi S. epidermidis ja yksi S. hemolyticus kanssa Mikrofonit ja 3µg/mL. Herkkyys ja spesifisyys oksasilliini MIC-E-testi verrattuna läsnäolo mecA olivat vastaavasti joutuneista 87,4% ja 82.3%.
suhteen Miinukset lajeja, parametri jakelu MIC50 ja MIC90 paljasti korkea oksasilliini vastus S. hemolyticus., Tämä oli ainoa Miinukset lajit, joiden minimaalinen pitoisuus estää 50% isolaateista oli >256µg/mL, mikä on korkea vastus korko S. hemolyticus että oksasilliini (Taulukko 3).
kunkin mikrobilääkkeen MIC-vaihteluväliä verrattiin SCCmec-tyyppiin. Sccmeci-tyypillä kirjoitetut isolaatit esittivät korkeampia tigesykliinimikrofoneja ja SCCmecII-luokkaan luokitellut isolaatit korkeimpia oksasilliinimikrofoneja. Se SCCmecIV kantoja osoitti korkein MIC-arvot, vankomysiini, linetsolidi, daptomysiini, ja quinupristin/dalfopristiini (Taulukko 4).
Determination of the MIC range according to SCCmec.
| MIC range (μg/ml) | ||||
|---|---|---|---|---|
| Antimicrobial | SCCmec I | SCCmec II | SCCmec III | SCCmec IV |
| Oxacillin | 0.094≥256 | 6≥256 | 0.,125≥256 | 0.125≥256 |
| Vancomycin | 0.25–2 | 0.38–2 | 0.125–2 | 0.75–2 |
| Linezolid | 0.064–1 | 0.19–0.5 | 0.047–0.75 | 0.064–1 |
| Daptomycin | 0.016–025 | 0.016–0.094 | 0.019–0.5 | 0.047–0.75 |
| Quinupristin/Dalfopristin | 0.025–1.5 | 0.094–0.5 | 0.064–1 | 0.125–2 |
| Tigecycline | 0.016–2 | 0.023–0.75 | 0.016–0.75 | 0.,032-1 |
MIC, Minimaalinen Inhiboiva Pitoisuus.
arviointi oli suoritettu ja oksasilliini ja vankomysiini Mic yli 20 vuoden ajan, jaettu kolmeen ajanjaksojen mukaan jakelu oksasilliini ja vankomysiini MIC-alueet. Oksasilliinin osalta havaittiin ensimmäisellä kaudella (1990-2001) korkeampia MIC-arvoja, jotka kuitenkin viittaavat herkkyyteen., Muita aikoja (2002-2006 ja 2007-2009), lasku MIC-arvojen havaittiin, edelleen osoittaa alttius, sekä lisätä vastus hinnat. Koskien vankomysiinille, sama arviointi osoitti merkittäviä eroja kolmeen jaksoon keskuudessa kantoja, joiden Mikrofonit alkaen 0.047 µg/mL 0,38 µg/mL ja 0,5 µg/mL 2,0 µg/mL (Kuva. 1).
Määrittäminen alentunut vankomysiini
kasvua 214 (71,3 prosenttia) kantoja oli havaittu BHI-levy 4µg/mL vankomysiini, 89 (29.7%) on levy, jossa on 6µg/mL vankomysiini, ja 8 (2.,6%) isolaatit vankomysiinilevyllä 8µg/mL. Mikään isolaateista ei kasvanut väliaineessa 16µg/mL vankomysiiniä. Ei ollut merkittäviä eroja Mikrofonit välillä kantoja, jotka esitteli ei kasvua lautaselle täydennetty vankomysiini ja niille, jotka kasvoi 4µg/mL vankomysiini levy. Vankomysiinin 6ΜG/mL: lla kasvualustalla MIC–vaihteluväli oli 0,5-2µg/mL. Vankomysiinillä 8µg/mL kasvaneista MIC-vaihteluväli oli 0,75-24µg / mL. Kannat viljellään 8µg/mL vankomysiini oli neljä S. epidermidis, yksi S. hemolyticus, kaksi S. hominis, ja yksi S., capitis, kaikki kestää oksasilliini, ja S. epidermidis ja S. capitis on kantajia SCCmec III, S. hominis ja SCCmec minä, ja S. hemolyticus ei-kirjoitetaan SCCmec.
Analyysi solun seinämän paksuus kantoja, joilla on alentunut herkkyys vankomysiinille
solun seinämän paksuus alle solunjakautumisen mitattiin kahdeksan kantoja (arvot on esitetty nanometriä, keskiarvo±SD). Neljä S. epidermidis-kantoja esitetty keskiarvot 21.66±1.4, 20.12±0.9, 24.24±1.3, ja 14.20±1.3 nm. S. hemolyticus-isolaatin soluseinän paksuus oli 24,88±1,7 nm. S., capitis eristää, solun seinämän paksuus oli 19.33±1,8, ja kaksi S. hominis eristää arvot olivat 17.68±2.1 ja 24.92±1.5. Vertailun vuoksi käytetty viittaus kantoja S. epidermidis ATCC 12228 ja S. hemolyticus ATCC29970 osoitti, solun seinämän paksuudet, vastaavasti, 14.61±1.2 ja 14.73±0.7 nm. Vertailu tutkittu kantoja vastaan tarkastukset osoittivat korkeampia arvoja, jotka vaihtelevat 17nm, jotta 24.92 nm, lukuun ottamatta S. epidermidis-isolaatti, joka esitteli pienempi arvo verrattuna säätimet (Kuva. 2).,
Miinukset bakteremia kehitys
mahdollinen kehitys bakteremia, jotta muita infektioita, kuten sepsis, keuhkokuume, virtsatieinfektio, aivokalvontulehdus, peritoniitti, nekrotisoiva enterokoliitti, omphalitis, ja aivojen paise, seurasi 52 potilasta myönsi vastasyntyneiden osastoilla. Näistä 25: llä (46,3%) potilaalla varmistettiin, että samat Veriviljelmästä eristetyt haitat ovat infektion etiologinen aine. Kuudessa (11,1%) CoNS oli mahdollinen infektion aiheuttaja, ja 23: ssa (42,6%) CoNS ei liittynyt potilaan infektioon (Kuva. 3).,
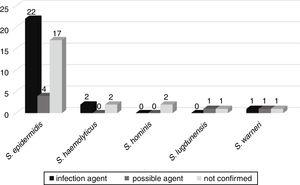
veriviljelmistä eristettyjen Consien korrelaatio mahdollisten vastasyntyneiden yksikköpotilaiden infektioiden etiologisten tekijöiden kanssa.
mecA-geenin havaittiin 33 (61.1%) näistä Haitoista, 20 (60,6 prosenttia) Miinukset liittynyt enemmän vakavia infektioita tai mahdollisia aineita näitä infektioita.
Keskustelu
haittoja pidetään yhtenä bakteremian pääsyistä., Näiden bakteerien merkitys on kasvanut sairaalaympäristössä viime vuosina lähinnä mikrobilääkeresistenssin vuoksi. Nykyisessä työssä, 300 Miinukset kantoja on eristetty veren kulttuurien vuodeosastoilla Sairaalassa Klinikat Botucatu, yli 20 vuoden ajan, tutkittiin. Näistä isolaateista oli ominaista niiden mikrobilääkeherkkyyden.
mecA havaitseminen määrittää oksasilliini vastus 78,5 prosenttia Huonoja puolia, ja MIC50-arvo (2µg/mL) oli osoitus vastustuskykyä tätä lääkettä, vahvistaa alhainen herkkyys näiden bakteerien β–laktaami-aineita., Aiemmat teokset ovat osoittaneet, että 1970-luvulta lähtien CoNS-isolaatit ovat esittäneet suurempia oksasilliiniresistenssejä kuin S. aureus.14,15 beetalaktaamiresistenssien on osoitettu olevan 65-95% sairaaloissa Brasiliassa ja muissa maissa.2,16,17 korkeimmat oksasilliini vastus löytyi S. epidermidis, jonka jälkeen S. hemolyticus, S. hominis, ja S. capitis. Samanlaisia tuloksia on kuvattu aikaisemmat tutkimukset, jotka osoittivat, oksasilliini vastus 97% S. epidermidis vuosina 1999 ja 2001 vastasyntyneiden tehohoidossa (NICU),18 96 prosenttia S., hemolyticus eristetty Brasiliassa, 19 ja 100% S. hominis eristetty NICU Espanjasta.20 Caierão et alin tutkimuksissa havaittiin poikkeavia tuloksia S. capitisin osalta.21
vaikka matalammalla taajuudella havaittiin mecA-geeni S. Warnerissa ja S. lugdunensiksessa. S. warneri on kuvattu hinnat 33,3% oksasilliini vastus NICUs,22 ja ensimmäinen kuvaus mecA S. lugdunensis oli tutkimuksessa Kawaguchi et al.23 alhaisesta resistenssistä huolimatta S: N mikrobilääkeresistenssin määritys 24., lugdunensis on tärkeää, ei vain koska sen kliiniset vaikutukset, koska tämä laji on kaikkein aggressiivinen ja Huonoja puolia, mutta myös perustamaan varhainen hoito, jossa on riittävä mikrobilääkkeiden ja hyviä kliinisiä tuloksia.25
luonnehdinta SCCmec osoitti läsnäolon tyypit I-IV-isolaatteja, joiden SCCmecIII on useimmin havaittu tutkittu kantoja, lähinnä S. epidermidis, ainoa laji, joka kuljettaa tyyppi IV., SCCmec tyyppi III on suurin niistä kaikista, kodifioidaan useita vastus-liittyvät geenit, ja se on yleisimmin eristetty Huonoja puolia sairaalasta yksilöitä. S. epidermidis on tärkein colonizer ihmisen ihon ja yleisimmin havaittu tartunnan sivustoja. Selektiivinen paine sairaalaympäristössä johtaa SCCmec III-kantojen leviämiseen, jotka liittyvät vakaviin infektioihin.26 SCCmec tyyppi IV on ollut yhteydessä yhteisöön liittyviin Staphylococcus spp., ja se kuvattiin ensimmäistä kertaa S. epidermidis-kannassa, mikä merkitsee sen siirtymistä S., epidermidis S. aureukselle. SCCmec IV: n kustannusten väheneminen sen pienen koon vuoksi johtaisi todennäköisesti SCCmec IV: n kantajien aiheuttamien infektioiden lisääntymiseen.12,27 SCCmecII esitti S. hemolyticuksen kanssa assosiaation, joka oli samanlainen kuin Machado et al.,12 joiden työ havaitsi vain tyypin II tässä lajissa.
vaihtoehtoinen hoitoon oksasilliini vastustuskykyisiä stafylokokkeja on vankomysiini, on glycopeptide käytettiin ensimmäisen kerran vuonna 1958 invasiivisia infektioita. On kuitenkin olemassa kuvaus resistenssistä ja alentuneesta herkkyydestä tälle lääkkeelle,6 vaikka se on epävakaa.,28 tulokset nykyinen työ osoitti, että lukuun ottamatta oksasilliini, vankomysiini oli huumeiden kanssa korkeimmat arvot MIC50 ja MIC90. Huolimatta täysi alttius kokoelma, MIC-arvot olivat korkeimmat aikana 20 vuotta, ja vähentää alttiutta on havaittu joissakin S. epidermidis, S. hemolyticus, S. hominis, ja S. capitis kantoja. Tutkimuksissa, joita Natoli et al.,29 alentunut vankomysiini oli havaittu taajuus 5,4% keskuudessa Miinukset-isolaatteja, S. epidermidis ja S. hemolyticus lajeja., Samojen tekijöiden, Staphylococcus siirtomaita kasvanut vankomysiini agar voi johtaa glycopeptide heteroresistance, joka voi olla edeltäjä glycopeptide vastus, joka aiheuttaa monimutkaisia infektioita ja hoidon epäonnistuminen. Tämä tulee ottaa huomioon terapeuttisissa päätöksissä.30
osuuden kasvu oksasilliini kestävä Miinukset ja vähentää niiden herkkyys vankomysiinille korostaa tutkimuksia, joissa käytetään muita terapeuttisia vaihtoehtoja., Tigesykliini, Gram-positiivisia ja negatiivisia puolisynteettinen laajakirjoinen glycylcycline, pidetään lääke, kanssa erinomainen toiminta vastaan oksasilliini alttiit ja kestävät Huonoja puolia,14,29 huolimatta meidän tiedot osoittavat, hinnat 8,3% vastus, useimmiten S. hemolyticus, jonka jälkeen S. hominis, S. lugdunensis, ja S. epidermidis. Samanlaisia MIC90-tuloksia on kuvattu tigesykliinillä, eikä oksasilliiniresistenttien ja herkille miinuksille alttiiden välillä ole eroa.31 Natoli et alin tutkimuksissa.29 tigesykliini tehosi hyvin miinuksia vastaan., Näiden tekijöiden mukaan tigesykliiniä ei suositella bakteremian hoitoon, ja sen käyttöä tulisi rajoittaa, jotta aktiivisuus moniresistenttejä gramnegatiivisia bakteereja vastaan säilyisi. Ribosomaalisen geenin S10 ja rpsJ-ja mepA-geenien mutaatiot näyttävät liittyvän tigesykliiniresistenssiin.32,33
Kinupristiini/dalfopristiini on makrolidi-linkosamidi-streptogramiiniryhmään kuuluva streptogramiini., Yhdistelmä quinupristin ja dalfopristiini on synergistinen ja yleensä bakterisidinen, kun nämä aineet ovat verrattuna yksittäin, tai verrattuna vastaaviin makrolidi mikrobilääkkeitä.34 tässä työssä, huolimatta esittelee erinomainen teho suurin osa opiskeli Huonoja puolia, väli vastustuskykyä tätä lääkettä havaittiin kaksi S. epidermidis ja yksi S. hemolyticus. Tutkimuksessa, jonka Mendes et al.,35 quinupristin/dalfopristiini osoitti erinomaista tehokkuutta Huonoja puolia, kannat olivat täysin alttiita, joiden MIC90-arvot 0,38 µg/mL oksasilliini-herkät ja 0.,75 µg/mL oksasilliiniresistenteille kannoille. Lisäksi Venkatesh et al.36 kuvattu kinupristiinin / dalfopristiinin hyvä teho oksasilliiniresistenteille ja herkille kannoille.
daptomysiini, vuosikymmenten ajan tutkittu mikrobilääke, otettiin takaisin käyttöön vuonna 2006 Staphylococcus-bakteerin aiheuttaman bakteremian ja endokardiitin hoitoon.37 tässä tutkimuksessa Daptomysiini osoitti erinomaista tehoa CoNS-isolaateille, joiden MIC50-arvot olivat alhaiset. Olivares ym.37 myös varmisti kaikkien haittojen herkkyyden daptomysiinille, ja MIC-arvojen vaihtelu oli vähäistä., Vuonna työ opiskelu 1126 CoNS, johtamat Critchley et al.,38 daptomysiini oli aktiivinen MIKROFONI välillä 0,015-2,0 µg/mL, ja MIC90 0,5 mikrog/mL. Mukaan ne tekijät, eniten aktiivisia aineita, nämä analyysit olivat daptomysiini ja quinupristin/dalfopristiini, joka korostaa merkitystä näiden mikrobilääkkeiden hoidossa infektioiden aiheuttamia Haittoja.
Linetsolidi, synteettinen oxazolidinone mahdollisesti tehoaa useisiin bakteereihin, on toinen lääke, joka on osoittanut hyvää tehoa vastaan Huonoja puolia.,39 Linetsolidista on tullut tärkeä kroonisten infektioiden hoidossa CoNS-menetelmällä resistenssin kuvauksesta huolimatta. Brasiliassa, ensimmäinen tapaus linezolid vastus oli kuvattu vuonna 2006 kliinisen eristää MRSA40 ja niistä Haitoista, S. epidermidis, S. hominis, ja S. hemolyticus.41 in the work conducted by Olivares et al.,37 huolimatta seitsemän linetsolidiresistentin kannan havaitsemisesta, tämä lääke esitti tehokkaita Mic-arvoja CoNS-kannoissa. Toisaalta linetsolidiresistentin S: n puhkeaminen., epidermidis klooneja, jotka sisältävät mutaatioita ribosomien proteiinit L3 ja L4 sekä cfr plasmidi, äskettäin tunnistettu Ranskassa, on raportoitu.42
S. hemolyticus oli laji, joka esitteli korkein oksasilliini MIC-arvot ja pitoisuudet korkeampia kuin 256µg/mL olivat tarpeen estää 50% isolaateista. Sekä oksasilliini, tämä laji esitetty korkeampi MIC-arvot tigesykliini ja useimmat mikrobilääkkeiden testattu. Useat teokset osoittavat korkea vastustuskyky mikrobilääkkeitä käytetään hoitoon aiheuttamien infektioiden S., hemolyticus, erityisesti metisilliini ja glykopeptidit. Jotkut kirjoittajat kuvaavat korkea esiintyvyys geenit koodaavat vastustuskykyä β-laktaami-ja aminoglykosidi aineet, sekä merkittävä osa-isolaatit, joiden MIC-arvot ovat lähellä vastus murtuessa,43,44 korostetaan S. hemolyticus kuin multiresistant taudinaiheuttaja.
yhdistys MIC-alue, jossa SCCmec tyypit osoittaneet, korkeampi Mikrofonin vankomysiini, linetsolidi, daptomysiini, ja quinupristin/dalfopristiini S. epidermidis kuljettaa SCCmecIV., Geenit liittyvät vastus näiden mikrobilääkkeiden välittyvät plasmideja, löytyy useimmiten metisilliinille resistenttejä kantoja sairaalan alkuperää.45 SCCmec IV on ominaista yhteisön isolaateille, erityisesti sen koon ja alhaisten mukautumiskustannusten vuoksi. Tutkimukset viittaavat siihen, että hankinta resistenssigeenien on ympäristö-ei-kliinistä alkuperää, koska suuri monimuotoisuus vastus geenin kantajia luonnossa.46,47 Lisäksi SCCmecIV oli vain osoittaa, S. epidermidis, jonka yleisin laji ihmisen iho on eniten vaikuttanut selektiivinen paine., Suurempi Mikrofonit verrattuna muiden mikrobilääkkeiden voi myös olla liittyvät selektiivinen paine, koska taso altistuminen nämä lääkkeet sairaalassa ympäristö vaikuttaisi valintaan alentunut ja resistenttejä kantoja, koska useita mutaatio tapahtumia, geneettinen rekombinaatio, ja muutokset mikrobien fysiologian tarvitaan tuottaa fenotyypin muutoksia.,48
Metabolisia ja fysiologisia muutoksia, jotka liittyvät selektiivinen paine voisi olla havaittu kantoja kasvatetaan 8µg/mL vankomysiini agar, kuten solun seinämän paksuuntumista havaittiin eniten Haittoja eristää lisääntyneen peptidoglykaanin synteesi. Tämä mekanismi on edullisempaa Haittoja kuin hankinta van operon, joka on välittäjänä vankomysiini vastus. Van operon on hankittu horisontaalinen geenin siirtyminen ja sen ilme on vain kannustanut läsnä glycopeptide., Tämä ärsyke aiheuttaa erittäin korkea mukautuva kustannus läsnä vankomysiini, on epäedullinen Miinukset on vankomysiini medium.48,49 hankintaa Koskevat muut vastus geenien Huonoja puolia, kuten mecA-geeni, alkuperäisen mukautuva kustannus on pehmennetty korvaavia lisää mutaatioita vastus ”kustannuksia”. Äskettäin, täsmällinen mutaatioita geenien, kuten vraR on osoitettu olevan yhteydessä alentuneeseen herkkyys vankomysiinille ja solun seinämän paksuuntuminen stafylokokit.,50
tämä tutkimus osoitti, korkea bakteremia aiheuttamia Haittoja vastasyntyneiden ja pediatric yksiköitä, joissa alle vuoden iässä, tärkeimmät aineet on S. epidermidis, S. hemolyticus, S. hominis, S. lugdunensis, ja S. warneri. S. capitis ei ollut eristetty näissä yksiköissä, on agentteja bakteremia aikuisilla myönsi sisätautien osastolla, gastroenterologian, neurologia, ja ensiapuun.,
Koska tutkimuksessa mukana bakteremia aiheuttanut stafylokokit eristetty yli 30 vuotta, paljon tiedot, jotka liittyvät potilaiden potilastietoja ei voitu hakea, niin se ei ole ollut mahdollista liittää infektio tulokset kaikki potilaat, mikä on rajoitus nykyinen tutkimus. Saatuja tietoja potilaiden vastasyntyneiden yksiköitä ilmoitettu kliinistä merkitystä Miinukset bakteremia, joka voi kehittyä sairauksia, jotka tarvitsevat erikoissairaanhoidon.
mikrobilääkeresistenssin tuntemus on erittäin tärkeää Consin aiheuttamien infektioiden oikean hoidon kannalta., Lisäksi näiden bakteerien virulenssitekijät ja potilaiden immuniteetti ovat tekijöitä, jotka edistävät mikro-organismin kykyä aiheuttaa vakavampia infektioita.
tulokset tutkimuksemme ulottuu 20 vuotta oli korkea taajuus mikrobilääkeresistenssin Miinukset, joka heijastaa liiallinen käyttö näitä lääkkeitä., Lisäksi metabolisia ja fysiologisia muutoksia, jotka voivat johtaa vähentynyt herkkyys mikrobilääkkeille, niiden kunto kuin ihmisen commensal bakteerit tekevät niistä ihanteellisia kuljettajat ja tehokas säiliö resistenssigeenit, erityisesti edullisia elementtejä, kuten SCCmec.45 mikrobilääkkeitä, jotka tarjosivat parhaat tulokset, olisi käytettävä siten, että niiden teho säilyy ja resistenssi estetään.,
eturistiriitoja
kirjoittajat ilmoittavat, että tutkimus on tehty ilman mitään kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdollisia eturistiriitoja.