Introduction
Contrairement aux animaux qui peuvent se déplacer pour éviter les environnements défavorables, les plantes sessiles présentent une adaptation très développée aux conditions environnementales compliquées. Pour atteindre cette profonde adaptabilité, les communications entre les cellules sont nécessaires. La communication de cellule à cellule chez les plantes implique un traitement de signalisation intracellulaire robuste et des réseaux de signalisation intercellulaire complexes., Jusqu’à présent, il existe au moins neuf substances de signalisation, appelées hormones végétales, dont l’auxine, le brassinostéroïde (BR), la cytokinine, les gibbérellines (GA), l’éthylène, l’acide jasmonique (JA), la strigolactone (SL), l’acide abscissique (ABA) et l’acide salicylique (SA) découverts (Druege et al., 2016; Verma et coll., 2016). Les études génétiques et physiologiques ont révélé les rôles critiques et les mécanismes fonctionnels de ces hormones ci-dessus dans la croissance et le développement des plantes (Gray, 2004)., Selon les études précédentes, l’auxine, le BR, Le GA, le SL et la cytokinine fonctionnent principalement pendant la croissance et le développement normaux des plantes, tandis que L’ABA, l’éthylène, le JA et le SA jouent un rôle important dans la réponse de la croissance des plantes à divers stress biotiques et abiotiques (Pieterse et al., 2009; Santner et coll., 2009; Denance et coll., 2013). Et aussi certaines de ces hormones ont un double rôle, par exemple, L’ABA joue également des rôles importants dans le développement des semences et la dormance (Seo et Koshiba, 2002)., Bien que chaque hormone joue des rôles prédominants dans certains aspects, de nombreuses hormones ont des activités chevauchantes et les interactions de différentes hormones contrôlent de nombreux aspects du développement et de la croissance en réponse à des signaux développementaux et exogènes endogènes.
L’auxine et la BR sont deux grandes classes d’hormones favorisant la croissance., BR, Un groupe d’hormones stéroïdes spécifiques aux plantes qui pourraient interagir avec d’autres phytohormones telles que l’auxine, la cytokinine, l’éthylène, le GA, Le JA et le SA et réguler un large éventail de processus de croissance et de développement des plantes, y compris la germination des graines, l’élongation cellulaire, la différenciation vasculaire, la formation et le mouvement des stomates, , 2015). Fait intéressant, chacun de ces processus est également contrôlé par l’auxine, suggérant que ces deux hormones interagissent pour contrôler le développement des plantes., Dans cette revue, nous décrirons la transduction du signal de l’auxine et du BR en fonction des progrès récents et examinerons la diaphonie entre la croissance et le développement des plantes médiées par l’auxine et le BR.
voie de signalisation de l’auxine
l’auxine a d’abord été reconnue comme hormone végétale en raison de son rôle dans le tropisme végétal face aux stimuli de la gravité ou de la lumière., Plus tard, l’auxine a été identifiée chimiquement comme l’acide indole-3-acétique et a montré qu’elle jouait un rôle essentiel dans une pléthore de processus de développement et physiologiques des plantes, y compris l’embryogenèse, l’organogenèse, la différenciation vasculaire, le développement des racines et des pousses, la croissance tropicale et le développement des fruits (Estelle, 2011).
en utilisant L’analyse génétique chez Arabidopsis, le mécanisme moléculaire sous-jacent à la transduction du signal d’auxine a été bien étudié. L’inhibiteur du TRANSPORT RESPONSE1 (TIR1) a été le premier récepteur nucléaire identifié de l’auxine (Ruegger et al., 1998; Dharmasiri et coll., 2005)., TIR1 code une protéine nucléaire appartenant à la protéine F-box en tant que sous-unité du complexe protéique SCF E3 ubiquitine ligase (Gray et al., 1999, 2002; Hellmann et coll., 2003; Quint et coll., 2005), en plus de TIR1, il existe trois protéines F-box supplémentaires, à savoir les protéines F-BOX de signalisation auxine (AFBs) qui montrent une activité de liaison auxine et médient la signalisation auxine chez Arabidopsis (Badescu et Napier, 2006). Le récepteur TIR1 peut interagir avec un groupe de protéines AUX/IAA (acide auxine/indole-3-acétique) (Dharmasiri et al., 2003)., Les protéines AUX / IAA sont des régulateurs négatifs de la signalisation auxine et il y a 29 membres d’AUX/IAA codés dans le génome D’Arabidopsis. Les protéines AUX / IAA pourraient interagir avec la classe de régulateurs transcriptionnels, les facteurs de réponse auxine (ARF), pour médier les réponses transcriptionnelles à l’auxine. Sous un niveau élevé d’auxine, les protéines AUX/IAA interagissent avec TIR1 en tant que corécepteur de l’auxine, et peuvent être ubiquitinées par le complexe SCFtir1 et ainsi être dégradées par la voie ubiquitine–protéasome (Gray et al., 2001; Lanza et coll., 2012)., Lors de la destruction des répresseurs AUX/IAA, les régulateurs de transcription auxine ARF qui comprennent 23 adhésions peuvent être libérés de la répression AUX/IAA et ainsi médier les réponses auxines par activation ou répression des gènes cibles (Guilfoyle et Hagen, 2007). Les différents ensembles de protéines F-box et AUX / IAA ou ARFs en déduisent la complexité lors de la transduction du signal auxine (Goh et al., 2012; Guilfoyle, 2015; Salehin et coll., 2015).,
L’action coordonnée des répresseurs transcriptionnels Aux/IAA et des facteurs de transcription ARF produit des réseaux complexes de régulation génique qui ont également été rapportés chez Physcomitrella (Lavy et al., 2016). Récemment, il a été constaté que la sous-unité CULLIN1 (CUL1) du SCF interagit avec TIR1 et régule ainsi la stabilité des substrats TIR1 et la signalisation de l’auxine (Wang et al., 2016). L’interaction entre TIR1 et Aux / IAA est également influencée par la conformation spatiale De Aux/IAAs, contrôlée par une cyclophiline isomérase LRT2 dans le riz (Jing et al., 2015)., Le facteur de choc thermique 90 (HSP90) et le co-chaperon SGT1, respectivement, interagissent avec TIR1 et régulent ainsi la stabilité de TIR1, ce qui affecte les interactions entre TIR1 et la signalisation Aux/IAA et auxin (Wang et al., 2016).
outre la voie de signalisation canonique de L’auxine dépendante de TIR1, il a été récemment rapporté que l’auxine provoquait une gamme variée de réponses développementales grâce à un mécanisme de signalisation de l’auxine non canonique., Dans ce processus non canonique de détection de l’auxine, ARF3/ETTIN contrôle l’expression des gènes grâce à des interactions avec des facteurs de transcription spécifiques au processus, ce qui enrichit fortement la diversité développementale des plantes médiées par l’auxine (Simonini et al., 2016, 2017).
voie de signalisation BR
Le BRASSINOSTÉROÏDE a été découvert pour la première fois dans le pollen pour sa capacité à favoriser l’élongation cellulaire. Plus tard, il a été constaté que BR joue un rôle dans un large éventail d’aspects de la croissance des plantes et peut répondre aux stress biotiques et abiotiques., De nos jours, la voie de transduction du signal BR a été largement clarifiée par des combinaisons de différentes méthodes, y compris la génétique moléculaire, la biochimie, la protéomique et la génomique, etc. La kinase BRASSINOSTÉROÏDE INSENSITIVE1 de surface cellulaire (BRI1) a été identifiée comme le récepteur de BR qui peut se lier au domaine extracellulaire de BRI1 et activer son activité kinase et ainsi activer une cascade de signaux pour réguler la transcription (Li et Chory, 1997; Wang et al., 2001; Kinoshita et coll., 2005; Kim et Wang, 2010; Paragraphe, 2011; Hothorn et coll., 2011; Elle a, et al., 2011; Oh et coll., 2012)., Lors de la perception de BR, BRI1 interagit avec la KINASE 1 associée au co-récepteur BRI1 (BAK1) et ses Embryogenesisreceptor kinases homologiques somatiques (SERKs) pour former un complexe récepteur BR plus actif (Li et al., 2002; Nam et Li, 2002; Wang et coll., 2005; Tang et coll., 2008; Guo et coll., 2012). Le BRI1 activé phosphoryle deux substrats de kinases cytoplasmiques de type récepteur ancré dans la membrane plasmique: les KINASES1 de signalisation BRASSINOSTÉROÏDE (BSK1) et la croissance différentielle CONSTITUTIVE (CDG1) (Tang et al., 2008; Kim et coll.,, 2011), qui à son tour phosphoryleune phosphatase de type PP1 nommée BRI1-SUPPRESSOR1 (BSU1) pour activer BSU1, conduisant à la déphosphorylation BSU1 et à l’inactivation de la kinase de type GSK3 INSENSITIVE2 BRASSINOSTÉROÏDE (BIN2). L’activité kinase de BIN2 est également inhibée par L’HISTONE désacétylase HDA6, qui interagit et désacétylate au niveau du K189 de BIN2., Lorsque les niveaux de BR sont faibles, BRI1 est en repos en raison de son régulateur négatif, L’inhibiteur de la KINASE BRI1 1 (BKI1) et la protéine phosphatase 2A (PP2A), tandis que BIN2 phosphorylate deux facteurs de transcription homologues BR, BRASSINAZOLE RESISTANT1 (BZR1) et BZR2 (également nommé BES1 pour BRI1-EMS-SUPPRESSOR 1) (He et al., 2002; Wang et coll., 2002; Yin et coll., 2002; Mora-Garcia et coll., 2004; Kim et coll., 2009, 2011; Kim et Wang, 2010). Lorsque les niveaux de BR sont élevés, BIN2 est inactivé, et BZR1 et BZR2 sont déphosphorylés par PP2A, et se déplacent dans le noyau pour modifier l’expression de milliers de gènes de réponse BR (He et al.,, 2005; Yin et coll., 2005; Sun et coll., 2010; Tang et coll., 2011; Yu et coll., 2011).
la synergie entre la signalisation BR et L’auxine
Les voies de signalisation auxine et BR jouent divers rôles, mais elles ont également montré des interactions synergiques et interdépendantes dans un large éventail de processus de développement. Par exemple, les signaux auxine et BR peuvent favoriser l’expansion cellulaire et peuvent interagir de manière synergique pour favoriser l’allongement des hypocotyles (Nemhauser et al., 2004)., La réponse de l’une des deux voies dans la promotion de l’allongement hypocotyle nécessite la fonction de l’autre et l’interdépendance entre les voies BR et auxine (Nemhauser et al., 2004). L’auxine a augmenté la longueur de l’hypocotyle chez les plantes sauvages, mais pas chez le mutant bri1-116 insensible à la BR, et ce phénotype de bri1-116 insensible à la br a été supprimé par le mutant dominant bzr1-1D à gain de fonction, indiquant que BR ou bzr1 actif est nécessaire pour la promotion de l’élongation de l’hypocotyle par l’auxine., Il a été constaté que la signalisation BR converge avec le suppresseur du PHYTOCHROME B4-3 (SOB3) pour contrôler l’élongation cellulaire et la croissance hypocotyle grâce à la régulation de L’expression de la petite auxine UP rna19 (SAUR19) induite par l’auxine (Favero et al., 2017). D’autre part, le facteur de transcription régulé par l’auxine SMALL ORGAN SIZE 1 (SMOS1) a récemment été trouvé pour contrôler l’expansion cellulaire grâce à l’interaction directe avec SMOS2/DLT, un membre de la famille GRAS des co-régulateurs transcriptionnels qui joue un rôle positif dans la signalisation BR chez le riz (Kim et al., 2009; Tong et coll., 2012; Hirano et coll., 2017)., Les mutants apparentés à l’auxine tels que iaa3 et arf6/arf8 étaient moins sensibles au BR que ceux de type sauvage pour l’allongement de l’hypocotyle, et ont aboli l’hypersensibilité de bzr1-1D à l’auxine, suggérant que la promotion BR et BZR1 de l’allongement de l’hypocotyle nécessite ARF6/8. L’analyse ChIP-Seq à l’échelle du génome a révélé que ARF6 partage un grand nombre de cibles génomiques (environ 50%) avec BZR1 et le facteur de transcription lumière/température régulée PIF4 par des analyses CHIP-Seq (Oh et al., 2014)., BZR1 et PIF4 interagissent avec ARF6 et activent des gènes cibles partagés en se liant à des gènes cibles partagés en coopération pendant l’élongation des hypocotyles (Oh et al., 2014) et beaucoup de ces gènes cibles qui se chevauchent codent les protéines de la paroi cellulaire impliquées dans l’expansion cellulaire.
Le Brassinostéroïde et l’auxine jouent également un rôle important dans le maintien du méristème apical racinaire (RAM) (Durbak et al., 2012). Le RAM se compose d’un petit groupe de cellules rarement divisées connu sous le nom de Centre quiescent (QC), entouré de cellules souches qui donnent naissance aux différents types de tissus toot., Le maintien de la population de cellules souches racinaires est régulé par HOMEOBOX 5 (WOX5) lié à WUSCHEL (Sarkar et al., 2007). WOX5 est limité au QC par la signalisation auxine et facilite l’expression correcte des gènes PLT (Aida et al., 2004; Ding et Friml, 2010). Des Mutations dans le gène du récepteur BR 1 insensible aux BRASSINOSTÉROÏDES (BRI1) entraînent une progression aberrante du cycle cellulaire dans le RAM et provoquent un RAM plus petit (Gonzalez-Garcia et al., 2011; Hacham et coll., 2011). L’auxine est connue pour stimuler la biosynthèse du BR (Chung et al.,, 2011), mais L’activité de BR n’affecte pas l’expression des gènes PIN (Hacham et al., 2011). Les phénotypes de l’extrémité des racines des mutants BR ne montrent pas les mêmes que les mutants auxines (Gonzalez-Garcia et al., 2011), indiquant que les BR agissent sur le bélier indépendamment de l’auxine.
les signaux de Brassinostéroïde et d’auxine sont également nécessaires en synergie dans la formation de motifs radiaux de faisceaux vasculaires (Ibanes et al., 2009)., Par les combinaisons de modélisation mathématique et d’expériences biologiques, les maxima d’auxine, établis par le transport polaire asymétrique de l’auxine, mais pas les changements sur les niveaux d’auxine est important pour le positionnement des faisceaux vasculaires. Le signal BR a été montré pour servir de signal de promotion pour le nombre de cellules dans le cycle provasculaire qui sont compatibles avec les maxima d’auxine. Ainsi l’établissement de la disposition périodique des faisceaux vasculaires dans la pousse est sous l’action coordonnée de ces deux hormones végétales (Ibanes et al., 2009)., Les deux signaux sont également impliqués dans le développement des racines des plantes et l’interaction du BR et de l’auxine est médiée par BREVIS RADIX (BRX) au cours de ce processus. BRX est important pour la biosynthèse limitant la vitesse de BR et L’application exogène de BR peut sauver des défauts mutants de brx. De plus, l’expression du gène sensible à l’auxine est globalement altérée chez le mutant brx, et l’expression de BRX est fortement induite par l’auxine et supprimée par BR, ce qui implique que la biosynthèse de BR et la signalisation de l’auxine sont connectées via une boucle de rétroaction impliquant BRX pendant le développement racinaire (Mouchel et al., 2006).,
Les Brassinostéroïdes et l’auxine jouent également un rôle synergique lors du développement des racines latérales. Les BRs fonctionnent principalement à l’initiation des primordiums de la racine latérale, tandis que l’auxine est nécessaire aux stades d’initiation et d’émergence de la formation des racines latérales (Casimiro et al., 2001; Bhalerao et coll., 2002; Benkova et coll., 2003; Bao et coll., 2004). Au cours de ces processus, les BRs augmentent l’initiation du LRP en favorisant le transport de l’auxine acropétale dans la racine, mais pas en affectant le niveau d’AAI endogène (Bao et al., 2004)., Tous ces rapports suggèrent que la diaphonie entre le BR et l’auxine joue un rôle important dans la régulation de la croissance et du développement des plantes.
BR régule la signalisation de l’auxine
outre l’interdépendance et la coopération des signaux de l’auxine et du BR pendant le développement de la plante, le BR pourrait médier la voie du signal de l’auxine à plusieurs niveaux. BZR1 interagit avec les protéines ARF pour cibler directement plusieurs composants et gènes de signalisation auxine impliqués dans le métabolisme des auxines tels que le transport et la signalisation, y compris AUX/IAA, PINs, TIR1, et ARFs, etc. (Sun et coll., 2010)., Il a été constaté que les protéines Aux / IAA sont impliquées dans les réponses BR et que les mutants iaa7/axr2-1 et iaa17/axr3-3 ont montré une sensibilité au BR aberrante et une expression génique induite par le BR aberrante de manière dépendante des organes (Nakamura et al., 2006). Le traitement exogène au brassinolide (BL) pourrait induire l’expression de gènes sensibles à l’auxine tels que IAA5, IAA19, IAA17, etc., et l’expression des gènes ci-dessus est régulée à la baisse dans le mutant biosynthétique br déétiolé2 (det2), ce qui indique que la biosynthèse fonctionnelle BR est en partie nécessaire pour l’expression du gène dépendant de l’auxine (Nakamura et al.,, 2003; Kim et coll., 2006). De plus, le BR affecte également le flux d’auxine en régulant l’expression des exportateurs d’auxine tels que PIN4 et PIN7 (Nakamura et al., 2004). Au cours des réponses au gravitropisme des plantes, les BRs pourraient améliorer l’accumulation polaire de L’exportateur D’auxine PIN2 dans la zone du méristème racinaire et ainsi affecter la redistribution de l’auxine de la pointe des racines vers les zones d’élongation et entraîner la différence des niveaux D’AAI dans les côtés supérieur et inférieur des racines pour induire le gravitropisme des plantes., Au cours de ce processus, le rop2 ACTIVÉ PAR LE BR joue un rôle important dans la modulation de la localisation fonctionnelle de PIN2 à travers la régulation de l’assemblage / remontage des F-actines (Li et al., 2005). D’autres études ont montré qu’une diminution de la perception et/ou de la concentration de BL pourrait induire le CYP79B2, le gène codant pour une enzyme convertissant le tryptophane en indole-3-acétaldoxime et ainsi affecter la distribution (Kim et al., 2007).
de plus, il a été constaté que le signal BR pouvait réguler la sortie de signalisation auxine par son régulateur négatif GSK3 kinase BIN2., Le facteur de réponse auxine ARF2 a été identifié comme une protéine interagissant avec BIN2 dans un test de criblage à deux hybrides de levure et une analyse kinase a montré que BIN2 pouvait phosphoryler ARF2. La phosphorylation D’ARF2 entraîne la perte de sa capacité de liaison à L’ADN et l’activité de répression des gènes cibles (Vert et al., 2008). ARF2 est un gène cible BZR1 et son expression est réduite par le traitement BR (Sun et al., 2010)., De plus, BIN2 peut phosphoryler ARF7 et ARF19 pour supprimer leur interaction avec AUX / IAAs et ainsi améliorer l’activité transcriptionnelle sur leurs gènes cibles limites D’organes latéraux-DOMAIN16 (LBD16) et LBD29 pour réguler l’organogenèse radiculaire latérale (Cho et al., 2014). Cependant, BR joue un rôle mineur au cours de ce processus et BIN2 est sous le contrôle du module facteur inhibiteur de différenciation des éléments TRACHÉAIRES (TDIF)–récepteur du TDIF (TDR) (Cho et al., 2014). Ensemble, BR peut réguler les réponses auxines en influençant différents composants de signalisation auxine.,
L’auxine régule la signalisation BR
d’autre part, l’auxine peut également réguler la voie du signal BR dans certains aspects. L’expression de DWARF4, une hydroxylase cruciale pour la biosynthèse du BR afin de contrôler le niveau endogène de BR, dépend de l’auxine. Le traitement à l’auxine pourrait stimuler sensiblement l’expression de DWARF4 et l’auxine pourrait inhiber la liaison de BZR1 au promoteur de DWARF4. L’induction de DWARF4 par l’auxine nécessite une voie de signalisation auxine mais pas une voie de signalisation BR (Chung et al., 2011; Yoshimitsu et coll., 2011)., Le CPD catalysant L’oxydation C-3 du BR a été activé par le BRX, un facteur de transcription putatif agissant en aval de la signalisation de l’auxine (Mouchel et al., 2006). Une étude plus approfondie dans le riz indique que l’auxine exogène peut améliorer les niveaux d’expression de la transcription du gène du récepteur BR OsBRI1, suggérant que l’auxine améliore la signalisation BR par la régulation des récepteurs BR (Sakamoto et al., 2013). De plus, le promoteur D’OsBRI1 possède un motif auxine-response element (auxre) en amont qui est ciblé par les facteurs de transcription ARF., De plus, des études mutantes indiquent que lors de la mutation de L’AuxRE, l’induction de L’expression D’OsBRI1 par l’auxine est abolie et que l’expression D’OsBRI1 est également régulée chez le mutant arf (Sakamoto et al., 2013). Il a été rapporté que OsARF19 se lie au promoteur D’OsBRI1 et régule positivement son expression, ce qui active ensuite la signalisation BR (Zhang et al., 2015). BES1 peut se lier au promoteur du petit ARN auxine-UP 15 (SAUR15) et médier le gène de réponse précoce BR chez Arabidopsis, et cette liaison pourrait être améliorée par un traitement à l’auxine (Walcher et Nemhauser, 2012)., Prise ensemble, l’auxine peut également affecter les réponses BR et la croissance et le développement des plantes régulés par BR.
remarques finales et perspectives d’avenir
Au cours des quatre dernières décennies, les études sur les interactions de la voie auxine-BR ont suscité l’intérêt de plus en plus grand des chercheurs. L’utilisation d’outils physiologiques, moléculaires, génétiques et biochimiques a considérablement approfondi notre compréhension de cette question., Sur la base des études précédentes, la BR et l’auxine sont impliquées de manière synergique dans plusieurs processus de développement des plantes, notamment: l’allongement hypocotyle, le développement des faisceaux vasculaires, le développement des racines et les tropismes, etc. L’interdépendance et la coopération de l’auxine et du BR sont compliquées et impliquent de nombreux processus au niveau moléculaire, en partageant les mêmes gènes cibles, en se régulant mutuellement à plusieurs niveaux (Figure 1).
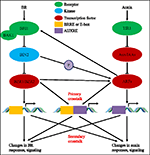
la FIGURE 1. Modèle de diaphonie auxine-brassinostéroïde (BR)., Chez Arabidopsis, les perceptions du signal BR et de l’auxine sont reconnues par les récepteurs BRI1 et TIR1, respectivement. BR se lie au domaine extracellulaire de BRI1 et favorise son interaction avec le co-récepteur BAK1 pour former un complexe récepteur BR plus actif, qui à son tour conduit à la déphosphorylation et à l’inactivation de BIN2. L’inactivation de BIN2 conduit à la déphosphorylation de deux facteurs de transcription homologues BR BZR1 et BZR2, qui se déplacent dans le noyau pour activer la transcription des gènes contenant BRRE ou e-box dans leur région promotrice., BIN2 peut également phosphoryler ARF7 et ARF19 pour supprimer leur interaction avec AUX/IAAs et ainsi améliorer l’activité transcriptionnelle sur leurs gènes cibles. TIR1 reçoit la signalisation auxine et interagit avec les protéines AUX/IAA en tant que co-récepteur de l’auxine. L’AUX / IAA est ensuite dégradé par la voie ubiquitine-protéasome, et les régulateurs de transcription de l’auxine les facteurs de réponse à l’auxine (ARF) sont libérés de la répression de L’AUX/IAA et activent la transcription de gènes avec des éléments sensibles à l’auxine (AUXRE) dans leur région régulatrice., Certains ARFs peuvent également se lier au promoteur de BRI1 et régule positivement son expression, ce qui active ensuite la signalisation BR. La diaphonie primaire se produit par l’activation de gènes qui contiennent à la fois BRRE/e-box et AUXRE dans leur région promotrice, permettant aux deux voies de signalisation de réguler directement la transcription. La diaphonie secondaire se produit par l’expression de gènes qui sont sensibles à l’auxine ou au BR, mais dont les activités contrôlent l’expression de gènes qui régulent la réponse et la signalisation d’autres hormones.,
La régulation de la Phosphorylation joue un rôle crucial dans la voie de signalisation BR, en particulier pendant le processus de perception, le BR est perçu par le récepteur bri1 kinase et les co-récepteurs BAK1 kinase, et contrôle finalement L’expression génique régulée par le BR en influençant les facteurs de transcription, 2005; Yin et coll., 2005; Sun et coll., 2010; Tang et coll., 2011; Yu et coll., 2011). Cependant, la régulation de l’ubiquitination semble essentielle pour la signalisation de l’auxine., Une fois que L’auxine se lie au récepteur TIR1, qui agit comme une ubiquitine E3-ligase, la TIR1 E3-ligase activée ubiquitinate les protéines aux/IAA, conduit à la dégradation de ces répresseurs et déséprime les facteurs de transcription ARF, et finalement provoque des changements de modèle d’expression des gènes régulés par l’auxine et des réponses, 1999, 2002; Hellmann et coll., 2003; Quint et coll., 2005). Comme il a été constaté que la bin2 kinase, qui fonctionne bien dans la signalisation BR, pourrait phosphoryler et améliorer les activités des ARF tels que ARF2 et ARF7 (Vert et al., 2008; Cho et coll.,, 2014), il sera intéressant de tester si des kinases telles que BIN2, impliquées dans la signalisation BR, pourraient également interagir avec d’autres composants de signalisation auxine tels que le récepteur TIR1 ou les répresseurs AUX/IAA, et influencer L’activité de la E3-ligase TIR1 ou les stabilités des protéines aux/IAA. D’autre part, le rôle de l’ubiquitination dans la signalisation BR doit également être abordé, en particulier si la TIR1 E3-ligase pourrait interagir directement avec les composants de signalisation BR et réguler leurs stabilités protéiques.,
en outre, en utilisant la réponse auxine DR5 et d’autres rapporteurs auxines, il a été observé que l’auxine régule la croissance et le développement des plantes d’une manière dépendante des tissus ou des cellules. Les diverses sorties transcriptionnelles en fonction du contexte cellulaire et environnemental (Clark et al., 2014; Etchells et coll., 2016; Lavy et coll., 2016)., Bien que la signalisation spatiotemporale BR ait été démontrée pour contrôler la croissance racinaire par l’action antagoniste avec l’auxine (Chaiwanon et Wang, 2015), on ignore encore si la signalisation tissulaire ou cellulaire BR, qui pourrait être visualisée par pBZR1:BZR1-YFP, est également importante pour contrôler d’autres processus en plus du développement racinaire. De plus, la génération d’une carte tissulaire détaillée ou de cave des distributions d’auxine et de BR est actuellement possible en utilisant le tri cellulaire activé par fluorescence ou la microdissection laser en combinaison avec une analyse d’expression génique à haute résolution., Cela finira par conduire à traiter si l’auxine traverse avec BR d’une manière tissulaire ou cellulaire.
contributions des auteurs
tous les auteurs ont participé à la rédaction de ce manuscrit. Pour plus d’informations sur ce qui constitue la paternité, veuillez vous référer à nos directives d’auteur.,
Financement
Ce travail est soutenu par des subventions de la Fondation Nationale des sciences naturelles de Chine (projets 31500229 et 31770305), Shandong Province Natural Science Foundation of Major Basic Research Program (2017c03), Shandong Provincial Funds for Distinguished Young Scholars (2014jq201408).
déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêts potentiel.
Paragraphe, S. D. (2011)., Transduction de signal de Brassinosteroid: de l’activation de kinase de récepteur aux réseaux transcriptionnels régulant le développement d’usine. Cellule Végétale 23, 1219-1230. doi: 10.1105/tpc.111.084475
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
Estelle, M. (2011). Signalisation auxine: de la synthèse à la biologie des systèmes; une collection de sujets de Cold Spring Harbor Perspectives en biologie. Cold Spring Harbor, NY: presse de laboratoire Cold Spring Harbor.
Google Scholar
Guilfoyle, T. J. (2015)., The PB1 domain in auxin response factor and Aux/IAA proteins: a versatile protein interaction module in the auxin response. Plant Cell 27, 33–43. doi: 10.1105/tpc.114.132753
PubMed Abstract | CrossRef Full Text | Google Scholar