Introduction
syndrome D’encéphalopathie réversible postérieure (PRES), décrit pour la première fois par Hinchey et al. en 1996, représente un trouble neurologique avec une présentation clinique variée et des résultats d’imagerie typiques du schéma pariéto-occipital prédominant d’œdème vasogénique (1, 2). Il existe de nombreuses causes documentées de PRES, avec des cas décrits pour la première fois dans le cadre de pressions artérielles élevées., Des exemples de scénarios cliniques dans lesquels on peut voir des PRES comprennent: urgence hypertensive, (pré)éclampsie, maladie rénale, troubles auto-immunes et médicaments cytotoxiques, entre autres (3, 4) (Tableau 1). Le PRES peut survenir dans n’importe quel groupe d’âge et a un taux d’occurrence plus élevé chez les patientes (7, 8). Bien que la littérature actuelle soit relativement clairsemée par rapport aux populations adultes, une mention particulière devrait être faite de PRES chez le patient pédiatrique., Les patients pédiatriques ont une présentation clinique similaire à celle de la population adulte, l’hypertension, les convulsions et l’état mental altéré étant des manifestations courantes de la maladie (9). Bien que la plupart des cas de PRES pédiatriques soient signalés chez les patients en oncologie, en particulier les patients transplantés post-cellules souches (10, 11), Une étude de Gupta et al. (12) ont constaté que la maladie rénale était peut-être la cause la plus fréquente de PRES chez le patient pédiatrique. Dans leur étude, les patients pédiatriques avaient tendance à présenter des résultats d’imagerie plus atypiques (62,5%), y compris une atteinte du lobe frontal (56%).,
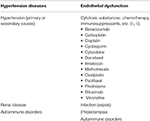
le Tableau 1. Principaux états pathologiques associés à PRES.
Les manifestations cliniques sont aiguës à subaiguës et vont de maux de tête et de troubles visuels à des niveaux altérés de conscience et des convulsions dans les cas plus graves (1). Le traitement vise généralement à cibler la cause sous-jacente, avec des symptômes généralement réversibles et des résultats d’imagerie dans la plupart des cas (8)., Bien que les résultats soient généralement favorables avec une bonne prise en charge, de mauvais résultats cliniques ont été associés à un diabète sucré préexistant et à une implication du corps calleux; cependant, d’autres biomarqueurs d’imagerie fiables pour le pronostic font actuellement défaut (13). L’imagerie neuroradiologique joue un rôle fondamental dans le diagnostic des PRES avec les caractéristiques d’imagerie typiques les mieux appréciées en imagerie par résonance magnétique (IRM) (2).
physiopathologie
Le(s) mécanisme (s) physiopathologique (s) précis (s) derrière le PRES n’ont pas encore été complètement élucidés et restent controversés (3)., Il existe actuellement deux principaux mécanismes proposés pour la physiopathologie du PRES (Figure 1). La première théorie propose l’augmentation des pressions artérielles comme facteur principal (8). Les augmentations rapides de la pression artérielle finissent par surmonter les capacités autorégulatrices du système vasculaire cérébral, provoquant une fuite vasculaire et un œdème vasogénique (14). Il y a un dysfonctionnement éventuel de la barrière hémato-encéphalique (BBB) avec des protéines passant par la jonction serrée (15)., Les zones alimentées par la circulation postérieure (artères vertébrales, artères basilaires et artères cérébrales postérieures) présentent un risque exceptionnel par rapport à la circulation antérieure (artères carotides internes, artères cérébrales moyennes et artères cérébrales antérieures) en raison de l’absence de tonus sympathique de la vascularisation de l’artère basilaire (8)., Une théorie connexe proposée par certains postule que l’hypertension extrême entraîne un vasospasme et une ischémie locale qui provoque une dégradation du BBB et un œdème vasogénique qui en résulte, comme cela a été observé chez les patients traités par des agents immunosuppresseurs cyclosporine A et FK-506 (16). La perturbation du BBB provoque les résultats typiques d’œdème vasogène par rapport à l’œdème cytotoxique (qui peut être observé dans le cadre d’un infarctus aigu et représente une augmentation de la teneur en eau intracellulaire due à la perte du gradient osmotique habituel dans le cadre de la mort cellulaire (17).,
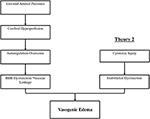
la Figure 1. Deux théories majeures de la physiopathologie du PRES. La théorie 1 est la théorie de l’hyperperfusion hypertensive et cérébrale et la théorie 2 est la théorie de la dysfonction endothéliale.
la deuxième théorie majeure porte sur le fait que jusqu’à 30% des patients atteints de PRES ne présentent pas les pressions artérielles élevées nécessaires pour dépasser le contrôle autorégulateur du système vasculaire cérébral (18, 19)., Cette théorie propose que le dysfonctionnement endothélial soit le principal responsable, qui peut être causé par diverses toxines endogènes ou exogènes (20). Cette théorie peut expliquer les résultats de PRES observés chez les patients recevant des médicaments immunosuppresseurs et / ou une chimiothérapie ainsi que chez les patients atteints de septicémie (21, 22). Dans ce modèle, les toxines circulantes provoquent des lésions vasculaires avec le développement d’un œdème vasogénique qui en résulte. Les lésions endothéliales provoquent une libération supplémentaire d’agents vasoconstricteurs et immunogènes, ce qui peut provoquer un vasospasme et/ou une augmentation de la perméabilité vasculaire., En fin de compte, le dysfonctionnement endothélial permettant une fuite vasculaire et un œdème vasogénique est le facteur moteur du PRES, indépendamment de l’anomalie primaire du système vasculaire cérébral (dans le cas de l’hypertension artérielle) ou secondaire aux toxines circulantes. Un résumé de ces deux théories ainsi qu’une liste des chimiothérapeutiques et autres immunosuppresseurs précédemment rapportés sont présentés à la Figure 2.
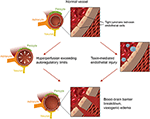
la Figure 2. Illustration des deux théories majeures de la physiopathologie sous-jacente du PRES., Remerciements: gracieuseté de Caroline O » Driscoll, MA (elle a illustré cela elle-même et est une employée de notre université).
les manifestations Cliniques dépendent les région(s) du cerveau; ainsi, la présentation peut être large. Par exemple, l’atteinte primaire des lobes occipitaux peut entraîner des troubles visuels/hallucinations. Des déficits neurologiques focaux correspondant à l’emplacement des lésions focales se produisent chez ~5-15% des patients atteints de PRES (23)., Rarement, l’atteinte de la moelle épinière peut entraîner des signes cliniques et des symptômes de myélopathie ou de paralysie (24).
imagerie
comme son nom l’indique, PRES se manifeste généralement sur les études d’imagerie comme un œdème vasogénique de la substance blanche à prédominance postérieure. Les lobes pariétal et occipital sont presque universellement impliqués et les résultats sont généralement symétriques et bilatéraux (1). L’atteinte des lobes frontaux, en particulier adjacents au sulci frontal supérieur, est également fréquemment observée., L’œdème vasogénique, bien qu’il puisse impliquer la matière grise cérébrale, est souvent plus facilement apprécié dans la substance blanche sous-corticale. L’examen CT est souvent le test d’imagerie initial dans le cadre de symptômes neurologiques aigus et peut démontrer une hypoattenuation de la substance blanche dans les régions touchées (25) (Figure 3: CT of PRES). Dans l’ensemble, les résultats sont mieux représentés par L’IRM, qui présente une sensibilité accrue et une meilleure caractérisation anatomique par rapport à la tomodensitométrie (26). De plus, L’IRM peut aider à distinguer d’autres états pathologiques qui peuvent se manifester cliniquement de la même manière que le PRES., Les séquences T2-weighted et T2 FLAIR (fluid-atténuated inversion recovery), en particulier, sont les plus utiles pour détecter un œdème vasogène à L’IRM (Figure 4: MR of PRES; Figure 5: MR of PRES Coronal).
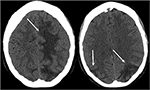
la Figure 3. Patient avec le lupus érythémateux disséminé et la glomérulonéphrite rapidement progressive présentant avec la saisie. Les images CT Non contrastées de la tête montrent un œdème vasogène dans les lobes pariétal et occipital bilatéraux, gauche supérieure à droite, ainsi que l’extension dans le lobe frontal gauche.,
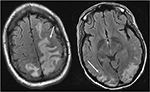
la Figure 4. Patient avec le lupus érythémateux disséminé et la glomérulonéphrite rapidement progressive présentant avec la saisie. Les images T2-FLAIR de la tête montrent un œdème vasogène dans les lobes pariétal et occipital bilatéraux, gauche supérieure à droite, ainsi que l’extension dans le lobe frontal gauche. Notez qu’avec le schéma vasogénique de l’œdème, il y a une épargne d’anomalie du signal dans le cortex.
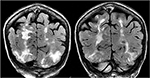
la Figure 5., Patient ayant des antécédents de myélofibrose primaire et de greffe de moelle osseuse sous Tacrolimus présentant une première crise. Les séquences de T2-FLAIR Coronal démontrent une anomalie de signal étendue dans les lobes occipital et pariétal bilatéraux, comme c’est typique avec PRES.
le diagnostic différentiel pour PRES est large et comprend des entités avec une hyperintensité de la substance blanche T2 confluente similaire., Les exemples incluent: l’ischémie / infarctus (en particulier la circulation postérieure), les maladies démyélinisantes, les étiologies infectieuses (méningite, encéphalite), la leucoencéphalopathie multifocale progressive (LEMP), la vascularite et divers troubles métaboliques (27). Une entité cliniquement apparentée appelée syndrome de vasoconstriction cérébrale réversible (RCVS) serait causée par des altérations du tonus vasculaire cérébral entraînant une vasoconstriction., Les VCR se manifestent par des céphalées d’orage récurrentes, des convulsions, des accidents vasculaires cérébraux et des hémorragies sous-arachnoïdiennes non anévrismales (28), qui pourraient être confondues avec les PRES sur une base clinique. Cette entité survient généralement dans la période post-partum ou après une exposition à des médicaments adrénergiques ou sérotoninergiques. Les RCV peuvent généralement être diagnostiqués avec des études angiographiques démontrant des zones multifocales de rétrécissement impliquant les artères cérébrales (29). Ce diagnostic peut être confondu avec le fait que les RCV et les PRES se produisent souvent de manière concomitante, ce que le neuroradiologue doit savoir pour éviter les erreurs de diagnostic (30).,
la PRES peut généralement être distinguée de l’ischémie aiguë parce que cette dernière démontre invariablement un œdème cytotoxique et une restriction de diffusion. La diffusion restreinte dans l’ischémie aiguë peut être facilement détectée sur l’imagerie pondérée par diffusion (DWI) et le coefficient de diffusion apparent (ADC) en tant que signal hyperintensif sur DWI avec un signal diminué correspondant sur ADC (en raison du mouvement relativement diminué des molécules d’eau intracellulaires)., L’œdème vasogène dans le cadre de PRES, en revanche, peut montrer un signal hyperintensif sur DWI qui n’est pas accompagné d’un signal diminué correspondant sur ADC (31). De plus, l’ischémie aiguë a tendance à être unilatérale et à l’intérieur d’un territoire vasculaire singulier. Bien que l’évaluation de la restriction de diffusion pour différencier le PRES DE l’anomalie ischémique soit généralement fiable, il existe de rares cas de PRES qui peuvent être associés à des zones de restriction de diffusion superposées à des zones d’œdème vasogénique isolé plus classique.,
Les techniques d’imagerie »avancées” en PRES ont récemment été décrites comme un outil d’appoint dans des cas difficiles ou équivoques. Ces techniques d’imagerie avancées comprennent: la perfusion CT/MR, la spectroscopie MR (MRS), l’imagerie pondérée de susceptibilité (SWI) et les techniques de médecine nucléaire, y compris la tomographie par émission d’un seul photon (SPECT) et la tomographie par émission de positons (TEP) avec divers Radiotraceurs. Bien qu’une discussion complète dépasse la portée de cet examen, une variété de résultats d’imagerie peuvent être vus sur ces techniques avancées pour aider à suggérer un diagnostic de PRES., Une Hyperperfusion peut être observée lors d’études de perfusion par tomodensitométrie/IRM, démontrée par une augmentation du débit sanguin cérébral et du volume sanguin avec une réduction du temps de perfusion et du temps de transit moyen (32), bien que des cas d’hypoperfusion aient été rapportés (33). Sur le MRS, il y a généralement une réduction du rapport N-Acétylaspartate (NAA)/Créatine (Cr) et NAA/Choline (Chol), suggérant une perturbation des synapses normales et de la fonction neuroaxonale (34). SWI peut aider à identifier la présence d’hémorragie dans PRES, avec une sensibilité plus élevée que l’imagerie GRE (35)., L’imagerie SPECT/TEP montre généralement une hyperperfusion ou une hypoperfusion (similaire aux études de perfusion CT/MR) avec un faible métabolisme par FDG-TEP (36).
En outre, le PRES peut être distingué d’autres conditions telles que l’encéphalite auto-immune dans le cadre de l’encéphalomyélite aiguë disséminée (ADEM) par l’ancien œdème vasogénique bilatéral diffus mais asymétrique (37)., PML peut avoir une apparence similaire par rapport à PRES, ayant une prédominance pariéto-occipitale, mais peut être distinguée par son implication plus unilatérale ou asymétrique, ainsi que par sa prédilection pour la substance blanche sous-corticale (38).
Caractéristiques D’imagerie atypiques
Les caractéristiques atypiques de PRES comprennent des zones d’amélioration du contraste, d’hémorragie ou de restriction de diffusion (39)., Bien que les lobes pariétal et occipital soient généralement impliqués, des zones atypiques d’implication peuvent être observées, notamment: le tronc cérébral, le cervelet, le corps calleux et d’autres zones cérébrales, avec des zones plus communes comprenant les lobes frontaux (vus dans jusqu’à 68%) et les lobes temporaux inférieurs (jusqu’à 40%) (23, 40) (Figure 6: cervelet; Figure 7: tronc cérébral).
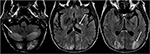
la Figure 6. Patient avec transplantation hépatique 6 semaines plus tôt. Le patient a commencé à recevoir du Tacrolimus après une transplantation hépatique., Les images T2-FLAIR du cerveau démontrent une anomalie du signal dans les lobes occipitaux. Il existe également une anomalie de signal étendue observée dans les hémisphères cérébelleux bilatéraux et dans le thalami. Ces résultats se sont rapidement résolus après l’arrêt du Tacrolimus.
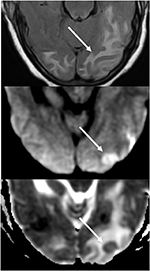
la Figure 7. Patient souffrant d’hypertension non contrôlée présentant une altération de l’état mental. L’image T2-FLAIR (en haut) montre un œdème dans les lobes occipitaux., Les images DWI (milieu) et ADC map (bas) montrent une petite flèche de diffusion restreinte, avec un signal hyperintense sur DWI et une hypointensité correspondante sur la carte ADC.
de plus, une découverte précoce de PRES, qui peut précéder l’œdème pariéto-occipital typique, comprend une légère HYPERINTENSITÉ du FLAIR sulcal et une amélioration leptoméningienne sur les images pondérées T1 post-contraste, comme décrit par Nakagawa et al. (41). Benziada-Boudour et coll., (42) décrit un développement simultané d’œdème cytotoxique, entraînant une diffusion restreinte (Figure 8: restriction de Diffusion). Inhérents au nom du processus de la maladie, les résultats liés à PRES sont généralement réversibles, avec normalisation des résultats cliniques et d’imagerie une fois que le problème d’incitation est traité. Cependant, dans certains cas, les zones de diffusion restreinte peuvent finalement entraîner une lésion permanente du parenchyme cérébral (Figure 9: nécrose laminaire)., Les hémorragies sont moins fréquentes dans les SPR, survenant dans 5 à 30% des cas, mais il faut reconnaître qu’il ne faut pas confondre ce résultat avec une autre entité pathologique dans le contexte clinique approprié des SPR (39). Les résultats d’imagerie dans l’hémorragie peuvent inclure: hématome focal, hémorragie gyrale pétéchiale et/ou hémorragie sous-arachnoïdienne (43) (Figure 10: hémorragie).
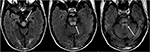
la Figure 8. Patient ayant des antécédents de transplantation hépatique deux semaines plus tôt sous Tacrolimus., Les images T2-FLAIR montrent une anomalie du signal dans le mésencéphale, les pons et les pédoncules cérébelleux supérieurs.
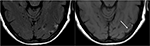
la Figure 9. T2-FLAIR (à gauche) image chez un patient souffrant d’hypertension non contrôlée et d’imagerie antérieure indiquant PRES (voir Figure 6), Maintenant contrôlée et 6 semaines plus tard, démontre la résolution de l’œdème précédemment vu. De petites zones de gliose dues à une blessure sont observées dans le lobe temporal gauche. T1 Axial sans contraste montre une nécrose laminaire corticale curviligne liée à la lésion antérieure liée au PRES., Bien que le PRES soit généralement entièrement réversible, il peut entraîner des blessures permanentes dans certaines situations.
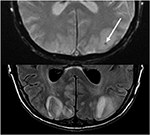
la Figure 10. Patient avec une transplantation hépatique antérieure sur Tacrolimus. T2 gradient recalled echo (top) montre une zone focale d’hémorragie dans l’œdème vasogénique dans le lobe occipital gauche. T2-FLAIR démontre la découverte la plus typique liée à PRES avec anomalie du signal dans les lobes occipitaux bilatéraux.,
Traitement
le Traitement des PRÉS est généralement destinées à contrôler la principale étiologie causant des PRES (44). Par exemple, en cas de pression artérielle élevée, le traitement vise à corriger la pression artérielle élevée dans un environnement contrôlé, similaire à l’approche de l’urgence hypertensive/ urgence (45). En règle générale, une réduction non rapide de la pression artérielle est recherchée pour éviter le risque de provoquer une maladie cérébrale ischémique à la suite d’un abaissement drastique de la pression artérielle (46)., Parfois, des médicaments anticonvulsivants sont utilisés comme traitement d’appoint, bien que le ou les agents optimaux, le moment et la durée du traitement restent controversés(4) (Figure 11: avant et après).
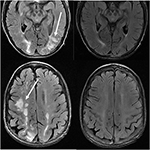
la Figure 11. Patient ayant des antécédents de myélofibrose primaire et de greffe de moelle osseuse sous Tacrolimus. Les images T2-FLAIR axiales montrent les zones d’anomalie du signal dans les lobes pariétal et occipital, et le lobe frontal droit (images de gauche)., Le Tacrolimus a été arrêté et les images de suivi (images de droite) ont été obtenues 6 semaines après les images initiales.
En cas de (pré)éclampsie, le traitement vise à l’accouchement en temps opportun du fœtus ainsi qu’à la gestion de la pression artérielle et au sulfate de magnésium pour la prophylaxie épileptique (47). Dans le cadre de la PRES induite par des agents chimiothérapeutiques ou d’autres agents immunosuppresseurs, le rétrécissement ou l’arrêt absolu du médicament a montré une amélioration clinique et radiologique (48) (Figure 12: éclampsie)., L’hypomagnésémie est une découverte commune dans le PRES et un facteur étiologique possible. Par conséquent, les auteurs ont suggéré que la supplémentation en magnésium pourrait être un complément utile dans la gestion des PRES (49).
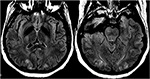
la Figure 12. Patient avec éclampsie et présentant une crise. Les images T2-FLAIR axiales montrent une anomalie du signal symétrique dans les lobes occipitaux bilatéraux.,
Conclusion
PRES est une entité unique avec des résultats cliniques et neuroradiologiques caractéristiques, en plus d’une myriade de causes bien documentées. Bien que le ou les mécanismes physiopathologiques précis derrière PRES n’aient pas encore été élucidés (et pourraient en effet être dus à une combinaison de processus interdépendants), le mécanisme généralement accepté est un dysfonctionnement de la barrière hémato-encéphalique entraînant un œdème vasogénique avec prédominance de la circulation postérieure., Les caractéristiques d’imagerie sont mieux évaluées sur les séquences D’IRM sensibles aux fluides qui révèlent des hyperintensities T2 de substance blanche prédominante pariéto-occipitale, bien que de nombreuses caractéristiques d’imagerie atypiques puissent être observées et doivent être gardées à l’esprit lors de l’évaluation de cas difficiles. Divers outils d’imagerie avancés sont disponibles pour aider dans les cas difficiles ou équivoques. Le traitement vise à gérer la cause sous-jacente en accordant une attention particulière à la surveillance de la pression artérielle et à la prophylaxie éventuelle des crises épileptiques.,
Contributions des auteurs
conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêts potentiel.
1. Bartynski WS. Syndrome d’encéphalopathie réversible postérieure, Partie 1: imagerie fondamentale et caractéristiques cliniques. Am J Neuroradiol. (2008) 29:1036–42. doi: 10.3174 / ajnr.,A0928
CrossRef Full Text | Google Scholar
3. Bartynski WS. Posterior reversible encephalopathy syndrome, Part 2: controversies surrounding pathophysiology of vasogenic edema. Am J Neuroradiol. (2008) 29:1043–9. doi: 10.3174/ajnr.A0929
CrossRef Full Text | Google Scholar
5. Singer S, Grommes C, Reiner AS, Rosenblum MK, DeAngelis LM. Posterior reversible encephalopathy syndrome in patients with cancer., Oncologist. (2015) 20:806–11. doi: 10.1634/theoncologist.2014-0149
PubMed Abstract | CrossRef Full Text | Google Scholar
6. How J, Blattner M, Fowler S, Wang-Gillam A, Schindler SE. Chemotherapy-associated posterior reversible encephalopathy syndrome: a case report and review of the literature. Neurologist. (2016) 21:112–7. doi: 10.1097/NRL.,0000000000000105
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Habetz K, Ramakrishnaiah R, Raina SK, Fitzgerald RT, Hinduja A. Posterior reversible encephalopathy syndrome: a comparative study of pediatric versus adult patients. Pediatr Neurol. (2016) 65:45–51. doi: 10.1016/j.pediatrneurol.2016.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Fugate JE, Rabinstein AA., Posterior reversible encephalopathy syndrome: clinical and radiological manifestations, pathophysiology, and outstanding questions. Lancet Neurol. (2015) 14:914–25. doi: 10.1016/S1474-4422(15)00111-8
CrossRef Full Text | Google Scholar
9. Zama, D, Gasperini P, Berger M, Petris M, De Pasquale MD, et al. A survey on hematology-oncology pediatric AIEOP centres: the challenge of posterior reversible encephalopathy syndrome. Eur J Haematol. (2018) 100:75–82. doi: 10.1111/ejh.,12984
CrossRef Full Text | Google Scholar
12. Gupta V, Bhatia V, Khandelwal N, Singh P, Singhi P. Imaging findings in pediatric posterior reversible encephalopathy syndrome (PRES): 5 years of experience from a tertiary care center in India. J Child Neurol. (2016) 31:1166–73. doi: 10.1177/0883073816643409
PubMed Abstract | CrossRef Full Text | Google Scholar
13., Hinduja A, Habetz K, Raina s, Ramakrishnaiah R, Fitzgerald RT. prédicteurs de mauvais résultats chez les patients atteints du syndrome d’encéphalopathie réversible postérieure. Int J Neurosci. (2017) 127:134–44. doi: 10.3109/00207454.2016.1152966
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
15. MacKenzie ET, Strandgaard S, Graham DI, Jones JV, Harper AM, Farrar JK. Effets de l’hypertension induite aiguë chez les chats sur le calibre artériolaire pial, le flux sanguin cérébral local et la barrière hémato-encéphalique. Circ Rés., (1976) 39:33–41. doi: 10.1161/01.RES.39.1.33
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bartynski WS, Zeigler Z, Spearman MP, Lin L, Shadduck RK, Lister J. Etiology of cortical and white matter lesions in Cyclosporin-A and FK-506 neurotoxicity. Am J Neuroradiol. (2001) 22:1901–14.
PubMed Abstract | Google Scholar
21. Bartynski WS, Boardman JF, Zeigler ZR, Shadduck RK, Lister J., Posterior reversible encephalopathy syndrome in infection, sepsis, and shock. Am J Neuroradiol. (2006) 27:2179–90.
PubMed Abstract | Google Scholar
22. Mayama M, Uno K, Tano S, Yoshihara M, Ukai M, Kishigami Y, et al. Incidence of posterior reversible encephalopathy syndrome in eclamptic and patients with preeclampsia with neurologic symptoms. Am J Obstet Gynecol. (2016) 215:239.e1–e5. doi: 10.1016/j.ajog.2016.02.,039
PubMed Abstract | CrossRef Full Text | Google Scholar
23. McKinney AM, Short J, Truwit CL, McKinney ZJ, Kozak OS, SantaCruz KS, et al. Posterior reversible encephalopathy syndrome: incidence of atypical regions of involvement and imaging findings. Am J Roentgenol. (2007) 189:904–12. doi: 10.2214/AJR.07.2024
PubMed Abstract | CrossRef Full Text | Google Scholar
24., de Havenon A, Joos Z, Longenecker L, Shah L, Ansari S, Digre K. Posterior reversible encephalopathy syndrome with spinal cord involvement. Neurology. (2014) 83:2002–6. doi: 10.1212/WNL.0000000000001026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Dandoy CE, Linscott LL, Davies SM, Leach JL, Myers KC, El-Bietar J, et al., Clinical utility of computed tomography and magnetic resonance imaging for diagnosis of posterior reversible encephalopathy syndrome after stem cell transplantation in children and adolescents. Biol Blood Marrow Transplant. (2015) 21:2028–32. doi: 10.1016/j.bbmt.2015.07.023
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Noda K, Fukae J, Fujishima K, Mori K, Urabe T, Hattori N, et al., Reversible cerebral vasoconstriction syndrome presenting as subarachnoid hemorrhage, reversible posterior leukoencephalopathy, and cerebral infarction. Intern Med. (2011) 50:1227–33. doi: 10.2169/internalmedicine.50.4812
CrossRef Full Text | Google Scholar
31. Doelken M, Lanz S, Rennert J, Alibek S, Richter G, Doerfler A, et al. Differentiation of cytotoxic and vasogenic edema in a patient with reversible posterior leukoencephalopathy syndrome using diffusion-weighted MRI. Diagn Interv Radiol., (2007) 13:125–8.
Google Scholar
32. Wartenberg KE, Parra A. CT and CT-perfusion findings of reversible leukoencephalopathy during triple-H therapy for symptomatic subarachnoid hemorrhage-related vasospasm. J Neuroimaging. (2006) 16:170–5. doi: 10.1111/j.1552-6569.2006.00031.x
CrossRef Full Text | Google Scholar
33. Vanacker P, Matias G, Hagmann P, Michel P., Cerebral hypoperfusion in posterior reversible encephalopathy syndrome is different from transient ischemic attack on CT perfusion. J Neuroimaging. (2015) 25:643–6. doi: 10.1111/jon.12158
CrossRef Full Text | Google Scholar
34. Lee SY, Kim SH, Lee SH, Baek HJ, Shon HS, Kim SS. Serial MR spectroscopy in relapsing reversible posterior leukoencephalopathy syndrome. Neurologist. (2009) 15:338–41. doi: 10.1097/NRL.,0b013e3181914af6
PubMed Abstract | CrossRef Full Text | Google Scholar
35. McKinney AM, Sarikaya B, Gustafson C, Truwit CL. Detection of microhemorrhage in posterior reversible encephalopathy syndrome using susceptibility-weighted imaging. Am J Neuroradiol. (2012) 33:896–903. doi: 10.3174/ajnr.A2886
PubMed Abstract | CrossRef Full Text | Google Scholar
38., Berger JR, Aksamit AJ, Clifford DB, Davis L, Koralnik IJ, Sejvar JJ et al. Critères diagnostiques de LMP: déclaration de consensus de la section des maladies neuroinfectieuses de L’AAN. Neurologie. (2013) 80:1430-8. doi: 10.1212 / WNL.0b013e31828c2fa1
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
39. Aracki-Trenkić et, Stojanov D, Trenkić M, Radovanovic Z, Ignjatovic J, Ristic s, et coll., Atypical presentation of posterior reversible encephalopathy syndrome: clinical and radiological characteristics in eclamptic patients. Bosn J Basic Med Sci. (2016) 16:180–6. doi: 10.17305/bjbms.2016.1201
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Bartynski WS, Boardman JF. Distinct imaging patterns and lesion distribution in posterior reversible encephalopathy syndrome. Am J Neuroradiol. (2007) 28:1320–7. doi: 10.3174/ajnr.,A0549
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Brickman AM, Reitz C, Luchsinger JA, Manly JJ, Schupf N, Muraskin J, et al. Long-term blood pressure fluctuation and cerebrovascular disease in an elderly cohort. Arch Neurol. (2010) 67:564–9. doi: 10.1001/archneurol.2010.70
PubMed Abstract | CrossRef Full Text | Google Scholar
47., Cozzolino M, Bianchi C, Mariani G, Marchi L, Fambrini M, Mecacci F. Therapy and differential diagnosis of posterior reversible encephalopathy syndrome (PRES) during pregnancy and postpartum. Arch Gynecol Obstet. (2015) 292:1217–23. doi: 10.1007/s00404-015-3800-4
PubMed Abstract | CrossRef Full Text | Google Scholar
48. Masetti R, Cordelli DM, Zama D, Vendemini F, Biagi C, Franzoni E, et al. PRES in children undergoing hematopoietic stem cell or solid organ transplantation. Pediatrics., (2015) 135:890–901. doi: 10.1542/peds.2014-2325
CrossRef Full Text | Google Scholar