유전자 p53 에 처음으로 발견되었습 1979. 항-T 혈청을 이용한 면역 교정으로 simian 바이러스 40 형질 전환 마우스 세포(SV40)에서 단백질이 확인되었다;이 단백질은 단백질 p53 이라고 불렸다. 같은 해 Kress 와 다른 과학자들은 분자 질량이 50-60kDa 에 이르는 새로운 종류의 단백질을 발견했습니다. 그런 다음 이러한 종류의 단백질이 p53 으로 확인되었습니다. 단백질 p53 은 또한 immunoprecipitation 에 의해 다양한 변형 된 세포주로부터 확인 될 수있다., Lane 과 Linzer 도 1979 년에 비슷한 결과를 얻었습니다. 다른 증거를 식별하기 위한 p53p53 에 표현되었는데 모든 테스 변 마우스 셀;이러한 테스트를 포함한 화학적 유도 sarcomas,변환 섬유 아세포,그리고 백혈병하면서 정상세포,p53 었 표시되지 않습니다. 또한,세포가 자발적으로 또는 비 자발적으로 어떻게 변형되었는지에 상관없이 대부분의 변형 된 세포에서 높은 수준의 p53 이 검출되었다., 는 크게 증가로 인해 안정성의 p53,그러나,F9 배아 carcinoa 셀,그것은 높은 수준을 나타냈 p53,이 때문에 양의 번역 p53mRNA.
1979 년에 단백질 p53 이 발견 된 후 분석하기 위해 인기를 얻었습니다. 그러나 그 시간에,그것은 새로 발견된 단백질이 없었던 이전의 이름은 그것을 위해,다른 기관에 사용되는 다른 이름과 출판된 논문과 함께 다른 이름입니다., 기 위해서 이 문제를 해결하기 위해서는 1983 년 동안 제 1 회 국제 p53 작업장에서 개최 Oxted,영국,과학자 다른 연구 그룹을 다른 나라에서 얻을 논의하기 위해 함께 일반적인 명칭이 새로 발견된 단백질이다. 이 회의에서”p53″은 그 이름이되어 그 이후로 사용되었습니다. 과학자들이 단백질 p53 이라고 불렀던 이유는이 단백질의 분자 질량이 SDS 겔에서의 이동을 기반으로하는 53kDa 라고 생각되었습니다. 나중에 분자 질량이 틀린 것으로 판명되었고 올바른 분자 질량은 43 이어야합니다.,7kDa p53 은 프롤린이 풍부한 영역을 포함하고 있기 때문에이 영역은 SDS 겔에서 p53 의 이동을 감소시킬 수 있습니다. 그러나”p53″이라는 이름은 남아있었습니다.
1980 년대 동안,단백질 p53 믿고 있었기에 참여하는 세포 주기뿐만 아니라,역할을 DNA 복제에서. 나중에 1982 년에서 1994 년까지 사람들은 일부 바이러스 성 oncoproteins 가 p53 에 결합하여 복합체를 형성 할 수 있음을 발견했습니다. 1982 년에,Sarnow 외. 아데노 바이러스 E1b(58kDa)가 위에서 언급 한 SV40 변형 마우스 세포에 존재하는 54kDa 단백질과 상호 작용할 수 있음을 발견했다., T 항체의 면역 학적 특이성과 54kDa 단백질의 펩타이드 맵의 결과에 따르면,이 54kDa 단백질은 p53 으로 확인된다. 같은 해에,과학자들이 발견되는 경우 그들은 주사 p53 항체 스위 3T3mouse cells 것을 억제하세포를 입력하 S 의 위상을 세포주기,그러나 같은 상황,p53 체에 영향을 미치지 않았다 SV40 나 아데노 induced DNA synthesis.,
나중에는 1984 년에 과학자들은 검사의 효과 p53 에 비 변환 3T3fibroblasts,그들을 분석 종합의 단백질 p53 다른 시간에 포인트를 발견에서 늦은 G1 단계에서,합성을 평가하고 수준의 단백질 p53 및 관련 mRNA 증가합니다. 이 결과는 단백질 p53 이 세포 간에서 분열 단계로 들어가는 것을 억제한다는 것을 시사한다. Maltzman w 외. 같은 해에 또 다른 실험을했습니다. 그들은 변형되지 않은 마우스 세포를 자외선 및 UV 모방 화학 발암 물질 4NQO 로 처리했으며 높은 수준의 p53 을 검출했습니다., 결과 보는 높은 표현의 p53 뿐만 아니라 상징을 나타내는 세포주기,하지만 또한 더 중요한 것은 구성 요소입에 관여 DNA 를 합성 세포 증식. 1987 년 simian 바이러스 40 의 t 항원과 DNA 중합 효소 α 의 복합체를 연구 할 때 Gannon 과 다른 과학자들은 p53 과 중합 효소 α 에 결합 할 때 항원에서 유사한 변화를 발견했다. 그들은 또한 세 가지 성분의 특정 농도에서 T 항원,p53 및 DNA 중합 효소 α 를 포함하는 특수 trimeric 복합체를 형성 할 수 있음을 발견했습니다., T 항원이 바이러스 DNA 복제 및 세포 변형에 관여함에 따라,이 결과는 p53 이 세포주기 및 DNA 복제의 제어에 역할을한다는 것을 나타낸다.
상기 실험에서 보여준 바와 같이,p53 은 세포를 불멸화시키는 능력을 갖는다. 1984 년에,Eliyahu d 외. p53 과 oncogene myc 의 생성물이 몇 가지 유사한 특성을 공유한다는 것을 발견했다. 둘 다 다른 단백질에 결합하는 능력을 가지고 있으며 세포주기에 관여하며 둘 다 변형 된 세포의 핵에 축적됩니다., Bienz,Pennica 과학 분석되는 아미노산 시퀀스는 단백질의 p53 및 제품의 myc,그리고 그들을 발견했는지 두 단백질 유사성을 보여 분자 구조에서의 위치를 특별한 위탁 잔류물. 그런 다음 과학자들은 p53 이 oncogene 으로 작용할 수 있다고 제안했습니다. 이 가설에 기초하여,Eliyahu d et al. 몇 가지 실험을했습니다. 기본 비율 배아 섬유아세포 변환할 수 있습에 참여하의 myc 제품 및 Ha-ras,primary 아기 쥐의 신장세포할 수 있도에 의해 변형 협력 Ha-ras 아데노기 지역 1A,Eliyahu D et al., p53 의 종양 발생 기능을 확인하기 위해 이러한 종류의 생물학적 시험 시스템을 사용하기로 결정했습니다. 그들은 정상적인 배아 세포를 p53 으로 처리하고 Ha-ras 를 활성화시켰다. 결과는 표적 세포가 형태 변화를 만나 높은 수준의 p53 을 생성한다는 것을 보여 주었다,Eliyahu d et al. p53 과 Ha-ras 에 의한 배아 섬유 아세포의 변형은 유전자 p53 이 oncogene 이라고 설명했다., 1985 년에 Jenkins 제 p53 유전자할 수 있는 수명을 연장,세포의 향상 affectivity 의 변형을 정리하여 이를 코딩하는 순서를 발생시킬 수 있는 생산의 안정된 단백질이다.
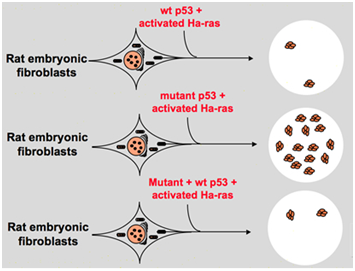
그러나 1980 년대 후반에,과학을 깨닫기 시작하는 p53 종양 억제 유전자로 대 oncogene. 그들은 관찰되는 p53 으로 정상적인 기능에서 검출될 수 없다는 많은 종양의 잃는 것을 발견했다고 표현하는 기능의 wild-type p53 유전자는 동안 필요한 세포 변환입니다., 이들은 야생형 p53 유전자가 신 생물 진행을 억제 할 수있는 가능성을 제기한다. 그들은 공식화를 다른 가설:clone 유전자 p53 이전에 사용되는 실험이 포함되어 지배적인 부정적인 돌연변이 내에서 높게 보존된 도메인을 때는 반대 실험 결과입니다. 1988 년 Ben 과 다른 과학자들은 친구 백혈병 바이러스에 감염된 murine 의 spleens 에서 유래 된 murine erythroleukemia 세포주 인 DP20-1 과 CB3 에서 엄청난 양의 재 배열 된 p53 을 발견했습니다., 1989 년 P53 이 oncogene 이라고 지적한 Eliyahu 는 마음이 바뀌었고 야생형 p53 유전자가 세포 전이를 억제 할 수 있다고 가정했다. Eliyahu 와 다른 과학자들의 효과를 연구하 wild-type p53 단백질 인코딩된 플라스미드 및 돌연변이 p53 에는 기능을 이끌어내는 기본 비율 배아 섬유아세포 변환하여 다양한 oncogene 조합에서 체외. 예를 들어 돌연변이 p53plus ras 및 myc plus ras., 결과 보는 wild-type p53 생하는 거대한 감소의 변환된 초점에 의해 발생 돌연변이 p53plus ras;돌연변이 p53 보 억제 변화에 초점에 발생 myc 플러스 라스 동안,myc 플러스 라스-중재 변환에 매우 민감의 표현 wild-type p53. 그림 1 은이 실험을 간결하게 보여줍니다. 돌연변이 p53 과 비교하여 야생형 p53 이 세포 변형에 명백하게 억제 효과를 나타냄을 보여 주었다. 이 효과는 야생형 p53 의 발현 수준과 긍정적으로 관련되어 있으며 돌연변이 p53 의 발현 수준과 부정적으로 관련되어있다., 이 실험은 야생형 p53 이 실제로 돌연변이 p53 과 비교하여 반대 기능을 가질 수 있으며 tumorigenesis 를 억제 할 수 있다고 제안했다. 현재 p53 은 종양 억제 유전자로 인식되고 있습니다. 종양의 약 절반이 p53 에 의한 것으로 추정됩니다. 그것은 인간에서 가장 빈번하게 변이 된 유전자 중 하나이며 전 세계에서 가장 자주 분석되는 유전자입니다.
1980 년대의 처음 몇 년 동안,p53 의 생화학 적 경로와 p53 돌연변이의 효과는 명확하지 않았다. 1991 년 Kern 과 다른 과학자들은 33 염기 쌍의 DNA 서열이 시험 관내에서 야생형 p53 에 특이 적으로 결합한다는 것을 발견했다. 그들은 또한 p53 단백질이 포함되어 두 가지 돌연변이 있는 일반적으로 발견된 인간의 종양에는 바인딩할 수 없습니다 이는 특정 DNA 지역입니다. 그래서 그들은 생각의 기능 p53 에 따라 달라집할 수 있는 특정 DNA,이 능력은 변경으로 돌연변이 발견에서 인간의 종양입니다., 그들은 또한 가정을 이 33-기초 쌍 DNA sequence 되지 않을 수 있습의 순서만이 있는 능력을 결합하는 특별하 p53 에서 인간은 그러나,그것은 사람들을 도울 수 있는 더 나은 기능을 이해하의 p53. 나중에,p53 은 세포주기,DNA 수리,분화,세포 사멸 및 혈관 신생을 시작하는 동안 역할을하는 것으로 밝혀졌다. 로터 브이 외. p53 이 세포의 분화를 상향 조절한다는 것을 발견했다. 예를 들어,b 세포 분화 동안 몇 가지 주요 단계에서 높은 수준의 p53 단백질이 검출되었다. 상승 된 p53 은 또한 정자 형성 중에 검출 될 수있다., 한편,성인 마우스의 일부 기관에서는 매우 낮은 수준의 p53 단백질 만 검출 할 수 있습니다.1990 년에 유용한 도구가 때때로 발견되었습니다. P53val135 라고 불리는 p53 의 온도에 민감한 돌연변이 체입니다. 그것은 역할을 할 수 있으로 wild-type p53 온도에 32.5oC,억압 변환,그리고 그것은 역할을 할 수 있습니다 다른 변이 p53 온도에 37.5oC 또는 위 48oC,도출 하는 변화입니다. 또한,변형된 세포 표현 p53val135,그것의 확산 제어에 허용온도,그리고 이러한 종류의 제어가 되돌릴 수 있습니다., 이 p53val135 돌연변이 체를 사용함으로써,야생형 p53 은 g1 또는 G2/M 중 하나에서 세포주기 정지를 유도하는 것으로 밝혀졌다. 1991 년,Elisheva 등. 온도에 민감한 p53val135 가 뮤린 골수성 백혈병 세포주에서 다른 기능을 수행한다는 것을 발견했다. 며칠 동안 p53val135 의 재 활성화 후,모든 세포는 죽었고,이 죽음은 세포 사멸의 일부 특성을 나타낸다. 1 년 후 비슷한 결과가 Shaw 에 의해 얻어졌습니다. 야생형 p53 을 인간 결장 종양 유래 세포주 EB 로 형질 전환시켰다., 세포는 빛과 전자 현미경 하에서 검사되었고,아폽토시스의 일부 특성을 나타내는 것으로 밝혀졌다. 1990 년 셰프너 외. 와 다른 과학자들이 발견 E6 자극하는 파괴의 규제 호스트 세포 단백질은 인코딩에 의해 발암 인유두종 바이러스 형식 16 18,그리고 그것을 형성할 수 있는 복잡한으로 wild-type p53 시험관에서는 저하를 일으키는 원인이 되는 단백질의 p53.
1992 년에,주요 단백질 MDM2 는 p53 과 단단히 결합하기 때문에 발견되었으며,p53 에 의해 매개되는 transactivation 을 억제한다., MDM2 의 분자 질량은 90kDa 이며 돌연변이 형 및 야생형 p53 과 복합체를 형성합니다. 같은 해에 Livingstone RL et al. 공부했는지 여부를 셀 잃은 하나 또는 모두의 사본 야생 type p53 대립과는 경우에는 충분한 원인 유전자 증폭. 유전자 증폭은 변형 된 세포에서 주로 검출되었지만 정상 섬유 아세포에서는 검출되지 않았다. 결과를 보여주는 세포 중 하나를 잃어의 복사본을 p53 대립 행동으로 wild-type p53 하는 동안,세포 복사본을 모두 잃고 야생의 유형 p53 대립 전시 높은 빈도의 증폭. Yin y 등이 만든 또 다른 실험., 비슷한 결과를 보였다.
1993 년에 CDKN1A 라고 불리는 p53 표적 유전자가 확인되었다. 그것은 그(것)들에 결합해서 cyclin CDK2 와 CDK1 를 금하는 cyclin 의존하는 키나아제 억제물인 단백질 p21 를 암호로 고쳐 씁니다. 1993 년 Szekely 는 Epstein-Barr 바이러스 핵 항원 5(EBNA-5)가 Epstein-Barr 바이러스에 의해 암호화되어 인간 B 림프 모세포 세포를 감염시킬 수 있음을 발견했습니다. 66 아미노산 장 펩타이드의 형성에 대한 책임은 복잡한 EBNA-5-p53,돌연변이 포인트의 p53 에 영향을 미치지 않았다 바인딩하는 기능 EBNA-5., 그러나,그것은 다른 분자와의 복합체의 형성을 억제한다. 1994 년 Cho 와 그의 동료들은 복잡한 p53-DNA 의 결정 구조를 처음으로 기술했다. 이 DNA 결합 도메인은 코어 도메인이라고도합니다. 잔류 물 102-222 를 포함하고 베타 샌드위치로 구성됩니다. 그들은 또한 핵심 도메인의 상세한 구조를 시연했습니다. 또한 1994 년 왕 XW 등. b 형 간염 바이러스 X 단백질(hbx)과 인간에서 야생형 p53 단백질 사이의 상호 작용., 그들은 HBX 가 p53 에 결합 된 후 p53 이 다른 서열 특이 적 DNA 에 결합하는 능력을 억제 할 수 있으며 전사 인자와 p53 의 연관성을 억제 할 수 있음을 발견했다.
1997 년,혼다 R 등. 먼저 MDM2 가 p53 유비퀴틸화를 유발하고 유비퀴틴-프로 테아 좀 시스템에 의한 p53 의 분해를 초래할 수 있다는 가설을 세웠다. 그들은 MDM2 가 p53 의 N-말단 도메인(NTD)에 결합하여 유비퀴틴 리가 제 E3 로 작용한다고 지적했다. 또한 1997 년에 p53 과 실질적인 상 동성을 공유하는 두 개의 새로운 단백질 계열 인 p63 과 p73 이 발견되었습니다., 종양 단백질 73 이라고도하는 p73 은 1p36 에 위치한 유전자에 의해 암호화됩니다. 위치는 신경 모세포종 및 다른 종양에서 자주 삭제됩니다. p73 은 p53 표적 유전자를 활성화시키고 p53 과 상호 작용할 수있다. 양 외. 유전자 p63 은 3q27-29 에 위치하고 있으며 다양한 마우스 및 인간 세포에서 검출 될 수 있음을 발견했다. P73 과 마찬가지로,p63 은 p53 표적 유전자를 유의하게 transactivate 할 수 있으며,또한 세포 사멸을 유도 할 수있다. P63 의 한 가지 특징은 p63 의 대다수가 N-말단이 부족하다는 것입니다., 같은 해,세라노고 공동 노동자들을 발견하는 기본 murine 게재 의해 변형 될 수 있 ras 의 부재에서 p53 또는 p16,그리고 비활성 p53 또는 p16 을 용이하게 할 수 있다고 불멸화 달성 과정에서는 인간 세포입니다. 이러한 발견은 p53 이 세포 노화에 역할을한다는 것을 시사한다. 그런 다음 1997 년에 p53 이 아폽토시스의 개시에 역할을하는 것으로 나타났습니다. 면 세포로 확산 단계에 텔로미어의 것 염색체 단축한 후 각 라운드의 DNA 복제 인해 불완전한 복제의 단일 가닥 DNA 의 끝에서 DNA 니다., 활성화 된 종양 억제 유전자 p53 은 세포 분열이 발생할 수있는 횟수를 제한합니다. Wynford TD 는 야생형 p53 의 기능 상실로 모든 섬유 아세포가 세포 사멸에서 탈출한다는 것을 발견했다. 또한,p53 의 transactivation 기능은 apoptosis 에 의해 켜질 수 있습니다. Wynford TD 는 p53 이 어떻게 활성화되는지에 대한 세 가지 가능성이 있다고 제안했다. 첫 번역 후 변형으로 인산화,두 번째는 최대 규제 transcritional 보조 인자 같은 p33ING1,마지막으로 하나 아래로 통제 p53 억제제 MDM2.
2000 년,Brodsky MH 등., 초파리에서 p53 의 전사 표적을 연구했다. 증거가 있을 보여주는 초파리 눈을 표시하는 심각한 거친 눈 형 아래의 표현이 인간의 p53 는 것을 유도하멸의 눈 imaginal 디스크 세포의 손실을 일으키는 원인이 안료 셀,마지막으로 눈을 억제하는 개발의 초파리,그래서는 초파리 모델이 될 수있는 동물에 대한 공부의 기능 p53. Brodsky 는 유전자 rpr 이 rpr 의 cis-조절 영역에 위치한 합의 p53 결합 부위를 포함하고 있으며,또한 아폽토시스의 활성제임을 발견했다., 다른 증거들과 함께,Brodsky 는 rpr 이 p53 의 하나의 전사 표적이라고 주장했다. 2001 년에 데리고 공동 노동자들을 발견 C.elegans 없 p53 유전자,하지만 실제로 포함하는 유전자 cep-1 인코딩하는 단백질이 있는 비슷한 단백질 시퀀스 p53. 이 C.elegans 유전자 인코딩합 단백질 CEP-1 수있는 능력을 가지고 apoptosis 유도 차적인 스트레스에 의해 필요한 구성요소 중에 meiosis.
2002 년 Tyner 와 동료들은 p53 이 유기체의 노화를 조절하는 역할을한다고 제안했다., 기 위해서는 기능을 연구의 p53,그들이 만들어진 유전자 조작된 생쥐로 돌연변이 p53 삭제하여 exons1-6 업스트림 영역의 wild-type p53 유전자(p53+/+),불 p53+/m. 그것을 행동으로 wild-type p53 및 향상된 저항하는 자발적인 종양보다 더 나은 야생 type p53. 실험에서,그들은 p53+/m,p53+/+및 p53+/-를 함유 한 마우스를 모니터링했다. p53+/-는 야생형 p53 유전자의 사본 하나를 잃어 버리는 마우스를 의미합니다., 결과 보는 쥐의 아무도 p53+/m 개발된 생명을 위협하는 종양,그러나,의 80%이상 마우스로 p53+/-와 45%이상의 마우스로 p53+/+개발에 이러한 종류의 종양입니다. 보고의 내부 종양,지역화된 종양 병변을 관찰되었에서 2 개의 35p53+/m 생쥐,반대로,다양한 종양처럼 림프종 및 osteosarcomas 에서 발견되었 p53+/-p53+/+마우스. 이 실험 동안,그들은 또한 p53+/m 의 중간 연령이 96 주인 반면 p53+/m 의 중간 연령은 116~118 주임을 관찰했다., Tyner 와 동료들은 또한 p53+/m 의 짧은 수명이 노화와 관련이있을 가능성을 조사했습니다. 그들은 18 개월 후,p53+/m 쥐을 잃기 시작하량과 활기 위해,p53+/m 쥐,감소된 무게의 관찰에서 나이 30-36 개월입니다. p53+/m 마우스는 또한 lordokyphosis 를 나타낸다. X 선 분석에 따라,p53+/m 마우스는 12 개월의 나이에 감소 된 골밀도를 나타내었고,18 개월의 나이에 심각해질 것이다. 이것은 골다공증의 상징이며 골다공증은 인간과 생쥐의 노화의 마커입니다. 타이너 외., 또한이 능력은 노화의 마커이기 때문에 스트레스의 내성을 테스트했습니다. 그들은 노인 및 젊은 마취 p53+/m 및 p53+/+마우스의 등 피부에서 3mm 펀치 생검을 수행했습니다. 그들의 결과를 보여주는 많은 오래된 p53+/m 쥐의 사망 후에 주입의 표준 복용량 Avertin,을 나타내는 세 p53+/m 쥐었다 적은 관대하여 스트레스입니다.미하라(mihara)와 다른 과학자들은 p53 이 또한 미토콘드리아에서 세포 사멸 역할을 가지고 있음을 발견했다., 부터 미토콘드리아 단백질의 기능을 활성화 cellular apoptosis 중 하나에 의해 활성 caspases 또는 중화 cytosolic 억제제입니다. 예제에서의 시토크롬 c-유도 caspase,을 받은 후 apoptosis 신호,시토크롬 c 에서 발표 intermembrane space 의 미토콘드리아,그리고 다음 차례로 묶 Apf-1 는 존재로 비활성 단량체,유도의 구조적 변화를,그리고 증가하는 바인딩에 대한 선호도 dATP/ATP 해 10 배 이상 Apaf-1 바인딩 dATP/ATP 혼자입니다. 그런 다음 복잡한 Apaf-1-시토크롬 c 가 dATP/ATP 에 결합하여 apoptosome 을 형성합니다., 그 후 apoptosome 에 노출 된 Apaf-1 의 caspase 모집 도메인(CARD)을 procaspase-9 를 모집 한 다음 스스로 자동 활성화하십시오. 최종 복잡한 다음 고대의 활성화는 다른 caspases 등 caspase-3 는 이후 다니엘 중에서 분자,세포를 일으키는 chromatin 응축,DNA fragmentation 고 마지막으로 선도하 apoptosis. 그림 2 는 시토크롬 c 유도 카스파 제 활성화 경로를 보여줍니다.
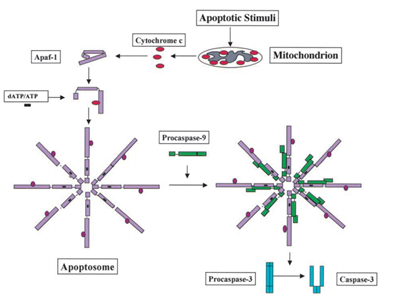
미하라 M 외. 과학자들은 야생형 p53 유전자가 종양 세포의 미토콘드리아 표면으로 빠르게 전좌 될 수 있음을 발견했다. 실험에서 그들이 발견되는 몇 가지 스트레스 유발 wild-type p53 단백질하는 능력이 있는 이동을 미토콘드리아의 thymocytes 에서 인간이나 쥐 세포 후 apoptosis 인 DNA 손상 hypoxia. 그런 다음 이러한 wild-type p53 단백질을 유도 permeabilization 의 미토콘드리아 발생 시리즈의 변경에서 발생하는 미토콘드리아 해 사이토크롬 c 을 형성하여 복잡 Bcl2BclXL.,
부작용이 거의없는 좋은 임상 결과로 유전자 요법이 인기가 있습니다. 2005 년 말까지 Journal Of Gene Medicine 의 데이터베이스에 1020 건의 유전자 치료 시험이있었습니다. 이 시험 중 66%의 유전자 요법이 암 환자에게 실시되었으며,58 건의 시험에서 인간 p53 유전자를 암호화하는 재조합 아데노 바이러스 인 rAd-p53 을 사용했습니다. 2004 년 4 월 재조합 인간 아데노 바이러스-p53 주사(Gendicine)가 공식적으로 시작되었습니다. Gendicine 치료하는 데 사용되는 머리와 목이 편평상피세포 암 그리고 승인에 의해 국가 식품의약품 관리에 중국의 Oct. 16, 2003., 그것은 중국 정부에 의해 승인 된 세계 최초의 유전자 치료 제품이되었습니다.
유전자 p53 은 2005 년에 신진 대사를 조절하는 것으로 밝혀졌다. G1 에서 S 단계로 옮기기 위해서는 세포가 DNA,세포 소기관 및 단백질 합성에 충분한 원료 지원을 가져야합니다. 이 프로세스를 규제하려면 몇 가지 체크 포인트가 필요합니다. 그 중 하나는 G1/S. 에서 포도당 의존성 검사 점이며 AMP 활성화 단백질 키나아제(AMPK)에 의해 조절됩니다. 포도당이 소진되면 AMPK 는 단백질 p53 을 인산화 할 수 있으며,이는 차례로 세포 정지를 유도하고 세포 사멸을 피할 수 있습니다., P53 의존성 체포가 발생하는 세포는 포도당이 충분할 때 세포주기에 다시 들어갑니다.
종양의 형성에 p53 의 불 활성화가 필요하다는 것이 알려져있다. Bykov 등. VJ 및 Snydel EL 등. p53 의 부적절한 기능은 기존 종양의 증식으로 이어질 수 있음을 지적하십시오. 벤츄라와 그의 동료들은이 가설을 시험하기 위해 몇 가지 실험을했다. 그들은 p53 재 활성화의 결과를 조사하기 위해 원발성자가 종양에서 내인성 p53 의 기능을 회복시켰다., 결과는 p53 재 활성화가자가 종양의 퇴행을 담당한다는 것을 보여 주었다. 즉,비활성화 된 p53 단백질이 종양 발달로 이어질 수 있음을 의미합니다. Xue 와 다른 과학자들은 또한 종양에서 p53 을 재 활성화 한 결과를 테스트하기위한 실험을했습니다. 그들은 간암을 가진 생쥐에서 내인성 p53 의 발현을 조절하기 위해 가역적 인 RNA 간섭(RNAi)을 사용했다. 실험에서 doxycycline(Dox)은 Dox 가 없을 때 p53 의 발현이 완전히 억제되고 Dox 가 추가 될 때 빠르게 복원되므로 p53 을 재 활성화하는 데 사용됩니다., Dox 로 치료할 때,p53miRNA 는 차단되어 차례로 p53 의 증가 된 발현을 유발합니다. 결과는 Dox 처리 된 마우스의 종양이 12 일 후에 감지 할 수 없게되는 반면,치료되지 않은 마우스의 종양은 빠르게 성장한다는 것을 보여 주었다. P53 의 일시적인 재 활성화의 결과를 시험하기 위해,그들은 4 일 동안 dox 로 마우스를 치료 한 다음 중단했다. 결과 보는 두 가지 일을 처리할 수 있는 원인을 회귀분석의 종양 및 치료 4 일을 일으킬 수 있는 종양을 완전히 퇴보이다., 그들은 또한 종양 퇴행 동안 과도하게 재 활성화 된 p53 이 세포 사멸을 유발할 수 있으며 세포 사멸을 유발할 수 있다고 지적했다. 같은 해에 Hu 는 P53-/-암컷 마우스에서 배아 이식이 백혈병 억제 인자(LIF)에 의해 조절된다는 것을 발견했다. LIF 는 분비 된 사이토 카인이며 배반포 이식에 중요합니다. LIF 를 코딩하는 유전자는 p53 표적 유전자로 확인되고 p53 결합 부위는 인간과 마우스 모두에서 인트론 1 에 위치한다. 피>