Innledning
Coagulase-negative stafylokokker (Ulemper), medlemmer av stafylokokker gruppe, er karakterisert som Gram-positive cocci, presentert som enkeltceller eller med uregelmessig gemytt, og er immobile, ikke-spore forming, catalase-positive, det meste facultative anaerober, og mangel på enzymet coagulase.,1 Ulemper er en del av den menneskelige microbiota, anses opportunistiske patogener som forårsaker infeksjoner for det meste hos for tidlig fødte barn, og immunsupprimerte og protese pasienter.2
fremveksten av antimikrobiell resistens i de siste årene har hatt en stor innvirkning på sykehus infeksjoner forårsaket av Ulemper. Oxacillin er en semisynthetic penicillin som brukes i mottakelighet test for påvisning av meticillin-motstand og behandling av stafylokokk-infeksjoner. Imidlertid, priser fra 66% til 95% av oxacillin har blitt observert i CoNS kliniske isolater.,2 Oxacillin er ofte mediert av mecA-genet, som koder for en supplerende penicillin-bindende protein (PBP2a) med lav affinitet til semisynthetic penicilliner.3 mecA-genet er lokalisert på mobile genetiske element kjent som Stafylokokk Kassett Kromosom mec (SCCmec) som inneholder mec-kompleks, og består av mecA-genet og dets regulator gener mecI og mecRI, og ccr-komplekset, som er ansvarlig for integrering og eksisjon av SCCmec, og J-regionen, som er ikke avgjørende for SCCmec dannelse, men kan ha ikke-β–lactam resistens gener.,4 Til dato, 13 SCCmec typer har blitt beskrevet, basert på kombinasjonen av ccr-genet komplekse typer og mec genet sammensatte klasser. Undergrupper ble definert av J-regionen polymorfismer i den samme kombinasjonen av mec og ccr-komplekser.5
fremveksten av oxacillin-resistente isolater har ført til optimal bruk av alternative antimikrobielle midler for behandling av Ulemper infeksjoner, for eksempel glycopeptide vancomycin. I mellomtiden, beskrivelser av redusert følsomhet og resistens mot vankomycin har blitt rapportert i de siste tiårene.,6 Redusert mottakelighet for vankomycin kan være relatert til metabolske endringer som akselerasjon i peptidoglycan syntese, noe som resulterer i celleveggen jevning. I denne prosessen, vankomycin er ikke i stand til å hemme peptidoglycan syntese, siden det er utarmet på grunn av høyere tilgjengelighet av L-alanyl-L-alanin nettsteder.,7
Gitt oppsving i sykehus infeksjoner forårsaket av CoNS, denne studien hadde som mål å karakterisere oxacillin-resistente stammer og bestemme antimikrobielle mottakelighet av en 20-års innsamling av blod kultur Ulemper isolater fra Botucatu Sykehus das Clínicas inneliggende pasienter.
Materiale og methodsStrains
Tre-hundre Ulemper stammer ble isolert fra blod kulturer fra inneliggende pasienter på Botucatu Sykehus das Clínicas – Paulista State University (UNESP)., Den isolater ble samlet inn fra 1990 til 2009, og holdt i Kultur-Samling Laboratorium for Mikrobiologi og Immunologi, Institutt for den Botucatu Biovitenskap Institutt – UNESP. Kriteriene anses som en gjennomsnittlig prevalens av hendelser på 35%, med en feilmargin på 5%, og 95% konfidensintervall.
salmen ble isolert i henhold til Koneman et al.8 Blod-agar-isolater ble utsatt til gramfarging for observasjon av kolonien morfologi og catalase testen ble utført for bekreftelse av slekten Staphylococcus., Stafylokokk stammer ble sendt til coagulase-test for differensiering av coagulase-negative og coagulase-positiv grupper. Coagulase-negative-isolater ble utsatt for biokjemiske tester for fenotypiske identifisering av arter. Den genotypic identifikasjon ble utført ved å bruke primere som er trukket over bevart sekvenser i tilknytning til 16S og 23S gener, ved SIN-PCR (interne transkribert avstandsstykke for overflatemontering–polymerase chain reaction), og ble beskrevet av Couto et al.9 Forsterkning effektivitet ble overvåket av elektroforese i 3% metafor agarose og farget med SYBR Trygt., The following lineages of international reference were used: S. auricularis ATCC 33753, S. capitis subsp. capitis ATCC 27843, S. capitis subsp. urealyticus ATCC 49325, S. caprae ATCC 35538, S. cohnii ATCC 49330, S. cohnii subsp. cohnii ATCC 29974, S. epidermidis ATCC 12228, S. epidermidis ATCC 35983, S. hemolyticus ATCC 29970, S. hominis ATCC 27844, S. hominis subsp. novobiosepticus ATCC 700237, S. lentus ATCC 700403, S. lugdunensis ATCC 700328, S. saprophyticus ATCC 15305, S. schleiferi subsp. schleiferi ATCC 43808, S. sciuri subsp. sciuri ATCC 29062, S. simulans ATCC 27851, S., xylosus ATCC 29979, og S. warneri ATCC 10209.
DNA-ekstraksjon
Den Illustra kit (GE Healthcare) ble brukt til DNA-ekstraksjon. Fremgangsmåten inkludert en første fordøyelsen av stafylokokk-celler med lysozyme (10mg/mL) og proteinase K (20mg/mL). Neste, 500µL av utvinning buffer ble tilsatt blandingen, som var sentrifugerte på 10 000 x g i 4 min. Supernatanten ble overført til en kolonne, og sentrifugerte på 5000 g i 1 minutt. Væsken ble forkastet, og 500µL av utvinning buffer ble tilsatt i kolonnen., Etter sentrifugering og forkaster av samlet væske, 500µL av vaske buffer ble tilsatt i kolonnen, som ble sendt til sentrifugering på 20 000 g i 3 min. Neste kolonnen ble overført til et 1,5 mL tube og elution ble utført ved hjelp av 200µL av varme MilliQ vann ved 70°C.
mecA deteksjon
PCR ble utført for påvisning av mecA-genet. Reaksjoner ble utført ved hjelp av en protokoll som beskrevet av Murakami et al.10 forsterkning effektivitet ble overvåket av elektroforese i en 2% agarose gel farget med SYBR Trygt.,
Fastsettelse av SCCmec
Den SCCmec skriv inn ble bestemt på mecA-positive stammer. Reaksjoner ble utført ved hjelp av en protokoll som beskrevet av Oliveira et al.11 og endres av Machado et al.12
Multiplex PCR ble utført i 50µL av reaksjon volum med 1X enzym-bufferen, kan du 1.,25 U Taq polymerase DNA, 200 μM dNTP Mix, and the following primers: 10pmol of RIF2 F2 (TTCGAGTTGCTGATGAAGAAGG) and CIF2 R2 (ATTTACCACAAGGACTACCAGC), 6pmol of KDP F1 (AATCATCTGCCATTGGTGATGC) and KDP R1 (CGAATGAAGTGAAAGAAAGTGG), 5pmol of DCS F2 (CATCCTATGATAGCTTGGTC) and DSC R1 (CTAAATCATAGCCATGACCG), 5pmol of RIF4 F3 (GTGATTGTTCGAGATATGTGG), and RIF4 R9 (CGCTTTATCTGTATCTATCGC). For each reaction, 10μL DNA was added. The cycle sequencing reactions were performed at 92°C for 3min, followed by 30 cycles of 92°C for 1min, 56°C for 1min, and 72°C for 1min and 30s., Forsterkning effektivitet ble overvåket av elektroforese i en 2% agarose gel farget med SYBR Trygt.
Fastsettelse av minste hemmende konsentrasjon (MIC) av E-test
in vitro følsomhet av Ulemper stammer ble testet for følgende antimikrobielle midler: Oxacillin, Vankomycin, Daptomycin, Linezolid, Quinupristin/Dalfopristin, og Tigecycline. MIC av disse stoffene ble bestemt av E-testen. Kriteriene som brukes for det mottakelighet klassifisering var: Oxacillin
µg/mL (utsatt) for CoNS, unntatt S., lugdunensis (utsatt ≤2µg/mL og tåler ≥4µg/mL), Vankomycin µg/mL (utsatt), 8–16µg/mL (middels resistente), og >32µg/mL (motstandsdyktig); Linezolid ≤4µg/mL (utsatt); Daptomycin ≤1µg/mL; Quinupristin/Dalfopristin ≤1µg/mL (utsatt), 2µg/mL (middels), og ≥4µg/mL (motstandsdyktig); Tigecycline ≤0.5 µg/mL.,13Screening test for påvisning av redusert mottakelighet for vankomycin
for å oppdage redusert mottakelighet for vankomycin, en screening test agar forberedt med Brain Heart Infusion (BHI) Agar og 4µg/mL, 6µg/mL, 8µg/mL, og 16µg/mL vancomycin ble brukt. Referanse belastning S. aureus ATCC 29213, utsatt for vankomycin, ble brukt som en negativ kontroll, og belastningen E. faecalis ATCC 51299, motstandsdyktig mot vankomycin, som positiv kontroll. Flekker av 2.,0 McFarland inokulat ble lagt til Agar plate og inkubert ved 35°C i 24 timer, og den økende av minst én koloni ble ansett som et positivt resultat.
Analyse av cellen vegg tykkelse
Den Ulemper stammer som presenteres redusert mottakelighet for vankomycin ble sendt til overføring av elektronisk regjering for celle veggtykkelse analyse. Stammer som ble dyrket i BHI buljong og inkubert ved 37° C i 24 timer. I en microtube, 1000µL av en Ulemper kultur suppen var sentrifugerte for ett minutt på rundt 12 000 rpm. Etter kasting av supernatanten, stammer ble fikset i en Karnovsky løsning (2.,5% glutaraldehyde i fosfat buffer 0,1 M ) for fire timer. Prøvene ble fjernet fra fiks og vasket tre ganger i løpet av fem minutter i destillert vann. Neste prøvene ble nedsenket i 0,5% osmium tetroxide for 40min, før de ble vasket tre ganger for 10min i destillert vann. Prøvene ble dehydrert ved hjelp av økende konsentrasjoner av alkohol: to ganger for 10min i 7.,5% alkohol, to ganger for 10min på 15% alkohol, to ganger for 10min i 30% alkohol, to ganger for 10min i 50% alkohol; tre ganger for 15min i 70% alkohol, to ganger for 15min i 90% alkohol, to ganger for 10min i 100% alkohol. Etter dehydrering den stubber ble montert og prøver metalized. Analysene ble utført i en elektronisk regjering Tecnai Ånd Fei Selskapet og bildene som ble oppnådd i en forstørrelse av 30000×.,
ResultsIdentification av isolater
Tabell 1 presenterer kilden til de Ulemper arter isolater, samt demografiske data om pasienter med bakterier.
Påvisning av mecA-genet og karakterisering av SCCmec Fastsettelse av minste hemmende konsentrasjon (MIC)
Den Mikrofoner av antimikrobielle midler som brukes for behandling av Ulemper infeksjoner ble bestemt av E-testen. Oxacillin ble funnet i 206 (68.7%) Ulemper stammer og 25 ble tigecycline resistente (8.3%). Motstand mot tigecycline ble oppdaget i 4,5% av S. epidermidis, 13.8% av S. hemolyticus, 13% av S., hominis, og 11,1% av S. lugdunensis. For quinupristin/dalfopristin, ett S. epidermidis isolere presentert middels motstand med en MIC på 2µg/mL, og en S. epidermidis og en S. hemolyticus med Mikrofoner av 3µg/mL. Sensitivitet og spesifisitet av MIC oxacillin av E-testen sammenlignet med tilstedeværelse av mecA var henholdsvis 87.4% og 82.3 kongress -, messe%.
Med hensyn til Ulemper arter, parameteren distribusjon av MIC50 og MIC90 avslørt høy forekomst av oxacillin i S. hemolyticus., Dette var bare Ulemper arter som minimal konsentrasjon til å hemme 50% av isolatene var >256µg/mL, noe som gjenspeiler den høye motstand pris S. hemolyticus å oxacillin (Tabell 3).
MIC spekter av hver antimikrobielle var i forhold til SCCmec type. Den isolerer skrevet som SCCmecI presentert høyere tigecycline Mikrofoner og de som er klassifisert som SCCmecII presentert den høyeste oxacillin-Mikrofoner. Den SCCmecIV stammer viste den høyeste MIC-verdier for vankomycin, linezolid, daptomycin, og quinupristin/dalfopristin (Tabell 4).
– >
Determination of the MIC range according to SCCmec.
| MIC range (μg/ml) | ||||
|---|---|---|---|---|
| Antimicrobial | SCCmec I | SCCmec II | SCCmec III | SCCmec IV |
| Oxacillin | 0.094≥256 | 6≥256 | 0.,125≥256 | 0.125≥256 |
| Vancomycin | 0.25–2 | 0.38–2 | 0.125–2 | 0.75–2 |
| Linezolid | 0.064–1 | 0.19–0.5 | 0.047–0.75 | 0.064–1 |
| Daptomycin | 0.016–025 | 0.016–0.094 | 0.019–0.5 | 0.047–0.75 |
| Quinupristin/Dalfopristin | 0.025–1.5 | 0.094–0.5 | 0.064–1 | 0.125–2 |
| Tigecycline | 0.016–2 | 0.023–0.75 | 0.016–0.75 | 0.,032-1 |
MIC, Minimal Hemmende Konsentrasjon.
En evaluering ble utført av oxacillin og vankomycin Mikrofoner over en periode på 20 år, delt inn i tre tidsperioder i henhold til fordelingen av oxacillin og vankomycin MIC områder. For oxacillin, i den første perioden (1990-2001), høyere verdier av MIC ble observert, men likevel indikerer mottakelighet., I andre perioder (2002-2006 og 2007-2009), en nedgang i MIC-verdier ble observert, fortsatt som indikerer risiko, samt en økning i motstand priser. Om vankomycin, den samme evalueringen viste betydelige forskjeller i de tre periodene blant stammer med Mikrofoner fra 0.047 µg/mL til 0.38 µg/mL og 0,5 µg/mL til 2,0 µg/mL (Fig. 1).
Fastsettelse av redusert mottakelighet for vankomycin
dette er En økning på 214 (71.3%) stammer som ble observert på BHI plate med 4µg/mL av vankomycin, 89 (29.7%) på tallerkenen med 6µg/mL av vankomycin, og 8 (2.,6%) isolater på 8µg/mL vancomycin-plate. Ingen av isolater vokste i medium med 16µg/mL vancomycin. Det var ingen signifikante forskjeller i Mikrofoner mellom stammer som presenteres ingen vekst på plate supplert med vankomycin og de som vokste på 4µg/mL vancomycin-plate. Blant dem som viste vekst på mellomlang med 6µg/mL av vankomycin, MIC-serien var 0,5–2µg/mL. Blant dem som vokste på 8µg/mL av vankomycin, MIC-serien var 0,75–24µg/mL. Den stammer vokst på 8µg/mL vancomycin var fire S. epidermidis, ett S. hemolyticus, to S. hominis, og en S., capitis, alle motstandsdyktig mot oxacillin, og S. epidermidis og S. capitis å være bærere av SCCmec III, S. hominis av SCCmec jeg, og S. hemolyticus med ikke-skrevet SCCmec.
Analyse av cellen vegg tykkelse av stammer med redusert følsomhet for vankomycin
cellen vegg tykkelse under celledeling ble målt i åtte stammer (verdiene er presentert i nanometer, gjennomsnitt±SD). De fire S. epidermidis stammer presentert som gjennomsnittsverdier av 21.66±1.4, 20.12±0.9, 24.24±1.3, og 14.20±1,3 nm. S. hemolyticus isolere viste en celle veggtykkelse på 24.88±1.7 nm. For S., capitis isolere, cellen veggtykkelse var 19.33±1.8, og for de to S. hominis isolater verdiene var 17.68±2.1 og 24.92±1.5. For sammenligningen, er brukt som referanse stammer S. epidermidis ATCC 12228 og S. hemolyticus ATCC29970 viste celle veggtykkelser av, henholdsvis, 14.61±1.2 og 14.73±0.7 nm. Sammenligningen av de undersøkte stammer mot kontrollene viste høyere verdier, alt fra 17nm å 24.92 nm, med unntak av ett S. epidermidis isolere, som presenterte en lavere verdi i forhold til kontrollene (Fig. 2).,
Ulemper bakterier utviklingen
Den mulige utviklingen av bakterier til andre infeksjoner som sepsis, lungebetennelse, urinveisinfeksjon, meningitt, peritonitis, necrotizing enterokolitt, omphalitis, og hjerne svulst, ble fulgt opp i 52 pasienter innlagt til neonatal menigheter. Av disse 25 (46.3%) pasienter de samme Ulemper som er isolert fra blod kultur ble bekreftet å være etiologic agent for infeksjon. I seks (11.1%), CoNS var mulig agent for infeksjon, og i 23 (42.6%) Ulemper var ikke relatert til pasienten»s infeksjon (Fig. 3).,
– >
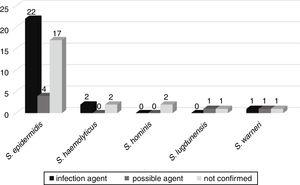
Korrelasjon av Ulemper isolert fra blod kulturer som mulige etiologiske agenter av infeksjoner forårsaket i neonatal enhet pasienter.
mecA-genet ble påvist i 33 (61.1%) av disse Ulempene, med 20 (60.6%) Ulemper forbundet med mer alvorlige infeksjoner eller mulige agenter for disse infeksjonene.
Diskusjon
Den Ulemper er ansett som en av de viktigste årsakene til bakterier., Betydningen av disse bakteriene har økt i sykehuset miljø i løpet av de siste årene, hovedsakelig på grunn av antimikrobiell resistens. I det foreliggende arbeidet, 300 Ulemper stammer isolert fra blod kulturer av inneliggende pasienter på Sykehus, Klinikker av Botucatu, over en periode på 20 år, ble studert. Disse isolatene ble karakterisert med hensyn til sine antimikrobielle mottakelighet.
De mecA deteksjon bestemt oxacillin i 78.5% av Ulemper, og MIC50 verdi (2µg/mL) var indikasjon for motstand mot dette stoffet, som bekrefter lav mottakelighet av disse bakteriene til β–lactam agenter., Tidligere arbeider har vist at siden 1970-tallet Ulemper isolater har presentert høyere oxacillin priser enn S. aureus.14,15 Den β–lactam motstand priser har vist seg å variere fra 65% til 95% i sykehus i Brasil og i andre land.2,16,17 høyest forekomst av oxacillin ble funnet i S. epidermidis, etterfulgt av S. hemolyticus, S. hominis, og S. capitis. Tilsvarende resultater ble beskrevet i tidligere studier, som viste oxacillin i 97% av S. epidermidis mellom 1999 og 2001 i en neonatal intensive care unit (NICU),18 i 96% av S., hemolyticus isolert i Brasil,19 og i 100% av S. hominis isolert i en NICU fra Spania.20 Om S. capitis, motsigende resultater ble funnet i studier utført av Caierão et al.21
Selv på en lavere frekvens, mecA-genet ble påvist i S. warneri og S. lugdunensis. S. warneri har blitt beskrevet med priser av 33.3% av oxacillin i neonatale intensivavdelinger,22 og den første beskrivelsen av mecA i S. lugdunensis var i studie utført av Kawaguchi et al.23 til Tross for den lave motstand priser,24 fastsettelse av antimikrobielle mottakelighet S., lugdunensis er viktig, ikke bare på grunn av sin kliniske implikasjoner, siden denne arten er den mest aggressive av de Ulemper, men også for etablering av tidlig behandling med tilstrekkelig antimikrobielle midler og gode kliniske resultater.25
karakterisering av SCCmec viste tilstedeværelse av typer i-IV i-isolater, med SCCmecIII blir ofte påvist i de undersøkte stammer, hovedsakelig i S. epidermidis, den eneste arten som bar type IV., SCCmec type III er den største av dem alle, codifies for flere motstand-forbundet gener, og er den hyppigst isolerte Ulemper fra sykehuset prøver. S. epidermidis er den viktigste colonizer av den menneskelige huden, og som oftest oppdaget i infeksjon nettsteder. Den selektive press på sykehuset miljø fører til spredning av SCCmec III stammer, som er forbundet med alvorlige infeksjoner.26 SCCmec type IV har vært i slekt med samfunns-forbundet Staphylococcus spp. og ble beskrevet for første gang i en S. epidermidis belastning, noe som innebærer sine overføring fra S., epidermidis til S. aureus. En redusert kostnad overføring av SCCmec IV på grunn av sin lille størrelse vil trolig føre til en høyere forekomst av infeksjoner forårsaket av SCCmec IV bærere.12,27 SCCmecII presentert en forening med S. hemolyticus, lignende funn Machado et al.,12 som arbeider bare oppdaget type II i denne arten.
alternativ for behandling av oxacillin-resistente stafylokokker er vankomycin, en glycopeptide først brukt i 1958 i invasive infeksjoner. Det er imidlertid beskrivelser av motstand og redusert mottakelighet for dette stoffet,6 selv om ustabil.,28 resultater av det aktuelle arbeidet viste at med unntak av oxacillin, vankomycin var stoffet med de høyeste verdiene av MIC50 og MIC90. Til tross for full mottakelighet for innsamling, MIC-verdier var den høyeste i perioden på 20 år, og redusert mottakelighet ble oppdaget i noen S. epidermidis, S. hemolyticus, S. hominis, og S. capitis stammer. I studier utført av Natoli et al.,29 redusert mottakelighet for vankomycin ble oppdaget med en frekvens på 5,4% blant Ulemper isolater, i S. epidermidis og S. hemolyticus arter., Ifølge de samme forfatterne, Staphylococcus kolonier vokst på vancomycin-agar kan føre til glycopeptide heteroresistance, som kan være en forløper til glycopeptide motstand, noe som fører kompliserte infeksjoner og behandlingen feil. Dette bør tas i betraktning i terapeutiske avgjørelser.30
økningen i andelen av oxacillin-resistent Ulemper og reduksjon i deres mottakelighet for vankomycin understreke viktigheten av studier som involverer andre terapeutiske valg., Tigecycline, en Gram-positive og negative bredt spekter semisynthetic glycylcycline, regnes som et legemiddel med utmerket aktivitet mot oxacillin mottakelige og resistente Ulemper,14,29 til tross for våre data viser priser på 8,3% av motstand, som oftest i S. hemolyticus, etterfulgt av S. hominis, S. lugdunensis, og S. epidermidis. Lignende MIC90 resultater ble beskrevet for tigecycline, med ingen forskjell mellom oxacillin-resistent og utsatt Ulemper.31 I studier utført av Natoli et al.29 tigecycline viste god aktivitet mot Ulemper., I henhold til de forfatterne, tigecycline er ikke anbefalt for behandling av bakterier og bruken bør begrenses for å bevare aktivitet mot multi-resistente Gram-negative bakterier. Mutasjoner i ribosom-genet S10 og rpsJ og mepA genene synes å være assosiert med tigecycline motstand.32,33
Quinupristin/dalfopristin er en streptogramin tilhørighet til makrolid-lincosamide-streptogramin gruppe., Kombinasjonen av quinupristin og dalfopristin er gjensidig forsterkende og vanligvis bakteriedrepende når disse agentene er i forhold enkeltvis, eller i forhold til tilsvarende makrolid antimikrobielle midler.34 I dette arbeidet, til tross for å presentere utmerket effekt i flertallet av de undersøkte Ulemper, middels motstand mot dette stoffet ble oppdaget i to S. epidermidis og en S. hemolyticus. I studien utført av Mendes et al.,35 quinupristin/dalfopristin vist utmerket effektivitet for CoNS, stammer var fullt utsatt, med MIC90 verdier av 0.38 µg/mL for oxacillin-følsomme stammer og 0.,75µg/mL for oxacillin-resistente stammer. I tillegg, Venkatesh et al.36 beskrevet god effektivitet av quinupristin/dalfopristin for oxacillin-resistent og utsatt stammer.
Daptomycin, et antimikrobielt studert i flere tiår, ble tatt i bruk igjen i 2006, for behandling av bakterier og endokarditt forårsaket av Staphylococcus.37 I den foreliggende studien, daptomycin viste god effekt for Ulemper isolater, med lave MIC50 verdier. Olivares et al.37 også bekreftet mottakelighet av alle Ulemper daptomycin, med lav variasjon i MIC-verdier., I et arbeid å studere 1126 Ulemper, utført av Critchley et al.,38 daptomycin var aktiv på en MIC spenner fra 0.015 2,0 µg/mL, og MIC90 var 0,5 µg/mL. I henhold til de forfatterne, de mest aktive agenter i disse analysene ble daptomycin og quinupristin/dalfopristin, noe som understreker relevansen av disse antimikrobielle midler i behandling av infeksjoner forårsaket av Ulemper.
Linezolid, et syntetisk oxazolidinone potensielt aktive mot flere bakterier, er et annet stoff som har vist god effekt mot Ulemper.,39 Linezolid har blitt viktig for terapeutisk behandling av kroniske infeksjoner av CoNS, til tross for beskrivelsen av motstand. I Brasil, det første tilfellet av linezolid motstand ble beskrevet i 2006, på en klinisk isolere av MRSA40 og blant de Ulemper, i S. epidermidis, S. hominis, og S. hemolyticus.41 I arbeidet ble utført av Olivares et al.,37 til tross for deteksjon av syv linezolid resistente stammer, dette stoffet presentert effektiv MIC-verdier i CoNS stammer. På den annen side, et utbrudd av linezolid resistent S., epidermidis kloner som inneholder mutasjoner i ribosom proteiner L3 og L4, samt cfr plasmider, nylig identifisert i Frankrike, har vært rapportert.42
S. hemolyticus var arter som presenterte den høyeste oxacillin MIC-verdier, og konsentrasjoner høyere enn 256µg/mL var nødvendig for å hemme 50% av isolatene. Så vel som for oxacillin, er dette arter som er presentert høyere MIC-verdier for tigecycline og de fleste av antimikrobielle midler testet. Flere av verkene viser høy forekomst av resistens mot antimikrobielle midler som brukes for behandling av infeksjoner forårsaket av S., hemolyticus, spesielt meticillin og glykopeptider. Noen forfattere beskriver en høy forekomst av genene som koder resistens mot beta-lactam og aminoglycoside agenter, samt en betydelig andel av isolater med MIC-verdier nær motstanden stoppunkt,43,44 og understreker betydningen av S. hemolyticus som en multiresistant patogen.
The association of The MIC-serien med SCCmec typer vist høyere Mikrofoner for vankomycin, linezolid, daptomycin, og quinupristin/dalfopristin i S. epidermidis bærer SCCmecIV., Gener knyttet til motstand mot disse antimikrobielle midler er mediert av plasmider, finnes det meste i meticillin resistente stammer med sykehuset opprinnelse.45 SCCmec IV er karakteristisk for samfunnet isolater, spesielt på grunn av sin størrelse og lave adaptive kostnad. Studier tyder på at oppkjøpet av resistens gener har miljømessige ikke-kliniske opprinnelse, gitt den høye mangfold av motstand genet operatører i det naturlige miljøet.46,47 Videre, SCCmecIV ble bare påvist i S. epidermidis, som er de vanligste artene i menneskelig hud er den mest påvirket av selektiv press., Den høyere Mikrofoner i forhold til andre antimikrobielle midler kan også være relatert til selektiv press, som graden av eksponering for disse stoffene i sykehuset miljø vil påvirke utvalget av redusert mottakelighet og resistente stammer, siden flere mutasjon hendelser, genetisk rekombinasjon, og endringer i mikrobiell fysiologi er nødvendig for å generere fenotypiske endringer.,48
Metabolske og fysiologiske endringer knyttet til selektive press kan være observert i stammer som vokser på 8µg/mL vancomycin-agar, som celleveggen fortykkelse ble funnet i de fleste Ulemper isolater på grunn av økt peptidoglycan syntese. Denne mekanismen er mer fordelaktig for Ulemper enn kjøpet av van operon, som er en mellommann av vankomycin motstand. Van operon er kjøpt opp av horisontale gene transfer og dens uttrykk er bare stimulert i nærvær av glycopeptide., Dette stimulus fører til en svært høy adaptive kostnader i nærvær av vankomycin, være uheldig for Ulemper i en vancomycin medium.48,49 for erverv av andre resistens gener i Ulemper, slik som de mecA, den første adaptive kostnadene er myknet med kompenserende flere mutasjoner for motstand «kostnader». Nylig, punktlig mutasjoner i gener som vraR har vist seg å være assosiert med redusert risiko for vankomycin og cellevegg fortykkelse i stafylokokker.,50
Den foreliggende studien viste en høy forekomst av bakterier forårsaket av Ulemper i neonatal og pediatric enheter, som involverer barn under ett år, er den viktigste agenter blir S. epidermidis, S. hemolyticus, S. hominis, S. lugdunensis, og S. warneri. S. capitis ikke var isolert i disse enhetene, blir agenter for bakterier i voksne adgang til interne medisin menigheten, gastroenterology, nevrologi, og legevakten.,
Som studiet involvert bakterier forårsaket av stafylokokker isolert over mer enn 30 år, mye av de data som er knyttet til pasientenes medisinske dokumenter kan ikke bli hentet frem, slik at det ikke var mulig å knytte infeksjon utfallet av alle pasienter, som er en begrensning i denne studien. Data innhentet fra pasienter i neonatal enheter angitt i den kliniske betydningen av Ulemper bakterier, som kan utvikle seg til sykdommer som krever spesialisert omsorg.
Kunnskap om antimikrobiell resistens er av stor betydning for riktig behandling av infeksjoner forårsaket av Ulemper., Videre virulence factors av disse bakteriene og immunitet av pasienter er faktorer som bidrar til muligheten av mikroorganismen å forårsake mer alvorlige infeksjoner.
resultatene av vår studie som strekker seg over 20 år, viste en høy frekvens av antimikrobiell resistens i Ulemper, som gjenspeiler overdreven bruk av disse stoffene., I tillegg til de metabolske og fysiologiske endringer som kan føre til redusert følsomhet for antimikrobielle midler, deres tilstand som menneskelige commensal bakterier gjør dem ideelle transporter og en effektiv reservoar av resistens gener, spesielt lave kostnader elementer, for eksempel SCCmec.45 antimikrobielle midler som ga de beste resultatene skal bli brukt på en slik måte som å bevare sin effekt og hindre motstand.,
Interessekonflikter
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller finansielle forhold som kan oppfattes som en potensiell interessekonflikt.