Innledning
nasse Nøff dødelighet er en av de store utvalget trekk i grisen avl og er påvirket av sår, grisungene, og miljø. Derfor, nasse nøff dødelighet er en kompleks fenotypen og avhenger av kapasiteten for så å øke sitt avkom, men er også en funksjon av fødselsvekt, ledelse, og utvalget (Knol et al., 2002)., Men også monogenic recessiv feil bidra til nasse nøff dødelighet, selv om bare noen få eksempler har vært rapportert tidligere (Murgiano et al., 2012; Matika et al., 2019). Selv i de tilfeller der effekten av mutasjon er alvorlig, velge effektivt mot en slik mutasjon er hemmet av lav frekvens. I mange alvorlige feil, zygotes dø svært tidlig i svangerskapet, og etterlater ingen spor annet enn fravær av homozygotes i befolkningen for øvrig (Derks et al., 2019).,
Innavl virkninger i kommersielle gris bestander er vanligvis holdt i sjakk av selektiv avl for redusert dødelighet hos smågris ved å forbedre både mothering evner og nasse nøff levedyktighet (Olijslagers, 2018). Imidlertid, varianter underliggende recessiv monogenic defekter er ikke godt tatt i avl verdier, og potensielt drift til høyere frekvenser som et resultat av intens utvalget (Georges et al., 2019). Videre, de variantene kan også opprettholdes som et resultat av å balansere utvalget for en samordnet positiv effekt i heterozygot state (Derks et al., 2018).,
Recessiv mangler bare marginalt bidra samlet nasse nøff dødelighet (Alonso-Spilsbury et al., 2007). Likevel, varianter som påvirker nasse nøff dødelighet er av stor betydning fordi de variantene direkte påvirke produksjon og dyrevelferd (Baxter et al., 2013; Rutherford et al., 2013). Imidlertid, i dyrebestanden ledelse, lav-frekvens forekomst av misdannelser er vanligvis dårlig dokumentert (ofte svært generelle termer er brukt), og syndromer er ofte kun balanseført når de har nådd en høy frekvens., Dette er spesielt relevant for syndromer som ikke fører til svært forskjellige phenotypes. Derfor, selv i kommersielle hekkende bestander lite sporing kan gjøres på spesifikke syndromer, og for å effektivt velg mot spesifikke lav-frekvens syndromer derfor krever nye tilnærminger.
I dette arbeidet, vi beskriver oppdagelsen av en svært ødeleggende syndrom i en kommersiell gris befolkningen gjennom en survey basert på et kombinert medium-density SNP-matriser og hel-genom-sekvensering (WGS)., Undersøkelsen førte til oppdagelsen av en 16-bp frameshift sletting i SPTBN4 gen, med spådd klart fenotypiske konsekvensene i homozygotes. Transportøren frekvens er ca 9% i befolkningen under studiet, berører om lag 0.81% av befolkningen kull. Frekvensen var tilstrekkelig lav til å være ukjent til å ha en genetisk basis, og selv effektivt blir ikke gjenkjent som en bestemt syndrom i det hele tatt. Ved gjennomføring av undersøkelsen, en gravid så ble identifisert far av en operatør villsvin., De berørte smågris lider av myopati og er ikke i stand til å gå, noe som vanligvis fører til død i løpet av noen få timer etter fødselen, helt i tråd med spådd patologi i forhold til lignende menneske og mus tilfeller.
Materiale og Metoder
Dyr, Genotypes, og Pre-Prosessering
datasettet består av 31,839 dyr fra en syntetisk villsvin linje med stor hvit bakgrunn. Linjen er vedlikeholdt og oppvokst i Topigs Norsvin kjernen gårder, først og fremst å velge på produksjon og helse-trekk., Dyrene var genotyped på Illumina GeneSeek tilpasset 50K SNP-chip (Lincoln, NE, USA). Dyr med en frekvens på manglende genotypes > 0.15 ble fjernet. Vi forkastet markører som ikke oppfyller følgende filtrering kriterier: minimum ring pris på 0.85, en mindre allelet frekvens > 0.01, og en Hardy-Weinberg proporsjoner eksakte test p-verdi under P < 10-12. Videre, markører med ukjent sted på Sscrofa11.1 genom bygg ble forkastet, forlater 41,573 markører etter filtrering., Alle trinn ble utført i Plink v1.90b3.30 (Purcell et al., 2007).
Haplotype Innfasing og Identifisering av SSC6 Haplotype
Vi har utført haplotype innfasing og godtgjørelsessystemet av manglende nettsteder i Beagle5.0 med parameter for effektiv bestandsstørrelse er satt til 100, andre innstillinger var standardinnstillinger (Browning et al., 2018). Forventet homozygotes ble estimert basert på haplotype frekvens, ved hjelp av Hardy-Weinberg-prinsippet. En eksakt binomial test ble brukt for å teste antall observerte homozygotes med antall forventet homozygotes., Den haplotype ble ansett som vesentlig redusert hvis P < 5 × 10-3.
Fenotypiske Effekter Forbundet Med SSC6 Haplotype
Vi undersøkte SSC6 haplotype for oppføringer på totalt antall fødte, antall dødfødte, mummified smågris, farrowing overlevelse, og amming overlevelse (overlevelse opp til ca 21 dager gammel) av en total av 9,666 kull. Vi listet opp disse phenotypes for alle CxC, og CxN kull identifisert. Vi brukte en Welch ‘ s t-test for å vurdere om phenotypes fra CxC kull avvike betydelig fra CxN kull. En p-verdi < 0.,05 ble vurdert som vesentlig.
Hel-Genom Sekvensering og Analyse Kandidat Variant Identifikasjon
datasettet består av 71 hele genom sekvensert individer fra en populasjon under studien. Alle de 71 prøvene var også til stede i vårt datasett av 31,839 dyr genotyped på 50K. De 71 prøvene har et samlet volum på 1.93 Tbp (tera-base-par) fra 14.16 milliarder kroner 150-bp sammenkoblede-end leser (Tabell S3). Prøvene ble sekvensert på Illumina HiSeq 2000. Vi justerte sekvenser til Sscrofa11.1 genom bygger ved hjelp av BWA-MEM versjon 0.7.,15 (Li og Durbin, 2009) med et gjennomsnitt mappability av 98.9% og et eksempel på et dekning alt fra 8.8 å 14.8 X (X 10.9 gjennomsnitt). Samblaster ble brukt til å fjerne PCR-duplikater (Faust og Hall, 2014). Samtools ble brukt til å sortere, fusjonere, og indeksen bam-filer (Li et al., 2009). Kartlegging og statistikk av høy kvalitet ble generert ved hjelp av Qualimap (Okonechnikov et al., 2016). Variant ringer ble utført med Freebayes v1.1.0 med følgende innstillinger: –min-base-kvalitet 10 –min-alternative-brøkdel 0.2 –haplotype-lengde 0 –min-alternative-count-2 (Garrison og Marth, 2012)., Varianter med Phred kvalitet score < 20 ble forkastet (Li et al., 2009). Varianter ble forklart ved hjelp av Ensembl variant effekt prediktor (VEP, slipper 96) (Mclaren et al., 2016). Virkningen av missense varianter ble spådd å bruke sortering intolerante fra tolerant (SILE) (Kumar et al., 2009). LD analyse ble utført ved hjelp av Plink v1.90b3.30 (Purcell et al., 2007) med følgende innstillinger –chr-set 18, –r2, ld-vindu-r2 0.8.
SPTBN4 Protein Justering
Protein justering mellom vill-type og muterte proteinet ble utført ved hjelp av ClustalO (Madeira et al.,, 2019) og visualisert ved hjelp av ESPript 3 (Robert og Gouet, 2014). Videre visualisering og validering ble utført ved hjelp av JBrowse genom viewer versjon 1.12.1 (Skinner et al., 2009).
Validering av Årsakssammenheng 16 bp SPTBN4 Sletting
PCR ble utført med 60 ng av genomisk DNA, med 0.4 µm av hver primer, 1.8 mM MgCl2, og 25 enheter/ml OneTaq® DNA-Polymerase (OneTaq® 2X Master Mix med Standard Buffer, New England Biolabs) i produsentens PCR buffer i et endelig volum på 12 µl., Første denaturering for 1 min ved 95°C, og ble etterfulgt av 35 sykluser med 95°C i 30 s, 55°C i 45 s, 72°C 90 s, etterfulgt av en 5 min extension 72°C. PCR-primere for SPTBN4 er TCAAGGGTGCAGGCTCTTTC frem og GGTAGGAAGCTCGAAGTGGG omvendt. Den forward primer var dye-merket, enten med 6-FAM til å produsere et fluoriserende fargestoff PCR-produkt synlig på ABI 3730 DNA sequencer (Applied Biosystems). Fragment størrelser ble fastsatt ved hjelp av GeneMapper-programvare 5 fra ABI.,
Histopatologiske Undersøkelsen
To berørte smågris mindre enn 1 uke gammel ble send til patologi avdeling av Royal dyrehelse (Deventer) for undersøkelse. Macroscopically, alle observasjonene var innenfor normale grenser. Skjelettmuskulatur av foreleg, dorsal muskel, og baksiden etappe av både dyr ble samplet for rutinemessig H&E farging og PTAH farging. Muskelvev ble lagret i separate beholdere og fiksert i formaldehyd løsning på 4% bufret (=formalin løsning 10%, bufret)., Etter at vevet ble innebygd i parafin og oppskåret inn 2 µm i henhold til standard for drift prosedyre (SOP RAH). Deretter glir var deparaffinized og rutinemessig farget for hematoksylin og eosin (H&E) i en automatisk farge maskinen. Samtidig flere lysbilder av 2 µm av muskelvev, så vel som positiv kontroll skyv av muskelvev var forberedt for manuell farging med «phosphotungstic syre hematoksylin,» forkortet til PTAH. Dette flekker er å foretrekke for å demonstrere cross-styrke av skjelettmuskulatur.,
Avl Verdier og Foreningen Analyse
I denne studien, har vi evaluert 63 egenskaper som brukes i avlsprogrammet. Deregressed beregnet avl verdier (DEBV) ble brukt som responsvariabel for hver egenskap under studien. Estimert avl verdi (EBV) av alle evaluert trekk var deregressed ved hjelp av metoden beskrevet av Garrick et al. (2009). Den EBV til hvert dyr ble hentet fra rutinemessig genetisk evaluering av en kommersiell oppdrett (Topigs Norsvin) med en dyr modell., Den reliabilities per dyr for det formål å deregression ble tatt ut fra genetisk vurdering basert på metodologien av Tier og Meyer (2004). Den heritabilities brukt til deregression ble også hentet fra rutinemessig genetisk evaluering. Til slutt, vekting faktorer som er basert på estimert reliability av DEBV ble også beregnet i henhold til Garrick et al. (2009) ved hjelp av en verdi på 0,5 for skalar c. For å sikre kvaliteten på DEBV, bare dyr med en vekting faktorer som er større enn null og reliability av DEBV større enn 0.,20 ble brukt i foreningen analyser. Påliteligheten av DEBV ble også innhentet i henhold til Garrick et al. (2009).
Association analyser ble utført ved hjelp av programvaren ASREML (Gilmour et al.,, 2009) å bruke følgende lineære blandede dyr modell:
hvor DEBVij er observert DEBV for dyr j, w er vektfaktor for gjenværende, µ er den samlede DEBV gjennomsnittet av befolkningen, Ri er transportøren status (opptelling av de skadelige allel) av de 4 mutasjon jeg, aj er den additive genetiske effekten estimert ved hjelp av en stamtavle-basert gjennomsnittlige forhold matrise, og den gjenværende feil. Foreninger med −log10(P-verdi) som er større enn fem ble erklært som viktig.
Resultater
1.,5 Mb Segment på Kromosom 6 Påvirker Amming Overlevelse i Griser
Vi analysert 31,638 dyr fra en enkelt renraset villsvin linje (syntetisk linje med stor hvit bakgrunn), genotyped på Svin 50K SNP-chip (Sscrofa11.1 bygg) (Kr et al., 2019). Analysen avdekket en 1,5 Mb segment på kromosom 6 (SSC6:48.75–50.25) viser et underskudd i homozygosity assosiert med redusert amming overlevelse (tabell 1 og 2). Den haplotype er segregerende på et moderat allelet frekvens på 4,5% (9.0% transportøren frekvens) i befolkningen under studien., Den haplotype frekvensen har vært varierende i løpet av det siste tiåret, men redusert i løpet av de siste 3 årene (Figur S1). Vi testet om frekvensen var drevet av en heterozygot fordel effekt. Men, vi fant det meste negative assosiasjoner med viktig utvalget trekk, bortsett fra for loin dybde og svangerskap lengde (Tabell 3), noe som tyder på at frekvensen er rent følge av genetisk drift.

Tabell 1 SSC6 haplotype egenskaper.,

Tabell 2 Operatør-av-carrier kull viser at 24% reduksjon i amming overlevelse i forhold til transportøren ved non-carrier-kullene. Signifikante resultater er skrevet i fet skrift.

Tabell 3 Egenskaper signifikant forbundet med heterozygote bærere av SPTBN4 sletting.
52 carrier-av-carrier (CxC) kull viser ingen signifikant reduksjon i totalt antall født eller liveborn dyr., Men, amming overlevelse er redusert med ca 24% i CxC kull i forhold til transportør-av-noncarrier (CxN) parringer, noe som indikerer at homozygote smågris dør innen amming perioden (Tabell 2). Neste, vi undersøkte kommentarer for tid og årsak til dødelighet av CxC kull. Dette avdekket at de fleste smågris som døde i løpet av de første 24 t etter fødselen. De fleste av disse smågris var for det meste beskrevet av bønder som «svake nasse nøff ved fødselen.,»
Hel-Genom-Sekvensering Analyse Avslører en 16-bp Frameshift Sletting i SPTBN4 som Sannsynlig Utløsende Variant
for Å identifisere den kausale mutasjon, undersøkte vi hel-genom sekvens data fra 71 dyr fra befolkningen under studien og identifisert fem transportøren dyr. Sammenhengen ulikevekt (LD) analyse avslørte 267 SNP og indel varianter i høy LD (r2 > 0.8) med SSC6 haplotype (Tabell S1), de fleste å være i perfekt LD (247 varianter)., Bare fem varianter potensielt påvirke den kodende sekvensen (tre missense, en frameshift, en skjøte-akseptor). De tre missense varianter er spådd til å bli tolerert av SILE (score > 0.18, Tabell S1), mens skjøte-akseptor variant påvirker et gen som koder en 28 bp peptid av ukjent funksjon, er det lite sannsynlig årsakssammenheng. Imidlertid, en variant i komplett LD (r2 = 1) med haplotype som ble spådd til å ha høy effekt; en 16-bp frameshift sletting i ekson 26 av SPTBN4 genet (6:g.48801280delGACGGTGTACGCCGGT) (Figur 1A, B)., Den frameshift sletting (ENSSSCP00000031537:p.Arg1902fs) introduserer 30 roman aminosyrer og en tidlig stopp codon, produsere en svekket og avkortet spectrin beta ikke-erythrocytic 4 protein (SPTBN4). Mutanter mangler den siste 662 aminosyrer av vill type protein (Figur 1C), inkludert pleckstrin homologi (PH) domene kreves for protein transport til membraner (Wang et al., 2018). Den SPTBN4 protein er medlem av beta-spectrin proteiner og er en actin som lenker cellemembranen til actin cytoskeleton., SPTBN4 mutasjoner forstyrre cytoskeletal maskiner kontrollere riktig lokalisering av ion-tv i myelinated nerver forårsaker motor nevropatier (Parkinsons et al. I 2001; Wang et al., 2018).

Figur 1 (A) SPTBN4 genet modell. Plasseringen av de berørte 26. ekson er indikert i rødt. (B) Illustrasjon av 16-bp sletting. Figuren viser wild-type og mutant ekson. (C) Justering av mutant (Mt) og vill-type (Wt) SPTBN4 protein sekvens. Mutasjonen fører til 30 roman aminosyrer og en tidlig stopp codon.,
– Genotyping Fem CxC Kull Bekrefter SPTBN4 Sletting som den Sannsynlige Årsaken
Vi genotyped fem CxC kull for 16-bp sletting som hadde minst to grisunger (område 2-6) som døde i løpet av de første 48 t etter fødselen. De fem kullene som produseres 53 smågris, hvorav 19 var homozygote for 16 bp sletting (Tabell 4). Alle 19 homozygote smågris døde innen 48 t etter fødselen (18 innen 24 t). Fra 34 gjenværende smågris (8 wild-type, og 26 bærere), bare 1 døde innen 48 t, sannsynligvis forårsaket av andre (miljø) faktorer.,

Tabell 4 Genotyping av sannsynlig årsakssammenheng 16-bp SPTBN4 frameshift sletting i fem carrier-av-carrier-kullene. Summen per genotype klasse er skrevet i fet skrift.
Smågris Homozygote for SPTBN4 Sletting Lider av Myopati og bakbein Lammelse
Vi overvåket en siste CxC kull (farrowing dato: 28. April 2019) som har produsert seks sunt, to berørt (prøver: 9912, 9916) (Figur 2A), og tre dødfødte grisunger., Vi bekreftet homozygote SPTBN4 sletting status for de to berørte smågris (Tabell S2). Videre observerte vi fire heterozygote bærere og to homozygote wild-type smågris blant friske individer. En av de dødfødte grisunger (eksempel: 9921) også var homozygote for sletting, mens de to andre var heterozygote. De berørte smågris lider av ekstrem muskel svakhet (Figur 2B, C), lammelse av bakbeina lemmer, og skjelvinger (S1 Video). Derfor, grisungene var i stand til å gå eller drikke.,
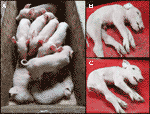
Figur 2 (A) To berørte smågris (live) sammen med seks sunn littermates. Grisungene stammer fra en CxC parring farrowed på 28. April 2019. (B) Berørte mannlige nasse nøff 9912. (C) Påvirket kvinnelige nasse nøff 9916.
Påvirket Smågris Mangel Cross Styrke i Rygg-og bakbein skjelettmuskulatur
Histopatologiske undersøkelsen avdekket spredt degenerasjon av muskelfibre i både smågris, og focally nekrose og vaskulitt i ryggfinnen muskel i en av smågris (ID = 9912)., Videre, phosphotungstic syre hematoksylin (PTAH) farging viser avvikende farging av skjelett-muskel fiber, noe som indikerer nedgang på tvers av styrke, særlig i musklene i rygg og bakben av de berørte dyr (Figur 3B), mens den fremre ben synes upåvirket (Figur 3A). Reduksjon av cross styrke er indikert ved unormal farge og generelt tap i volumet av muskelfibre (Figur 3B). Den histopathologically observerte endringer i bakbein og rygg muskler er veiledende for muskeldystrofi.,

Figur 3 (A) Cross-sectional visning av skjelett-muskel fra den fremre benet. Den svarte pilen indikerer normal coloring (mørk) av muskelfibre som indikerer tilstedeværelse av en cross-styrke. PTAH Bar = 50 µm. (B) Cross-sectional visning av en skjelettmuskulatur fra hind etappe. Den svarte pilen viser unormal farge (rosa) av muskelfibre som indikerer mangel på cross-styrke. Den gule pilen indikerer normal farge og tilstedeværelse av en cross-styrke. PTAH Bar = 50 µm.,
Diskusjon
I dette arbeidet rapporterer vi en roman medfødt defekt som forårsaker nasse nøff dødelighet sannsynlig på grunn av en 16 bp frameshift sletting i SPTBN4 genet. Grisungene lider av ekstrem muskel svakhet (myopati) og dø i løpet av få timer etter fødselen. Sletting er forventet å gi en fullstendig tap-av-funksjon spectrin beta, ikke-erythrocytic 4 protein. SPTBN4 er et medlem av familien av spectrin gener, og er nødvendig for ion-kanal clustering på noder av Ranvier, påvirker handling potensial (Devaux, 2010)., Mutasjoner forstyrre cytoskeletal maskiner som styrer riktig lokalisering av ion-tv og funksjon av aksoner (domener hovedsakelig på axon første segmenter (AIS) og noder av Ranvier (Wang et al., 2018). Mer spesifikt, det berørte C-terminal domene av SPTBN4 er avgjørende for KCNQ2 kanal for menneskehandel og oppstemthet på noder av Ranvier (Devaux, 2010).
Påfølgende oppfølging forskning identifisert menneske og mus tilfeller som tydet på at den påfølgende syndrom vil sannsynligvis ikke vise seg å være umiddelbart dødelige, men heller gi alvorlige myopati., Ved middels tetthet SNP genotype data, tilgjengelig for alle dyr i hekkebestanden (N = 31,839), operatører kan identifiseres. Blant de som er bærere var et sår som var rundt midten av begrepet i svangerskapet på tidspunktet for identifikasjon, far av et villsvin som også ble operatør. Avl gården ble varslet for å dokumentere kullet ved fødselen. Den observerte fenotypen av de berørte smågris (myopati, bakbein lammelse, tremors) var helt sammenfallende med det som ble observert i menneskelig pasienter med homozygot tap-av-funksjon eller compound heterozygote mutasjoner i SPTBN4 genet (OMIM: 606214)., To av de menneskelige pasienter har tap-av-funksjon mutasjoner i PH-domene (Wang et al., 2018), som støtter at et tap av PH domene i griser vil trolig føre til en fullstendig tap-av-funksjon SPTBN4 protein. I menneskelige, lignende mutasjoner føre til alvorlige medfødte myopati skyldes fravær av muskel type i fibre, neuropathy, og døvhet (Knierim et al., 2017; Wang et al., 2018). Wang et al. (2018) også observert motor aksoner (neuropathy i flere pasienter preget av medfødte hypotoni, dyp svakhet og tap av dyp sene reflekser av tidlig barndom., Videre, nerve biopsi åpenbart redusert nodal Na+ – kanaler og ingen nodal KCNQ2 K+ – kanaler, avslører molekylær patologi forårsaker nerve-systemet dysfunksjon. Vi må derfor konkludere med at dette frameshift varianten er sannsynlig årsakssammenheng mutasjon som fører til den observerte fenotypen og nedbryting av homozygot genotype i befolkningen. Fremtidige studier kan fokusere på å gjøre en in vivo knockout av SPTBN4 genet i grisen, for å studere syndrom og tilhørende fenotypen i mer detalj.,
Vi ikke observere degenerasjon av muskelfibre i forbena, mens dorsal og hind etappe muskel fiber var tydelig berørt. Denne observasjonen kan delvis forklare den bakbein lammelse, mens den fremre ben, er ikke berørt. Avviket mellom front-og bakben muskel fiber har også blitt beskrevet i dirrende mus, som SPTBN4 tap-av-funksjon mutasjoner føre motor neuropathy, bakbein lammelse, skjelvinger, og sentrale døvhet (Parkinsons et al. I 2001; Komada og Soriano, 2002). Parkinsons et al., (2001) beskriver redusert nerve-conduction fart i sciatic nerver av mus med dirrende alleler forårsaker perifer bakbein neuropathy. Uttrykk for SPTBN4 i mus er begrenset til hjernen, ryggmargen, og sciatic nerve og ikke observert i skjelettmuskulatur, slik at denne sykdommen er først og fremst en neuronal feil. Totalt sett er det fortsatt uklart hvilken mekanisme som fører til fravær av symptomer i forbena. Denne «naturlige knockout» i griser kan være en nyttig ressurs for å studere menneskelig sykdom, som griser er vanligvis en bedre modell for å studere menneskelig sykdom i forhold til gnager arter., Videre, som følge av tap av SPTBN4 funksjonen kan studeres i mer detalj.
effektiv bestandsstørrelse (Ne) av rasen under studiet er beregnet til å være rundt 100 (Hidalgo et al., 2016). I husdyravl, lave Ne øker risikoen for at skadelige alleler økning i frekvens ved en tilfeldighet. Videre, tidligere studier har vist at recessiv dødelig alleler kan være drevet av fordelaktige virkninger i heterozygote katter (Derks et al., 2018; Matika et al., 2019). Matika et al.,, 2019 funnet en recessiv stopp-fikk mutasjon i MSTN genet forbundet med en betydelig økning i muskel dybde i heterozygote katter. Imidlertid finner vi ingen bevis for noen heterozygot fordel i vår studie. Med dagens genom teknikker kan vi nå identifisere skadelige alleler drivende til høyere frekvenser, og overvåke fremveksten av nye skadelige alleler nøyaktig, slik at mer effektiv tømming. Videre er resultatet av denne typen studier vil i stor grad forbedre bevissthet «skjult» genetiske defekter på både oppdretter og bonde nivå., Uten forutgående informasjon, sjeldne misdannelser er ofte registrert som «svake nasse nøff.»Og uten noen forskjell av spesifikke syndromer, for videre handling er ikke mulig. I de fleste tilfeller er det ukjent om det er en genetisk basis, eller at det kan være andre konfunderende effekter. Med før genomisk informasjon, syndromet kan identifiseres, i forhold til andre saker, og transportører som er identifisert, noe som fører til praktisk informasjon.
nasse Nøff dødelighet er av stor økonomisk og dyrevelferd betydning., Derfor, oppdagelsen av SPTBN4 mutasjon har ført til umiddelbar gjennomføring av avlsprogrammet for å minimere hyppigheten av operatør-av-carrier parringer. Dette kan for å unngå fødselen av berørte individer, og dermed bedre dyrevelferd og redusere økonomisk tap.
Konklusjon
I denne studien rapporterer vi en roman medfødt defekt sannsynlig forårsaket av en recessiv frameshift sletting i SPTBN4 genet i griser. Funnene støttes av slående likheter til SPTBN4 forbundet syndromic phenotypes hos mennesker og mus., Studiet gir mulighet til å overvåke og renske ut de skadelige allelet fra befolkningen. Carrier-av-bærer kors kan forebygges, er til hinder for berørte personer, for derved å redusere økonomisk tap, og bedre dyrevelferd. Til slutt, disse «naturlige knockouts» fikk i avl industrien kan gi en modell for menneskelig sykdom og øke vår forståelse av genet funksjon i mammalske clade, og gi en potensiell modell for menneskelig sykdom.,
Data Tilgjengelighet Uttalelse
Etikk Uttalelse
Etisk vurdering og godkjenning ikke var nødvendig for dyr studie, fordi de data som brukes i denne studien har blitt innhentet som en del av rutinemessig innsamling av data fra Topigs Norsvin avlsprogram, og ikke spesielt for det formål av dette prosjektet. Derfor, godkjenning av en etisk komité var ikke obligatorisk. Prøvetaking og datainnsamling ble gjennomført strengt i henhold til nederlandsk lov om dyrevelferd og velferd (Gezondheids – no welzijnswet voor dieren)., Skriftlig informert samtykke ble innhentet fra eierne for deltakelse av deres dyr i denne studien.
Forfatter Bidrag
MG, H-JM, og MD unnfanget og designet for studien. BH var ansvarlig for de generelle organisasjon og kommunikasjon med Topigs Norsvin og bønder. MD og ML utført på data-analyse. BD og KL utført laboratoriearbeid. SG-V utført patologiske analyse. MD skrev manus. H-JM, MG, BH, SG-V, BD, KL, og ML gitt nyttige kommentarer og forslag og hjalp til med å lage utkast til manus. Fenotypiske data ble analysert ved ML., Alle forfattere lest og godkjent det siste manuskriptet.
Midler
Denne forskningen ble finansiert av STW-Breed4Food Partnerskap, prosjekt nummer 14283: Fra sekvens til fenotypen: å oppdage skadelige variasjon ved prediksjon av funksjonalitet. Denne studien ble støttet av NWO-TTW og Breed4Food partnere Cobb-Europa, CRV, Hendrix Genetics og Topigs Norsvin. I tillegg, denne studien ble støttet av BILDET prosjektet (Horizon 2020, Nr 677353). Den funders hadde ingen rolle i studien design, datainnsamling og analyse, og beslutningen om å publisere, eller utarbeidelse av manuskriptet., Bruk av HPC klyngen ble gjort mulig ved CATAgroFood (Felles Forskning Fasiliteter Wageningen UR).
Ansvarsfraskrivelse
De data som brukes i denne studien har blitt innhentet som en del av rutinemessig innsamling av data fra Topigs Norsvin avlsprogram, og ikke spesielt for det formål av dette prosjektet. Derfor, godkjenning av en etisk komité var ikke obligatorisk. Prøvetaking og datainnsamling ble gjennomført strengt i henhold til nederlandsk lov om dyrevelferd og velferd (Gezondheids – no welzijnswet voor dieren).,
interessekonflikt
ML og BH er ansatte i Topigs Norsvin Research Center, et forskningsinstitutt som er nært knyttet til en av de funders (Topigs Norsvin).
Alle de øvrige forfattere erklærer at forskningen ble utført i fravær av kommersielle eller finansielle forhold som kan oppfattes som en potensiell interessekonflikt.
Den andre Breed4Food partnere Cobb-Europa, CRV, Hendrix Genetics, erklærer å ha noen konkurrerende interesser for denne studien.,
Erkjennelsene
forfatterne takker Frank van Haaren og Toon Janssen for å organisere kommunikasjon med gården. Vi takker Manon tilbyr boenheter for hennes bidrag til patologiske undersøkelser. Vi takker Mout Viller for å ta video og bilder av de berørte og sunn smågris etter fødselen. Vi takker Jürgen Harlizius for å ta vare på smågris etter overlevering. Vi takker Gerda van Eldik for prøvetaking. Vi takker Egbert Knol og Egiel Hanenberg for generell støtte og veiledning fra Topigs-Norsvin.,
Supplerende Materiale
Video S1 | Video som viser både berørte personer etter fødselen.
Tabell S1 | Genom variasjon i høy LD med SSC6 haplotype.
Tabell S2 | Genotyping av CxC kullet inkludert to berørte personer (farrowing dato: 28. April 2019). Tabellen viser homozygote del/del status for de to berørte smågris 9912,9916.
Tabell S3 | Kartlegging og dekning statistikk fra WGS prøver.
Figur S1 | SPTBN4 sletting transportøren frekvens fra 2007-2019.