genet p53 ble først oppdaget i 1979. Et protein som ble identifisert i simian virus 40-forvandlet musen celler (SV40) av immunoprecipitation med anti-T serum; dette proteinet ble kalt p53 protein . I det samme året, Kress og andre forskere har funnet en ny klasse av proteiner med en molekylær masse med alt fra 50-60kDa. Denne type protein ble deretter identifisert som p53 . Proteinet p53 kan også identifiseres ut fra ulike forvandlet cellelinjer av immunoprecipitation., Lane og Linzer også fikk et tilsvarende resultat i 1979. Andre bevis for å identifisere p53 er at p53 ble uttrykt i alle testede forvandlet musen celler, og disse testene inkluderer kjemisk indusert sarcomas, forvandlet fibroblaster, og leukemias, mens i normale celler, p53 ble ikke uttrykt. I tillegg, et høyt nivå av p53 ble oppdaget i de fleste transformerte celler uansett hvordan cellene ble forvandlet, enten spontant eller ikke-spontant ., Det var hovedsakelig på grunn av økt stabilitet av p53, men i F9 embryonale carcinoa celler, er det uttrykt et høyt nivå av p53, dette var på grunn av mengden av oversatt p53 mRNA .
Etter at proteinet p53 hadde blitt oppdaget i 1979, ble det populært å analysere det. Men, på den tiden, så det var en nylig oppdaget protein, og det var ikke en tidligere navn for det, forskjellige institusjoner brukes forskjellige navn og publiserte arbeider med forskjellige navn., For å løse dette problemet, i 1983, under den 1. Internasjonale p53 workshop holdt i Oxted, STORBRITANNIA, forskere fra ulike forskningsmiljøer i forskjellige land kom sammen for å diskutere en felles nomenklatur for dette nylig oppdaget protein. På dette møtet, «p53» blir navnet sitt, og det har vært brukt siden da. Det var tenkt at grunnen til at forskere kalt proteinet p53 er at den molekylære massen av dette proteinet er 53kDa som er basert på migrasjon i SDS gel. Senere den molekylære massen var det viste seg å være feil, og riktig molekylære massen skal være 43.,7kDa fordi p53 inneholder en proline-rik region, og denne regionen kan redusere overføringen av p53 i SDS gel. Men navnet «p53» holdt .
i Løpet av 1980-tallet, proteinet p53 ble antatt å være involvert i celle syklus, så vel som å spille en rolle i DNA-replikasjon. Senere, i 1982 til 1994, folk fant at noen av viral oncoproteins var i stand til å binde seg til p53, og danner et kompleks. I 1982, Sarnow et al. fant ut at adenovirus E1b (58kDa) kan samhandle med en 54kDa protein som er til stede i SV40-forvandlet musen celler som er nevnt ovenfor., I henhold til resultatene av immunologiske særegenheter av T-antistoffer og peptid kart over 54kDa protein, dette 54kDa protein er identifisert som p53 . I samme år, har forskere funnet ut at hvis de injiserte p53-antistoff i Sveitsiske 3T3 musen celler det vil hemme celler inn i S-fasen av celle syklus, men; under den samme situasjonen, p53-antistoff ikke påvirke SV40 eller adenovirus indusert DNA-syntese .,
Senere i 1984, har forskere undersøkt effekten av p53 på ikke forvandlet 3T3 fibroblaster, de analysert syntese pris av proteinet p53 på forskjellige tidspunkter, og fant at i sen G1 fasen, syntese pris og nivået av proteinet p53 og tilhørende mRNA øke. Dette resultatet tyder på at proteinet p53 hemme celler inn dele fase fra interphase . Maltzman W et al. gjorde et eksperiment i samme år. De behandlet den ikke forvandlet mus celle med UV-lys og UV-mimetic kjemiske karsinogen 4NQO, og de oppdaget et høyt nivå av p53., Resultatet viste at forhøyet uttrykk for p53 er ikke bare et symbol som indikerer celle syklus, men også viktigere en komponent som er involvert i DNA-syntese og celleproliferasjon . I 1987, da studere komplekse av T-antigen av simian virus 40 og DNA-polymerase α, Gannon, og andre forskere har funnet en liknende endring i antigen når bundet til p53 og α-polymerase. De fant også at en viss konsentrasjon av tre komponenter, kan de danne en spesiell trimeric kompleks som inkluderer T-antigen, p53 og DNA-polymerase α., Som T-antigen er involvert i viral DNA replikasjon og mobile transformasjon, og dette resultatet indikerer at p53 spiller en rolle i kontrollen av celle syklus og DNA-replikasjon .
Som eksperimentet viste ovenfor, p53 har muligheten til å forevige celler. I 1984, Eliyahu D et al. fant ut at p53 og produktet av onkogenet myc delt noen lignende eiendommer. Begge har evnen til å binde seg til andre proteiner, og er involvert i celle syklus, og de begge opp i kjerner av transformerte celler ., Bienz, Pennica og Oren analysert aminosyre sekvenser av proteinet p53 og produktet av myc, og de fant at de to proteiner viser likheter i molekylær struktur og plassering av spesielle belastet rester. Deretter forskere foreslått at p53 kan fungere som en onkogenet. Basert på denne hypotesen, Eliyahu D et al. gjorde noen eksperimenter. Som det primære pris embryo fibroblaster kan bli forvandlet ved involvering av både myc produkt-og Ha-ras, primær baby rotte nyre-celler kan også bli forvandlet ved samarbeid av Ha-ras-og adenovirus tidlig regionen 1A , Eliyahu D et al., bestemte meg for å bruke denne type biologisk test system for å identifisere oncogenic funksjon av p53. De behandlet normal embryonale celler med p53 og aktivert Ha-ras. Resultatet viste at målet celler møte morfologi endringer og produsere høye nivåer av p53, Eliyahu D et al. tenkte at transformasjon av embryonale fibroblaster av p53 og Ha-ras forklart at genet p53 er en onkogenet ., I 1985, Jenkins foreslått at p53-genet kan forlenge levetiden av celler, forbedre affectivity av transformasjon ved å omorganisere sin koding rekkefølge som kan føre til produksjon av stabile proteiner .
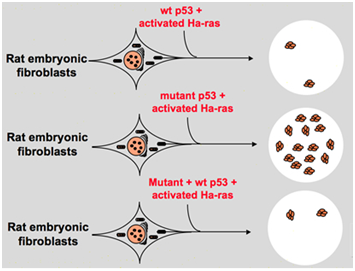
Men i slutten av 1980-tallet, har forskere begynt å innse at p53 er en tumor suppressor gen i stedet for en onkogenet. De observerte at p53 med normal funksjon kan ikke påvises i mange av svulster og funnet det å miste uttrykk og funksjon av vill-type p53-genet er nødvendig i løpet av cellen transformasjon., Disse øker muligheten for at wild-type p53-genet kan hemme neoplastiske progresjon . Da de formulerte en annen hypotese: the clone genet p53 brukt i tidligere eksperimenter inneholder dominerende negative mutasjoner i svært bevart domenet av og til, noe som fører til motsatt eksperiment resultater . I 1988, Ben og andre forskere oppdaget en enorm mengde omorganisert p53 i murin erythroleukemia celle linjer–DP20-1 og CB3 som er avledet fra spleens av murin infisert med en Venn, leukemi virus ., I 1989, Eliyahu, som påpekte at p53 er en onkogenet ombestemt seg, og han antok at wild-type p53-genet kan hemme celle transformasjon. Eliyahu og andre forskere studert effekten av vill-type p53 proteinet kodet av plasmider og mutant p53 på evnen til å lokke fram primære pris embryo fibroblast transformasjon av ulike onkogenet kombinasjon in vitro. For eksempel mutant p53 pluss ras og myc pluss ras., Resultatet viste at wild-type p53 føre til en stor reduksjon av forvandlet foci forårsaket av mutant p53 pluss ras; mutant p53 viste ingen hemming på forvandlet foci forårsaket av myc pluss ras, mens myc pluss ras-mediert transformasjon er svært sensitive til uttrykk i wild-type p53. Figur 1 viser dette eksperimentet konsist. Det viste at sammenlignet med mutant p53, wild-type p53 viser en åpenbart hemmende effekt på cellen transformasjon. Effekten er positivt relatert til uttrykk nivå av vill-type p53 og negativt relatert til uttrykk nivå av mutant p53., Dette eksperimentet foreslått at wild-type p53 kan faktisk ha en motsatt funksjon sammenlignet med mutant p53 og kan hemme tumorigenesis . I dag, p53 er anerkjent som en tumor suppressor gen. Det er anslått at om lag halvparten av svulster er forårsaket av p53. Det er en av de mest vanlige muterte gener hos mennesker, og de mest vanlige analysert gene rundt om i verden .
i Løpet av de første på flere år av 1980-tallet, biokjemiske vei av p53 og effekten av p53 genet ikke var klart. I 1991, Kern og andre forskere har funnet ut at en 33-base-par DNA-sekvens som binder seg spesifikt til wild-type p53 in vitro. De fant også at p53 protein inneholder to mutasjoner som vanligvis finnes i humane svulster som ikke kan binde seg til dette spesifikke DNA-regionen. Så de antok at funksjonen av p53 avhenger av dens evne til å binde spesifikke DNA-sekvenser, og denne evnen er endret ved mutasjoner er funnet i humane svulster., De har også anta at dette 33-base-par DNA-sekvens kan ikke være den eneste sekvens som har evnen til å binde seg spesifikt til p53 i mennesker, men det kan hjelpe oss til bedre å forstå funksjonen av p53 . Senere, p53 ble funnet å spille en rolle under celle syklus, DNA-reparasjon, differensiering, initiere apoptosis og angiogenese. Brock V et al. fant ut at p53 opp-regulerer differensiering av celler. For eksempel, et høyt nivå av p53 protein ble oppdaget i flere viktige trinn i B-celle differensiering. Forhøyet p53 kan også oppdages i løpet av spermatogenese., I mellomtiden, bare et svært lavt nivå av p53 protein kan være registrert i enkelte organer av voksne mus .
I 1990, et nyttig verktøy ble oppdaget av og til. Det er en temperatur-sensitive mutant av p53, kalt p53val135. Det kan fungere som en ekte wild-type p53 ved temperatur på 32.5 oC, undertrykke transformasjon, og det kan også fungere som andre muterte p53 ved en temperatur på 37,5 oC eller høyere 48oC, fremmane transformasjon. I tillegg, for transformerte celler som uttrykker p53val135, dens spredning kontrolleres på tillatte temperatur, og denne type kontroll er reversibel., Ved hjelp av denne p53val135 mutant, wild-type p53 ble oppdaget å indusere celle syklus arrest på enten G1 eller G2/M . I 1991, Elisheva et al. fant ut at temperatur-sensitive p53val135 utført en annen funksjon i murin myelogen leukemi cellelinje. Etter reaktivering av p53val135 for et par dager, alle cellene døde, og dette dødsfallet viser noen egenskaper for apoptosis . Et år senere, et lignende resultat ble oppnådd ved Shaw. Et wild-type p53 var transfekte til en menneskelig kolon tumor-avledet cellelinje EB., Cellene ble undersøkt under lys og elektron mikroskop, og som er funnet å ha noen egenskaper for apoptosis . I 1990, Scheffner et al. og andre forskere har funnet ut at E6 som stimulerer til ødeleggelse av verts-cellen regulatoriske proteiner er kodet av oncogenic humant papillomavirus-typene 16 og 18, og det kan dannes et kompleks med wild-type p53 in vitro, som i sin tur fører til nedbrytning av proteinet p53 .
I 1992, en nøkkel protein MDM2 ble oppdaget fordi det binder seg fast med p53, og det hemmer transactivation mediert av p53., Den molekylære massen av MDM2 er 90kDa, og den danner et kompleks med både muterte og wild-type p53 . I det samme året, Livingstone RL et al. undersøkt hvorvidt celle mistet en eller begge kopier av vill type p53-alleler og om det var tilstrekkelig til å forårsake gen-amplifikasjon. Gen-amplifikasjon ble oppdaget for det meste i transformerte celler, men ikke i den normale fibroblaster. Resultatet viste at celler å miste en kopi av p53 alleler fungerer som wild-type p53, mens cellene mister begge kopier av vill type p53 alleler som viser en høyere hyppighet av forsterkning . Et annet eksperiment gjort av Yin Y et al., viste et lignende resultat .
I 1993, en p53 mål genet kalles CDKN1A ble identifisert. Det inneheld protein p21 som er en cyclin-avhengig kinase inhibitor som hemmer cyclin-CDK2 og CDK1 ved binding til dem. I 1993, Szekely funnet at Epstein-Barr virus nuclear antigen 5(EBNA-5) er kodet av Epstein-Barr virus, og det kan infisere humane lymphoblastoid celle. En 66 aminosyre lang peptid er ansvarlig for dannelsen av komplekse EBNA-5-p53, punkt mutasjoner i p53 ikke påvirke sin bindende evne til å EBNA-5., Men, det hemmer sine formasjoner av komplekser med andre molekyler . I 1994, Cho og hans co-arbeidere først beskrevet crystal strukturen i komplekse p53-DNA. Dette DNA-bindende domene ble også kalt core domene. Den inneholder rester 102-292, og består av en beta-sandwich. De viste også den detaljerte strukturen i kjernen domene . Også i 1994, Wang XW et al. samspillet mellom hepatitt B-viruset X protein (HBX) og vill-type p53 protein i mennesker., De fant at HBX kan hemme muligheten for p53 å binde seg til andre sekvens-spesifikke DNA etter at den er bundet til p53 og det kan også hemme association of p53 med transkripsjon faktorer .
I 1997, Honda R et al. første hypotese om at MDM2 kan utløse p53 ubiquitylation og føre til nedbrytning av p53 av en ubiquitin-proteasome system. De påpekte at MDM2 binder seg til N-terminal domene (NTD) av p53 og fungerer som ubiquitin ligase E3 . Også i 1997, to nye familie av proteiner, p63 og p73 ble oppdaget at andelen betydelig homologi med p53., p73, også kalt svulst protein 73, er kodet av et gen som ligger i 1p36. Plasseringen er slettet ofte i neuroblastoma og andre svulster. p73 kan aktivere p53 mål gener og samhandler med p53 . Yang et al. fant ut at genet p63 ligger i 3q27-29, og det kan bli oppdaget i forskjellige mus og humane celler. Som p73, p63 kan transactivate p53 mål gener betydelig, kan det også bidra til at apoptosis. En karakteristikk av p63 er at flertallet av p63 mangler en N-terminus ., I det samme året, Serrano og medarbeidere fant at det primære murin fibroblaster kan bli forvandlet ved ras i fravær av p53 eller p16, og inaktive p53 eller p16 kan lette immortalization prosessen av humane celler. Disse funnene tyder på at p53 spiller en rolle i cellulære senescence . Så, i 1997, p53 ble funnet å spille en rolle i initiering av apoptosis. Når cellene kommer inn spredning fase, telomeres på slutten av hvert kromosom ville forkorte etter hver runde av DNA replikering på grunn av ufullstendig gjengivelse av én strand DNA på slutten av DNA-stand ., Aktivert tumor suppressor gen p53 begrenser antall ganger celledeling kan oppstå. Wynford TD fant ut at med tap av funksjon av vill-type p53, alle fibroblaster flykte fra apoptosis. Også transactivation funksjon av p53 kan slås på ved apoptosis . Wynford TD foreslått at det er tre muligheter for hvordan p53 er aktivert. Den første er post-translational endring av phosphorylation, den andre en opp-regulerer transcritional kofaktorer som p33ING1, den siste er ned-regulerer p53-hemmere som MDM2 .
I 2000, Brodsky MH et al., studerte transkripsjon mål av p53 i Drosophila. Det er bevis for å vise Drosophila øyne vise en alvorlig grov øye fenotypen under uttrykk for menneskelig p53 som vil indusere apoptosis av øye imaginal plate celler, forårsaker tap av pigment cellene, endelig hemme øye utvikling av Drosophila , så Drosophila kan være en modell dyr for å studere funksjonen av p53. Brodsky funnet ut at genet rpr inneholder en konsensus p53 bindende nettstedet som ligger i cis-myndighetskrav-regionen i rpr, og det også er en aktivator av apoptosis., Med andre bevis, Brodsky hevdet at rpr er en transcriptional mål av p53 . I 2001, Derry og medarbeidere fant at C. elegans ikke har en p53-genet, men faktisk inneholder et gen cep-1 som koder for proteiner som har en tilsvarende sekvens med proteinet p53. Dette C. elegans genet koder protein CEP-1 som har evne til å indusere apoptosis av gentoksisk stress og er en nødvendig komponent under meiose .
I 2002, Tyner og co-arbeidere foreslått at p53 spiller en rolle i regulering av aldring av organismer., For å studere funksjonen av p53, de skapte genmodifiserte mus med muterte p53 ved å slette exons 1-6 og en oppstrøms regionen wild-type p53-genet (p53+/+), kalt p53+/m. Det fungerer som wild-type p53 og har forbedret motstand mot spontane svulster bedre enn vill-type p53. I eksperimentet, overvåket de musene som inneholder p53+/m, p53+/+ og p53+/-. p53+/- betyr mus lossing en kopi av vill-type p53-genet., Resultatene viste at ingen av mus med p53+/m utviklet livstruende svulster, men mer enn 80% av mus med p53+/- og mer enn 45% av mus med p53+/+ utviklet disse typer svulster. Leter innsiden av svulster, lokalisert svulst lesjoner ble observert i 2 av 35 p53+/m mus, i kontrast, ulike svulster som lymfomer, og osteosarcomas ble funnet i p53+/- og p53+/+ mus. Under dette eksperimentet, de har også observert at median alder av p53+/m var 96 uker mens median alder av p53+/m var 116 118 uker., Tyner og medarbeidere undersøkte også muligheten for at kortere levetid av p53+/m var forbundet med aldring. De fant at etter 18 måneder, p53+/m mus begynte å miste vekt og energi, som for p53+/m mus, reduserte vekter ble observert i en alder av 30-36 måneder. p53+/m mus også utstilling lordokyphosis. Avhengig av X-ray analyse, p53+/m mus viste redusert bentetthet i en alder av 12 måneder, og det vil bli alvorlig i en alder av 18 måneder. Dette er et symbol av osteoporose og osteoporotiske er en markør for aldring hos mennesker og mus . Tyner et al., testet også toleransen for stress, som denne evnen er også en markør av aldring . De fremførte 3 mm punch biopsi i ryggen hud av gamle og unge anaesthetized p53+/m og p53+/+ mus. Deres resultater viste at en rekke gamle p53+/m mus døde etter å ha injisert standard dose av Avertin, noe som indikerer at gamle p53+/m mus ble mindre toleranse for stress .
I 1991, ble det funnet at p53 har evnen til å indusere apoptosis, mens i 2003; Mihara og andre forskere har funnet ut at p53 har også en apoptosis rolle i mitokondriene ., Siden noen mitokondrie proteiner har evne til å aktivere mobile apoptosis enten ved aktiv caspases eller nøytralisere cytosolic-hemmere. I eksempelet av cytokrom c-indusert caspase, etter å ha mottatt apoptosis signal, cytokrom c er gitt ut fra intermembrane plass i mitokondriene, og så i sin tur binder seg til Apf-1, som eksisterer som en inaktiv monomer, induserer sin conformational endre, og øker sin bindende affinitet for dATP/ATP ved 10-fold enn Apaf-1 binder dATP/ATP alene. Så komplekse Apaf-1 – cytokrom c binder seg til dATP/ATP, danner apoptosome., Etter at caspase rekruttering domene (KORT) av Apaf-1 utsatt i apoptosome, rekruttere procaspase-9, og deretter autoactivate seg selv. Den endelige kompleks enn cleaves og aktiverer andre caspases som caspase-3, noe som i sin tur senere cleave viktige molekyler i cellen, forårsaker chromatin kondens, DNA-fragmentering og til slutt fører til apoptosis . Figur 2 viser cytokrom c-indusert caspase aktivering veien.
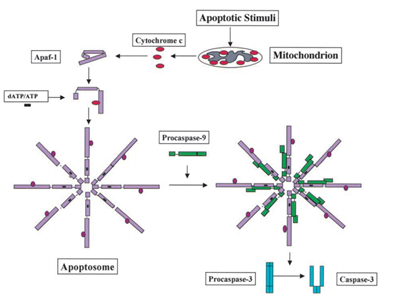
Mihara M et al. forskere har funnet ut at vill-type p53-genet kan være translocated til mitokondrie overflaten av kreftceller raskt. I eksperimentet, de fant at noen av stress-indusert wild-type p53 protein har evnen til å translocate til mitokondriene av thymocytter i menneskelig eller mus celler etter apoptosis på grunn av DNA-skade og hypoksi. Da disse wild-type p53 protein indusere permeabilization av mitokondrier og forårsake en rekke endringer som skjer i mitokondriene som avgi cytokrom c ved danner kompleks med Bcl2 og BclXL .,
Som et godt klinisk resultat med liten bivirkning, genterapi er populære. Ved utgangen av 2005, var det 1020 genterapi forsøk i databasen av Journal of Gene Medisin. Blant disse prøvelsene, 66% av gen-terapi ble utført på pasienter, og 58 studier av dette brukes rAd-p53, et rekombinant adenovirus koding av menneskelig p53-genet. I April 2004, en rekombinant human adenovirus-p53 injeksjon (Gendicine) ble formelt lansert. Gendicine brukes til å behandle hode og nakke plateepitelkarsinom og det ble godkjent av Staten Food and Drug Administration i Kina i Oktober. 16, 2003., Det ble den første genterapi produkt i verden for å bli godkjent av den Kinesiske regjeringen .
genet p53 ble oppdaget å regulere stoffskiftet i 2005. For å overføre fra G1 til S fasen, celler må ha tilstrekkelig med råstoff støtte for DNA, organeller og protein syntese. For å regulere denne prosessen, noen sjekkpunkter er nødvendig. En av dem er glukose-avhengige sjekkpunkt G1/S. Det er regulert av AMP-aktivert protein kinase (AMPK). Når glukose er oppbrukt, AMPK kan phosphorylate proteinet p53, som i sin tur fører til cellen ble arrestert, og unngår celledød., Celler som møter p53-avhengige arrestasjonen vil angi celle syklus når glukose er tilstrekkelig .
Det er kjent at inaktivering av p53 er nødvendig for dannelse av svulster. Bykov et al. VJ og Snydel EL et al. påpeke at feilaktig funksjon av p53 kan føre til spredning av en eksisterende svulst . Ventura og hans medarbeidere gjorde noen eksperimenter for å teste denne hypotesen. De restaurerte funksjon av endogene p53 i primær stedegne svulster å undersøke konsekvensen av p53 reaktivering., Resultatet viste at p53 reaktivering var ansvarlig for regresjon av stedegne svulster. Det betyr at inaktivert p53 protein kan føre til tumor utvikling . Xue og andre forskere som også gjorde et eksperiment for å teste konsekvens av reaktivering av p53 på svulster. De brukte snus RNA-interferens (RNAi) for å regulere uttrykk av endogene p53 i mus med leverkreft. I eksperimentet, doxycycline (Dox) brukes til å aktivere p53, som uttrykk for p53 er helt undertrykt når Dox mangler og raskt gjenopprettes når Dox er lagt til., Når behandlet med Dox, p53 miRNA var slått av, som i sin tur fører til økt uttrykk av p53. Resultatet viste at svulster i Dox-behandlede mus bli undetectable etter 12 dager, mens svulster i ubehandlet mus vokste raskt. For å teste følge av forbigående aktivering av p53, de behandlede mus med Dox for 4 dager og deretter stoppet. Resultatet viste at selv en to-dagers behandling kan føre til regresjon av svulster og 4 dager av behandlingen kan føre til svulster helt til regress., De pekte også på at i løpet av tumor regresjon, kortvarig-nytt p53 kan utløse mobil senescence, ikke apoptosis. I det samme året, Hu fant at embryonale implantasjon i p53-/- kvinnelige mus er regulert av Leukemi hemmende faktor (LIF). Den LIF er en utskilt cytokin og er viktig for blastocyst implantasjon. Genet koder for LIF er identifisert som p53 mål-genet og p53 bindende nettstedet, er forretningsvennlig og ligger i intron 1 i både mennesker og mus .