Inleiding
Coagulase-negatieve stafylokokken (CoNS), leden van de stafylokokken groep, worden gekenmerkt als Gram-positieve cocci, gepresenteerd als losse cellen of met een onregelmatig karakter, en zijn onbeweeglijk, niet-spore-vormende, katalase-positief, meestal facultatieve anaerobes, en het ontbreken van het enzym coagulase.,1 CoNS maken deel uit van de menselijke microbiota, beschouwd opportunistische pathogenen, die infecties veroorzaken meestal in premature baby ‘ s, en immunogecompromitteerde en prothese patiënten.2
de toename van antimicrobiële resistentie in de afgelopen jaren heeft een grote impact gehad op ziekenhuisinfecties veroorzaakt door CoNS. Oxacilline is een semisynthetische penicilline die in de gevoeligheidstest voor de opsporing van methicillineweerstand en de behandeling van stafylokokkeninfecties wordt gebruikt. Echter, percentages van 66% tot 95% van oxacilline resistentie zijn waargenomen in CoNS klinische isolaten.,2 Oxacilline-resistentie wordt vaak gemedieerd door het Meca-gen, dat codeert voor een aanvullend penicillinebindend eiwit (PBP2a) met een lage affiniteit voor semisynthetische penicillines.3 het Meca-gen bevindt zich op een mobiel genetisch element dat bekend staat als het staphylococcen Cassette chromosoom MEC (SCCmec) dat het MEC-complex bevat, samengesteld uit het Meca–gen en de regulerende genen mecI en mecRI, het CCR-complex, verantwoordelijk voor de integratie en excisie van het SCCmec, en het J-gebied, dat niet essentieel is voor de SCCmec-vorming, maar wel niet-β-lactam-resistentiegenen kan dragen.,4 tot op heden zijn 13 SCCmec-types beschreven, gebaseerd op de combinatie van CCR-gencomplextypes en MEC-gencomplexklassen. De subtypes werden gedefinieerd door J regio polymorfismen in dezelfde combinatie van MEC en ccr complexen.5
het ontstaan van oxacillineresistente isolaten heeft geleid tot het uiteindelijke gebruik van alternatieve antimicrobiële middelen voor de behandeling van CoNS-infecties, zoals het glycopeptide vancomycine. In de tussentijd zijn beschrijvingen van verminderde gevoeligheid en resistentie tegen vancomycine gemeld in de afgelopen decennia.,Verminderde gevoeligheid voor vancomycine kan gerelateerd zijn aan metabole modificaties zoals versnelling van de peptidoglycansynthese, resulterend in verdikking van de celwand. In dit proces, is vancomycine niet in staat om de peptidoglycaansynthese te remmen, aangezien het wegens de hogere beschikbaarheid van D-alanyl-d-alanineplaatsen wordt uitgeput.,Gezien de toename van ziekenhuisinfecties veroorzaakt door CoNS, was deze studie gericht op het karakteriseren van de oxacilline resistente stammen en het bepalen van de antimicrobiële gevoeligheid van een 20-jarige verzameling van bloedkweek CoNS isolaten van Botucatu Hospital das Clínicas inpatients.
materiaal en methodenstrains
driehonderd CoNS-stammen werden geïsoleerd uit bloedculturen van patiënten van het Botucatu Hospital das Clínicas – Paulista State University (UNESP)., De isolaten werden verzameld van 1990 tot 2009 en bewaard in het Culture Collection Laboratory van de afdeling Microbiologie en Immunologie van het Botucatu Biosciences Institute – UNESP. Bij de selectiecriteria werd uitgegaan van een gemiddelde prevalentie van voorvallen van 35%, met een foutenmarge van 5%, en een 95% betrouwbaarheidsinterval.
de stammen werden geïsoleerd volgens Koneman et al.8 bloed-agarisolaten werden onderworpen aan gramkleuring voor observatie van koloniemorfologie en de catalasetest werd uitgevoerd voor bevestiging van het geslacht Staphylococcus., Staphylococcus stammen werden onderworpen aan de coagulasetest voor differentiatie van de coagulase-negatieve en coagulase-positieve groepen. Coagulase-negatieve isolaten werden onderworpen aan biochemische tests voor de fenotypische identificatie van species. De genotypische identificatie werd uitgevoerd met primers getrokken over geconserveerde sequenties naast 16S en 23S genen, door ITS-PCR (internal transcribed spacer-polymerase chain reaction), beschreven door Couto et al.9 versterking efficiëntie werd gecontroleerd door elektroforese in 3% metafoor agarose en gekleurd met SYBR veilig., The following lineages of international reference were used: S. auricularis ATCC 33753, S. capitis subsp. capitis ATCC 27843, S. capitis subsp. urealyticus ATCC 49325, S. caprae ATCC 35538, S. cohnii ATCC 49330, S. cohnii subsp. cohnii ATCC 29974, S. epidermidis ATCC 12228, S. epidermidis ATCC 35983, S. hemolyticus ATCC 29970, S. hominis ATCC 27844, S. hominis subsp. novobiosepticus ATCC 700237, S. lentus ATCC 700403, S. lugdunensis ATCC 700328, S. saprophyticus ATCC 15305, S. schleiferi subsp. schleiferi ATCC 43808, S. sciuri subsp. sciuri ATCC 29062, S. simulans ATCC 27851, S., xylosus ATCC 29979, en S. warneri ATCC 10209.
DNA-extractie
De Illustra-kit (GE Healthcare) werd gebruikt voor DNA-extractie. De stappen omvatten een initiële vertering van stafylokokkencellen met lysozym (10 mg/mL) en proteïnase K (20 mg/mL). Vervolgens werd 500µL van de extractiebuffer toegevoegd aan het mengsel, dat werd gecentrifugeerd bij 10.000 x g gedurende 4min. Het supernatant werd overgebracht naar een kolom en gecentrifugeerd bij 5.000 g gedurende 1min. De vloeistof werd weggegooid en 500µL extractiebuffer werd toegevoegd aan de kolom., Na de centrifugering en het weggooien van de opgevangen vloeistof, werd 500µL wasbuffer toegevoegd aan de kolom, die aan centrifugatie bij 20.000 g gedurende 3min werd voorgelegd. Vervolgens werd de kolom overgebracht naar een buis van 1,5 mL en elutie werd uitgevoerd met 200µL verwarmd MilliQ water bij 70°C.
De Meca-gendetectie
PCR werd uitgevoerd voor de detectie van het Meca-gen. Reacties werden uitgevoerd met behulp van een protocol beschreven door Murakami et al.10 de versterking efficiëntie werd gecontroleerd door elektroforese in een 2% agarose gel gekleurd met SYBR veilig.,
bepaling van SCCmec
het SCCmec-type werd bepaald op mecA-positieve stammen. Reacties werden uitgevoerd met behulp van een protocol beschreven door Oliveira et al.11 en gewijzigd door Machado et al.12
Multiplex PCR werd uitgevoerd in 50µL reactievolume met 1x enzymbuffer, 1.,25 U Taq polymerase DNA, 200 μM dNTP Mix, and the following primers: 10pmol of RIF2 F2 (TTCGAGTTGCTGATGAAGAAGG) and CIF2 R2 (ATTTACCACAAGGACTACCAGC), 6pmol of KDP F1 (AATCATCTGCCATTGGTGATGC) and KDP R1 (CGAATGAAGTGAAAGAAAGTGG), 5pmol of DCS F2 (CATCCTATGATAGCTTGGTC) and DSC R1 (CTAAATCATAGCCATGACCG), 5pmol of RIF4 F3 (GTGATTGTTCGAGATATGTGG), and RIF4 R9 (CGCTTTATCTGTATCTATCGC). For each reaction, 10μL DNA was added. The cycle sequencing reactions were performed at 92°C for 3min, followed by 30 cycles of 92°C for 1min, 56°C for 1min, and 72°C for 1min and 30s., De versterking efficiëntie werd gecontroleerd door elektroforese in een 2% agarose gel gekleurd met SYBR veilig.
bepaling van de minimale remmende concentratie (mic) door de E-test
de in vitro gevoeligheid van CoNS-stammen werd getest op de volgende antimicrobiële stoffen: Oxacilline, Vancomycine, Daptomycine, Linezolide, Quinupristine/Dalfopristine en Tigecycline. De MIC van deze geneesmiddelen werd bepaald door de E-test. De criteria voor de gevoeligheidsclassificatie waren: Oxacilline
µg / mL (gevoelig) voor CoNS, behalve S., lugdunensis (gevoelig ≤2µg/mL en resistent ≥4µg/mL), Vancomycine µg/mL (gevoelig), 8–16µg/mL (intermediair resistent), en >32µg/mL (resistent); Linezolid ≤4µg/mL (gevoelig); Daptomycin ≤1µg/mL; Quinupristin/Dalfopristine ≤1µg/mL (gevoelig), 2µg/mL (intermediair), en ≥4µg/mL (resistent); Tigecycline ≤0.5 µg/mL.,13 screeningtest voor de detectie van verminderde gevoeligheid voor vancomycine
om verminderde gevoeligheid voor vancomycine te detecteren, werd een screeningagar-test gebruikt, bereid met Brain Heart Infusion (Bhi) Agar en 4µg/mL, 6µg/mL, 8µg/mL en 16µg/mL vancomycine. De referentiestam S. aureus ATCC 29213, gevoelig voor vancomycine, werd gebruikt als negatieve controle, en stam E. faecalis ATCC 51299, resistent tegen vancomycine, als positieve controle. Vlekken van een 2.,0 McFarland entmateriaal werd aan de agarplaat toegevoegd en gedurende 24 uur bij 35°C geïncubeerd, en het kweken van ten minste één kolonie werd als een positief resultaat beschouwd.
analyse van de celwanddikte
De CoNS-stammen die een verminderde gevoeligheid voor vancomycine vertoonden, werden onderworpen aan de transmissie elektronische microscopie voor de analyse van de celwanddikte. Stammen werden gekweekt in bhi bouillon en geïncubeerd bij 37° C gedurende 24 uur. in een microbuis werd 1000µL van een CoNS cultuur bouillon gecentrifugeerd gedurende één minuut bij 12.000 rpm. Na verwijdering van het supernatant werden de stammen gefixeerd in een Karnovsky-oplossing (2.,5% glutaaraldehyde in fosfaatbuffer 0,1 M) gedurende vier uur. Monsters werden uit de fixer gehaald en gedurende vijf minuten driemaal in gedestilleerd water gewassen. Vervolgens werden de monsters gedurende 40 minuten ondergedompeld in 0,5% osmiumtetroxide, voordat ze driemaal gedurende 10 minuten in gedestilleerd water werden gewassen. Monsters werden gedehydrateerd met behulp van toenemende concentraties alcohol: twee keer gedurende 10 minuten in 7.,5% alcohol; twee keer voor 10min in 15% alcohol; twee keer voor 10min in 30% alcohol; twee keer voor 10min in 50% alcohol; drie keer voor 15min in 70% alcohol; twee keer voor 15min in 90% alcohol; twee keer voor 10min in 100% alcohol. Na de uitdroging werden de stubs gemonteerd en de monsters gemetalliseerd. De analyses werden uitgevoerd in een elektronische microscopie Tecnai Spirit FEI Company en de beelden werden verkregen bij een vergroting van 30000×.,
Resultsidentificatie van isolaten
Tabel 1 geeft de bron van de CoNS-soortisolaten weer, evenals de demografische gegevens van de patiënten met bacteriëmie.
detectie van mecA gen en karakterisering van SCCmec bepaling van de minimal inhibitory concentration (MIC)
De Mic ‘ s van de antimicrobiële stoffen die worden gebruikt voor de behandeling van CoNS-infecties werden bepaald door de E-test. Oxacilline resistentie werd gevonden in 206 (68,7%) CoNS stammen en 25 waren tigecycline resistent (8,3%). Resistentie tegen tigecycline werd waargenomen bij 4,5% van S. epidermidis, 13,8% van S. hemolyticus, 13% van S., hominis en 11,1% van S. lugdunensis. Voor quinupristine / dalfopristine vertoonde één isolaat van S. epidermidis een gemiddelde resistentie met een MIC van 2µg/mL, en één isolaat van S. epidermidis en één isolaat van S. hemolyticus met MICs van 3µg/mL. De gevoeligheid en specificiteit van de oxacilline MIC door de E-test vergeleken met de aanwezigheid van mecA waren respectievelijk 87,4% en 82,3%.
met betrekking tot CoNS-soorten toonde de parameterdistributie van MIC50 en MIC90 hoge percentages van oxacilline-resistentie aan bij S. hemolyticus., Dit was de enige CoNS-soorten waarvoor de minimale concentratie om 50% van de isolaten te remmen >256µg/mL was, wat de hoge resistentiegraad van S. hemolyticus tegen oxacilline weerspiegelde (Tabel 3).
het MIC-bereik van elk antimicrobieel middel werd vergeleken met het SCCmec-type. De isolaten getypt als SCCmecI presenteerden hogere tigecycline MICs en die geclassificeerd als SCCmecII presenteerden de hoogste Oxacilline MICs. De SCCmecIV-stammen vertoonden de hoogste MIC-waarden voor vancomycine, linezolide, daptomycine en quinupristine/dalfopristine (Tabel 4).
Determination of the MIC range according to SCCmec.
| MIC range (μg/ml) | ||||
|---|---|---|---|---|
| Antimicrobial | SCCmec I | SCCmec II | SCCmec III | SCCmec IV |
| Oxacillin | 0.094≥256 | 6≥256 | 0.,125≥256 | 0.125≥256 |
| Vancomycin | 0.25–2 | 0.38–2 | 0.125–2 | 0.75–2 |
| Linezolid | 0.064–1 | 0.19–0.5 | 0.047–0.75 | 0.064–1 |
| Daptomycin | 0.016–025 | 0.016–0.094 | 0.019–0.5 | 0.047–0.75 |
| Quinupristin/Dalfopristin | 0.025–1.5 | 0.094–0.5 | 0.064–1 | 0.125–2 |
| Tigecycline | 0.016–2 | 0.023–0.75 | 0.016–0.75 | 0.,032-1 |
MIC, minimale remmende concentratie.
een evaluatie werd uitgevoerd van de Oxacilline-en vancomycine-MICs over een periode van 20 jaar, verdeeld in drie perioden volgens de verdeling van het oxacilline-en vancomycine-mic-bereik. Voor oxacilline werden in de eerste periode (1990-2001) hogere MIC-waarden waargenomen, maar die wijzen nog steeds op gevoeligheid., In de andere perioden (2002-2006 en 2007-2009) werd een afname van de MIC-waarden waargenomen, die nog steeds wijst op gevoeligheid, evenals een toename van de resistentiepercentages. Wat vancomycine betreft, toonde dezelfde evaluatie significante verschillen aan in de drie perioden tussen stammen met MICs van 0,047 µg / mL tot 0,38 µg/mL en van 0,5 µg/mL tot 2,0 µg / mL (Fig. 1).
bepaling van de verminderde gevoeligheid voor vancomycine
een groei van 214 (71,3%) stammen werd waargenomen op de bhi-plaat met 4µg/mL vancomycine, 89 (29,7%) op de plaat met 6µg/mL vancomycine en 8 (2.,6%) isolaten op de 8µg / mL vancomycine plaat. Geen van de isolaten groeide in het medium met 16µg / mL vancomycine. Er waren geen significante verschillen in MICs tussen stammen die geen groei vertoonden op de plaat aangevuld met vancomycine en stammen die groeiden op de 4µg/mL vancomycine plaat. Onder degenen die groei op het medium met 6µg/mL vancomycine toonden, was het MIC bereik 0,5-2µg / mL. Onder die die op 8µg/mL vancomycine groeiden, was de mic waaier 0.75-24µg / mL. De stammen geteeld op 8µg/mL vancomycine waren vier S. epidermidis, één S. hemolyticus, twee S. hominis en één S., capitis, alle resistent tegen oxacilline, en S. epidermidis en S. capitis dragers van SCCmec III, S. hominis van SCCmec I, en S. hemolyticus met niet-getypt SCCmec.
analyse van de celwanddikte van stammen met verminderde gevoeligheid voor vancomycine
De celwanddikte onder celdeling werd gemeten in acht stammen (waarden worden weergegeven in nanometers, gemiddelde±SD). De vier stammen van S. epidermidis gaven gemiddelde waarden van 21.66±1.4, 20.12±0.9, 24.24±1.3, en 14,20±1,3 nm. Het isolaat van S. hemolyticus vertoonde een celwanddikte van 24,88±1,7 nm. Voor de S., capitis isolaat, de celwanddikte was 19,33±1,8, en voor de twee S. hominis isolaten waren de waarden 17,68±2,1 en 24,92±1,5. Ter vergelijking: de gebruikte referentiestammen S. epidermidis ATCC 12228 en S. hemolyticus ATCC29970 vertoonden celwanddiktes van respectievelijk 14,61±1,2 en 14,73±0,7 nm. De vergelijking van de bestudeerde stammen met de controlegroepen toonde hogere waarden aan, variërend van 17 nm tot 24,92 nm, met uitzondering van één isolaat van S. epidermidis, dat een lagere waarde had dan de controlegroepen (Fig. 2).,de mogelijke evolutie van bacteriëmie naar andere infecties, zoals sepsis, pneumonie, urineweginfectie, meningitis, peritonitis, necrotiserende enterocolitis, omphalitis en hersenabces, werd gevolgd bij 52 patiënten die werden opgenomen in de neonatale afdelingen. Van deze patiënten werd bij 25 (46,3%) patiënten bevestigd dat dezelfde nadelen geïsoleerd uit bloedkweek het etiologische agens van de infectie zijn. Bij zes (11,1%) waren CoNS de mogelijke oorzaak van infectie en bij 23 (42,6%) CoNS was geen verband met de infectie van de patiënt (Fig. 3).,
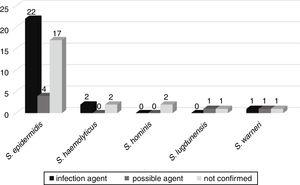
correlatie van CoNS geïsoleerd uit bloedculturen als mogelijke etiologische agentia van infecties veroorzaakt bij neonatale patiënten.
het Meca-gen werd gedetecteerd bij 33 (61,1%) van deze nadelen, met 20 (60,6%) nadelen geassocieerd met ernstigere infecties of mogelijke agentia van deze infecties.
discussie
De CoNS worden beschouwd als een van de belangrijkste oorzaken van bacteriëmie., Het belang van deze bacteriën is de afgelopen jaren toegenomen in de ziekenhuisomgeving, voornamelijk als gevolg van antimicrobiële resistentie. In het huidige werk, 300 CoNS stammen geïsoleerd uit bloed culturen van patiënten in het Ziekenhuis van klinieken van Botucatu, over een periode van 20 jaar, werden bestudeerd. Deze isolaten werden gekarakteriseerd met betrekking tot hun antimicrobiële gevoeligheid.
De Meca-detectie bepaalde oxacilline-resistentie bij 78,5% van de CoNS, en de MIC50-waarde (2µg/mL) was indicatief voor resistentie tegen dit geneesmiddel, wat de lage gevoeligheid van deze bacteriën voor β–lactammiddelen bevestigt., Eerdere werken hebben aangetoond dat sinds de jaren 1970 de CoNS isolaten hogere oxacilline resistentiepercentages hebben gepresenteerd dan S. aureus.14,15 De β-lactam resistentiepercentages variëren van 65% tot 95% in ziekenhuizen in Brazilië en in andere landen.2,16,17 de hoogste percentages van oxacilline resistentie werden gevonden bij S. epidermidis, gevolgd door S. hemolyticus, S. hominis en S. capitis. Vergelijkbare resultaten werden beschreven in eerdere studies, die oxacilline resistentie lieten zien bij 97% van S. epidermidis tussen 1999 en 2001 op een neonatale intensive care unit (NICU),18 bij 96% van S., hemolyticus geïsoleerd in Brazilië, 19 en in 100% van S. hominis geïsoleerd in een NICU uit Spanje.Met betrekking tot S. capitis werden afwijkende resultaten gevonden in de onderzoeken uitgevoerd door Caierão et al.21
hoewel met een lagere frequentie, werd het Meca gen gedetecteerd in S. warneri en S. lugdunensis. S. warneri is beschreven met percentages van 33,3% van de oxacillineresistentie in NICUs,22 en de eerste beschrijving van mecA in S. lugdunensis was in de studie uitgevoerd door Kawaguchi et al.23 ondanks de lage resistentiepercentages, 24 bepaling van antimicrobiële gevoeligheid van S., lugdunensis is belangrijk, niet alleen vanwege de klinische implicaties, omdat deze soort is de meest agressieve van de nadelen, maar ook voor de oprichting van vroege behandeling met adequate antimicrobiële middelen en goede klinische resultaten.25
de karakterisering van het SCCmec toonde de aanwezigheid van type I-IV in de isolaten, waarbij SCCmecIII het vaakst werd aangetroffen in de bestudeerde stammen, voornamelijk bij S. epidermidis, de enige soort die type IV droeg., SCCmec type III is de grootste van hen allen, codificeert voor verscheidene weerstand-geassocieerde genen, en is het meest meestal geà soleerde CoNS van het ziekenhuis specimens. S. epidermidis is de belangrijkste kolonisator van de menselijke huid en wordt het vaakst aangetroffen op infectieplaatsen. De selectieve druk in de ziekenhuisomgeving leidt tot verspreiding van sccmec III stammen, die geassocieerd worden met ernstige infecties.26 SCCmec type IV is gerelateerd aan in de gemeenschap geassocieerde Staphylococcus spp., en werd voor het eerst beschreven in een stam van S. epidermidis, een feit dat de overdracht van S. impliceert., epidermidis aan S. aureus. Een lagere kostenoverdracht van SCCmec IV vanwege zijn geringe omvang zou waarschijnlijk leiden tot een hogere incidentie van infecties veroorzaakt door sccmec IV dragers.12,27 SCCmecII presenteerde een associatie met S. hemolyticus, vergelijkbaar met de bevindingen van Machado et al., 12 waarvan het werk alleen type II bij deze soort ontdekte.
Het alternatief voor de behandeling van oxacilline-resistente stafylokokken is vancomycine, een glycopeptide dat in 1958 voor het eerst werd gebruikt bij invasieve infecties. Er zijn echter beschrijvingen van resistentie en verminderde gevoeligheid voor dit medicijn,6 hoewel onstabiel.,28 de resultaten van het huidige werk toonden aan dat, met uitzondering van oxacilline, vancomycine het geneesmiddel was met de hoogste waarden van MIC50 en MIC90. Ondanks de volledige gevoeligheid van de verzameling waren de MIC-waarden de hoogste in de periode van 20 jaar, en verminderde gevoeligheid werd gedetecteerd in sommige stammen van S. epidermidis, S. hemolyticus, S. hominis en S. capitis. In de studies uitgevoerd door Natoli et al.Verminderde gevoeligheid voor vancomycine werd aangetoond met een frequentie van 5,4% bij CoNS-isolaten, in S. epidermidis en S. hemolyticus-species., Volgens dezelfde auteurs, Staphylococcus kolonies gekweekt op vancomycine agar kan leiden tot glycopeptide heteroresistance, die een voorloper van glycopeptide resistentie kan zijn, waardoor gecompliceerde infecties en behandeling falen. Hiermee moet rekening worden gehouden bij therapeutische beslissingen.
de toename van het aandeel oxacilline resistente CoNS en de afname van hun gevoeligheid voor vancomycine benadrukken het belang van studies waarbij andere therapeutische keuzes betrokken zijn., Tigecycline, een grampositieve en negatieve breedspectrum semisynthetische glycylcycline,wordt beschouwd als een geneesmiddel met uitstekende activiteit tegen oxacillinegevoelige en resistente CoNS,14, 29 ondanks onze gegevens die percentages van 8,3% van de resistentie laten zien, meestal in S. hemolyticus, gevolgd door S. hominis, S. lugdunensis en S. epidermidis. Vergelijkbare MIC90 resultaten werden beschreven voor tigecycline, zonder verschil tussen oxacilline resistente en gevoelige CoNS.31 in de studies uitgevoerd door Natoli et al.Tigecycline vertoonde een goede werking tegen CoNS., Volgens deze auteurs wordt tigecycline niet aanbevolen voor de behandeling van bacteriëmie en dient het gebruik ervan beperkt te zijn om de activiteit tegen multiresistente gramnegatieve bacteriën te behouden. Mutaties in het ribosomale gen S10 en rpsj en mepA genen lijken geassocieerd te zijn met tigecycline resistentie.32,33
Quinupristine / dalfopristine is een streptogramine behorend tot de macrolide-lincosamide-streptograminegroep., De combinatie van quinupristine en dalfopristine is synergetisch en meestal bacteriedodend wanneer deze middelen afzonderlijk worden vergeleken of worden vergeleken met soortgelijke macrolide antimicrobiële stoffen.In dit werk werd, ondanks de uitstekende werkzaamheid bij de meerderheid van de bestudeerde CoNS, intermediaire resistentie tegen dit geneesmiddel gedetecteerd in twee S. epidermidis en één S. hemolyticus. In de studie uitgevoerd door Mendes et al., 35 quinupristine / dalfopristine bleek een uitstekende werkzaamheid voor CoNS, de stammen waren volledig gevoelig, met MIC90-waarden van 0,38 µg / mL voor de oxacilline-gevoelige stammen en 0.,75µg / mL voor de oxacilline resistente stammen. Bovendien, Venkatesh et al.Beschreven goede werkzaamheid van quinupristine / dalfopristine voor oxacilline resistente en gevoelige stammen.
Daptomycine, een antimicrobieel middel dat decennialang werd bestudeerd, werd in 2006 weer in gebruik genomen voor de behandeling van bacteriëmie en endocarditis veroorzaakt door Staphylococcus.In dit onderzoek toonde daptomycine een uitstekende werkzaamheid voor CoNS-isolaten, met lage MIC50-waarden. Olivares et al.37 controleerden ook de gevoeligheid van alle Con ‘ s voor daptomycine, met een lage variatie in de MIC-waarden., In een werk bestuderen 1126 CoNS, uitgevoerd door Critchley et al.Daptomycine was actief op een MIC-bereik van 0,015 tot 2,0 µg/mL en de MIC90 was 0,5 µg / mL. Volgens deze auteurs waren de meest actieve stoffen in deze analyses daptomycine en quinupristine/dalfopristine, wat de relevantie van deze antimicrobiële stoffen benadrukt bij de behandeling van infecties veroorzaakt door CoNS.
Linezolid, een synthetisch oxazolidinon dat mogelijk actief is tegen verschillende bacteriën, is een ander geneesmiddel dat een goede werkzaamheid tegen CoNS heeft aangetoond.,Linezolid is belangrijk geworden voor de therapeutische behandeling van chronische infecties door CoNS, ondanks de beschrijving van resistentie. In Brazilië werd het eerste geval van linezolide resistentie beschreven in 2006, op een klinisch isolaat van MRSA40 en, onder de nadelen, in S. epidermidis, S. hominis en S. hemolyticus.41 in het werk van Olivares et al., 37 ondanks de detectie van zeven linezolide resistente stammen, dit medicijn gepresenteerd effectieve MIC waarden in CoNS stammen. Aan de andere kant, een uitbraak van linezolide resistente S., epidermidisklonen met mutaties in ribosomale eiwitten L3 en L4, evenals het CFR-plasmide, dat onlangs in Frankrijk is geïdentificeerd, zijn gemeld.42
S. hemolyticus was de soort met de hoogste oxacilline MIC waarden, en concentraties hoger dan 256µg/mL waren nodig om 50% van de isolaten te remmen. Evenals voor oxacilline, presenteerde deze soort hogere MIC waarden voor tigecycline en de meeste geteste antimicrobiële stoffen. Verscheidene werken tonen hoge tarieven van weerstand tegen de antimicrobiële middelen die voor de behandeling van besmettingen worden gebruikt die door S. worden veroorzaakt., hemolyticus, vooral methicilline en glycopeptiden. Sommige auteurs beschrijven een hoge prevalentie van genen die coderen resistentie tegen β-lactam en aminoglycoside agenten,evenals een significant deel van isolaten met MIC waarden dicht bij de weerstand breekpunt, 43, 44 benadrukken het belang van S. hemolyticus als een multiresistant pathogeen.
De Associatie van het MIC-bereik met de SCCmec-typen toonde hogere Mic ‘ s aan voor vancomycine, linezolid, daptomycine en quinupristine/dalfopristine bij S. epidermidis die SCCmecIV droeg., De genen met betrekking tot resistentie tegen deze antimicrobiële stoffen worden gemedieerd door plasmiden, meestal gevonden in methicilline resistente stammen met ziekenhuis oorsprong.45 SCCmec IV is kenmerkend voor isolaten uit de gemeenschap, vooral vanwege de omvang en de lage aanpassingskosten. Studies suggereren dat de verwerving van resistentiegenen niet-klinische oorsprong in het milieu heeft, gezien de hoge diversiteit van resistentiegendragers in het natuurlijke milieu.46,47 verder werd SCCmecIV alleen gedetecteerd bij S. epidermidis, die als meest voorkomende soort in de menselijke huid het meest wordt beïnvloed door selectieve druk., De hogere MICs in vergelijking met andere antimicrobiële stoffen kunnen ook worden gerelateerd aan de selectieve druk, aangezien het niveau van blootstelling aan deze geneesmiddelen in het ziekenhuismilieu de selectie van verminderde gevoeligheid en resistente stammen zou beïnvloeden, aangezien verscheidene veranderingsgebeurtenissen, genetische recombinatie, en wijzigingen in de microbiële fysiologie nodig zijn om fenotypische veranderingen te produceren.,48
metabole en fysiologische modificaties gerelateerd aan selectieve druk konden worden waargenomen bij stammen gekweekt op 8µg/mL vancomycine agar, aangezien de verdikking van de celwand werd gevonden in de meeste CoNS isolaten als gevolg van verhoogde peptidoglycansynthese. Dit mechanisme is voordeliger voor tegens dan de verwerving van het van operon, dat een mediator van vancomycine resistentie is. Het van-operon wordt verkregen door horizontale genoverdracht en de expressie ervan wordt alleen gestimuleerd in aanwezigheid van glycopeptide., Deze stimulus veroorzaakt een zeer hoge adaptieve kosten in de aanwezigheid van vancomycine, nadelig voor de nadelen in een vancomycine medium.48,49 met betrekking tot de verwerving van andere resistentiegenen in CoNS, zoals het Meca-gen, worden de initiële aanpassingskosten verzacht door compenserende extra mutaties voor de resistentiekosten. Recent is aangetoond dat punctuele mutaties in genen zoals vraR geassocieerd zijn met verminderde gevoeligheid voor vancomycine en verdikking van de celwand bij stafylokokken.,Deze studie toonde een hoog percentage door CoNS veroorzaakte bacteriëmie aan bij neonatale en pediatrische eenheden, waarbij kinderen jonger dan één jaar betrokken waren, met als belangrijkste middelen S. epidermidis, S. hemolyticus, S. hominis, S. lugdunensis en S. warneri. S. capitis werden Niet geïsoleerd in deze eenheden, zijnde agentia van bacteriëmie bij volwassenen opgenomen in de interne geneeskunde afdeling, gastro-enterologie, neurologie, en eerste hulp.,
aangezien het onderzoek betrekking had op bacteriëmie veroorzaakt door gedurende meer dan 30 jaar geïsoleerde stafylokokken, konden veel van de gegevens in verband met de medische dossiers van patiënten niet worden opgehaald, zodat het niet mogelijk was om de infectieresultaten van alle patiënten te associëren, wat een beperking is van het huidige onderzoek. Gegevens verkregen van patiënten in neonatale eenheden duidden op het klinische belang van CoNS bacteriëmie, die kan evolueren naar ziekten die gespecialiseerde zorg vereisen.
kennis van antimicrobiële resistentie is van groot belang voor de juiste behandeling van infecties veroorzaakt door CoNS., Bovendien zijn de virulentiefactoren van deze bacteriën en de immuniteit van patiënten factoren die bijdragen aan het vermogen van het micro-organisme om ernstigere infecties te veroorzaken.
de resultaten van onze studie van 20 jaar toonden een hoge frequentie van antimicrobiële resistentie aan bij CoNS, wat het overmatig gebruik van deze geneesmiddelen weerspiegelt., Naast de metabole en fysiologische wijzigingen die kunnen leiden tot verminderde gevoeligheid voor antimicrobiële stoffen, maken hun conditie als menselijke commensale bacteriën hen ideale transporters en een efficiënt reservoir van resistentiegenen, vooral de low-cost elementen, zoals SCCmec.45 de antimicrobiële stoffen die de beste resultaten opleverden, moeten op zodanige wijze worden gebruikt dat hun werkzaamheid behouden blijft en resistentie wordt voorkomen.,
belangenconflicten
De auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.