Inleiding
Posterior reversible encephalopathy syndrome (PRES), voor het eerst beschreven door Hinchey et al. in 1996, vertegenwoordigt een neurologische aandoening met gevarieerde klinische presentatie en typische beeldvorming bevindingen van parieto-occipitale overheersende patroon van vasogeen oedeem (1, 2). Er zijn tal van gedocumenteerde oorzaken van PRES, met gevallen eerst beschreven in de setting van verhoogde arteriële druk., Voorbeelden van klinische scenario ‘ s waarin PRES kan worden gezien zijn onder andere: hypertensieve noodsituatie, (pre)eclampsie, nierziekte, auto-immuunziekten en cytotoxische geneesmiddelen (3, 4) (Tabel 1). PRES kan in elke leeftijdsgroep voorkomen en komt vaker voor bij vrouwelijke patiënten (7, 8). Hoewel de huidige literatuur relatief schaars is in vergelijking met volwassen populaties, moet bijzondere vermelding worden gemaakt van PRES bij de pediatrische patiënt., Pediatrische patiënten hebben een vergelijkbare klinische presentatie als de volwassen populatie, met hypertensie, epileptische aanvallen, en veranderde mentale status zijn gemeenschappelijke manifestaties van de ziekte (9). Ondanks de meeste gevallen van pediatrische PRES worden gemeld bij oncologie patiënten, met name de post-stamceltransplantatie patiënten (10, 11), een studie door Gupta et al. (12) vond dat de nierziekte misschien de gemeenschappelijkste oorzaak van PRES in de pediatrische patiënt was. In hun studie vertoonden pediatrische patiënten meer atypische beeldvormingsbevindingen (62,5%), waaronder betrokkenheid van de frontale kwab (56%).,
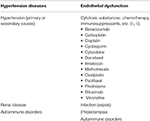
Tabel 1. Belangrijke ziektetoestanden geassocieerd met PRES.
klinische manifestaties zijn acuut tot subacuut en variëren van hoofdpijn en visuele stoornissen tot veranderde bewustzijnsniveaus en aanvallen in ernstigere gevallen (1). De behandeling is over het algemeen gericht op de onderliggende oorzaak, met in de meeste gevallen over het algemeen reversibele symptomen en beeldvormende bevindingen (8)., Hoewel de resultaten over het algemeen gunstig zijn met het juiste beheer, zijn de slechte klinische resultaten geassocieerd met reeds bestaande diabetes mellitus, en betrokkenheid van het corpus callosum; nochtans, ontbreken andere betrouwbare weergavebiomarkers voor prognostication momenteel (13). Neuroradiologische beeldvorming speelt een fundamentele rol bij de diagnose van PRES met de typische beeldvormingskenmerken die het best worden gewaardeerd op magnetic resonance imaging (MRI) (2).
Pathofysiologie
het exacte pathofysiologische mechanisme(n) achter PRES is (zijn) nog niet volledig opgehelderd en blijft controversieel (3)., Er zijn momenteel twee belangrijke voorgestelde mechanismen voor de pathofysiologie van PRES (figuur 1). De eerste theorie stelt verhoogde arteriële druk als primaire factor voor (8). De snelle stijgingen van de bloeddruk overwinnen uiteindelijk de autoregulatoire mogelijkheden van de cerebrale vasculatuur die vasculaire lekkage en resulterend vasogeen oedeem veroorzaken (14). Er is een eventuele bloed-hersenbarrière (BBB) disfunctie met eiwitten die door de tight-junction (15)., De gebieden die door de posterieure circulatie (vertebrale slagaders, basilaire slagaders, en posterieure cerebrale slagaders) worden geleverd, lopen een uitzonderlijk risico in vergelijking met de anterieure circulatie (interne halsslagaders, midden cerebrale slagaders, en anterieure cerebrale slagaders) als gevolg van het gebrek aan sympathische tonus van de basilaire slagaders vasculatuur (8)., Een verwante theorie die door sommige postulaten wordt voorgesteld dat extreme hypertensie in vasospasme en lokale ischemie resulteert die BBB-afbraak en resulterend vasogeen oedeem veroorzaakt, zoals werd waargenomen bij patiënten die met immunosuppressiva ciclosporine A en FK-506 worden behandeld (16). De verstoring in de BBB veroorzaakt de typische bevindingen van vasogeen oedeem Versus cytotoxisch oedeem (dat kan worden gezien in de setting van acuut infarct en vertegenwoordigt verhoogd intracellulair watergehalte als gevolg van verlies van de gebruikelijke osmotische gradiënt in de setting van celdood (17).,
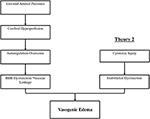
figuur 1. Twee belangrijke theorieën over de pathofysiologie van PRES. Theorie 1 is de hypertensieve en cerebrale hyperperfusie theorie en theorie 2 is de endotheliale dysfunctie theorie.
de tweede belangrijke theorie behandelt het feit dat tot 30% van de patiënten met PRES niet de verhoogde arteriële druk vertonen die nodig is om de autoregulatoire controle van de cerebrale vasculatuur te overschrijden (18, 19)., Deze theorie stelt voor dat endothelial dysfunctie de primaire boosdoener is, die door diverse endogene of exogene toxines kan worden veroorzaakt (20). Deze theorie kan de bevindingen van PRES verklaren die worden gezien bij patiënten die immunosuppressieve medicijnen en/of chemotherapie krijgen en ook bij patiënten met sepsis (21, 22). In dit model veroorzaken circulerende toxines vasculaire schade met resulterende ontwikkeling van vasogeen oedeem. De endotheliale schade veroorzaakt verdere afgifte van vasoconstrictieve en immunogene middelen, die vasospasme en/of verhoogde vasculaire permeabiliteit kunnen veroorzaken., Uiteindelijk is endotheliale dysfunctie die vasculaire lekkage en vasogeen oedeem mogelijk maakt de drijvende factor achter PRES, ongeacht de primaire cerebrale vasculatuur afwijking (in het geval van arteriële hypertensie) of secundair aan circulerende toxines. Een samenvatting van deze twee theorieën en een lijst van eerder gemelde chemotherapeutica en andere immunosuppressiva zijn weergegeven in Figuur 2.
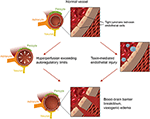
Figuur 2. Illustratie van de twee belangrijkste theorieën van de onderliggende pathofysiologie van PRES., Dankbetuiging: met dank aan Caroline O ” Driscoll, MA (ze illustreerde dit op haar eigen en is een medewerker van onze universiteit).
klinische manifestaties hangen af van de betrokken regio (‘s) van de hersenen; de presentatie kan dus breed zijn. Bijvoorbeeld, primaire betrokkenheid van de occipitale kwabben kan resulteren in visuele stoornissen/hallucinaties. Focale neurologische afwijkingen die overeenkomen met de locatie van focale laesies komen voor bij ~5-15% van de patiënten met PRES (23)., In zeldzame gevallen kan betrokkenheid van het ruggenmerg leiden tot klinische tekenen en symptomen van myelopathie of verlamming (24).
beeldvorming
zoals de naam al doet vermoeden, manifesteert PRES zich in beeldvormingsstudies meestal als posterieur-overheersend vasogeen oedeem van de witte stof. De pariëtale en occipitale kwabben zijn bijna universeel betrokken en de bevindingen zijn typisch symmetrisch en bilateraal (1). Betrokkenheid van de frontale kwabben, in het bijzonder grenzend aan de superieure frontale sulci, wordt ook vaak gezien., Vasogeen oedeem, hoewel het de cerebrale grijze stof kan betrekken, wordt vaak gemakkelijker gewaardeerd in de subcorticale witte stof. CT-onderzoek is vaak de eerste beeldvormingstest bij het instellen van acute neurologische symptomen en kan hypoattenuatie van witte stof in getroffen gebieden aantonen (25) (Figuur 3: CT van PRES). Over het algemeen worden de bevindingen het best weergegeven met MRI, die een verhoogde gevoeligheid en een betere anatomische karakterisering vertoont in vergelijking met CT (26). Daarnaast kan MRI helpen om andere pathologische toestanden te onderscheiden die zich klinisch op dezelfde manier kunnen manifesteren als PRES., Met name de T2-gewogen en T2-FLAIR (fluid-attenuated inversion recovery) sequenties zijn het nuttigst om vasogeen oedeem op MRI te detecteren (Figuur 4: MR of PRES; Figuur 5: MR of PRES Coronal).
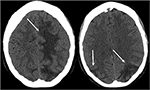
Figuur 3. Patiënt met systemische lupus erythematosus en snel progressieve glomerulonefritis met convulsies. Niet-contrast CT beelden van het hoofd toont vasogeen oedeem in de bilaterale pariëtale en occipitale kwab, links groter dan rechts, evenals uitbreiding in de linker frontale kwab.,
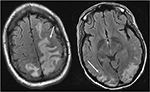
Figuur 4. Patiënt met systemische lupus erythematosus en snel progressieve glomerulonefritis met convulsies. T2-FLAIR beelden van het hoofd toont vasogeen oedeem in de bilaterale pariëtale en occipitale kwab, links groter dan rechts, evenals uitbreiding in de linker frontale kwab. Merk op dat met het vasogene patroon van oedeem, is er sparen van signaalafwijking in de cortex.
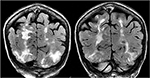
Figuur 5., Patiënt met een voorgeschiedenis van primaire myelofibrose en beenmergtransplantatie op Tacrolimus, waarbij voor het eerst convulsies optreden. Coronale T2-FLAIR sequenties vertonen uitgebreide signaalafwijking in de bilaterale occipitale en pariëtale kwabben, zoals typisch is voor PRES.
de differentiaaldiagnose voor PRES is breed en omvat entiteiten met een vergelijkbare samenvloeiende T2 witte stof hyperintensiteit., Voorbeelden hiervan zijn: ischemie/infarct (met name posterieure circulatie), demyeliniserende aandoeningen, infectieuze etiologieën (meningitis, encefalitis), progressieve multifocale leuko-encefalopathie (PML), vasculitis en diverse metabole stoornissen (27). Een klinisch gerelateerde entiteit genaamd reversible cerebral vasoconstriction syndrome (RCVS) wordt vermoedelijk veroorzaakt door veranderingen in de cerebrale vasculaire tonus die resulteren in vasoconstrictie., RCVS manifesteert zich als terugkerende thunderclap hoofdpijn, epileptische aanvallen, beroerte en niet-aneurysmale subarachnoïdale bloeding (28), die op klinische basis kan worden verward met PRES. Deze entiteit treedt meestal op in de postpartumperiode of na blootstelling aan adrenerge of serotonerge geneesmiddelen. RCV ‘ s kunnen typisch worden gediagnosticeerd met angiografische studies die multifocale gebieden van vernauwing aantonen waarbij de cerebrale slagaders betrokken zijn (29). Deze diagnose kan worden verward met het feit dat RCV ‘ s en PRES vaak gelijktijdig optreden, waarvan de neuroradioloog op de hoogte moet zijn om een verkeerde diagnose te voorkomen (30).,
PRES kan typisch worden onderscheiden van acute ischemie omdat deze laatste steevast cytotoxisch oedeem en diffusiebeperking vertoont. Beperkte diffusie in acute ischemie kan gemakkelijk worden gedetecteerd op diffusie-gewogen beeldvorming (DWI) en schijnbare diffusiecoëfficiënt (ADC) als een hyperintense signaal op DWI met overeenkomstige verminderde signaal op ADC (als gevolg van de relatief verminderde beweging van intracellulaire watermoleculen)., Vasogeen oedeem in de PRES-omgeving kan daarentegen een hyperintensensignaal op DWI vertonen dat niet gepaard gaat met een overeenkomstig verminderd signaal op ADC (31). Bovendien, neigt de scherpe ischemie unilateraal en binnen een enkelvoudig vasculair grondgebied te zijn. Hoewel het beoordelen van diffusiebeperking om PRES te onderscheiden van ischemische abnormaliteit over het algemeen betrouwbaar is, zijn er zeldzame gevallen van PRES die geassocieerd kunnen worden met gebieden met diffusiebeperking die worden gesuperponeerd op gebieden met het meer klassiek gezien geïsoleerde vasogeen oedeem.,
“geavanceerde” beeldvormingstechnieken in PRES zijn onlangs beschreven als een hulpmiddel bij moeilijke of onduidelijke gevallen. Deze geavanceerde beeldvormingstechnieken omvatten: CT / MR perfusie, Mr spectroscopie (MRS), Gevoeligheidsgewogen beeldvorming (SWI) en nucleaire geneeskunde technieken, met inbegrip van single-foton emissie tomografie (SPECT) en positron emissie tomografie (PET) met variërende radiotracers. Hoewel een volledige discussie buiten de reikwijdte van dit overzicht valt, kan een verscheidenheid aan beeldvormingsbevindingen worden gezien op deze geavanceerde technieken om een diagnose van PRES te helpen suggereren., Hyperperfusie kan worden waargenomen bij CT / MR-perfusiestudies die zijn aangetoond door een verhoogde cerebrale bloeddoorstroming en bloedvolume met een verminderde tijd tot perfusie en gemiddelde transittijd (32), hoewel gevallen van hypoperfusie zijn gemeld (33). Bij MRS is er in het algemeen een vermindering van de n-Acetylaspartaat (NAA)/Creatine (Cr) en NAA/Choline (Chol) ratio, hetgeen wijst op een verstoring van normale synapsen en neuroaxonale functie (34). SWI kan helpen om de aanwezigheid van bloeding in PRES te identificeren, met een hogere gevoeligheid dan GRE imaging (35)., SPECT / PET-beeldvorming vertoont doorgaans hyperperfusie of hypoperfusie (vergelijkbaar met CT / MR-perfusiestudies) met een laag metabolisme door FDG-PET (36).
bovendien kan PRES worden onderscheiden van andere aandoeningen zoals auto-immune encefalitis in de setting van acute gedissemineerde encefalomyelitis (ADEM) door het voormalige diffuse bilaterale maar asymmetrisch vasogeen oedeem (37)., PML kan een vergelijkbaar uiterlijk hebben in vergelijking met PRES, met een parieto-occipitale predominantie, maar kan worden onderscheiden door zijn meer unilaterale of asymmetrische betrokkenheid, evenals voorliefde voor subcorticale witte stof (38).
atypische Beeldvormingskenmerken
atypische kenmerken van PRES omvatten gebieden met contrastversterking, bloeding of diffusiebeperking (39)., Hoewel de pariëtale en occipitale kwabben over het algemeen betrokken zijn, kunnen atypische gebieden van betrokkenheid worden gezien, waaronder: hersenstam, cerebellum, corpus callosum, en andere cerebrale gebieden, met meer gemeenschappelijke gebieden, waaronder de frontale kwabben (waargenomen in tot 68%) en inferieure temporale kwabben (tot 40%) (23, 40) (Figuur 6: Cerebellum; Figuur 7: hersenstam).
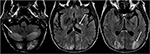
Figuur 6. Patiënt met levertransplantatie 6 weken eerder. De patiënt werd na levertransplantatie gestart met Tacrolimus., T2-FLAIR beelden van de hersenen tonen signaalafwijking in de occipitale kwabben. Er is ook uitgebreide signaalafwijking waargenomen in de bilaterale cerebellaire hemisferen en in de thalami. Deze bevindingen verdwenen snel na het stoppen met Tacrolimus.
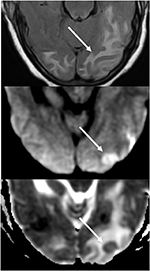
Figuur 7. Patiënt met ongecontroleerde hypertensie met verandering van mentale toestand. T2-FLAIR (boven) beeld toont oedeem in de occipitale kwabben., DWI (Midden) en ADC kaart (onder) beelden toont een kleine pijl van beperkte verspreiding, met hyperintense signaal op DWI en bijbehorende hypointensity op de ADC kaart.
bovendien omvat een vroege bevinding van PRES, die kan voorafgaan aan het typische parieto-occipitale oedeem, milde sulcal FLAIR hyperintensity en leptomeningeale versterking op post-contrast T1 gewogen beelden, zoals beschreven door Nakagawa et al. (41). Benziada-Boudour et al., (42) beschreven een gelijktijdige ontwikkeling van cytotoxisch oedeem, resulterend in beperkte diffusie (Figuur 8: Diffusiebeperking). Inherent aan de naam van het ziekteproces, de bevindingen met betrekking tot PRES zijn meestal reversibel, met normalisatie van klinische en beeldvormende bevindingen zodra de opruiende kwestie wordt behandeld. Echter, in sommige gevallen kunnen gebieden met beperkte diffusie uiteindelijk leiden tot permanent letsel aan het hersenparenchym (figuur 9: laminaire necrose)., Bloedingen komen minder vaak voor bij PRES, in 5-30% van de gevallen, maar moeten worden erkend om deze bevinding niet te verwarren met een andere pathologische entiteit in de juiste klinische setting van PRES (39). Beeldvorming bevindingen in bloeding kan omvatten: focale hematoom, petechiale gyrale bloeding, en / of subarachnoïdale bloeding (43) (Figuur 10: bloeding).
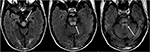
Figuur 8. Patiënt met een voorgeschiedenis van levertransplantatie twee weken eerder op Tacrolimus., T2-FLAIR beelden tonen signaalafwijking in de middenhersenen, pons, en superieure cerebellaire steeltjes.
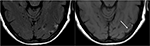
figuur 9. T2-FLAIR (links) beeld bij een patiënt met ongecontroleerde hypertensie en eerdere beeldvorming die wijst op PRES (zie Figuur 6), nu gecontroleerd en 6 weken later, toont het verdwijnen van het eerder waargenomen oedeem. Kleine gebieden van gliose als gevolg van letsel worden gezien in de linker temporale kwab. Axiale non-contrast T1 vertoont kromlijnige corticale laminaire necrose gerelateerd aan het eerdere letsel gerelateerd aan PRES., Hoewel PRES over het algemeen volledig omkeerbaar is, kan het in sommige situaties leiden tot permanent letsel.
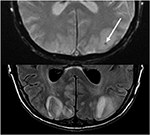
Figuur 10. Patiënt met een voorafgaande levertransplantatie op Tacrolimus. T2 gradiënt herinnerde echo (boven) toont een focaal gebied van bloeding binnen het vasogeen oedeem in de linker occipitale kwab. T2-FLAIR toont de meer typische bevinding gerelateerd aan PRES met signaalafwijking in de bilaterale occipitale kwabben.,
behandeling
behandeling van PRES is doorgaans gericht op het beheersen van de primaire etiologie die PRES veroorzaakt (44). Bijvoorbeeld, in gevallen van verhoogde arteriële druk, is de behandeling gericht op het corrigeren van de verhoogde bloeddruk in een gecontroleerde omgeving, vergelijkbaar met de aanpak voor hypertensieve urgentie/ noodsituatie (45). Typisch, een niet-snelle verlaging van de bloeddruk wordt nagestreefd om het risico van het veroorzaken van ischemische cerebrale ziekte als gevolg van drastische bloeddrukverlaging te vermijden (46)., Af en toe worden anticonvulsiva gebruikt als aanvullende therapie, hoewel het optimale middel(en), de timing en de duur van de behandeling controversieel blijven (4) (Figuur 11: Voor en na).
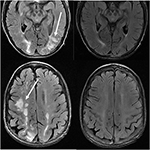
Figuur 11. Patiënt met een voorgeschiedenis van primaire myelofibrose en beenmergtransplantatie op Tacrolimus. Axiale T2-FLAIR beelden tonen de gebieden van signaalafwijking in de pariëtale en occipitale kwab, en rechter frontale kwab (linker beelden)., De Tacrolimus werd gestopt en de vervolgbeelden (rechterfoto ‘ s) werden 6 weken na de eerste beelden verkregen.
in gevallen van (pre)eclampsie is de behandeling gericht op de tijdige bevalling van de foetus, evenals op bloeddrukbeheersing en magnesiumsulfaat voor epileptische aanvallen (47). In de setting van PRES geïnduceerd door chemotherapeutische of andere immunosuppressiva, heeft het geleidelijk afbouwen of absoluut staken van het geneesmiddel zowel klinische als radiologische verbetering aangetoond (48) (Figuur 12: eclampsie)., Hypomagnesiëmie is een gemeenschappelijke bevinding in PRES en een mogelijke etiologische factor. Daarom hebben de auteurs gesuggereerd dat magnesiumsuppletie een nuttige aanvulling kan zijn in het PRES management (49).
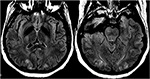
Figuur 12. Patiënt met eclampsie en een aanval. Axiale T2-FLAIR beelden tonen symmetrische signaalafwijking in de bilaterale occipitale kwabben.,
conclusie
PRES is een unieke entiteit met karakteristieke klinische en neuroradiologische bevindingen, naast talloze goed gedocumenteerde oorzaken. Hoewel het exacte pathofysiologische mechanisme(en) achter PRES nog niet is opgehelderd (en inderdaad te wijten kan zijn aan een combinatie van onderling gerelateerde processen), is het algemeen aanvaarde mechanisme een disfunctie van de bloed-hersenbarrière, resulterend in vasogeen oedeem met overheersing van de posterieure circulatie., De weergaveeigenschappen worden het best geëvalueerd op vloeistof-gevoelige Mr opeenvolgingen die parieto-occipitale overheersende witte stof T2 hyperintensities onthullen, hoewel vele atypische weergaveeigenschappen kunnen worden gezien en in mening moeten worden gehouden wanneer het evalueren van uitdagende gevallen. Diverse geavanceerde weergavehulpmiddelen zijn beschikbaar om in moeilijke of twijfelachtige gevallen te helpen. De behandeling is gericht op het beheersen van de onderliggende oorzaak met specifieke aandacht voor bloeddrukmonitoring en mogelijke epileptische profylaxe.,
Auteursbijdragen
belangenconflict
De auteurs verklaren dat het onderzoek werd uitgevoerd in afwezigheid van commerciële of financiële relaties die als een potentieel belangenconflict kunnen worden opgevat.
1. Bartynski WS. Posterieur reversibel encefalopathiesyndroom, deel 1: fundamentele beeldvorming en klinische kenmerken. Am J Neuroradiol. (2008) 29:1036–42. doi: 10.3174/ajnr.,A0928
CrossRef Full Text | Google Scholar
3. Bartynski WS. Posterior reversible encephalopathy syndrome, Part 2: controversies surrounding pathophysiology of vasogenic edema. Am J Neuroradiol. (2008) 29:1043–9. doi: 10.3174/ajnr.A0929
CrossRef Full Text | Google Scholar
5. Singer S, Grommes C, Reiner AS, Rosenblum MK, DeAngelis LM. Posterior reversible encephalopathy syndrome in patients with cancer., Oncologist. (2015) 20:806–11. doi: 10.1634/theoncologist.2014-0149
PubMed Abstract | CrossRef Full Text | Google Scholar
6. How J, Blattner M, Fowler S, Wang-Gillam A, Schindler SE. Chemotherapy-associated posterior reversible encephalopathy syndrome: a case report and review of the literature. Neurologist. (2016) 21:112–7. doi: 10.1097/NRL.,0000000000000105
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Habetz K, Ramakrishnaiah R, Raina SK, Fitzgerald RT, Hinduja A. Posterior reversible encephalopathy syndrome: a comparative study of pediatric versus adult patients. Pediatr Neurol. (2016) 65:45–51. doi: 10.1016/j.pediatrneurol.2016.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Fugate JE, Rabinstein AA., Posterior reversible encephalopathy syndrome: clinical and radiological manifestations, pathophysiology, and outstanding questions. Lancet Neurol. (2015) 14:914–25. doi: 10.1016/S1474-4422(15)00111-8
CrossRef Full Text | Google Scholar
9. Zama, D, Gasperini P, Berger M, Petris M, De Pasquale MD, et al. A survey on hematology-oncology pediatric AIEOP centres: the challenge of posterior reversible encephalopathy syndrome. Eur J Haematol. (2018) 100:75–82. doi: 10.1111/ejh.,12984
CrossRef Full Text | Google Scholar
12. Gupta V, Bhatia V, Khandelwal N, Singh P, Singhi P. Imaging findings in pediatric posterior reversible encephalopathy syndrome (PRES): 5 years of experience from a tertiary care center in India. J Child Neurol. (2016) 31:1166–73. doi: 10.1177/0883073816643409
PubMed Abstract | CrossRef Full Text | Google Scholar
13., Hinduja a, Habetz K, Raina S, Ramakrishnaiah R, Fitzgerald RT. Predictors of poor outcome in patients with posterior reversible encephalopathy syndrome. Int J Neurosci. (2017) 127:134–44. doi: 10.3109 / 00207454.2016.1152966
PubMed Abstract | CrossRef Full Text/Google Scholar
15. MacKenzie ET, Strandgaard S, Graham DI, Jones JV, Harper AM, Farrar JK. Effecten van acuut geïnduceerde hypertensie bij katten op pial arteriolar kaliber, lokale cerebrale bloedstroom, en de bloed-hersenbarrière. Circ Res., (1976) 39:33–41. doi: 10.1161/01.RES.39.1.33
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bartynski WS, Zeigler Z, Spearman MP, Lin L, Shadduck RK, Lister J. Etiology of cortical and white matter lesions in Cyclosporin-A and FK-506 neurotoxicity. Am J Neuroradiol. (2001) 22:1901–14.
PubMed Abstract | Google Scholar
21. Bartynski WS, Boardman JF, Zeigler ZR, Shadduck RK, Lister J., Posterior reversible encephalopathy syndrome in infection, sepsis, and shock. Am J Neuroradiol. (2006) 27:2179–90.
PubMed Abstract | Google Scholar
22. Mayama M, Uno K, Tano S, Yoshihara M, Ukai M, Kishigami Y, et al. Incidence of posterior reversible encephalopathy syndrome in eclamptic and patients with preeclampsia with neurologic symptoms. Am J Obstet Gynecol. (2016) 215:239.e1–e5. doi: 10.1016/j.ajog.2016.02.,039
PubMed Abstract | CrossRef Full Text | Google Scholar
23. McKinney AM, Short J, Truwit CL, McKinney ZJ, Kozak OS, SantaCruz KS, et al. Posterior reversible encephalopathy syndrome: incidence of atypical regions of involvement and imaging findings. Am J Roentgenol. (2007) 189:904–12. doi: 10.2214/AJR.07.2024
PubMed Abstract | CrossRef Full Text | Google Scholar
24., de Havenon A, Joos Z, Longenecker L, Shah L, Ansari S, Digre K. Posterior reversible encephalopathy syndrome with spinal cord involvement. Neurology. (2014) 83:2002–6. doi: 10.1212/WNL.0000000000001026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Dandoy CE, Linscott LL, Davies SM, Leach JL, Myers KC, El-Bietar J, et al., Clinical utility of computed tomography and magnetic resonance imaging for diagnosis of posterior reversible encephalopathy syndrome after stem cell transplantation in children and adolescents. Biol Blood Marrow Transplant. (2015) 21:2028–32. doi: 10.1016/j.bbmt.2015.07.023
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Noda K, Fukae J, Fujishima K, Mori K, Urabe T, Hattori N, et al., Reversible cerebral vasoconstriction syndrome presenting as subarachnoid hemorrhage, reversible posterior leukoencephalopathy, and cerebral infarction. Intern Med. (2011) 50:1227–33. doi: 10.2169/internalmedicine.50.4812
CrossRef Full Text | Google Scholar
31. Doelken M, Lanz S, Rennert J, Alibek S, Richter G, Doerfler A, et al. Differentiation of cytotoxic and vasogenic edema in a patient with reversible posterior leukoencephalopathy syndrome using diffusion-weighted MRI. Diagn Interv Radiol., (2007) 13:125–8.
Google Scholar
32. Wartenberg KE, Parra A. CT and CT-perfusion findings of reversible leukoencephalopathy during triple-H therapy for symptomatic subarachnoid hemorrhage-related vasospasm. J Neuroimaging. (2006) 16:170–5. doi: 10.1111/j.1552-6569.2006.00031.x
CrossRef Full Text | Google Scholar
33. Vanacker P, Matias G, Hagmann P, Michel P., Cerebral hypoperfusion in posterior reversible encephalopathy syndrome is different from transient ischemic attack on CT perfusion. J Neuroimaging. (2015) 25:643–6. doi: 10.1111/jon.12158
CrossRef Full Text | Google Scholar
34. Lee SY, Kim SH, Lee SH, Baek HJ, Shon HS, Kim SS. Serial MR spectroscopy in relapsing reversible posterior leukoencephalopathy syndrome. Neurologist. (2009) 15:338–41. doi: 10.1097/NRL.,0b013e3181914af6
PubMed Abstract | CrossRef Full Text | Google Scholar
35. McKinney AM, Sarikaya B, Gustafson C, Truwit CL. Detection of microhemorrhage in posterior reversible encephalopathy syndrome using susceptibility-weighted imaging. Am J Neuroradiol. (2012) 33:896–903. doi: 10.3174/ajnr.A2886
PubMed Abstract | CrossRef Full Text | Google Scholar
38., Berger JR, Aksamit AJ, Clifford DB, Davis L, Koralnik IJ, Sejvar JJ, et al. PML diagnostische criteria: consensusverklaring van de sectie aan neuroinfectious disease. Neurologie. (2013) 80:1430-8. doi: 10.1212 / WNL.0b013e31828c2fa1
PubMed Abstract | CrossRef Full Text/Google Scholar
39. Araki-Trenkić And, Stojanov D, Trenkić M, Radovanovic Z, Ignjatovic J, Ristic S, et al., Atypical presentation of posterior reversible encephalopathy syndrome: clinical and radiological characteristics in eclamptic patients. Bosn J Basic Med Sci. (2016) 16:180–6. doi: 10.17305/bjbms.2016.1201
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Bartynski WS, Boardman JF. Distinct imaging patterns and lesion distribution in posterior reversible encephalopathy syndrome. Am J Neuroradiol. (2007) 28:1320–7. doi: 10.3174/ajnr.,A0549
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Brickman AM, Reitz C, Luchsinger JA, Manly JJ, Schupf N, Muraskin J, et al. Long-term blood pressure fluctuation and cerebrovascular disease in an elderly cohort. Arch Neurol. (2010) 67:564–9. doi: 10.1001/archneurol.2010.70
PubMed Abstract | CrossRef Full Text | Google Scholar
47., Cozzolino M, Bianchi C, Mariani G, Marchi L, Fambrini M, Mecacci F. Therapy and differential diagnosis of posterior reversible encephalopathy syndrome (PRES) during pregnancy and postpartum. Arch Gynecol Obstet. (2015) 292:1217–23. doi: 10.1007/s00404-015-3800-4
PubMed Abstract | CrossRef Full Text | Google Scholar
48. Masetti R, Cordelli DM, Zama D, Vendemini F, Biagi C, Franzoni E, et al. PRES in children undergoing hematopoietic stem cell or solid organ transplantation. Pediatrics., (2015) 135:890–901. doi: 10.1542/peds.2014-2325
CrossRef Full Text | Google Scholar