het gen p53 werd voor het eerst ontdekt in 1979. Een eiwit werd geà dentificeerd in simian virus 40-getransformeerde muiscellen (SV40) door immunoprecipitation met anti-t-serum; dit eiwit werd eiwit p53 genoemd . In hetzelfde jaar, vonden Kress en andere wetenschappers een nieuwe klasse van proteã nen met een moleculaire massa die zich van 50-60kDa uitstrekken. Dit soort proteã ne werd toen geà dentificeerd als p53 . Eiwit p53 kan ook van diverse getransformeerde cellijnen door immunoprecipitation worden geà dentificeerd., Ook Lane en Linzer behaalden een vergelijkbaar resultaat in 1979. Ander bewijsmateriaal voor het identificeren van p53 is dat p53 in alle geteste getransformeerde muiscellen werd uitgedrukt; deze tests omvatten chemisch-veroorzaakte sarcomen, getransformeerde fibroblasten, en leukemias, terwijl in normale cellen, p53 niet werd uitgedrukt. Bovendien, werd een hoog niveau van p53 ontdekt in de meeste getransformeerde cellen geen kwestie hoe de cellen werden getransformeerd, hetzij spontaan of niet-spontaan ., Dat was grotendeels toe te schrijven aan de verhoogde stabiliteit van p53, nochtans, in F9 embryonale carcinoacellen, drukte het een hoog niveau van p53 uit, dit was toe te schrijven aan de hoeveelheid vertaalde p53 mRNA .
nadat het eiwit p53 in 1979 was ontdekt, werd het populair om het te analyseren. Echter, op dat moment, omdat het een nieuw ontdekt eiwit was, en er geen vroegere naam voor was, gebruikten verschillende instellingen verschillende namen en publiceerden papers met verschillende namen., Om dit probleem op te lossen, kwamen in 1983, tijdens de eerste internationale p53 workshop in Oxted, Verenigd Koninkrijk, wetenschappers uit verschillende onderzoeksgroepen in verschillende landen samen om een gemeenschappelijke nomenclatuur voor dit nieuw ontdekte eiwit te bespreken. Op deze bijeenkomst, “p53” zijn naam geworden en het is sindsdien gebruikt. Men dacht dat de reden waarom wetenschappers de proteã ne p53 genoemd is dat de moleculaire massa van deze proteã ne 53kDa is die op zijn migratie in SDS-gel is gebaseerd. Later bleek de molecuulmassa verkeerd te zijn, en de juiste molecuulmassa zou 43 moeten zijn.,7kDa omdat p53 een Proline-rijk gebied bevat, en dit gebied kan de migratie van p53 in SDS-gel verminderen. Maar de naam “p53” bleef .
tijdens de jaren 1980 werd aangenomen dat eiwit p53 betrokken was bij de celcyclus en een rol speelde in de DNA-replicatie. Later, in 1982 aan 1994, vonden de mensen dat sommige virale oncoproteins aan p53 konden binden, die een complex vormen. In 1982, Sarnow et al. gevonden dat adenovirus E1b (58kDa) met een 54kDa-proteã ne kan in wisselwerking staan die in SV40-getransformeerde bovengenoemde muiscellen aanwezig is., Volgens de resultaten van immunologische specificiteiten van t antilichamen en de peptide kaarten van de 54kda proteã ne, wordt deze 54kda proteã ne geà dentificeerd als p53 . In hetzelfde jaar, vonden de wetenschappers dat als zij het antilichaam p53 in Zwitserse 3T3 muiscellen inspoten het cellen zou verbieden die de S fase van de celcyclus ingaan, nochtans; onder dezelfde situatie, beà nvloedt het antilichaam p53 SV40 of adenovirus veroorzaakte synthese van DNA niet .,later in 1984 onderzochten wetenschappers het effect van p53 op niet-getransformeerde 3T3-fibroblasten; zij analyseerden de synthesesnelheid van het eiwit p53 op verschillende tijdstippen en vonden dat in de late G1-fase, de synthesesnelheid en het niveau van het eiwit p53 en zijn gerelateerde mRNA toenemen. Dit resultaat stelt voor dat de proteã ne p53 cellen inhibeert die de het verdelen fase van de interfase ingaan . Maltzman W et al. deed een ander experiment in hetzelfde jaar. Ze behandelden de niet getransformeerde muiscel met UV-licht en UV-mimetisch chemisch carcinogeen 4NQO, en ze detecteerden een hoog niveau van p53., Het resultaat toonde aan dat de opgeheven uitdrukking van p53 niet alleen een symbool is dat de celcyclus, maar ook belangrijker een component aangeeft die bij de synthese en de celproliferatie van DNA betrokken is . In 1987, toen het bestuderen van het complex van t-antigeen van Simian virus 40 en de polymerase α van DNA, vonden Gannon, en andere wetenschappers een gelijkaardige verandering in het antigeen wanneer gebonden aan p53 en polymerase α. Zij vonden ook dat bij een bepaalde concentratie van de drie componenten, zij een speciaal trimeric complex kunnen vormen dat t-antigeen, p53 en de polymerase α van DNA omvat., Aangezien het antigeen van T betrokken is bij virale DNA-replicatie en cellulaire transformatie, wijst dit resultaat erop dat p53 een rol in de controle van de celcyclus en de replicatie van DNA speelt .
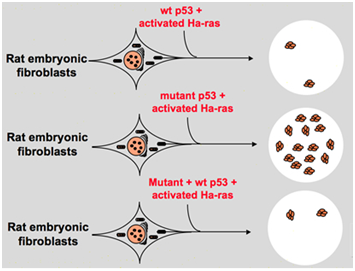
zoals het experiment hierboven liet zien, heeft p53 de mogelijkheid om cellen te vereeuwigen. In 1984, Eliyahu D et al. gevonden dat p53 en het product van oncogene myc deelden een aantal soortgelijke eigenschappen. Beiden hebben de capaciteit om aan andere proteã nen te binden en zijn betrokken bij de celcyclus, en zij accumuleren allebei in kernen van getransformeerde cellen ., Bienz, Pennica en Oren analyseerden de aminozuursequenties van het eiwit p53 en het product van myc, en ze vonden dat de twee eiwitten overeenkomsten vertonen in moleculaire structuur en de positie van speciale geladen residuen. Toen stelden de wetenschappers voor dat p53 als oncogeen kan handelen. Op basis van deze hypothese, Eliyahu D et al. ik heb wat experimenten gedaan. Aangezien de primaire fibroblasten van het tariefembryo door de betrokkenheid van zowel myc-product als Ha-ras kunnen worden getransformeerd , kunnen de primaire niercellen van de babyrat ook door samenwerking van Ha-ras en adenovirus vroege regio 1A, Eliyahu D et al worden getransformeerd., besloten om dit soort biologisch testsysteem te gebruiken om de oncogene functie van p53 te identificeren. Zij behandelden normale embryonale cellen met p53 en activeerden Ha-ras. Het resultaat toonde aan dat de doelcellen morfologieveranderingen ontmoeten en hoge niveaus van p53, Eliyahu D et al veroorzaken. dacht dat de transformatie van embryonale fibroblasten door p53 en Ha-ras verklaarde dat het gen p53 een oncogeen is ., In 1985, stelde Jenkins voor dat het gen p53 de levensduur van cellen kan uitbreiden, de affectiviteit van transformatie kan verbeteren door zijn codageopeenvolging te herschikken die de productie van stabiele proteã nen kon veroorzaken .in de late jaren 1980 begonnen wetenschappers zich echter te realiseren dat p53 een tumorontstoringsgen is in plaats van een oncogeen. Zij merkten op dat p53 met normale functie niet in veel van de tumors kan worden ontdekt en vonden dat het verliezen van de uitdrukking en de functie van wild-type p53 gen tijdens celtransformatie noodzakelijk is., Deze verhogen de mogelijkheid dat het wild-type p53 gen neoplastische progressie kan remmen . Toen formuleerden zij een andere hypothese: het kloon gen p53 dat in vorige experimenten wordt gebruikt bevat soms dominante negatieve veranderingen binnen het hoogst behouden domein, die tot tegenovergestelde experimentresultaten leiden . In 1988 ontdekten Ben en andere wetenschappers een enorme hoeveelheid herschikt p53 in muizen erytroleukemia cellijnen–DP20-1 en CB3 die zijn afgeleid van de milten van muizen geïnfecteerd met het vriend leukemie virus ., In 1989 veranderde Eliyahu, die erop wees dat p53 een oncogeen is, van gedachten en hij veronderstelde dat het wild-type p53-gen de celtransformatie kan remmen. Eliyahu en andere wetenschappers bestudeerden het effect van wild-type p53 eiwit gecodeerd door plasmiden en mutant p53 op de mogelijkheid om primaire snelheid embryo fibroblast transformatie door verschillende oncogene combinatie in vitro. Bijvoorbeeld mutant p53 plus ras, en myc plus ras., Het resultaat toonde aan dat wild-type p53 leiden tot een enorme vermindering van de getransformeerde foci veroorzaakt door mutant p53 plus ras; mutant p53 toonde geen remming op getransformeerde foci veroorzaakt door myc plus ras, terwijl myc plus ras-gemedieerde transformatie is zeer gevoelig voor de expressie van wild-type p53. Figuur 1 toont dit experiment beknopt. Het toonde aan dat vergeleken met mutant p53, wild-type p53 een duidelijk remmend effect op de celtransformatie tentoonstelt. Het effect is positief gerelateerd aan het expressieniveau van wild-type p53 en negatief gerelateerd aan het expressieniveau van mutant p53., Dit experiment stelde voor dat wild-type p53 inderdaad een tegenovergestelde functie kan hebben die met mutant p53 wordt vergeleken en de tumorigenese kan remmen . Momenteel, wordt p53 erkend als een gen van het tumorontstoringsapparaat. Er wordt geschat dat ongeveer de helft van de tumoren worden veroorzaakt door p53. Het is één van de vaakst gemuteerde genen in mensen, en het vaakst geanalyseerde gen over de hele wereld .
gedurende de eerste jaren van de jaren tachtig waren de biochemische route van p53 en het effect van p53-mutatie niet duidelijk. In 1991, vonden Kern en andere wetenschappers dat een opeenvolging van DNA van het 33-basispaar specifiek aan wild-type p53 in vitro bindt. Zij vonden ook dat de proteã ne p53 twee veranderingen bevat die gewoonlijk in menselijke tumors worden gevonden die niet aan dit specifieke gebied van DNA kunnen binden. Dus ze veronderstelden dat de functie van p53 afhangt van zijn vermogen om specifieke DNA-sequenties te binden, en dit vermogen wordt veranderd door mutaties gevonden in menselijke tumoren., Zij veronderstellen ook dat deze de opeenvolging van DNA van het 33-basispaar niet de enige opeenvolging kan zijn die de capaciteit heeft om specifiek aan p53 in mensen te binden; nochtans, kan het mensen helpen beter de functie van p53 begrijpen . Later, werd p53 gevonden om een rol tijdens de celcyclus, de reparatie van DNA, differentiatie te spelen, initiërend apoptosis en angiogenesis. Rotter V et al. gevonden dat p53 omhoog-regelt differentiatie van cellen. Bijvoorbeeld, werd een hoog niveau van p53 proteã ne ontdekt in verscheidene zeer belangrijke stappen tijdens B-cel differentiatie. Verhoogde p53 kan ook worden gedetecteerd tijdens spermatogenese., Ondertussen, kan slechts een zeer laag niveau van p53 proteã ne in sommige organen van volwassen muizen worden ontdekt .
in 1990 werd af en toe een nuttig hulpmiddel ontdekt. Het is een temperatuurgevoelige mutant van p53, genaamd p53val135. Het kan fungeren als een echte wild-type p53 bij de temperatuur van 32.5 oC, onderdrukken transformatie, en het kan ook fungeren als andere gemuteerde p53 bij de temperatuur van 37.5 oC of boven 48oC, ontlokken transformatie. Bovendien, voor getransformeerde cellen die p53val135 uitdrukken, wordt zijn proliferatie gecontroleerd bij de tolerante temperatuur, en dit soort controle is omkeerbaar., Door deze mutant p53val135 te gebruiken, werd wild-type p53 ontdekt om de arrestatie van de celcyclus bij of G1 of G2/M te veroorzaken . In 1991, Elisheva et al. vond dat de temperatuurgevoelige p53val135 een andere functie in de muriene myeloid leukemiecellijn uitvoerde. Na reactivering van p53val135 voor een paar dagen, stierven alle cellen, en deze dood vertoont sommige eigenschappen van apoptosis . Een jaar later werd een vergelijkbaar resultaat behaald door Shaw. Een wild type p53 werd getransfecteerd in een menselijke darm tumor-afgeleide cellijn EB., De cellen werden onderzocht onder lichte en elektronenmicroscopen, en gevonden om sommige eigenschappen van apoptosis tentoon te stellen . In 1990, Scheffner et al. andere wetenschappers vonden dat E6, dat de vernietiging van gastheercel regulerende eiwitten stimuleert, gecodeerd is door het oncogene humane papillomavirus types 16 en 18, en het kan een complex vormen met wild-type p53 in vitro, wat op zijn beurt de afbraak van eiwit p53 veroorzaakt .
in 1992 werd een belangrijk eiwit MDM2 ontdekt omdat het zich stevig aan p53 bindt en de door p53 gemedieerde transactie remt., De molecuulmassa van MDM2 is 90kDa, en het vormt een complex met zowel gemuteerd als wild-type p53 . In hetzelfde jaar, Livingstone RL et al. onderzocht of de cel één of beide exemplaren van wild type p53 allelen verloor en of dat voldoende was om genamplificatie te veroorzaken. De versterking van het gen werd ontdekt meestal in getransformeerde cellen maar niet in de normale fibroblasten. Het resultaat toonde aan dat de cellen die één exemplaar van de p53 allelen verliezen dienst doen als wild-type p53, terwijl de cellen die beide exemplaren van de wild type p53 allelen verliezen een hogere frequentie van versterking tentoonstellen . Een ander experiment gemaakt door Yin Y et al., toonde een vergelijkbaar resultaat .
in 1993 werd een p53-doelgen, CDKN1A genaamd, geïdentificeerd. Het codeert de proteã ne p21 die een cyclin-afhankelijke kinaseinhibitor is die cyclin-CDK2 en CDK1 door aan hen te binden remt. In 1993, vond Szekely dat het Epstein-Barr virus kernantigeen 5 (EBNA-5) door het Epstein-Barr virus wordt gecodeerd, en het menselijke B lymfoblastoid cel kan besmetten. Een 66 aminozuur lange peptide is de oorzaak van de vorming van complexe EBNA-5-p53, puntveranderingen van p53 beà nvloedden zijn bindende capaciteit aan EBNA-5 niet., Echter, het remt zijn formaties van complexen met andere moleculen . In 1994 beschreven Cho en zijn collega ‘ s voor het eerst de kristalstructuur van complex p53-DNA. Dit bindende domein van DNA werd ook genoemd het kerndomein. Het bevat residuen 102-292, en bestaat uit een beta sandwich. Ze demonstreerden ook de gedetailleerde structuur van het kerndomein . Ook in 1994, Wang XW et al. de interactie tussen hepatitis B-virus x-eiwit (HBX) en wild-type p53-eiwit bij de mens., Zij vonden dat HBX de capaciteit van p53 kan remmen om aan andere opeenvolging-specifiek DNA te binden nadat het aan p53 wordt gebonden en het kan de Vereniging van p53 met transcriptiefactoren ook remmen .
in 1997, Honda R et al. eerst veronderstelde dat MDM2 p53 ubiquitylation kan teweegbrengen en tot degradatie van p53 door een ubiquitin-proteasome systeem leiden. Zij wezen erop dat MDM2 aan het n-einddomein (NTD) van p53 bindt en als ubiquitin ligase E3 dienst doet . Ook in 1997, werden twee nieuwe families van proteã nen, P63 en p73 ontdekt die wezenlijke homologie met p53 delen., P73, ook wel tumorproteïne 73 genoemd, wordt gecodeerd door een gen dat zich in 1p36 bevindt. De locatie wordt vaak verwijderd in neuroblastoom en andere tumoren. p73 kan p53 doelgenen activeren en staat in wisselwerking met p53 . Yang et al. gevonden dat het gen p63 in 3q27-29 wordt gevestigd en het in diverse muis en menselijke cellen kan worden ontdekt. Als p73, kan p63 p53 doelgenen beduidend transactiveren, kan het apoptosis ook veroorzaken. Een kenmerk van p63 is dat de meerderheid van p63 Geen n-eindpunt heeft ., In hetzelfde jaar, vonden Serrano en collega ‘ s dat primaire muriene fibroblasten door ras kunnen worden getransformeerd in afwezigheid van p53 of p16, en inactieve p53 of p16 kan het vereeuwigingsproces van menselijke cellen vergemakkelijken. Deze bevindingen suggereren dat p53 een rol speelt in cellulaire senescentie . Dan, in 1997, werd p53 gevonden om een rol in de initiatie van apoptosis te spelen. Wanneer de cellen in de proliferatiefase komen, zouden telomeren aan het eind van elk chromosoom na elke ronde van de replicatie van DNA wegens onvolledige replicatie van enige bundeldna aan het eind van de tribune van DNA verkorten ., Het geactiveerde gen p53 van de tumorontstoringsapparaat beperkt het aantal tijden celdeling kan voorkomen. Wynford TD ontdekte dat met het verlies van de functie van wild-type p53, alle fibroblasten ontsnappen aan apoptose. Ook kan de transactiefunctie van p53 worden ingeschakeld door apoptosis . Wynford TD stelde voor dat er drie mogelijkheden zijn om p53 te activeren. De eerste is post-translationele modificatie door phosphorylation, de tweede is up-reguleert de transcriptionele cofactoren zoals p33ING1, de laatste is down-reguleert de p53 inhibitors zoals MDM2 .
in 2000, Brodsky MH et al., bestudeerde de transcriptiedoelstellingen van p53 in Drosophila. Er is bewijsmateriaal om de ogen van Drosophila te tonen tonen een streng ruw oogfenotype onder de uitdrukking van menselijke p53 dat apoptose van de schijfcellen van het oog imaginal zal veroorzaken, veroorzakend het verlies van pigmentcellen, definitief remmend oogontwikkeling van Drosophila , zodat kan Drosophila een modeldier voor het bestuderen van de functie van p53 zijn. Brodsky vond dat het gen rpr een consensusp53 bindende plaats bevat die in het cis-regelgevende gebied van rpr wordt gevestigd, en het is ook een activator van apoptosis., Met ander bewijsmateriaal beweerde Brodsky dat rpr een transcriptioneel doel van de p53 is . In 2001 ontdekten Derry en collega ‘ s dat C. elegans geen p53-gen hebben, maar wel een gen cep-1 bevatten dat codeert voor eiwitten die een vergelijkbare sequentie hebben met proteïne p53. Dit C. elegans gen codeert proteïne CEP-1 die de capaciteit heeft om apoptosis door genotoxische spanning te veroorzaken en een noodzakelijke component tijdens meiosis is .
in 2002 stelden Tyner en collega ‘ s voor dat p53 een rol speelt bij het reguleren van de veroudering van organismen., Om de functie van p53 te bestuderen, creëerden zij genetisch gemanipuleerde muizen met gemuteerde p53 door exons 1-6 en een stroomopwaarts gebied van wild-type p53 gen (p53+/+) te schrappen, genoemd p53+/m. het handelt als wild-type p53 en heeft weerstand tegen spontane tumors beter dan wild type p53 verbeterd. In het experiment werden de muizen gecontroleerd die p53+/m, p53+/+ en p53+/-bevatten. p53+ / – betekent dat de muizen een kopie van het wild-type p53-gen verliezen., De resultaten toonden aan dat geen van de muizen met p53+/m levensbedreigende tumoren ontwikkelde, echter, meer dan 80% van muizen met p53+/-en meer dan 45% van muizen met p53+/+ ontwikkelde dit soort tumoren. Kijkend binnen van de tumors, werden gelokaliseerde tumorletsels waargenomen in 2 uit 35 p53+/m Muizen, in tegenstelling, werden diverse tumors zoals lymfomen, en osteosarcomen gevonden in p53+/- en p53+/+ muizen. Tijdens dit experiment, merkten zij ook op dat de mediane leeftijd van p53+/m 96 weken was terwijl de mediane leeftijd van p53+/m 116 tot 118 weken was., Tyner en collega ‘ s onderzochten ook de mogelijkheid dat de kortere levensduur van p53+/m geassocieerd werd met veroudering. Ze vonden dat na 18 maanden, de p53 + / m Muizen begon om gewicht te verliezen en kracht, zoals voor p53+/m muizen, verminderde gewichten werden waargenomen op de leeftijd 30-36 maanden. p53 + / m Muizen vertonen ook lordokyphosis. Afhankelijk van X-ray analyse, p53 + / m Muizen tentoongesteld verminderde botdichtheid in de leeftijd van 12 maanden, en het zal ernstig worden op de leeftijd van 18 maanden. Dit is een symbool van osteoporose en osteoporose is een marker van veroudering bij mensen en muizen . Tyner et al., ook getest de tolerantie van stress, omdat dit vermogen is ook een marker van veroudering . Ze voerden 3 mm punch biopten in de rug huid van oude en jonge verdoofde p53+/m en p53+/+ muizen. Hun resultaten toonden aan dat veel oude p53+/m Muizen stierven na de geïnjecteerde standaarddosis Avertin, wat erop wijst dat oude p53+/m muizen minder tolerant waren voor de stress .
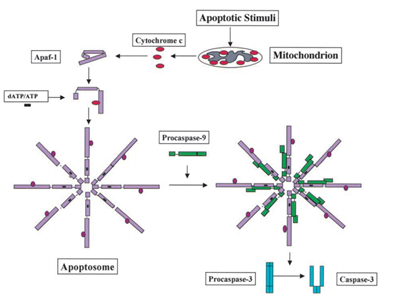
in 1991, werd gevonden dat p53 de capaciteit heeft om apoptosis te veroorzaken, terwijl in 2003; Mihara en andere wetenschappers vonden dat p53 ook een apoptosisrol in mitochondria heeft ., Aangezien sommige mitochondriale proteã nen de capaciteit hebben om cellulaire apoptose te activeren of door actieve caspasen of cytosolic inhibitors te neutraliseren. In het voorbeeld van cytochroom C-veroorzaakte caspase, na het ontvangen van het apoptosissignaal, wordt cytochroom c vrijgegeven van de intermembrane ruimte van mitochondria, en bindt dan beurtelings aan Apf-1 die als inactief monomeer bestaat, zijn conformational verandering veroorzaakt, en zijn bindende affiniteit voor datP/ATP 10 voudig verhoogt dan bindt Apaf-1 alleen datP/ATP. Dan bindt complexe Apaf-1 – cytochrome c aan datP / ATP, vorm apoptosome., Daarna het caspase recruitment domein (kaart) van Apaf-1 blootgesteld in het apoptosoom, werven procaspase-9, en vervolgens autoactiveren zichzelf. Het definitieve complex splijt dan en activeert andere caspasen zoals caspase-3 die op hun beurt later belangrijke molecules in de cel splijten, veroorzakend chromatin condensatie, de fragmentatie van DNA en uiteindelijk leidend tot apoptosis . Figuur 2 toont de cytochroom C-geïnduceerde caspase activeringsroute.
Mihara m et al. de wetenschappers vonden dat het wild-type p53 gen aan de mitochondrial oppervlakte van tumorcellen snel kan worden getransloceerd. In het experiment, vonden zij dat sommige spanning-veroorzaakte wild-type p53 proteã ne de capaciteit heeft om aan mitochondria van thymocytes in menselijke of muiscellen te transloceren na apoptosis toe te schrijven aan schade van DNA en hypoxie. Dan veroorzaken deze wild – type p53 proteã nen permeabilization van mitochondria en veroorzaken een reeks veranderingen die in mitochondria zoals het vrijgeven van cytochroom c voorkomen door complex met bcl2 en BclXL te vormen .,
als goed klinisch resultaat met weinig bijwerkingen is gentherapie populair. Tegen het einde van 2005, waren er 1020 gentherapie proeven in de database van Journal of Gene Medicine. Onder deze proeven, werden 66% van gentherapieën uitgevoerd op kankerpatiënten, en 58 proeven van dit gebruikte rAd-p53, een recombinant adenovirus die het menselijke gen p53 codeert. In April 2004, werd een recombinante menselijke injectie adenovirus-p53 (Gendicine) formeel gelanceerd. Gendicine wordt gebruikt om hoofd en nek plaveiselcelcarcinoom te behandelen en het werd goedgekeurd door de Staat Food and Drug Administration van China op Oct. 16, 2003., Het werd het eerste gentherapie product ter wereld dat door de Chinese overheid werd goedgekeurd .
het gen p53 werd ontdekt om metabolisme te reguleren in 2005. Om van fase G1 aan s over te brengen, moeten de cellen voldoende grondstoffensteun voor DNA, organellen en eiwitsynthese hebben. Om dit proces te reguleren zijn enkele controlepunten nodig. Een van hen is de glucose-afhankelijke controlepost bij G1 / S. Het wordt geregeld door het AMP-geactiveerde eiwitkinase (AMPK). Wanneer de glucose wordt uitgeput, AMPK kan phosphorylate proteã ne p53, die op zijn beurt celarrest veroorzaakt, en celdood vermijdt., De cellen die de p53-afhankelijke arrestatie ontmoeten zullen de celcyclus opnieuw binnengaan wanneer de glucose voldoende is .
Het is bekend dat inactivatie van p53 noodzakelijk is voor de vorming van tumoren. Bykov et al. VJ en Snydel EL et al. wijs erop dat onjuist functioneren van p53 kan leiden tot de proliferatie van een bestaande tumor . Ventura en zijn collega ‘ s deden enkele experimenten om deze hypothese te testen. Zij herstelde de functie van endogene p53 in primaire autochthonous tumors om het gevolg van p53 reactivering te onderzoeken., Het resultaat toonde aan dat de p53 reactivering van regressie van autochtone tumors de oorzaak was. Dat betekent dat de geïnactiveerde p53 proteã ne tot tumorontwikkeling kan leiden . Xue en andere wetenschappers deden ook een experiment om het gevolg van het reactiveren van p53 op tumoren te testen. Zij gebruikten omkeerbare interferentie van RNA (RNAi) om de uitdrukking van endogene p53 in muizen met leverkanker te regelen. In het experiment, wordt doxycycline (Dox) gebruikt om p53 te reactiveren, aangezien de uitdrukking van p53 volledig wordt onderdrukt wanneer Dox ontbreekt en snel wordt hersteld wanneer Dox wordt toegevoegd., Wanneer behandeld met Dox, werd p53 miRNA afgesloten die op zijn beurt verhoogde uitdrukking van p53 veroorzaakt. Het resultaat toonde aan dat de tumoren in DOX-behandelde muizen niet op te sporen na 12 dagen, terwijl tumoren in onbehandelde muizen groeide snel. Om het gevolg van voorbijgaande reactivering van p53 te testen, behandelden ze muizen gedurende 4 dagen met Dox en stopten daarna. Het resultaat toonde aan dat zelfs een tweedaagse behandeling kan leiden tot regressie van tumoren en 4 dagen van de behandeling kan leiden tot de tumoren volledig regressie., Zij wezen er ook op dat tijdens tumorregressie, tijdelijk-gereactiveerde p53 cellulaire senescentie, niet apoptosis kan teweegbrengen. In hetzelfde jaar ontdekte Hu dat de embryonale implantatie bij p53-/- vrouwtjesmuizen wordt gereguleerd door de Leukemie inhibitory factor (LIF). De LIF is een uitgescheiden cytokine en is belangrijk voor blastocyste implantatie. Het gen codage LIF wordt geà dentificeerd aangezien het doelgen van p53 en de verbindingsplaats van p53 in intron 1 in zowel mensen als muizen wordt gevestigd .