13 April 2017, door NCI-staf
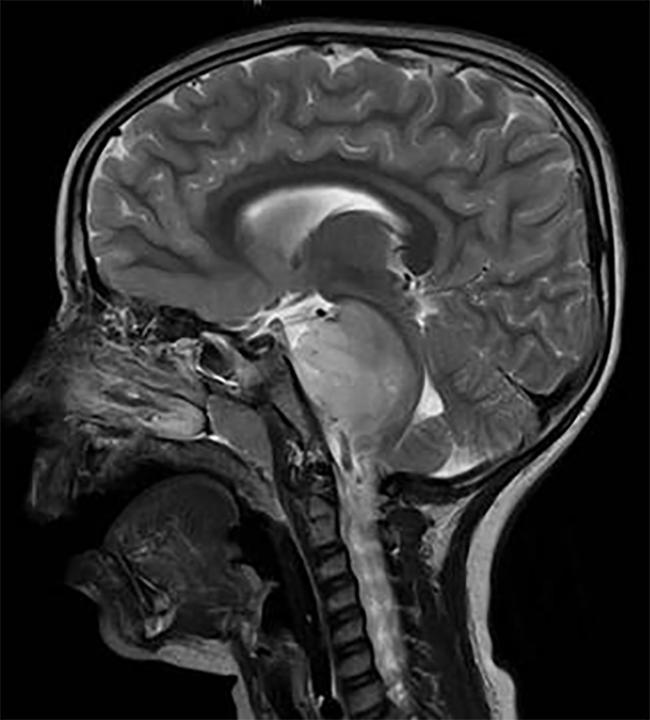
hersenscan van een kind met een DIPG-tumor, gelegen in de hersenstam.
twee afzonderlijke studies hebben potentiële therapeutische doelen geïdentificeerd in een inoperabele pediatrische hersentumor, diffuse intrinsieke pontine glioom (DIPG). Het blokkeren van deze doelstellingen met onderzoeksdrugs vertraagde tumorgroei in diermodellen van DIPG.
DIPG, een tumor die zich in de hersenstam bevindt, is bijna uniform fataal.,”als een pediatrische neurooncoloog is het een van de meest verwoestende tumoren die we zien,”zei Pratiti Bandopadhayay, M. B. B. S., Ph.D., van het Dana-Farber/Boston Children’ s Cancer and Blood Disorders Center, die niet betrokken was bij de studies. “We hebben helemaal geen curatieve behandelingen voor deze tumoren.”
hoewel de meerderheid van de DIPG-tumoren een specifieke genetische mutatie dragen, was het voorheen onduidelijk welke rol, indien aanwezig, het mutant-eiwit speelt in tumorontwikkeling, en of de functie ervan door therapieën kon worden gericht.,
voor beide nieuwe studies onderzochten de onderzoeksteams de biologie van menselijke DIPG-cellen met deze mutatie en identificeerden ze kenmerken die hen kwetsbaar kunnen maken voor behandeling. Vergeleken met controle behandelingen, ze vonden, geneesmiddelen bekend als PRC2 en Bet inhibitors kromp DIPG tumoren in muismodellen en verlengd de muizen ‘ s leven.de resultaten van beide studies, een van een onderzoeksgroep aan de Northwestern University en een van een groep aan de Universiteit van Kopenhagen in Denemarken, zijn op 27 februari gepubliceerd in Nature Medicine.,
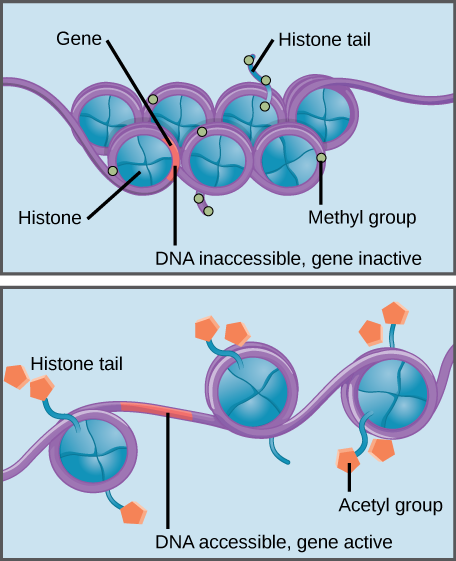
Histonmethylering versterkt de Histon–DNA-interactie, waardoor geassocieerde genen ontoegankelijk worden voor genexpressie (inactief). Histone acetylation verzwakt de interactie, makend geassocieerde genen toegankelijk voor genuitdrukking (actief).
Identificatie van een doel
ongeveer 5 jaar geleden werkten onderzoekers aan de St., Jude-Washington University pediatrische kanker genoom Project ontdekt dat bijna 80% van DIPG tumoren hebben een specifieke mutatie in het gen voor een eiwit genaamd histone H3.
dat zo ‘ n hoog percentage tumoren dezelfde mutatie heeft kwam als een verrassing voor de DIPG-onderzoeksgemeenschap, zei Ali Shilatifard, Ph.D., van de Northwestern University Feinberg School Of Medicine, hoofdonderzoeker voor een van de studies.
histonen zijn een familie van eiwitten die DNA helpen verpakken in compacte structuren., Korte secties van DNA wind rond histone proteã nen zoals draad op een spoel, en duizenden DNA–verpakte histonen (genoemd nucleosomen) maken omhoog elk chromosoom.
specifieke modificaties aan histonen kunnen genexpressie bevorderen of voorkomen. Bijvoorbeeld, verzwakt de gehechtheid van chemische samenstellingen genoemd acetylgroepen aan histones hun interactie met DNA, bevorderend genuitdrukking. Anderzijds, maakt de toevoeging van methylgroepen aan histones gewoonlijk de wind van DNA strakker rond histones, die genuitdrukking verhinderen.,
Het identificeren van de aanwezigheid van een histone H3 mutatie bij patiënten met DIPG was de eerste stap, aldus Dr.Bandopadhayay. “Maar om tumoren te kunnen behandelen met die wijziging, moet je begrijpen wat de mutatie doet,” voegde ze eraan toe.in een eerdere studie gebruikten Dr.Shilatifard en zijn collega ‘ s fruitvliegen om de functie van het mutant histone H3 gen te bestuderen. Vergeleken met vliegen met normale Histon-H3-eiwitten, hadden vliegen met de mutantversie meer histonen die bezaaid waren met acetylgroepen (geacetyleerd)., Op zijn beurt, werden deze geacetyleerde histonen gebonden door molecules genoemd bromodomain-bevattende (BRD) proteã nen, die genuitdrukking regelen.
voor hun huidige studie, die gedeeltelijk werd gefinancierd door het NCI, wilden de Northwestern onderzoekers bepalen of het mutant Histon dezelfde functie had in menselijke cellen. Inderdaad, vonden zij dat menselijke darmkanker of nierkankercellen veranderd om het gemuteerde histone H3 gen uit te drukken meer geacetyleerde histonen hadden dan cellen die het normale histone H3 gen tot expressie brachten.de eerste auteur, Andrea Piunti, Ph. D.,, vervolgens onderzocht alle mutant H3 histonen in de genomen van DIPG tumorcellen van drie patiënten. Zijn analyse toonde aan dat veel nucleosomen die mutante histonen bevatten geacetyleerd waren en gebonden door BRD-eiwitten.
aanvullende experimenten toonden aan dat BRD-eiwitten een directe rol kunnen spelen bij de groei van DIPG-tumoren. Het behandelen van menselijke DIPG-cellen met onderzoeksgeneesmiddelen die BRD-eiwitten blokkeren, zogenaamde bet-remmers, vertraagde de DIPG-celgroei in vergelijking met een controlebehandeling., En in studies van muizen met menselijke DIPG-cellen geïmplanteerd in hun hersenstammen, hadden degenen die behandeld werden met BET-remmers kleinere tumoren en leefden langer dan muizen die behandeld werden met de controlebehandeling.
deze experimenten ” suggereren dat Bet-remmers een potentiële therapeutische benadering bieden voor DIPG,” zei Dr.Shilatifard. Preclinical studies hebben aangetoond dat verscheidene verschillende kankertypes—met inbegrip van leukemie en glioblastoma—ook gevoelig zijn voor inhibitors van de weddenschap, voegde hij toe.,
een extra doel
de analyse van de noordwestelijke groep van humane DIPG tumorcellen met mutant histone H3 toonde ook aan dat naast meer histone H3 acetylering, vele histonen werden gedecoreerd met methylgroepen (gemethyleerd). Voorts vonden zij dat een enzym genoemd PRC2—dat methylgroepen aan histone H3 proteã nen hecht-dichtbij veel van deze histones aanwezig was.
Deze resultaten brachten de noordwestelijke onderzoekers ertoe om verder te kijken naar PRC2-activiteit., Zij vonden dat het blokkeren van PRC2 activiteit-hetzij genetisch of met een prc2 inhibitor genaamd tazemetostat-verminderde DIPG celgroei.
” onverwacht tonen deze resultaten een rol aan voor de PRC2-functie in het behoud van de DIPG-groei,” schreef de Northwestern-groep.
De Copenhagen group vond ook bewijs dat de rol van PRC2 in het bevorderen van DIPG tumorgroei ondersteunt. Zij merkten op dat tazemetostat en een andere prc2-remmer de groei van muizenhersencellen of menselijke DIPG-cellen met mutante histonen verminderden, terwijl de controlebehandeling dat niet deed.,
en wanneer zij muizenhersencellen met mutante histonen implanteerden in de hersenen van normale muizen of muizen waarbij PRC2 genetisch geblokkeerd was, leefden de muizen die geen PRC2-activiteit hadden langer.
daarentegen bleek uit een afzonderlijke studie van een onderzoeksgroep in Duitsland dat cellen van verschillende patiënten met DIPG niet gevoelig waren voor tazemetostaat, hoewel hun tumoren de histone H3-mutatie hadden.
een stap voorwaarts
decennia van klinische studies hebben aangetoond dat DIPG tumoren ongevoelig zijn voor traditionele chemotherapie, verklaarde Dr.Bandopadhayay., En hoewel straling symptomen kan verlichten, is het niet genezend, en de meeste kinderen met DIPG sterven binnen 2 jaar na diagnose.
in 2015 kwam een internationaal consortium van DIPG-onderzoekers samen om alle beschikbare DIPG-celmonsters te bestuderen. Hun studie toonde aan dat DIPG-cellen verzameld van verschillende patiënten werden gedood door een Histon-modifying drug genaamd panobinostat (Farydak®). Panobinostat blokkeert enzymen die acetylgroepen aan histonen toevoegen., Nu testen onderzoekers, die deel uitmaken van het NCI-ondersteunde pediatrische hersentumor Consortium, de veiligheid en beste dosis van panobinostat voor kinderen met DIPG in een Fase I klinische studie.de resultaten van beide studies wijzen nu op potentieel veelbelovende nieuwe behandelingsstrategieën, aldus Dr. Shilatifard.
“we willen BET inhibitors verplaatsen naar een Fase I studie voor de behandeling van DIPG, en onze collega’ s aan de Ann & Robert H. Lurie Children”s Hospital of Chicago duwen verder met deze studies,” zei hij.,
daarnaast worden in verschillende lopende klinische studies tazemetostat, de prc2-remmer, getest bij zowel volwassen als pediatrische patiënten met verschillende vormen van kanker. Er is echter geen specifiek onderzoek uitgevoerd naar tazemetostat bij kinderen met DIPG.
Er zijn nog veel onbeantwoorde vragen, zei Dr. Bandopadhayay, waaronder de vraag of deze onderzoeksgeneesmiddelen de mogelijkheid hebben om de bloed–hersenbarrière te passeren en menselijke hersentumoren te bereiken.
Dr., Bandopadhayay en haar collega ‘ s leren ook meer over DIPG-biologie door tumorcellen te bestuderen die uit biopsieën zijn verkregen, naast die uit autopsieën. Het verkrijgen van biopsiemonsters is pas onlangs mogelijk gemaakt door belangrijke verbeteringen in neurochirurgische technieken, legde ze uit.
“Het is een spannende tijd,” zei ze. “Er is veel werk aan de gang op dit moment. Het uiteindelijke doel is om deze kinderen te kunnen behandelen, zodat ze een kans op genezing hebben met minimale bijwerkingen.”