le gène p53 a été découvert en 1979. Une protéine a été identifiée dans des cellules de souris transformées par le virus Simien 40 (SV40) par immunoprécipitation avec du sérum anti-T; cette protéine a été appelée protéine p53 . Dans la même année, Kress et d’autres scientifiques ont trouvé une nouvelle classe de protéines avec une masse moléculaire allant de 50-60kda. Ce type de protéine a ensuite été identifié comme p53 . La protéine p53 peut également être identifiée à partir de diverses lignées cellulaires transformées par immunoprécipitation., Lane et Linzer ont également obtenu un résultat similaire en 1979. D’autres preuves de l’identification de p53 sont que p53 a été exprimé dans toutes les cellules de souris transformées testées; ces tests comprennent des sarcomes induits chimiquement, des fibroblastes transformés et des leucémies, alors que dans les cellules normales, p53 n’a pas été exprimé. De plus, un niveau élevé de p53 a été détecté dans la plupart des cellules transformées, quelle que soit la façon dont les cellules ont été transformées, spontanément ou non spontanément ., Cela était en grande partie dû à la stabilité accrue du p53, cependant, dans les cellules carcinoa embryonnaires F9, il exprimait un niveau élevé de p53, cela était dû à la quantité d’ARNm p53 traduit .
Après la découverte de la protéine p53 en 1979, il est devenu populaire de l’analyser. Cependant, à cette époque, comme il s’agissait d’une protéine nouvellement découverte et qu’il n’y avait pas d’ancien nom, différentes institutions utilisaient des noms différents et publiaient des articles avec des noms différents., Afin de résoudre ce problème, en 1983, lors du 1er atelier international p53 tenu à Oxted, AU ROYAUME-UNI, des scientifiques de différents groupes de recherche de différents pays se sont réunis pour discuter d’une nomenclature commune pour cette protéine nouvellement découverte. Lors de cette réunion, « p53 » devient son nom et il a été utilisé depuis lors. On pensait que la raison pour laquelle les scientifiques ont appelé la protéine p53 est que la masse moléculaire de cette protéine est de 53kDa qui est basée sur sa migration dans le gel SDS. Plus tard, la masse moléculaire s’est avérée fausse et la masse moléculaire correcte devrait être de 43.,7kDa parce que p53 contient une région riche en proline, et cette région peut réduire la migration de p53 dans le gel SDS. Mais le nom « p53 » est resté .
au cours des années 1980, on croyait que la protéine p53 était impliquée dans le cycle cellulaire, en plus de jouer un rôle dans la réplication de l’ADN. Plus tard, de 1982 à 1994, les gens ont constaté que certaines oncoprotéines virales étaient capables de se lier à p53, formant un complexe. En 1982, Sarnow et coll. trouvé que l’adénovirus E1b (58kDa) peut interagir avec une protéine de 54KDA présente dans les cellules de souris transformées en SV40 mentionnées ci-dessus., Selon les résultats des spécificités immunologiques des anticorps T et les cartes peptidiques de la protéine 54kDa, cette protéine 54kDa est identifiée comme p53 . La même année, les scientifiques ont découvert que s’ils injectaient l’anticorps p53 dans des cellules de souris Swiss 3T3, il inhiberait les cellules entrant dans la phase S du cycle cellulaire; dans la même situation, l’anticorps p53 n’affectait pas la synthèse de L’ADN induite par SV40 ou l’adénovirus .,
plus tard en 1984, les scientifiques ont examiné l’effet du p53 sur les fibroblastes 3T3 non transformés; ils ont analysé le taux de synthèse de la protéine p53 à différents moments et ont constaté qu’à la fin de la phase G1, le taux de synthèse et le niveau de la protéine p53 et Ce résultat suggère que la protéine p53 inhibe les cellules entrant dans la phase de division à partir de l’interphase . Maltzman W et coll. fait une autre expérience dans la même année. Ils ont traité la cellule de souris non transformée avec de la lumière UV et un cancérogène chimique uv-mimétique 4NQO, et ils ont détecté un niveau élevé de p53., Le résultat a montré que l’expression élevée de p53 n’est pas seulement un symbole qui indique le cycle cellulaire, mais aussi, plus important encore, un composant impliqué dans la synthèse de l’ADN et la prolifération cellulaire . En 1987, lors de l’étude du complexe de l’antigène T du virus Simien 40 et de L’ADN polymérase α, Gannon et d’autres scientifiques ont trouvé un changement similaire dans l’antigène lorsqu’il est lié à p53 et à la polymérase α. Ils ont également constaté qu’à une certaine concentration des trois composants, ils peuvent former un complexe trimérique spécial qui comprend l’antigène T, p53 et L’ADN polymérase α., Comme l’antigène T est impliqué dans la réplication de l’ADN viral et la transformation cellulaire, ce résultat indique que p53 joue un rôle dans le contrôle du cycle cellulaire et de la réplication de l’ADN .
Comme l’expérience a montré ci-dessus, p53 a la possibilité d’immortaliser les cellules. En 1984, Eliyahu D et al. trouvé que p53 et le produit de oncogene myc partageaient des propriétés similaires. Les deux ont la capacité de se lier à d’autres protéines et sont impliqués dans le cycle cellulaire, et ils s’accumulent tous deux dans les noyaux des cellules transformées ., Bienz, Pennica et Oren ont analysé les séquences d’acides aminés de la protéine p53 et du produit de myc, et ils ont constaté que les deux protéines présentent des similitudes dans la structure moléculaire et la position des résidus chargés Spéciaux. Ensuite, les scientifiques ont proposé que p53 puisse agir comme un oncogène. Sur la base de cette hypothèse, Eliyahu D et al. fait quelques expériences. Comme les fibroblastes embryonnaires à taux primaire peuvent être transformés par l’implication du produit myc et de L’Ha-ras, les cellules rénales primaires du bébé rat peuvent également être transformées par la coopération de L’Ha-ras et de l’adénovirus région précoce 1A , Eliyahu D et al., décidé d’utiliser ce type de système de test biologique pour identifier la fonction oncogène du p53. Ils ont traité les cellules embryonnaires normales avec p53 et activé Ha-ras. Le résultat a montré que les cellules cibles rencontrent des changements morphologiques et produisent des niveaux élevés de p53, Eliyahu D et al. pense que la transformation des fibroblastes embryonnaires par p53 et Ha-ras explique que le gène p53 est un oncogène ., En 1985, Jenkins a proposé que le gène p53 puisse prolonger la durée de vie des cellules, améliorer l’affectivité de la transformation en réorganisant sa séquence codante qui pourrait provoquer la production de protéines stables .
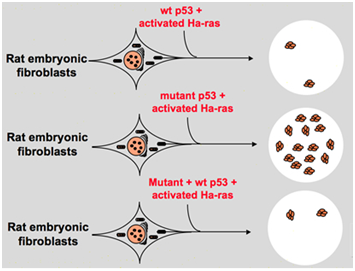
cependant, à la fin des années 1980, les scientifiques ont commencé à se rendre compte que le p53 est un gène suppresseur de tumeur au lieu d’un oncogène. Ils ont observé que p53 avec une fonction normale ne peut pas être détecté dans de nombreuses tumeurs et ont constaté que la perte de l’expression et de la fonction du gène p53 de type sauvage est nécessaire lors de la transformation cellulaire., Ceux-ci soulèvent la possibilité que le gène p53 de type sauvage puisse inhiber la progression néoplasique . Ensuite, ils ont formulé une autre hypothèse: le gène du clone p53 utilisé dans les expériences précédentes contient occasionnellement des mutations négatives dominantes dans le domaine hautement conservé, ce qui conduit à des résultats d’expérience opposés . En 1988, Ben et d’autres scientifiques ont détecté une énorme quantité de p53 réarrangée dans les lignées cellulaires d’érythroleucémie murine-DP20-1 et CB3 qui sont dérivées des spleens de murin infecté par le virus de la leucémie Friend ., En 1989, Eliyahu, qui a souligné que p53 est un oncogène a changé d’avis, et il a supposé que le gène p53 de type sauvage peut inhiber la transformation cellulaire. Eliyahu et d’autres scientifiques ont étudié l’effet de la protéine p53 de type sauvage codée par les plasmides et le mutant p53 sur la capacité à provoquer une transformation des fibroblastes embryonnaires à taux primaire par diverses combinaisons d’oncogènes in vitro. Par exemple mutant p53 plus ras, et myc plus ras., Le résultat a montré que le p53 de type sauvage conduit à une énorme réduction des foyers transformés causés par le mutant p53 plus ras; le mutant p53 n’a montré aucune inhibition des foyers transformés causés par myc plus ras, tandis que la transformation médiée par myc plus ras est très sensible à l’expression du p53 de type sauvage. La Figure 1 montre cette expérience de manière concise. Il a montré que comparé au mutant p53, le p53 de type sauvage présente un effet évidemment inhibiteur sur la transformation cellulaire. L’effet est positivement liée au niveau d’expression de p53 de type sauvage et en corrélation négative avec le niveau d’expression de p53 mutante., Cette expérience a suggéré que le p53 de type sauvage pourrait effectivement avoir une fonction opposée à celle du p53 mutant et pourrait inhiber la tumorigenèse . Actuellement, p53 est reconnu comme un gène suppresseur de tumeur. On estime qu’environ la moitié des tumeurs sont causées par p53. C’est l’un des gènes les plus fréquemment mutés chez l’homme, et le gène le plus fréquemment analysé dans le monde .
Au cours des premières années des années 1980, la voie biochimique de p53 et l’effet de la mutation p53 n’étaient pas clairs. En 1991, Kern et d’autres scientifiques ont découvert qu’une séquence D’ADN à 33 paires de bases se lie spécifiquement au type sauvage p53 in vitro. Ils ont également constaté que la protéine p53 contient deux mutations qui se trouvent généralement dans les tumeurs humaines qui ne peuvent pas se lier à cette région spécifique de l’ADN. Ils ont donc supposé que la fonction de p53 dépend de sa capacité à lier des séquences D’ADN spécifiques, et cette capacité est altérée par des mutations trouvées dans les tumeurs humaines., Ils supposent également que cette séquence D’ADN à 33 paires de bases n’est peut-être pas la seule séquence capable de se lier spécifiquement au p53 chez l’homme; cependant, elle peut aider les gens à mieux comprendre la fonction du p53 . Plus tard, p53 a été trouvé pour jouer un rôle pendant le cycle cellulaire, la réparation D’ADN, la différenciation, initiant l’apoptose et l’angiogenèse. Rotter C et coll. trouvé que p53 up-régule la différenciation des cellules. Par exemple, un niveau élevé de protéine p53 a été détecté dans plusieurs étapes clés au cours de la différenciation des cellules B. Une p53 élevée peut également être détectée pendant la spermatogenèse., Pendant ce temps, seul un très faible niveau de protéine p53 peut être détecté dans certains organes de souris adultes .
en 1990, un outil utile a été découvert occasionnellement. C’est un mutant sensible à la température de p53, appelé p53val135. Il peut agir comme un véritable p53 de type sauvage à la température de 32,5 oC, supprimant la transformation, et il peut également agir comme un autre p53 muté à la température de 37,5 oC ou au-dessus de 48oC, provoquant une transformation. De plus, pour les cellules transformées exprimant p53val135, sa prolifération est contrôlée à la température permissive, et ce type de contrôle est réversible., En utilisant ce mutant p53val135, on a découvert que le p53 de type sauvage induisait un arrêt du cycle cellulaire à G1 ou G2/M. En 1991, Elisheva et coll. on a constaté que le p53val135 sensible à la température remplissait une fonction différente dans la lignée cellulaire de leucémie myéloïde murine. Après la réactivation de p53val135 pendant quelques jours, toutes les cellules sont mortes, et cette mort présente certaines propriétés d’apoptose . Un an plus tard, un résultat similaire a été obtenu par Shaw. Un type sauvage p53 a été transfecté dans une lignée cellulaire dérivée d’une tumeur du côlon humain EB., Les cellules ont été examinées au microscope optique et électronique et ont montré certaines propriétés de l’apoptose . En 1990, Scheffner et coll. et d’autres scientifiques ont découvert que E6 qui stimule la destruction des protéines régulatrices des cellules hôtes est codé par les types oncogènes de papillomavirus humain 16 et 18, et il peut former un complexe avec p53 de type sauvage in vitro, ce qui provoque à son tour la dégradation de la protéine p53 .
en 1992, une protéine clé MDM2 a été découverte parce qu’elle se lie étroitement à p53 et qu’elle inhibe la transactivation médiée par p53., La masse moléculaire de MDM2 est de 90kDa, et il forme un complexe avec p53 muté et de type sauvage . La même année, Livingstone RL et al. a étudié si la cellule a perdu une ou les deux copies d’allèles de type sauvage p53 et si cela était suffisant pour provoquer une amplification génique. L’amplification génique a été détectée principalement dans les cellules transformées, mais pas dans les fibroblastes normaux. Le résultat a montré que les cellules perdant une copie des allèles p53 agissent comme des allèles de type sauvage p53, tandis que les cellules perdant les deux copies des allèles de type sauvage p53 présentent une fréquence d’amplification plus élevée . Une autre expérience faite par Yin Y et al., a montré un résultat similaire .
en 1993, un gène cible P53 appelé CDKN1A a été identifié. Il Code la protéine p21 qui est un inhibiteur de kinase cycline-dépendant qui inhibe la cycline-CDK2 et CDK1 en se liant à eux. En 1993, Szekely a découvert que L’antigène nucléaire du virus Epstein-Barr 5(EBNA-5) est codé par le virus Epstein-Barr et qu’il peut infecter les cellules lymphoblastoïdes B humaines. Un peptide long de 66 acides aminés est responsable de la formation du complexe EBNA-5-p53, les mutations ponctuelles de p53 n’ont pas affecté sa capacité de liaison à EBNA-5., Cependant, il inhibe ses formations de complexes avec d’autres molécules . En 1994, Cho et ses collègues ont décrit pour la première fois la structure cristalline du complexe P53-ADN. Ce domaine de liaison à L’ADN a également été appelé le domaine de base. Il contient des résidus 102-292, et se compose d’un sandwich bêta. Ils ont également démontré la structure détaillée du domaine Central . Toujours en 1994, Wang XW et al. l’interaction entre le virus de l’hépatite B X (protéine HBX) et p53 de type sauvage de la protéine chez l’homme., Ils ont découvert que HBX peut inhiber la capacité de p53 à se lier à d’autres ADN spécifiques à la séquence après qu’il soit lié à p53 et il peut également inhiber l’association de p53 avec des facteurs de transcription .
En 1997, Honda R et coll. première hypothèse que MDM2 peut déclencher p53 ubiquitylation et conduire à la dégradation de p53 par un système ubiquitine-protéasome. Ils ont souligné que MDM2 se lie au domaine n-terminal (NTD) de p53 et agit comme ubiquitine ligase E3 . Toujours en 1997, deux nouvelles familles de protéines, p63 et p73 ont été découvertes qui partagent une homologie substantielle avec p53., p73, également appelée protéine tumorale 73, est codée par un gène situé dans 1p36. L’emplacement est supprimé fréquemment dans le neuroblastome et d’autres tumeurs. p73 peut activer les gènes cibles p53 et interagit avec p53 . Yang et coll. trouvé que le gène p63 est situé dans 3q27 – 29 et il peut être détecté dans diverses cellules de souris et humaines. Comme p73, p63 peut transactiver les gènes cibles p53 de manière significative, il peut également induire l’apoptose. Une caractéristique de p63 est que la majorité de p63 n’a pas de N-terminus ., La même année, Serrano et ses collègues ont découvert que les fibroblastes murins primaires peuvent être transformés par ras en l’absence de p53 ou p16, et que p53 ou p16 inactifs peuvent faciliter le processus d’immortalisation des cellules humaines. Ces résultats suggèrent que p53 joue un rôle dans la sénescence cellulaire . Puis, en 1997, p53 a été trouvé à jouer un rôle dans l’initiation de l’apoptose. Lorsque les cellules entrent dans la phase de prolifération, les télomères à l’extrémité de chaque chromosome raccourciraient après chaque cycle de réplication de l’ADN en raison de la réplication incomplète de L’ADN monocaténaire à l’extrémité du support D’ADN ., Le gène suppresseur de tumeur activé p53 limite le nombre de fois que la division cellulaire peut se produire. Wynford TD a constaté qu’avec la perte de la fonction de p53 de type sauvage, tous les fibroblastes s’échappent de l’apoptose. Aussi, la fonction de transactivation de p53 peut être activée par apoptose . Wynford TD a proposé qu’il y ait trois possibilités de la façon dont p53 est activé. Le premier est la modification post-traductionnelle par phosphorylation, le second régule vers le haut les cofacteurs transcritionnels comme p33ING1, le dernier régule vers le bas les inhibiteurs de p53 comme MDM2 .
En 2000, Brodsky MH et coll., étude des cibles de transcription de p53 chez la drosophile. Il existe des preuves pour montrer que les yeux de Drosophile affichent un phénotype sévère sous l’expression de p53 humain qui induira l’apoptose des cellules du disque imaginal oculaire, provoquant la perte de cellules pigmentaires, inhibant enfin le développement oculaire de la drosophile , de sorte que la drosophile peut être un animal modèle pour étudier la fonction de p53. Brodsky a constaté que le gène rpr contient un site de liaison consensuel p53 situé dans la région cis-régulatrice du rpr, et qu’il est également un activateur de l’apoptose., Avec d’autres preuves, Brodsky a affirmé que rpr est une cible transcriptionnelle de la p53 . En 2001, Derry et ses collègues ont découvert que C. elegans n’a pas de gène p53, mais contient en effet un gène cep-1 qui Code des protéines qui ont une séquence similaire à la protéine p53. Ce gène de C. elegans code la protéine CEP-1 qui a la capacité d’induire l’apoptose par le stress génotoxique et est un composant nécessaire pendant la méiose .
en 2002, Tyner et ses collègues ont proposé que le p53 joue un rôle dans la régulation du vieillissement des organismes., Afin d’étudier la fonction de p53, ils ont créé des souris génétiquement modifiées avec p53 muté en supprimant les exons 1-6 et une région en amont du gène p53 de type sauvage (p53+/+), appelé p53+/m. Il agit comme p53 de type sauvage et a une résistance accrue aux tumeurs spontanées Dans l’expérience, ils ont surveillé la souris contenant p53+/m, p53+/+ et p53+/-. p53 + / – signifie que les souris perdent une copie du gène p53 de type sauvage., Les résultats ont montré qu’aucune des souris avec p53+/m n’a développé de tumeurs potentiellement mortelles, cependant, plus de 80% des souris avec p53+/-et plus de 45% des souris avec p53+/+ ont développé ce type de tumeurs. En regardant à l’intérieur des tumeurs, des lésions tumorales localisées ont été observées chez 2 souris p53+/m sur 35, en revanche, diverses tumeurs comme les lymphomes et les ostéosarcomes ont été trouvées chez les souris p53+/- et p53+/+. Au cours de cette expérience, ils ont également observé que l’âge médian de p53+/m était de 96 semaines tandis que l’âge médian de p53+/m était de 116 à 118 semaines., Tyner et ses collègues ont également examiné la possibilité que la durée de vie plus courte de p53+/m soit associée au vieillissement. Ils ont constaté qu’après 18 mois, les souris p53+/m ont commencé à perdre du poids et de la vigueur, comme pour les souris p53+/m, des poids réduits ont été observés à l’âge de 30 à 36 mois. les souris p53+/m présentent également une lordokyphose. Selon l’analyse aux rayons X, les souris p53+ / m ont présenté une densité osseuse réduite à l’âge de 12 mois et elle deviendra sévère à l’âge de 18 mois. C’est un symbole de l’ostéoporose l’ostéoporose est un marqueur du vieillissement chez les humains et les souris . Tyner et coll., également testé la tolérance de stress, que cette capacité est également un marqueur du vieillissement . Ils ont réalisé des biopsies perforées de 3 mm dans la peau du dos de souris p53+/m et p53+/+ anesthésiées âgées et jeunes. Leurs résultats ont montré que beaucoup de vieilles souris p53+/m sont mortes après avoir injecté la dose standard D’Avertin, indiquant que les vieilles souris p53+/m étaient moins tolérantes au stress .
en 1991, il a été constaté que p53 a la capacité d’induire l’apoptose, tandis qu’en 2003; Mihara et d’autres scientifiques ont découvert que p53 a également un rôle d’apoptose dans les mitochondries ., Étant donné que certaines protéines mitochondriales ont la capacité d’activer l’apoptose cellulaire soit par des caspases actives, soit par des inhibiteurs cytosoliques neutralisants. Dans l’exemple de la caspase induite par le cytochrome c, Après avoir reçu le signal d’apoptose, le cytochrome c est libéré de l’espace intermembranaire des mitochondries, puis se lie à son tour à Apf-1 qui existe en tant que monomère inactif, induit son changement conformationnel et augmente son affinité de liaison pour dATP/ATP de 10 fois Ensuite, le complexe Apaf-1 – cytochrome c se lie à dATP / ATP, forme l’apoptosome., Après cela, le domaine de recrutement de caspase (CARD) D’Apaf-1 exposé dans l’apoptosome, recrute procaspase-9, puis s’active automatiquement. Le complexe final Clive et active ensuite d’autres caspases telles que la caspase – 3 qui à leur tour clivent ensuite des molécules importantes dans la cellule, provoquant la condensation de la chromatine, la fragmentation de l’ADN et conduisant finalement à l’apoptose . La Figure 2 montre la voie d’activation de la caspase induite par le cytochrome C.
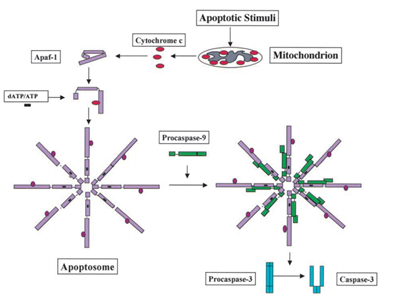
Mihara M et coll. les scientifiques ont découvert que le gène p53 de type sauvage peut être transféré rapidement à la surface mitochondriale des cellules tumorales. Dans l’expérience, ils ont constaté que certaines protéines p53 de type sauvage induites par le stress ont la capacité de se déplacer vers les mitochondries des thymocytes dans les cellules humaines ou de souris après l’apoptose due à des dommages à l’ADN et à l’hypoxie. Ensuite, ces protéines p53 de type sauvage induisent la perméabilisation des mitochondries et provoquent une série de changements qui se produisent dans les mitochondries, comme la libération du cytochrome c en formant un complexe avec Bcl2 et BclXL .,
Comme un bon résultat clinique avec peu d’effet secondaire, la thérapie génique est populaire. À la fin de 2005, il y avait 1020 essais de thérapie génique dans la base de données du Journal of Gene Medicine. Parmi ces essais, 66% des thérapies géniques ont été menées sur des patients atteints de cancer, et 58 essais ont utilisé rAd-p53, un adénovirus recombinant codant pour le gène p53 humain. En avril 2004, une injection humaine recombinante d’adénovirus-P53 (Gendicine) a été lancée officiellement. Gendicine est utilisé pour traiter le carcinome épidermoïde de la tête et du cou et il a été approuvé par la State Food and Drug Administration de Chine Le Octobre. 16, 2003., Il est devenu le premier produit de thérapie génique au monde à être approuvé par le gouvernement Chinois .
le gène p53 a été découvert pour réguler le métabolisme en 2005. Afin de passer de la phase G1 à la phase S, les cellules doivent avoir un support de matières premières suffisant pour la synthèse de L’ADN, des organites et des protéines. Pour réguler ce processus, certains points de contrôle sont nécessaires. L’un d’eux est le point de contrôle dépendant du glucose à G1/S. Il est régulé par la protéine kinase activée par L’AMP (AMPK). Lorsque le glucose est épuisé, L’AMPK peut phosphoryler la protéine p53, ce qui induit l’arrêt cellulaire et évite la mort cellulaire., Les cellules qui rencontrent l’arrêt p53-dépendant rentreront dans le cycle cellulaire quand le glucose est suffisant .
on sait que l’inactivation de p53 est nécessaire à la formation de tumeurs. Bykov et coll. VJ et Snydel EL et coll. soulignez qu’un mauvais fonctionnement de p53 peut entraîner la prolifération d’une tumeur existante . Ventura et ses collègues ont fait quelques expériences pour tester cette hypothèse. Ils ont restauré la fonction de p53 endogène dans les tumeurs autochtones primaires pour examiner la conséquence de la réactivation de p53., Le résultat a montré que la réactivation de p53 était responsable de la régression des tumeurs autochtones. Cela signifie que la protéine p53 inactivée peut entraîner le développement d’une tumeur . Xue et d’autres scientifiques ont également fait une expérience pour tester la conséquence de la réactivation de p53 sur les tumeurs. Ils ont utilisé l’interférence ARN réversible (Arni) pour réguler l’expression de p53 endogène chez des souris atteintes d’un cancer du foie. Dans l’expérience, la doxycycline (Dox) est utilisée pour réactiver p53, car l’expression de p53 est totalement supprimée lorsque Dox est manquant et rapidement restaurée lorsque Dox est ajouté., Lors du traitement par Dox, le miARN p53 a été arrêté, ce qui entraîne une augmentation de l’expression de p53. Le résultat a montré que les tumeurs chez les souris traitées par Dox deviennent indétectables après 12 jours, tandis que les tumeurs chez les souris non traitées ont augmenté rapidement. Pour tester la conséquence de la réactivation transitoire de p53, ils ont traité des souris avec du Dox pendant 4 jours, puis arrêté. Le résultat a montré que même un traitement de deux jours peut provoquer une régression des tumeurs et que 4 jours de traitement peuvent provoquer une régression complète des tumeurs., Ils ont également souligné que lors de la régression tumorale, le p53 réactivé de manière transitoire peut déclencher la sénescence cellulaire, et non l’apoptose. La même année, Hu a constaté que l’implantation embryonnaire chez les souris femelles p53-/- est régulée par le facteur inhibiteur de la leucémie (LIF). Le LIF est une cytokine sécrétée et est important pour l’implantation de blastocystes. Le gène codant le LIF est identifié comme le gène cible p53 et le site de liaison p53 est situé dans l’intron 1 chez l’homme et la souris .