Introduction
Posterior reversible encephal disordine (PRES), first described by Hinchey et al. em 1996, representa um distúrbio neurológico com apresentação clínica variada e resultados típicos de imagiologia de padrão predominante parieto-occipital de edema vasogênico (1, 2). Existem numerosas causas documentadas de PRES, com os casos descritos pela primeira vez no cenário de pressões arteriais elevadas., Exemplos de cenários clínicos em que podem ser observados PRES incluem: emergência hipertensiva, (pré)eclampsia, doença renal, distúrbios auto-imunes e medicamentos citotóxicos, entre outros (3, 4) (Tabela 1). O PRES pode ocorrer em qualquer grupo etário e tem uma maior taxa de ocorrência em pacientes do sexo feminino (7, 8). Embora a literatura actual seja relativamente escassa em comparação com as populações adultas, deve ser feita uma menção especial ao PRES no doente pediátrico., Os doentes pediátricos têm uma apresentação clínica semelhante à da população adulta, com hipertensão, convulsões e alteração do estado mental sendo manifestações comuns da doença (9). Apesar da maioria dos casos de pré-pediátricos notificados em doentes oncológicos, especialmente os doentes pós-transplante de células estaminais (10, 11), Um estudo realizado por Gupta et al. (12) verificou-se que a doença renal era talvez a causa mais comum do PRES no doente pediátrico. No seu estudo, os doentes pediátricos tiveram tendência a apresentar resultados imagiológicos mais atípicos (62, 5%), incluindo envolvimento do lobo frontal (56%).,
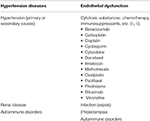
a Tabela 1. Principais doenças associadas ao PRES.as manifestações clínicas são agudas a subagudar e variam desde cefaleias e distúrbios visuais até níveis alterados de consciência e convulsões em casos mais graves (1). O tratamento é geralmente destinado a direcionar a causa subjacente, com sintomas geralmente reversíveis e achados de imagem na maioria dos casos (8)., Embora os resultados sejam geralmente favoráveis com o manejo adequado, os resultados clínicos pobres têm sido associados com a diabetes mellitus pré-existente, e envolvimento do corpo caloso; no entanto, outros biomarcadores de imagem confiável para prognóstico estão faltando atualmente (13). A imagiologia neuroradiológica desempenha um papel fundamental no diagnóstico do PRES com as características típicas da imagem que melhor se apreciam na imagiologia por ressonância magnética (MRI) (2).
Fisiopatologia
o(s) mecanismo (s) fisiopatológico (s) preciso (s) por trás do PRES ainda não foi completamente elucidado e permanece controverso (3)., Existem actualmente dois grandes mecanismos propostos para a fisiopatologia do PRES (Figura 1). A primeira teoria propõe o aumento das pressões arteriais como fator primário (8). Aumentos rápidos nas pressões sanguíneas eventualmente superam as capacidades autoregulatórias da vasculatura cerebral causando vazamento vascular e edema vasogênico resultante (14). Existe uma eventual disfunção de barreira hemato-encefálica (BBB) com proteínas que passam através da junção estreita (15)., As áreas fornecida por posterior circulação (artérias vertebrais, artéria basilar, e posterior artérias cerebrais) são excepcionais de risco, quando comparado ao anterior circulação interna (artérias carótidas, meio artérias cerebrais, e artérias cerebrais anterior), devido à falta de tônus simpático da artéria basilar vasculatura (8)., Uma teoria relacionada proposta por alguns postulados de que a hipertensão extrema resulta em vasospasmo e isquemia local que provoca a degradação do BBB e edema vasogénico resultante, como foi observado em doentes a serem tratados com agentes imunossupressores Ciclosporina A e FK-506 (16). A ruptura no BBB provoca os resultados típicos de edema vasogénico vs. edema citotóxico (que podem ser observados em caso de enfarte agudo e representa um aumento do teor de água intracelular devido à perda do gradiente osmótico habitual no cenário de morte celular (17).,
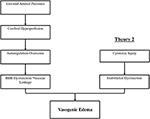
a Figura 1. Duas teorias principais da fisiopatologia de PRES. A teoria 1 é a teoria da hiperperfusão hipertensiva e cerebral e a teoria 2 é a teoria da disfunção endotelial.
a segunda teoria principal aborda o facto de que até 30% dos doentes com PRES não apresentam as pressões arterial elevadas necessárias para exceder o controlo autoregulatório da vasculatura cerebral (18, 19)., Esta teoria propõe que a disfunção endotelial é o principal culpado, que pode ser causado por várias toxinas endógenas ou exógenas (20). Esta teoria pode explicar os resultados do PRES observados em doentes a receber medicamentos imunossupressores e/ou quimioterapia, bem como nos doentes com sepsis (21, 22). Neste modelo, toxinas circulantes causam lesões vasculares com o desenvolvimento resultante de edema vasogênico. Os danos endoteliais provocam uma maior libertação de agentes vasoconstritivos e imunogénicos, que podem causar vasospasmo e/ou aumento da permeabilidade vascular., Em última análise, a disfunção endotelial que permite vazamento vascular e edema vasogênico é o fator condutor por trás do PRES, independentemente da anomalia da vasculatura cerebral primária (no caso de hipertensão arterial) ou secundária às toxinas circulantes. Um resumo destas duas teorias, bem como uma lista de quimioterapeutas previamente relatados e outros imunossupressores, é mostrado na Figura 2.
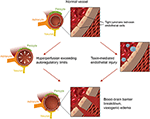
Figura 2. Ilustração das duas principais teorias da fisiopatologia subjacente de PRES., Agradecimentos: cortesia de Caroline O ” Driscoll, MA (ela ilustrou isso por conta própria e é uma funcionária da nossa universidade).
as manifestações clínicas dependem da(s) Região (ões) envolvida (s) do cérebro; assim, a apresentação pode ser ampla. Por exemplo, o envolvimento primário dos lobos occipitais pode resultar em distúrbios visuais/alucinações. Os défices neurológicos focais correspondentes à localização das lesões focais ocorrem em ~5-15% dos doentes com PRES (23)., Raramente, o envolvimento da espinal medula pode resultar em sinais clínicos e sintomas de mielopatia ou paralisia (24).
Imaging
As its name suggests, PRES typically manifests on imaging studies as posterior-predominant white matter vasogenic edema. Os lobos parietal e occipital estão quase universalmente envolvidos e os achados são tipicamente simétricos e bilaterais (1). O envolvimento dos lobos frontais, particularmente adjacentes ao sulco frontal superior, também é comumente visto., Edema vasogênico, embora possa envolver a matéria cinzenta cerebral, é muitas vezes mais facilmente apreciado na matéria branca subcortical. O exame de tomografia computadorizada é frequentemente o teste inicial de imagiologia em caso de sintomas neurológicos agudos e pode demonstrar hipoattenuação da matéria branca em regiões afetadas (25) (Figura 3: CT de PRES). No geral, os resultados são melhor retratados por ressonância magnética, que exibe aumento de sensibilidade e melhor caracterização anatômica em comparação com a CT (26). Adicionalmente, a ressonância magnética pode ajudar a distinguir outros estados patológicos que podem manifestar-se clinicamente semelhantes aos PRES., As sequências de FLAIR T2 ponderadas e T2 (recuperação de inversão atenuada do fluido), em particular, são mais úteis para detectar edema vasogénico na IRM (Figura 4: MR De PRES; Figura 5: MR De PRES Coronal).
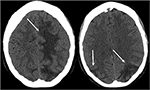
a Figura 3. Doente com lúpus eritematoso sistémico e glomerulonefrite rapidamente progressiva apresentando convulsões. As imagens CT não-contrastantes da cabeça mostram edema vasogênico nos lobos parietal e occipital bilaterais, esquerdo maior que direito, bem como a extensão para o lobo frontal esquerdo.,
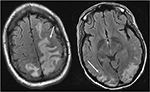
Figura 4. Doente com lúpus eritematoso sistémico e glomerulonefrite rapidamente progressiva apresentando convulsões. As imagens de T2-FLAIR da cabeça demonstram edema vasogênico nos lobos parietal e occipital bilaterais, esquerdo maior que direito, bem como a extensão para o lobo frontal esquerdo. Note – se que com o padrão vasogénico do edema, há poupamento da anormalidade do sinal no córtex.
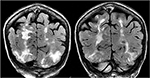
Figura 5., Doente com história de mielofibrose primária e transplante de medula óssea com Tacrolimus apresentando crises pela primeira vez. Sequências de T2-FLAIR Coronal demonstram uma grande anormalidade do sinal nos lobos occipital e parietal bilaterais, como é típico com PRES.
o diagnóstico diferencial para PRES é amplo e inclui entidades com uma hiperintensidade semelhante da matéria branca T2., Exemplos incluem: isquemia / enfarte( particularmente circulação posterior), doenças desmielinizantes, etiologias infecciosas (meningite, encefalite), leucoencefalopatia multifocal progressiva (LMP), vasculite e várias doenças metabólicas (27). Pensa-se que uma entidade clinicamente relacionada chamada síndrome de vasoconstrição cerebral reversível (RCVS) seja causada por alterações no tom vascular cerebral resultando em vasoconstrição., Os RCVS manifestam-se como dores de cabeça recorrentes, convulsões, AVC e hemorragia subaracnóide não aneurisma (28), que pode ser confundida com PRES em uma base clínica. Esta entidade tipicamente ocorre no período pós-parto ou após a exposição a medicamentos adrenérgicos ou serotoninérgicos. Os RCVS podem ser diagnosticados com estudos angiográficos demonstrando áreas multifocais de estreitamento envolvendo as artérias cerebrais (29). Este diagnóstico pode ser confundido com o fato de que RCVS e PRES muitas vezes ocorrem concomitantemente, que o neuroradiologista deve estar ciente para evitar o diagnóstico errado (30).,
PRES pode tipicamente ser distinguido da isquemia aguda porque esta última invariavelmente demonstra edema citotóxico e restrição de difusão. Difusão restrita em isquemia aguda pode ser facilmente detectada em imagens ponderadas por difusão (DWI) e coeficiente de difusão aparente (ADC) como um sinal de hiperintenção em DPI com o correspondente sinal diminuído em ADC (devido ao movimento relativamente diminuído de moléculas de água intracelulares)., Edema vasogénico no ajuste do PRES, por outro lado, pode mostrar sinal hiperintenso no DPI que não é acompanhado por um sinal correspondente de diminuição no ADC (31). Além disso, isquemia aguda tende a ser unilateral e dentro de um território vascular singular. Embora a avaliação da restrição de difusão para diferenciar PRES de anormalidade isquêmica geralmente é confiável, existem casos raros de PRES que podem ser associados com áreas de restrição de difusão sobrepostas em áreas do edema vasogênico isolado mais classicamente visto.,
técnicas de imagem”avançadas” em PRES foram recentemente descritas como uma ferramenta adjunta em casos difíceis ou equívocos. Estas técnicas avançadas de imagiologia incluem: CT / MR perfusion, Mr Spectroscopy (Mr), Susceptibility weighted imaging (SWI), and nuclear medicine techniques, including single-photon emission tomography (SPECT) and positron emission tomography (PET) with varying radiotracers. Embora uma discussão completa esteja além do escopo desta revisão, uma variedade de achados de imagem pode ser visto nestas técnicas avançadas para ajudar a sugerir um diagnóstico de PRES., A hiperperfusão pode ser observada em estudos de perfusão CT/MR demonstrados por aumento do fluxo sanguíneo cerebral e volume sanguíneo com redução do tempo de perfusão e tempo médio de trânsito (32) embora tenham sido notificados casos de hipoperfusão (33). Na MRS, verifica-se geralmente uma redução na razão N-Acetilaspartato (NAA)/creatina (Cr) e Naa/Colina (Chol), sugerindo uma perturbação das sinapses normais e da função neuroaxonal (34). A SWI pode ajudar a identificar a presença de hemorragia no PRES, com maior sensibilidade do que a imagem do GRE (35)., A imagem SPECT/PET demonstra tipicamente hiperperfusão ou hipoperfusão (semelhante a estudos de perfusão CT / MR) com baixo metabolismo por FDG-PET (36).adicionalmente, o PRES pode ser distinguido de outras condições, tais como a encefalite autoimune no contexto da encefalomielite aguda disseminada (ADEM) pelo primeiro edema vasogénico difuso bilateral mas assimétrico difuso (37)., PML pode ter uma aparência semelhante quando comparado com PRES, tendo uma predominância parieto-occipital, mas pode ser distinguido por seu envolvimento mais unilateral ou assimétrico, bem como predileção para a matéria branca subcortical (38).características de imagem atípicas
características atípicas de PRES incluem áreas de intensificação do contraste, hemorragia ou restrição de difusão (39)., Embora o parietal e occipital lobos estão geralmente envolvidos, atípico áreas de envolvimento podem ser vistos, incluindo: tronco cerebral, cerebelo, corpo caloso, e outras áreas cerebrais, com mais áreas comuns, incluindo os lobos frontais (em até 68%) e inferior dos lobos temporais (até 40%) (23, 40) (Figura 6: Cerebelo; Figura 7: Tronco cerebral).
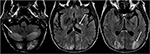
Figura 6. Doente com transplante hepático 6 semanas antes. O doente foi iniciado com Tacrolimus após transplante hepático., Imagens T2-FLAIR do cérebro demonstram anormalidade de sinal nos lobos occipitais. Há também uma extensa anormalidade de sinal Vista nos hemisférios cerebelares bilaterais e dentro do talami. Estes resultados resolveram-se rapidamente após a paragem do Tacrolimus.
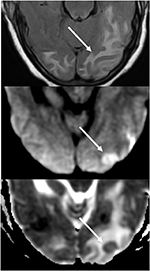
a Figura 7. Doente com hipertensão não controlada que apresente Alteração do estado mental. A imagem T2-FLAIR (superior) demonstra edema nos lobos occipitais., As imagens DPI (do meio) e ADC map (do fundo) demonstram uma pequena seta de difusão restrita, com sinal hiperintenso no dpi e hipointensidade correspondente no mapa ADC.
adicionalmente, uma descoberta precoce de PRES, que pode preceder o edema parieto-occipital típico inclui a hiperintensidade slcal FLAIR suave e potenciação leptomeningeal em imagens ponderadas pós-contraste T1, como descrito por Nakagawa et al. (41). Benziada-Boudour et al., (42) descreveu um desenvolvimento concomitante de edema citotóxico, resultando em difusão restrita (Figura 8: restrição de difusão). Inerente ao nome do processo da doença, os achados relacionados com PRES são geralmente reversíveis, com normalização de achados clínicos e imagiológicos uma vez que o problema incitante é tratado. No entanto, em alguns casos, áreas de difusão restrita podem resultar em lesões permanentes no parênquima cerebral (Figura 9: necrose Laminar)., Hemorragia é menos comum em PRES, ocorrendo em 5-30% dos casos, mas deve ser reconhecido como não confundir este achado com outra entidade patológica no ambiente clínico apropriado do PRES (39). Os achados de imagem na hemorragia podem incluir: hematoma focal, hemorragia petequial, e/ou hemorragia subaracnóide (43) (Figura 10: hemorragia).
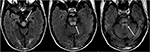
Figura 8. Doentes com história de transplante hepático duas semanas antes com Tacrolimus., As imagens T2-FLAIR mostram anormalidade de sinal dentro do mesencéfalo, pons, e pedúnculos cerebelares superiores.
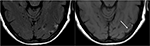
Figura 9. A imagem T2-FLAIR (esquerda) num doente com hipertensão não controlada e imagens prévias indicando PRES (ver Figura 6), agora controlada e 6 semanas mais tarde, demonstra a resolução do edema anteriormente observado. Pequenas áreas de gliose devido a lesão são vistas no lobo temporal esquerdo. T1 Axial Não-contraste mostra necrose laminar cortical curvilinear relacionada com a lesão anterior relacionada com PRES., Embora o PRES geralmente seja totalmente reversível, pode resultar em lesão permanente em algumas situações.
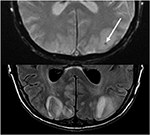
Figura 10. Doentes com transplante hepático prévio com Tacrolimus. Gradiente T2 chamado Eco (top) demonstra uma área focal de hemorragia dentro do edema vasogênico no lobo occipital esquerdo. T2-FLAIR demonstra a descoberta mais típica relacionada com PRES com anormalidade de sinal nos lobos occipitais bilaterais.,
o tratamento
o tratamento com PRES é tipicamente destinado a controlar a etiologia primária que causa PRES (44). Por exemplo, em casos de pressão arterial elevada, o tratamento destina-se a corrigir a pressão arterial elevada num ambiente controlado, semelhante à abordagem para Urgência/ Emergência hipertensiva (45). Normalmente, procura-se uma redução Não rápida da pressão arterial para evitar o risco de causar doença isquémica cerebral como resultado de uma redução drástica da pressão arterial (46)., Ocasionalmente, medicamentos anticonvulsivantes são usados como terapia adjuvante, embora o(s) agente (s) ideal (s), tempo e duração do tratamento permanecem controversos (4) (Figura 11: antes e depois).
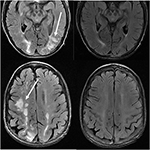
Figura 11. Doentes com história de mielofibrose primária e transplante de medula óssea com Tacrolimus. Imagens axiais T2-FLAIR demonstram as áreas de anormalidade de sinal nos lobos parietal e occipital, e lobo frontal direito (imagens da esquerda)., O Tacrolimus foi interrompido e as imagens de seguimento (imagens correctas) foram obtidas 6 semanas após as imagens iniciais.
em casos de eclampsia (Pré), o tratamento destina-se à entrega atempada do feto, bem como à gestão da pressão arterial e ao sulfato de magnésio para a profilaxia das crises (47). No caso de Prés induzidos por quimioterapeutas ou outros imunossupressores, a redução gradual ou a descontinuação absoluta do fármaco demonstrou melhoria clínica e radiológica (48) (Figura 12: Eclampsia)., Hipomagnesemia é um achado comum em PRES e um possível fator etiológico. Assim, os autores têm sugerido que a suplementação de magnésio pode ser um complemento útil na gestão do PRES (49).
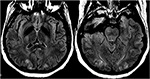
Figura 12. Paciente com eclampsia e com convulsões. As imagens axiais T2-FLAIR demonstram anormalidade de sinal simétrico nos lobos occipitais bilaterais.,
a conclusão
PRES é uma entidade única com resultados clínicos e neuroradiológicos característicos, para além de uma miríade de causas bem documentadas. Embora o(s) mecanismo (s) fisiopatológico (s) preciso (is) por trás do PRES ainda não tenha sido elucidado (e pode ser devido a uma combinação de processos inter-relacionados), o mecanismo geralmente aceito é a disfunção da barreira hemato-encefálica resultando em edema vasogênico com predominância da circulação posterior., As características de imagem são melhor avaliadas em sequências de MR sensíveis ao fluido que revelam hiperintensidades predominantes de matéria branca parieto-occipital T2, embora muitas características de imagem atípicas podem ser vistas e devem ser mantidas em mente ao avaliar casos desafiadores. Várias ferramentas avançadas de imagem estão disponíveis para ajudar em casos difíceis ou equívocos. O tratamento destina-se a gerir a causa subjacente com atenção específica à monitorização da pressão arterial e possível profilaxia de crises.,
contribuições do autor
conflito de interesses
os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
1. Bartynski WS. Síndrome de encefalopatia reversível Posterior, Parte 1: imagiologia fundamental e características clínicas. Am J Neuroradiol. (2008) 29:1036–42. doi: 10.3174 / ajnr.,A0928
CrossRef Full Text | Google Scholar
3. Bartynski WS. Posterior reversible encephalopathy syndrome, Part 2: controversies surrounding pathophysiology of vasogenic edema. Am J Neuroradiol. (2008) 29:1043–9. doi: 10.3174/ajnr.A0929
CrossRef Full Text | Google Scholar
5. Singer S, Grommes C, Reiner AS, Rosenblum MK, DeAngelis LM. Posterior reversible encephalopathy syndrome in patients with cancer., Oncologist. (2015) 20:806–11. doi: 10.1634/theoncologist.2014-0149
PubMed Abstract | CrossRef Full Text | Google Scholar
6. How J, Blattner M, Fowler S, Wang-Gillam A, Schindler SE. Chemotherapy-associated posterior reversible encephalopathy syndrome: a case report and review of the literature. Neurologist. (2016) 21:112–7. doi: 10.1097/NRL.,0000000000000105
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Habetz K, Ramakrishnaiah R, Raina SK, Fitzgerald RT, Hinduja A. Posterior reversible encephalopathy syndrome: a comparative study of pediatric versus adult patients. Pediatr Neurol. (2016) 65:45–51. doi: 10.1016/j.pediatrneurol.2016.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Fugate JE, Rabinstein AA., Posterior reversible encephalopathy syndrome: clinical and radiological manifestations, pathophysiology, and outstanding questions. Lancet Neurol. (2015) 14:914–25. doi: 10.1016/S1474-4422(15)00111-8
CrossRef Full Text | Google Scholar
9. Zama, D, Gasperini P, Berger M, Petris M, De Pasquale MD, et al. A survey on hematology-oncology pediatric AIEOP centres: the challenge of posterior reversible encephalopathy syndrome. Eur J Haematol. (2018) 100:75–82. doi: 10.1111/ejh.,12984
CrossRef Full Text | Google Scholar
12. Gupta V, Bhatia V, Khandelwal N, Singh P, Singhi P. Imaging findings in pediatric posterior reversible encephalopathy syndrome (PRES): 5 years of experience from a tertiary care center in India. J Child Neurol. (2016) 31:1166–73. doi: 10.1177/0883073816643409
PubMed Abstract | CrossRef Full Text | Google Scholar
13., Hinduja a, Habetz K, Raina S, Ramakrishnaiah R, Fitzgerald RT. Preditors of poor outcome in patients with posterior reversible Encyclopedia syndrome. Int J Neuroci. (2017) 127:134–44. doi: 10.3109/00207454.2016.1152966
PubMed Resumo | CrossRef Texto Completo | Google Scholar
15. MacKenzie ET, Strandgaard S, Graham DI, Jones JV, Harper AM, Farrar JK. Efeitos da hipertensão aguda induzida em gatos no calibre arteriolar pial, fluxo sanguíneo cerebral local e barreira hematoencefálica. Circ Res., (1976) 39:33–41. doi: 10.1161/01.RES.39.1.33
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bartynski WS, Zeigler Z, Spearman MP, Lin L, Shadduck RK, Lister J. Etiology of cortical and white matter lesions in Cyclosporin-A and FK-506 neurotoxicity. Am J Neuroradiol. (2001) 22:1901–14.
PubMed Abstract | Google Scholar
21. Bartynski WS, Boardman JF, Zeigler ZR, Shadduck RK, Lister J., Posterior reversible encephalopathy syndrome in infection, sepsis, and shock. Am J Neuroradiol. (2006) 27:2179–90.
PubMed Abstract | Google Scholar
22. Mayama M, Uno K, Tano S, Yoshihara M, Ukai M, Kishigami Y, et al. Incidence of posterior reversible encephalopathy syndrome in eclamptic and patients with preeclampsia with neurologic symptoms. Am J Obstet Gynecol. (2016) 215:239.e1–e5. doi: 10.1016/j.ajog.2016.02.,039
PubMed Abstract | CrossRef Full Text | Google Scholar
23. McKinney AM, Short J, Truwit CL, McKinney ZJ, Kozak OS, SantaCruz KS, et al. Posterior reversible encephalopathy syndrome: incidence of atypical regions of involvement and imaging findings. Am J Roentgenol. (2007) 189:904–12. doi: 10.2214/AJR.07.2024
PubMed Abstract | CrossRef Full Text | Google Scholar
24., de Havenon A, Joos Z, Longenecker L, Shah L, Ansari S, Digre K. Posterior reversible encephalopathy syndrome with spinal cord involvement. Neurology. (2014) 83:2002–6. doi: 10.1212/WNL.0000000000001026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Dandoy CE, Linscott LL, Davies SM, Leach JL, Myers KC, El-Bietar J, et al., Clinical utility of computed tomography and magnetic resonance imaging for diagnosis of posterior reversible encephalopathy syndrome after stem cell transplantation in children and adolescents. Biol Blood Marrow Transplant. (2015) 21:2028–32. doi: 10.1016/j.bbmt.2015.07.023
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Noda K, Fukae J, Fujishima K, Mori K, Urabe T, Hattori N, et al., Reversible cerebral vasoconstriction syndrome presenting as subarachnoid hemorrhage, reversible posterior leukoencephalopathy, and cerebral infarction. Intern Med. (2011) 50:1227–33. doi: 10.2169/internalmedicine.50.4812
CrossRef Full Text | Google Scholar
31. Doelken M, Lanz S, Rennert J, Alibek S, Richter G, Doerfler A, et al. Differentiation of cytotoxic and vasogenic edema in a patient with reversible posterior leukoencephalopathy syndrome using diffusion-weighted MRI. Diagn Interv Radiol., (2007) 13:125–8.
Google Scholar
32. Wartenberg KE, Parra A. CT and CT-perfusion findings of reversible leukoencephalopathy during triple-H therapy for symptomatic subarachnoid hemorrhage-related vasospasm. J Neuroimaging. (2006) 16:170–5. doi: 10.1111/j.1552-6569.2006.00031.x
CrossRef Full Text | Google Scholar
33. Vanacker P, Matias G, Hagmann P, Michel P., Cerebral hypoperfusion in posterior reversible encephalopathy syndrome is different from transient ischemic attack on CT perfusion. J Neuroimaging. (2015) 25:643–6. doi: 10.1111/jon.12158
CrossRef Full Text | Google Scholar
34. Lee SY, Kim SH, Lee SH, Baek HJ, Shon HS, Kim SS. Serial MR spectroscopy in relapsing reversible posterior leukoencephalopathy syndrome. Neurologist. (2009) 15:338–41. doi: 10.1097/NRL.,0b013e3181914af6
PubMed Abstract | CrossRef Full Text | Google Scholar
35. McKinney AM, Sarikaya B, Gustafson C, Truwit CL. Detection of microhemorrhage in posterior reversible encephalopathy syndrome using susceptibility-weighted imaging. Am J Neuroradiol. (2012) 33:896–903. doi: 10.3174/ajnr.A2886
PubMed Abstract | CrossRef Full Text | Google Scholar
38., Berger JR, Aksamit AJ, Clifford DB, Davis L, Koralnik IJ, Sejvar JJ, et al. PML diagnostic criteria: consensus statement from the AAN neuroinfectious disease section. Neurologia. (2013) 80:1430-8. doi: 10.1212 / WNL.0b013e31828c2fa1
PubMed Resumo | CrossRef Texto Completo | Google Scholar
39. Aranki-Trenkić And, Stojanov D, Trenkić M, Radovanovic Z, Ignjatovic J, Ristic S, et al., Atypical presentation of posterior reversible encephalopathy syndrome: clinical and radiological characteristics in eclamptic patients. Bosn J Basic Med Sci. (2016) 16:180–6. doi: 10.17305/bjbms.2016.1201
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Bartynski WS, Boardman JF. Distinct imaging patterns and lesion distribution in posterior reversible encephalopathy syndrome. Am J Neuroradiol. (2007) 28:1320–7. doi: 10.3174/ajnr.,A0549
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Brickman AM, Reitz C, Luchsinger JA, Manly JJ, Schupf N, Muraskin J, et al. Long-term blood pressure fluctuation and cerebrovascular disease in an elderly cohort. Arch Neurol. (2010) 67:564–9. doi: 10.1001/archneurol.2010.70
PubMed Abstract | CrossRef Full Text | Google Scholar
47., Cozzolino M, Bianchi C, Mariani G, Marchi L, Fambrini M, Mecacci F. Therapy and differential diagnosis of posterior reversible encephalopathy syndrome (PRES) during pregnancy and postpartum. Arch Gynecol Obstet. (2015) 292:1217–23. doi: 10.1007/s00404-015-3800-4
PubMed Abstract | CrossRef Full Text | Google Scholar
48. Masetti R, Cordelli DM, Zama D, Vendemini F, Biagi C, Franzoni E, et al. PRES in children undergoing hematopoietic stem cell or solid organ transplantation. Pediatrics., (2015) 135:890–901. doi: 10.1542/peds.2014-2325
CrossRef Full Text | Google Scholar