Introducere
mortalitatea Purceilor este una dintre principalele caracterele de selecție în creșterea porcilor și este influențată de scroafe, purcei, și a mediului. Prin urmare, mortalitatea purceilor este un fenotip complex și depinde de capacitatea scroafei de a-și crește descendenții, dar este și o funcție a greutății la naștere, a managementului și a selecției (Knol et al., 2002)., Cu toate acestea, defectele recesive monogene contribuie și la mortalitatea purceilor, deși doar câteva exemple au fost raportate în trecut (Murgiano et al., 2012; Matika și colab., 2019). Chiar și în acele cazuri în care efectul mutației este sever, selectarea eficientă împotriva unei astfel de mutații este împiedicată de frecvența scăzută. În multe defecte severe, zigoții mor foarte devreme în gestație, fără a lăsa altă urmă decât absența homozigoților în populație în general (Derks et al., 2019).,efectele consangvinizării la populațiile Comerciale de porci sunt de obicei ținute sub control prin creșterea selectivă pentru scăderea mortalității la purcei prin îmbunătățirea atât a abilităților de mamă, cât și a viabilității purceilor (Olijslagers, 2018). Cu toate acestea, variantele de fond al sistemului recesiv monogenice defecte nu sunt bine capturate în valorile de reproducere, și, eventual, drift la frecvențe mai mari, ca urmare a intens de selecție (Georges et al., 2019). Mai mult, aceste variante pot fi menținute și ca rezultat al selecției de echilibrare pentru un efect pozitiv corelat în starea heterozigotă (Derks et al., 2018).,defectele recesive contribuie doar marginal la mortalitatea generală a purceilor (Alonso-Spilsbury et al., 2007). Cu toate acestea, variantele care afectează mortalitatea purceilor sunt de o importanță deosebită, deoarece aceste variante influențează direct producția și bunăstarea animalelor (Baxter et al., 2013; Rutherford și colab., 2013). Cu toate acestea, în gestionarea populației de animale, apariția defectelor cu frecvență joasă este de obicei slab documentată (adesea se folosesc termeni foarte generali), iar sindroamele sunt adesea recunoscute doar după ce au atins o frecvență ridicată., Acest lucru este relevant în special pentru sindroamele care nu duc la fenotipuri foarte distincte. Prin urmare, chiar și în populațiile Comerciale de reproducție se poate face puțină urmărire pe sindroame specifice și, prin urmare, pentru a selecta eficient împotriva sindroamelor specifice cu frecvență joasă necesită noi abordări.în această lucrare, descriem descoperirea unui sindrom extrem de debilitant la o populație comercială de porci printr-un sondaj bazat pe o matrice SNP combinată cu densitate medie și secvențiere a genomului întreg (WGS)., Studiul a condus la identificarea unei deleții frameshift 16-bp în gena SPTBN4, cu consecințe fenotipice clare prezise în homozigote. Frecvența purtătoare este de aproximativ 9% în populația studiată, afectând aproximativ 0, 81% din populația de pui. Frecvența a fost suficient de scăzută pentru a fi necunoscută pentru a avea o bază genetică și chiar a fi efectiv nerecunoscută ca un sindrom specific. La punerea în aplicare a anchetei, o scroafă gestantă a fost identificată de un mistreț purtător., Purceii afectați suferă de miopatie și nu sunt capabili să meargă, de obicei ducând la moarte în câteva ore după naștere, complet în conformitate cu patologia prezisă în comparație cu cazurile similare de om și șoarece.
Material și Metode
Animale, Genotipuri, și Pre-Procesare
setul De date este format din 31,839 animale dintr-o sintetic boar conformitate cu mari fundal alb. Linia este menținută și crescută în fermele Topigs Norsvin nucleus, selectând în primul rând trăsăturile de producție și de sănătate., Animalele au fost genotipate pe cipul SNP Illumina GeneSeek custom 50K (Lincoln, NE, SUA). Animalele cu o frecvență a genotipurilor lipsă > 0,15 au fost eliminate. Am aruncat markeri care nu îndeplinesc următoarele criterii de filtrare: Un minim rata de 0.85, un minor frecvența alelei > 0.01, și un Hardy-Weinberg proporții testul exact valoarea p mai jos, P < 10-12. Mai mult decât atât, markere cu locație necunoscută pe Sscrofa11.1 genomului construi au fost eliminate, lăsând 41,573 markeri după filtrare., Toate etapele au fost efectuate în Plink v1.90b3.30 (Purcell et al., 2007).
Haplotip Treptată și Identificarea SSC6 Haplotip
Am efectuat haplotip treptată și imputarea lipsei site-uri în Beagle5.0 cu parametru pentru mărimea efectivă a populației setat la 100, alte setări au fost implicite (Browning et al., 2018). Homozigoții așteptați au fost estimați pe baza frecvenței haplotipului, folosind principiul Hardy-Weinberg. Un test binomial exact a fost aplicat pentru a testa numărul de homozigote observate cu numărul de homozigote așteptate., Haplotipul a fost considerat epuizat semnificativ dacă P < 5 × 10-3.
Efecte Fenotipice Asociate Cu SSC6 Haplotip
Am examinat SSC6 haplotip pentru înregistrările privind numărul total născut, numărul de născuți morți, mumifiați purcei, fătări de supraviețuire, și lactație survival (supraviețuire până la aproximativ 21 de zile de vârstă) dintr-un total de 9,666 litri. Am enumerat aceste fenotipuri pentru toate CXC, și litters cxn identificate. Am folosit testul T Welch pentru a evalua dacă fenotipurile din puțurile CxC diferă semnificativ de puțurile CxN. O valoare p < 0.,05 a fost considerat semnificativ.
analiza secvențierii întregului genom și identificarea variantelor Candidate
setul de date este format din 71 de indivizi secvențiați în genom întreg din populația studiată. Toate cele 71 de probe au fost, de asemenea, prezente în setul nostru de date de 31,839 animale genotipuri de pe la 50K. Cele 71 de probe au un volum total de 1.93 Tbp (tera perechi de baze) de la 14.16 miliarde de 150-bp asociat-end citește (Tabelul S3). Probele au fost secvențiate pe Illumina HiSeq 2000. Am aliniat secvențele la construirea genomului Sscrofa11.1 folosind versiunea BWA-MEM 0.7.,15 (Li și Durbin, 2009) cu o mapabilitate medie de 98,9% și o acoperire a eșantionului cuprinsă între 8,8 și 14,8 X (10,9 x medie). Samblaster a fost folosit pentru a elimina duplicatele PCR (Faust și Hall, 2014). Samtools a fost folosit pentru a sorta, îmbina și indexa fișierele bam (Li et al., 2009). Cartografierea și statisticile de calitate au fost generate folosind Qualimap (Okonechnikov et al., 2016). Apelarea variantei a fost efectuată cu Freebayes v1.1.0 cu următoarele setări: –min-base-quality 10 –min-alternate-fraction 0.2 –haplotype-length 0 –min-alternate-count 2 (Garrison și Marth, 2012)., Variantele cu scorul de calitate Phred < 20 au fost eliminate (Li et al., 2009). Variantele au fost adnotate folosind Ensembl variant effect predictor (VEP, release 96) (Mclaren et al., 2016). Impactul variantelor missense a fost prezis folosind sortarea intolerantă din tolerantă (SIFT) (Kumar et al., 2009). Analiza LD a fost efectuată utilizând Plink v1.90b3.30 (Purcell et al., 2007) cu următoarele setări –chr-set 18, –r2, LD-fereastră-r2 0.8.
alinierea proteinelor SPTBN4
alinierea proteinelor între tipul sălbatic și proteina mutantă a fost efectuată utilizând ClustalO (Madeira et al.,, 2019) și vizualizate folosind ESPript 3 (Robert și Gouet, 2014). Vizualizarea și validarea ulterioară au fost efectuate utilizând jbrowse genome viewer versiunea 1.12.1 (Skinner et al., 2009).
Validare de Cauzalitate 16 bp SPTBN4 Stergere
PCR a fost făcut cu ajutorul de 60 ng ADN genomic, cu 0,4 µm din fiecare primer, 1.8 mM MgCl2, și 25 de unități/ml OneTaq® ADN-Polimerazei (OneTaq® 2X Mix Master cu Standard Buffer, New England Biolabs) în producatorului PCR buffer într-un volum final de 12 µl., Denaturare inițială 1 min la 95°C a fost urmat de 35 de cicluri de 95°C timp de 30 s, 55°C timp de 45 s, 72°C 90 s, urmată de o 5 min de prelungire 72°C. PCR grunduri pentru SPTBN4 sunt TCAAGGGTGCAGGCTCTTTC înainte și GGTAGGAAGCTCGAAGTGGG inversă. Primerul înainte a fost marcat cu colorant fie cu 6-FAM pentru a produce un produs PCR marcat fluorescent detectabil pe secvențiatorul ADN ABI 3730 (Applied Biosystems). Dimensiunile fragmentelor au fost determinate folosind software-ul GeneMapper 5 de la ABI.,
examen histopatologic
doi purcei afectați cu vârsta mai mică de 1 săptămână au fost trimiși la Departamentul de patologie al sănătății animale Regale (Deventer) pentru examinare. Macroscopic, toate observațiile au fost în limite normale. Mușchiul scheletic al piciorului anterior, al mușchiului dorsal și al piciorului posterior al ambelor animale a fost prelevat pentru colorarea de rutină H&E și PTAH. Țesutul muscular a fost depozitat în borcane separate și fixat în soluție de formaldehidă 4%, tamponat (=soluție de formalină 10%, tamponat)., După aceea, țesutul a fost încorporat în parafină și tăiat în 2 µm conform procedurii standard de operare (SOP RAH). Ulterior, lamele au fost deparaffinized și de rutină colorate pentru hematoxilină și eozină (H&E) într-o culoare automată mașină. În același timp, au fost pregătite diapozitive suplimentare de 2 µm de țesut muscular, precum și o lamelă de control pozitivă a țesutului muscular pentru colorarea manuală cu „hematoxilină cu acid fosfotungstic”, abreviată ca PTAH. Această colorare este preferată pentru demonstrarea striațiilor încrucișate ale mușchilor scheletici.,
valorile de reproducție și analiza asociațiilor
în acest studiu, am evaluat 63 de trăsături utilizate în programul de reproducere. Valorile de reproducere estimate deregresate (DEBV) au fost utilizate ca variabilă de răspuns pentru fiecare trăsătură studiată. Valoarea estimată a reproducerii (EBV) a tuturor trăsăturilor evaluate a fost eliminată utilizând metodologia descrisă de Garrick et al. (2009). VEB a fiecărui animal a fost obținută din evaluarea genetică de rutină printr-un program de reproducere comercială (Topigs Norsvin) folosind un model animal., Dependențele per animal în scopul deregresiunii au fost extrase din evaluarea genetică bazată pe metodologia Tier and Meyer (2004). Heritabilitățile utilizate pentru deregresiune au fost, de asemenea, extrase din evaluarea genetică de rutină. În cele din urmă, factorii de ponderare bazați pe fiabilitatea estimată a DEBV au fost, de asemenea, estimați în conformitate cu Garrick et al. (2009) folosind o valoare de 0,5 pentru scalar c. pentru a asigura calitatea DEBV, numai animalele cu un factor de ponderare mai mare decât zero și o fiabilitate a DEBV mai mare decât 0.,20 au fost utilizate în analizele Asociației. Fiabilitatea DEBV a fost obținută și în conformitate cu Garrick et al. (2009).
analizele de Asociere au fost efectuate folosind software-ul ASREML (Gilmour et al.,, 2009) aplicarea următoarelor liniară mixtă de animale model:
în cazul în care DEBVij este observat DEBV pentru animale j, w este factorul de ponderare pentru rezidual, µ este în general DEBV înseamnă a populației, Ri este purtător de statut (număr de dăunătoare alelă) de 4 mutație eu, aj este efectul genetic aditiv estimate folosind un pedigree-bazate pe relația medie matrice, și de eroare reziduală. Asociațiile cu a −log10(valoarea P) mai mare de cinci au fost declarate semnificative.
rezultate
A 1.,5 Mb Segment pe Cromozomul 6 Afectează Alăptarea Supraviețuire în Porci
Am analizat 31,638 animale dintr-un singur vier rasa pura linie (sintetic conformitate cu mari fundal alb), genotipuri pe Porcină 50K SNP cip (Sscrofa11.1 build) (Warr et al., 2019). Analiza a relevat un segment de 1,5 Mb pe cromozomul 6 (SSC6:48.75–50.25) care prezintă un deficit de homozigozitate asociat cu supraviețuirea lactației reduse (tabelele 1 și 2). Haplotipul este segregat la o frecvență moderată a alelei de 4, 5% (9, 0% frecvență purtătoare) în populația studiată., Frecvența haplotipului a fluctuat în ultimul deceniu, dar a scăzut în ultimii 3 ani (figura S1). Am testat dacă frecvența a fost determinată de un efect avantaj heterozigot. Cu toate acestea, am găsit în mare parte asocieri negative cu trăsături de selecție importante, cu excepția adâncimii coapsei și a lungimii gestației (Tabelul 3), ceea ce sugerează că frecvența este pur rezultatul derivării genetice.

Tabelul 1 SSC6 haplotip caracteristici.,

Tabelul 2 Purtător-de-transport litri show scădere de 24% în lactație de supraviețuire comparativ cu transport prin non-purtătoare de litri. Rezultatele semnificative sunt indicate cu caractere aldine.

Tabelul 3 Trăsături asociate semnificativ cu heterozigot purtători de SPTBN4 stergere.
52 purtător-de-transport (CxC) litri arată nici o reducere semnificativă în numărul total născut sau liveborn animale., Cu toate acestea, alăptarea supraviețuirea este redusă cu aproximativ 24% în CxC de litri, comparativ cu purtător-de-noncarrier (CxN) împerecheri, indicând faptul că homozigotă purceii mor în perioada de lactație (Tabelul 2). În continuare, am examinat observațiile privind timpul și cauza mortalității puilor de CxC. Acest lucru a arătat că majoritatea purceilor care au murit în primele 24 de ore după naștere. Majoritatea acestor purcei au fost descriși în cea mai mare parte de fermieri ca „purcel slab la naștere.,”
Intreaga-Secventiere a Genomului Analiza Relevă un 16-bp Frameshift Ștergerea în SPTBN4 ca Probabil Cauzal Varianta
Pentru a identifica cauzalitate mutație, am examinat întregul genom secvența de date de la 71 de animale de la populație în studiu și a identificat cinci animalele purtătoare. Dezechilibru de Linkage (LD), analiza a relevat 267 SNP și indel variante în mare LD (r2 > 0.8) cu SSC6 haplotip (Tabelul S1), majoritatea fiind în perfectă LD (247 variante)., Doar cinci variante pot afecta secvența de codificare (trei missense, un frameshift, un splice-acceptor). Cele trei variante missense sunt prezise a fi tolerate de SIFT (scor > 0.18, tabelul S1), în timp ce varianta splice-acceptor afectează o genă care codifică o peptidă de 28 bp cu funcție necunoscută, puțin probabil să fie cauzală. Cu toate acestea, o variantă complet LD (r2 = 1) cu haplotip a fost prezis pentru a avea un impact ridicat; o 16-bp frameshift ștergerea în exonul 26 de SPTBN4 gene (6:g.48801280delGACGGTGTACGCCGGT) (Figurile 1A, B)., La frameshift stergere (ENSSSCP00000031537:p.Arg1902fs) introduce 30 de noi aminoacizi și un codon stop prematur, care produc o afectare și trunchiat spectrină beta non-eritrocitar 4 proteine (SPTBN4). Mutanții nu au ultimii 662 de aminoacizi din proteina de tip sălbatic (figura 1C), inclusiv domeniul omologiei pleckstrinului (PH) necesar pentru transportul proteinelor către membrane (Wang et al., 2018). Proteina SPTBN4 este un membru al proteinelor beta-spectrinei și este o actină care leagă membrana celulară de citoscheletul actinei., Mutațiile SPTBN4 perturbă mecanismul citoscheletului care controlează localizarea corectă a canalelor ionice în nervii mielinizați care provoacă neuropatii motorii (Parkinson et al., 2001; Wang și colab., 2018).

Figura 1 (UN) SPTBN4 gene model. Locația celui de-al 26-lea Exon afectat este indicată în roșu. (B) ilustrarea eliminării 16-bp. Figura arată tipul sălbatic și Exon mutant. (C) alinierea secvenței proteinei sptbn4 mutante (Mt) și de tip sălbatic (Wt). Mutația induce 30 de aminoacizi noi și un codon Stop prematur.,
Genotipare Cinci CxC Litri Confirmă SPTBN4 Stergerea ca Vinovat Probabil
Noi genotipuri cinci CxC litri pentru 16-bp stergerea care au avut cel puțin doi purcei (intervalul 2-6) care au murit în primele 48 de ore după naștere. Cele cinci pui au produs 53 de purcei din care 19 au fost homozigoți pentru eliminarea de 16 bp (Tabelul 4). Toți cei 19 purcei homozigoți au murit în 48 de ore după naștere (18 în 24 de ore). Din cei 34 de purcei rămași (8 de tip sălbatic și 26 de purtători), doar 1 a murit în 48 de ore, probabil cauzată de alți factori (de mediu).,

Tabelul 4 Genotipare de natură cauzală 16-bp SPTBN4 frameshift ștergerea în cinci purtător-de-transport de litri. Suma pe clasa de genotip este indicată cu caractere aldine.
Purcei Homozigote pentru SPTBN4 Ștergerea Sufera De Miopatie și Membrelor Posterioare Paralizie
Am monitorizat un recent CxC gunoi (fătare data: 28 aprilie 2019) care a produs șase sănătos, doi afectate (probe: 9912, 9916) (Figura 2A), și trei purceii născuți morți., Am confirmat starea de ștergere homozigotă a SPTBN4 pentru cei doi purcei afectați (tabelul S2). Mai mult, am observat patru purtători heterozigoți și doi purcei homozigoți de tip sălbatic printre indivizii sănătoși. Unul dintre purceii născuți morți (eșantion: 9921) a fost, de asemenea, homozigot pentru ștergere, în timp ce ceilalți doi au fost heterozigoți. Purceii afectați suferă de slăbiciune musculară extremă (figurile 2B, C), paralizie a membrelor posterioare și tremor (Video S1). Prin urmare, purceii nu au putut să meargă sau să bea.,
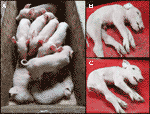
Figura 2 (a) doi purcei afectați (în viață) împreună cu șase pui sănătoși. Purceii provin dintr-o împerechere CxC fătată la 28 aprilie 2019. (B) purcel de sex masculin afectat 9912. (C) purcel de sex feminin afectat 9916.purceii afectați nu au striații încrucișate în mușchii scheletici ai membrelor dorsale și posterioare examenul histopatologic a evidențiat degenerarea împrăștiată a fibrelor musculare la ambii purcei și necroza focală și vasculita în mușchiul dorsal la unul dintre purcei (ID = 9912)., Mai mult, colorarea hematoxilinei cu acid fosfotungstic (PTAH) prezintă o colorare divergentă a fibrelor musculare scheletice, indicând scăderea striațiilor încrucișate, în special în mușchii picioarelor dorsale și posterioare ale animalelor afectate (figura 3B), în timp ce picioarele din față par neafectate (figura 3a). Scăderea striațiilor încrucișate este indicată prin colorarea anormală și pierderea generală a volumului fibrelor musculare (figura 3B). Modificările observate histopatologic în picioarele posterioare și în mușchii dorsali sunt indicative pentru distrofia musculară.,

Figura 3 (A) vedere în secțiune transversală a unui mușchi scheletic de la piciorul din față. Săgeata neagră indică colorarea normală (întunecată) a fibrelor musculare care indică prezența striațiilor încrucișate. PTAH Bar = 50 µm. (B) vedere în secțiune transversală a unui mușchi scheletic de la piciorul din spate. Săgeata neagră indică colorarea anormală (roz) a fibrelor musculare care indică lipsa striațiilor încrucișate. Săgeata galbenă indică colorarea normală și prezența striațiilor încrucișate. PTAH Bar = 50 µm.,
discuție
în această lucrare raportăm un nou defect congenital care provoacă mortalitatea purceilor probabil din cauza unei ștergeri de 16 bp frameshift în gena SPTBN4. Purceii suferă de slăbiciune musculară extremă (miopatie) și mor în câteva ore după naștere. Este de așteptat ca deleția să confere o pierdere completă a funcției spectrinei beta, proteina 4 Non-eritrocitară. SPTBN4 este un membru al familiei genelor spectrin și este necesar pentru gruparea canalelor ionice la nodurile Ranvier, afectând potențialul de acțiune (Devaux, 2010)., Mutațiile perturbă mecanismul citoscheletului care controlează localizarea corectă a canalelor ionice și funcția domeniilor axonale, în principal la segmentele inițiale ale axonului (AIS) și la nodurile Ranvier (Wang et al., 2018). Mai exact, domeniul C-terminal afectat al SPTBN4 este crucial pentru traficul de canale KCNQ2 și excitabilitatea la nodurile Ranvier (Devaux, 2010).cercetările ulterioare de urmărire au identificat cazuri umane și de șoarece care au indicat că sindromul care a urmat probabil nu se va dovedi imediat letal, ci mai degrabă conferă miopatie severă., Prin datele de genotip SNP cu densitate medie, disponibile pentru toate animalele din populația de reproducție (N = 31,839), s-au putut identifica purtători. Printre acești purtători se număra o scroafă care era aproximativ la jumătatea perioadei de sarcină la momentul identificării, provenită de un mistreț care era și purtător. Ferma de reproducție a fost notificată pentru a documenta așternutul la naștere. Observate fenotip afectat purcei (miopatie, membrelor posterioare paralizie, tremor) a fost complet congruent cu ceea ce a fost observată la pacienți umani cu homozigotă de pierdere a funcției sau heterozigot compus mutații în SPTBN4 gene (OMIM: 606214)., Doi dintre pacienții umani au mutații ale pierderii funcției în domeniul PH-ului (Wang et al., 2018), susținând că o pierdere a domeniului PH la porci ar duce probabil la o pierdere completă a funcției proteinei SPTBN4. La om, mutații similare duc la miopatie congenitală severă cauzată de absența fibrelor musculare de tip I, neuropatie și surditate (Knierim et al., 2017; Wang și colab., 2018). Wang și colab. (2018) a observat, de asemenea, neuropatie axonală motorie la mai mulți pacienți caracterizați prin hipotonie congenitală, slăbiciune profundă și pierderea reflexelor tendonului profund până la copilăria timpurie., Mai mult, biopsiile nervoase au evidențiat canale nodale Na+ reduse și niciun canal nodal kcnq2 K+, dezvăluind patologia moleculară care provoacă disfuncții ale sistemului nervos. Prin urmare, concluzionăm că această variantă frameshift este mutația cauzală probabilă care duce la fenotipul observat și epuizarea genotipului homozigot în populație. Studiile viitoare s-ar putea concentra pe realizarea unui knockout in vivo al genei SPTBN4 la porc, pentru a studia mai detaliat sindromul și fenotipul asociat.,nu am observat degenerarea fibrelor musculare în picioarele din față, în timp ce fibrele musculare dorsale și posterioare au fost clar afectate. Această observație ar putea explica parțial paralizia membrelor posterioare, în timp ce picioarele din față nu sunt afectate. Discrepanța dintre fibrele musculare ale picioarelor din față și din spate a fost, de asemenea, descrisă la șoarecii tremurători, în care mutațiile SPTBN4 loss-off-function provoacă neuropatie motorie, paralizie a membrelor posterioare, tremor și surditate centrală (Parkinson et al., 2001; Komada și Soriano, 2002). Parkinson și colab., (2001) descrieți vitezele reduse de conducere a nervilor în nervii sciatici ai șoarecilor cu alele tremurânde care provoacă neuropatia membrelor posterioare periferice. Expresia SPTBN4 la șoareci este limitată la creier, măduva spinării și nervii sciatici și nu este observată în mușchiul scheletic, astfel încât această boală este în primul rând un defect neuronal. În general, rămâne neclar ce mecanism cauzează absența simptomelor în membrele anterioare. Acest „knockout natural” la porci poate fi o resursă utilă pentru a studia boala umană, deoarece porcii sunt de obicei un model mai bun pentru a studia boala umană în comparație cu speciile de rozătoare., Mai mult, consecința pierderii funcției SPTBN4 poate fi studiată mai detaliat.dimensiunea efectivă a populației (Ne) a rasei studiate este estimată la aproximativ 100 (Hidalgo et al., 2016). În creșterea animalelor, Ne scăzut crește riscul ca alelele dăunătoare să crească în frecvență din întâmplare. Mai mult, studiile anterioare au arătat că alelele letale recesive pot fi conduse de efecte avantajoase la heterozigoți (Derks et al., 2018; Matika și colab., 2019). Matika și colab.,, 2019 a găsit o mutație recesivă câștigată în gena MSTN asociată cu o creștere majoră a adâncimii musculare la heterozigoți. Cu toate acestea, nu găsim dovezi pentru niciun avantaj heterozigot în studiul nostru. Cu tehnicile genomice actuale putem identifica acum alele dăunătoare care se deplasează la frecvențe mai mari și monitorizăm cu exactitate apariția unor noi alele dăunătoare, permițând o purjare mai eficientă. Mai mult, rezultatul acestui tip de studiu va îmbunătăți considerabil conștiința defectelor genetice „ascunse” atât la nivel de crescător, cât și la nivel de fermier., Fără nici o informație prealabilă, defecte congenitale rare sunt adesea înregistrate ca ” purcel slab.”Și fără nicio distincție suplimentară a sindroamelor specifice, acțiunile ulterioare nu sunt posibile. În cele mai multe cazuri, nu se cunoaște dacă există o bază genetică sau dacă pot exista alte efecte confuze. Cu informații genomice anterioare, sindromul poate fi identificat, comparativ cu alte cazuri, și purtători identificați, ceea ce duce la informații acționabile.mortalitatea purceilor are o mare importanță economică și pentru bunăstarea animalelor., Prin urmare, descoperirea mutației SPTBN4 a dus la implementarea imediată în programul de reproducere pentru a minimiza frecvența împerecherilor purtătoare cu purtătoare. Acest lucru permite evitarea nașterii persoanelor afectate, îmbunătățind astfel bunăstarea animalelor și reducând pierderile economice.
concluzie
În acest studiu raportăm un defect congenital nou cauzat probabil de o ștergere recesivă a cadrului în gena SPTBN4 la porci. Constatările sunt susținute de asemănări izbitoare cu fenotipurile sindromice asociate SPTBN4 la om și șoareci., Studiul permite monitorizarea și curățarea alelei dăunătoare din populație. Încrucișările între transportatori pot fi prevenite, împiedicând persoanele afectate, reducând astfel pierderile economice și îmbunătățind bunăstarea animalelor. În cele din urmă, aceste „knockouts naturale” obținute în industria de reproducere poate oferi un model pentru boala umană și de a crește înțelegerea noastră a funcției genei în clada de mamifere, și să ofere un model potențial pentru boala umană.,evaluarea etică și aprobarea nu au fost necesare pentru studiul pe animale, deoarece datele utilizate în acest studiu au fost obținute ca parte a colectării de date de rutină din programele de reproducere Topigs Norsvin și nu în mod specific în scopul acestui proiect. Prin urmare, aprobarea unui comitet de etică nu a fost obligatorie. Colectarea probelor și înregistrarea datelor au fost efectuate strict în conformitate cu legea olandeză privind protecția și bunăstarea animalelor (Gezondheids – en welzijnswet voor dieren)., Consimțământul informat în scris a fost obținut de la proprietari pentru participarea animalelor lor la acest studiu.
contribuțiile autorului
MG, H-JM și MD au conceput și proiectat studiul. BH a fost responsabil pentru organizarea generală și comunicarea cu Topigs Norsvin și fermieri. MD și ML au efectuat analiza datelor. BD și KL au efectuat lucrări de laborator. SG-V a efectuat analiza patologică. MD a scris manuscrisul. H-JM, MG, BH, SG-V, BD, KL și ML au oferit comentarii și sugestii utile și au ajutat la redactarea manuscrisului. Datele fenotipice au fost analizate prin ML., Toți autorii au citit și aprobat manuscrisul final.această cercetare a fost finanțată de parteneriatul STW-Breed4Food, Numărul proiectului 14283: de la secvență la fenotip: detectarea variației dăunătoare prin predicția funcționalității. Acest studiu a fost susținut financiar de NWO-TTW și partenerii Breed4Food Cobb Europe, CRV, Hendrix Genetics și Topigs Norsvin. În plus, acest studiu a fost susținut de proiectul IMAGE (Horizon 2020, nr. Finanțatorii nu au avut niciun rol în proiectarea studiului, colectarea și analiza datelor, decizia de publicare sau pregătirea manuscrisului., Utilizarea clusterului HPC a fost posibilă prin CATAgroFood (facilități de cercetare comune Wageningen UR).datele utilizate în acest studiu au fost obținute ca parte a colectării de date de rutină din programele de reproducere Topigs Norsvin și nu în mod specific în scopul acestui proiect. Prin urmare, aprobarea unui comitet de etică nu a fost obligatorie. Colectarea probelor și înregistrarea datelor au fost efectuate strict în conformitate cu legea olandeză privind protecția și bunăstarea animalelor (Gezondheids – en welzijnswet voor dieren).,ML și BH sunt angajați ai Topigs Norsvin Research Center, un institut de cercetare strâns legat de unul dintre finanțatori (Topigs Norsvin).toți autorii rămași declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.ceilalți parteneri Breed4Food Cobb Europe, CRV, Hendrix Genetics, declară că nu au interese concurente pentru acest studiu.,
mulțumiri
autorii le mulțumesc lui Frank van Haaren și Toon Janssen pentru organizarea comunicării cu ferma. Îi mulțumim lui Manon Houben pentru contribuția sa la examinările patologice. Mulțumim Mout Viller pentru că a făcut video și poze cu purceii afectați și sănătoși după naștere. Îi mulțumim lui Jürgen Harlizius pentru îngrijirea purceilor după predare. Mulțumim Gerda van eldik pentru colectarea probelor. Mulțumim Egbert Knol și Egiel Hanenberg pentru sprijinul general și îndrumarea din partea Topigs-Norsvin.,
material suplimentar
Video S1 / Video care arată ambele persoane afectate după naștere.
tabelul S1 / variația genomică în LD mare cu haplotipul SSC6.tabelul S2 / genotiparea litierei CxC, inclusiv două persoane afectate (data fătării: 28 aprilie 2019). Tabelul prezintă starea homozigotă del / del pentru cei doi purcei afectați 9912,9916.
tabelul S3 / cartografiere și statistici de acoperire din probele WGS.
figura S1 / SPTBN4 frecvența purtătoare de ștergere din 2007-2019.