Introducere
stafilococi Coagulazo-negativi (CoNS), membrii de stafilococi grup, sunt caracterizate ca fiind coci Gram-pozitivi, prezentat ca celule singure sau cu dispoziție neregulată, și sunt imobili, non-formare de spori, catalază-pozitiv, cea mai mare parte anaerobe facultative, precum și de lipsa enzimei coagulazei.,1 contra fac parte din microbiota umană, considerată agenți patogeni oportuniști, provocând infecții mai ales la copiii prematuri și la pacienții imunocompromiși și protetici.Creșterea rezistenței antimicrobiene în ultimii ani a avut un impact mare asupra infecțiilor spitalicești cauzate de contra. Oxacilina este o penicilină semisintetică utilizată în testul de susceptibilitate pentru detectarea rezistenței la meticilină și tratamentul infecțiilor stafilococice. Cu toate acestea, ratele de la 66% la 95% din rezistența la oxacilină au fost observate în tulpinile clinice izolate.,2 rezistența la oxacilină este adesea mediată de gena mecA, care codifică o proteină suplimentară de legare a penicilinei (PBP2a) cu afinitate scăzută la penicilinele semisintetice.3 genei mecA este situat pe un genetice mobile element cunoscut ca Stafilococice Casetă Cromozom mec (SCCmec) care conține mec complex, compus din genei mecA și de reglementare sale gene mecI și mecRI, ccr complex, responsabil pentru integrarea și excizia SCCmec, și J regiune, care nu este esențială pentru SCCmec formarea, dar poate transporta non-β–lactamice gene de rezistență.,4 până în prezent, au fost descrise 13 tipuri SCCmec, bazate pe combinația tipurilor complexe de gene ccr și a claselor complexe de gene mec. Subtipurile au fost definite de polimorfismele regiunii J în aceeași combinație de complexe mec și ccr.5
apariția izolatelor rezistente la oxacilină a dus la utilizarea finală a antimicrobienelor alternative pentru tratamentul infecțiilor contra, cum ar fi glicopeptida vancomicină. Între timp, descrierile sensibilității reduse și rezistenței la vancomicină au fost raportate în ultimele decenii.,6 susceptibilitatea redusă la vancomicină poate fi legată de modificări metabolice, cum ar fi accelerarea sintezei peptidoglicanului, având ca rezultat îngroșarea peretelui celular. În acest proces, vancomicina nu este capabilă să inhibe sinteza peptidoglicanului, deoarece este epuizată datorită disponibilității mai mari a situsurilor D-alanil-D-alanină.,7
Având în vedere creșterea în spital infecții cauzate de Contra, acest studiu și-a propus să caracterizeze oxacilină tulpini rezistente și determinarea sensibilității la antimicrobiene a 20 de ani de colectare de cultură de sânge Contra izolate din Botucatu Spital das Clínicas pacienții internați.trei sute de tulpini CoNS au fost izolate din culturile de sânge de la pacienții internați ai Spitalului Botucatu das Clínicas – Paulista State University (UNESP)., Izolatele au fost colectate din 1990 până în 2009 și păstrate în laboratorul de colectare a Culturii al Departamentului de Microbiologie și Imunologie al Institutului de Bioștiințe Botucatu – UNESP. Criteriile de selecție au considerat o prevalență medie a evenimentelor de 35%, cu o marjă de eroare de 5% și un interval de încredere de 95%.tulpinile au fost izolate în conformitate cu Koneman și colab.8 izolate de agar de sânge au fost supuse petei Gram pentru observarea morfologiei coloniei și testul catalazei a fost efectuat pentru confirmarea genului Staphylococcus., Tulpinile stafilococice au fost supuse testului de coagulază pentru diferențierea grupelor coagulazo-negative și coagulazo-pozitive. Izolatele coagulazo-negative au fost supuse unor teste biochimice pentru identificarea fenotipică a speciilor. Identificarea genotipică a fost realizată utilizând primeri trasați pe secvențe conservate adiacente genelor 16S și 23S, prin ITS-PCR (reacția în lanț a distanțierului transcris intern–polimerazei), descrisă de Couto et al.9 eficiența amplificării a fost monitorizată prin electroforeză în agaroză metaforică 3% și colorată cu SYBR Safe., The following lineages of international reference were used: S. auricularis ATCC 33753, S. capitis subsp. capitis ATCC 27843, S. capitis subsp. urealyticus ATCC 49325, S. caprae ATCC 35538, S. cohnii ATCC 49330, S. cohnii subsp. cohnii ATCC 29974, S. epidermidis ATCC 12228, S. epidermidis ATCC 35983, S. hemolyticus ATCC 29970, S. hominis ATCC 27844, S. hominis subsp. novobiosepticus ATCC 700237, S. lentus ATCC 700403, S. lugdunensis ATCC 700328, S. saprophyticus ATCC 15305, S. schleiferi subsp. schleiferi ATCC 43808, S. sciuri subsp. sciuri ATCC 29062, S. simulans ATCC 27851, S., xylosus ATCC 29979, și S. warneri ATCC 10209.
extracția ADN
kitul Illustra (GE Healthcare) a fost utilizat pentru extracția ADN-ului. Etapele au inclus o digestie inițială a celulelor stafilococice cu lizozimă (10mg/mL) și proteinază K (20mg / mL). Apoi, la amestec s-au adăugat 500µl de tampon de extracție, care a fost centrifugat la 10,000 x g timp de 4min. Supernatantul a fost transferat într-o coloană și centrifugat la 5,000 g timp de 1min. Lichidul a fost aruncat și 500µl de tampon de extracție au fost adăugate în coloană., După centrifugarea și aruncarea fluidului colectat, 500µl de tampon de spălare au fost adăugate în coloană, care a fost supusă centrifugării la 20,000 g timp de 3min. Apoi coloana a fost transferată într-un tub de 1,5 mL și eluția a fost efectuată utilizând 200µl de apă Miliq încălzită la 70°C.
detectarea genei mecA
PCR a fost efectuată pentru detectarea genei mecA. Reacțiile au fost efectuate utilizând un protocol descris de Murakami et al.10 eficiența amplificării a fost monitorizată prin electroforeză într-un gel de agaroză 2% colorat cu SYBR Safe.,
determinarea SCCmec
Tipul SCCmec a fost determinat pe tulpini mecA-pozitive. Reacțiile au fost efectuate utilizând un protocol descris de Oliveira et al.11 și modificat de Machado și colab.12
Multiplex PCR a fost efectuat în 50µl de volum de reacție cu tampon enzimatic 1x, 1.,25 U Taq polymerase DNA, 200 μM dNTP Mix, and the following primers: 10pmol of RIF2 F2 (TTCGAGTTGCTGATGAAGAAGG) and CIF2 R2 (ATTTACCACAAGGACTACCAGC), 6pmol of KDP F1 (AATCATCTGCCATTGGTGATGC) and KDP R1 (CGAATGAAGTGAAAGAAAGTGG), 5pmol of DCS F2 (CATCCTATGATAGCTTGGTC) and DSC R1 (CTAAATCATAGCCATGACCG), 5pmol of RIF4 F3 (GTGATTGTTCGAGATATGTGG), and RIF4 R9 (CGCTTTATCTGTATCTATCGC). For each reaction, 10μL DNA was added. The cycle sequencing reactions were performed at 92°C for 3min, followed by 30 cycles of 92°C for 1min, 56°C for 1min, and 72°C for 1min and 30s., Eficiența de amplificare a fost monitorizată prin electroforeză într-un gel de agaroză 2% colorat cu SYBR Safe.
Determinarea concentratiei minime inhibitorii (CMI) prin E-test
sensibilitatea in vitro a CoNS tulpini a fost testat pentru următoarele substanțe antimicrobiene: Oxacilina, Vancomicină, Daptomicina, Linezolid, Quinupristin/Dalfopristin și Tigeciclină. MIC-ul acestor medicamente a fost determinat de testul E. Criteriile utilizate pentru clasificarea susceptibilității au fost: oxacilină
µg / mL (susceptibilă) pentru CoNS, cu excepția S., lugdunensis (sensibile ≤2 µg/mL și rezistent ≥4µg/mL), Vancomicină µg/mL (sensibile), 8–16µg/mL (intermediar rezistent), iar >32µg/mL (rezistente); Linezolid ≤4µg/mL (sensibile); Daptomicină ≤1µg/mL; Quinupristin/Dalfopristin ≤1µg/mL (sensibile), 2 µg/mL (intermediar), iar creșterea ≥4µg/mL (rezistente); Tigeciclina ≤0,5 µg/mL.,13Screening test de detectare a redus sensibilitatea la vancomicină
În scopul de a detecta reducerea sensibilității la vancomicină, un screening agar test pregătit cu Creier, Inima de Perfuzie (BHI) Agar și 4µg/mL, 6µg/mL, 8µg/mL și 16µg/mL vancomicină a fost folosit. Tulpina de referință S. aureus ATCC 29213, susceptibilă la vancomicină, a fost utilizată ca martor negativ, iar tulpina E. faecalis ATCC 51299, rezistentă la vancomicină, ca martor pozitiv. Pete de un 2.,0 inocul McFarland a fost adăugat pe placa de Agar și incubat la 35°C timp de 24 de ore, iar creșterea a cel puțin o colonie a fost considerată ca un rezultat pozitiv.
analiza grosimii peretelui celular
tulpinile CoNS care au prezentat sensibilitate redusă la vancomicină au fost supuse microscopiei electronice de transmisie pentru analiza grosimii peretelui celular. Tulpinile au fost cultivate în bulion BHI și incubate la 37° C timp de 24h. într-un microtub, 1000µl dintr-un bulion de cultură CoNS au fost centrifugate timp de un minut la 12,000 rpm. După aruncarea supernatantului, tulpinile au fost fixate într-o soluție Karnovsky (2.,5% glutaraldehidă în tampon fosfat 0,1 M ) timp de patru ore. Probele au fost scoase din fixator și spălate de trei ori timp de cinci minute în apă distilată. Apoi, probele au fost scufundate în tetroxid de osmiu 0,5% timp de 40min, înainte de a fi spălate de trei ori timp de 10min în apă distilată. Probele au fost deshidratate folosind creșterea concentrațiilor de alcool: de două ori pentru 10min în 7.,5% alcool; de două ori pentru 10min în alcool 15%; de două ori pentru 10min în alcool 30%; de două ori pentru 10min în alcool 50%; de trei ori pentru 15min în alcool 70%; de două ori pentru 15min în alcool 90%; de două ori pentru 10min în alcool 100%. După deshidratare s-au montat cioturi și s-au metalizat probele. Analizele au fost efectuate într-o microscopie electronică Tecnai Spirit Fei Company, iar imaginile au fost obținute la o mărire de 30000×.,rezultatele identificării izolatelor Tabelul 1 prezintă sursa izolatelor din specia CoNS, precum și datele demografice ale pacienților cu bacteriemie.
Detectarea genei mecA și caracterizarea de SCCmec Determinarea concentratiei minime inhibitorii (CMI)
Microfoanele de antimicrobiene utilizate pentru tratamentul Contra infecțiilor a fost determinată de E-test. Rezistența la oxacilină a fost găsită în 206 (68,7%) tulpini CoNS și 25 au fost rezistente la tigeciclină (8,3%). Rezistența la tigeciclină a fost detectată la 4,5% din S. epidermidis, 13,8% din S. hemolyticus, 13% din S., hominis, și 11,1% din S. lugdunensis. Pentru quinupristin/dalfopristin, one S. epidermidis izola prezentat rezistență intermediară cu un MICROFON de 2 µg/mL, și una de S. epidermidis și one S. hemolyticus cu Microfoane de 3µg/mL. Sensibilitatea și specificitatea mic oxacilinei prin testul E comparativ cu prezența mecA au fost, respectiv, 87,4% și 82,3%.
Cu privire la CoNS specii, parametrul de distribuție de MIC50 și CMI90 arătat rate ridicate de oxacilină în S. hemolyticus., Aceasta a fost singura Contra speciilor pentru care concentrație minimă de a inhiba 50% din tulpinile izolate fost >256µg/mL, reflectând rezistență ridicată rată de S. hemolyticus la oxacilină (Tabelul 3).intervalul MIC al fiecărui antimicrobian a fost comparat cu tipul SCCmec. Izolatele tastate ca SCCmecI au prezentat Microfoane mai mari de tigeciclină, iar cele clasificate ca SCCmecII au prezentat cele mai mari microfoane de oxacilină. La SCCmecIV tulpini au prezentat cele mai mari valori ale CMI pentru vancomicină, linezolid, daptomicina, și quinupristin/dalfopristin (Tabelul 4).
Determination of the MIC range according to SCCmec.
| MIC range (μg/ml) | ||||
|---|---|---|---|---|
| Antimicrobial | SCCmec I | SCCmec II | SCCmec III | SCCmec IV |
| Oxacillin | 0.094≥256 | 6≥256 | 0.,125≥256 | 0.125≥256 |
| Vancomycin | 0.25–2 | 0.38–2 | 0.125–2 | 0.75–2 |
| Linezolid | 0.064–1 | 0.19–0.5 | 0.047–0.75 | 0.064–1 |
| Daptomycin | 0.016–025 | 0.016–0.094 | 0.019–0.5 | 0.047–0.75 |
| Quinupristin/Dalfopristin | 0.025–1.5 | 0.094–0.5 | 0.064–1 | 0.125–2 |
| Tigecycline | 0.016–2 | 0.023–0.75 | 0.016–0.75 | 0.,032-1 |
MICROFON, a concentratiei Minime Inhibitorii.
O evaluare a fost efectuată de oxacilină și vancomicină Microfoane pe o perioadă de 20 de ani, împărțită în trei perioade de timp în funcție de distribuția și vancomicină oxacilină MIC variază. Pentru oxacilină, în prima perioadă (1990-2001), s-au observat valori mai mari ale MIC, dar totuși indicând susceptibilitatea., În celelalte perioade (2002-2006 și 2007-2009), sa observat o scădere a valorilor CMI, indicând în continuare susceptibilitatea, precum și o creștere a ratelor de rezistență. În ceea ce privește vancomicina, aceeași evaluare a demonstrat diferențe semnificative în cele trei perioade dintre tulpinile cu CMI de la 0,047 µg/mL la 0,38 µg/mL și de la 0,5 µg/mL la 2,0 µg/mL (Fig. 1).
Determinarea reducerea sensibilității la vancomicină
O crestere de 214 (71.3%) tulpini a fost observată pe BHI placa cu 4µg/mL vancomicină, 89 (29.7%) pe placa cu 6µg/mL vancomicină, și 8 (2.,6%) izolate pe placa de vancomicină de 8 µg/mL. Niciunul dintre izolate nu a crescut în mediu cu 16µg / mL de vancomicină. Nu au existat diferențe semnificative în Microfoane între tulpini care a prezentat nici o creștere pe placa completate cu vancomicină și cei care au crescut pe 4µg/mL vancomicină placa. Dintre cele care au prezentat o creștere pe mediu cu 6µg/mL de vancomicină, intervalul MIC a fost de 0,5–2µg/mL. Dintre cele care au crescut pe 8µg / mL de vancomicină, intervalul MIC a fost 0.75–24µg/mL. Tulpinile cultivate pe 8µg/mL vancomicină au fost patru S. epidermidis, one S. hemolyticus, două S. hominis, și one S., capitis, toate rezistente la oxacilină, și S. epidermidis și S. capitis fiind purtători de SCCmec III, S. hominis de SCCmec eu, și S. hemolyticus cu non-introduce SCCmec.
analiza grosimii peretelui celular al tulpinilor cu sensibilitate redusă la vancomicină
grosimea peretelui celular sub diviziune celulară a fost măsurată în opt tulpini (valorile sunt prezentate în nanometri, media±SD). Cele patru tulpini de S. epidermidis au prezentat valori medii ale 21.66±1.4, 20.12±0.9, 24.24±1.3, și 14,20±1,3 nm. Izolatul S. hemolyticus a prezentat o grosime a peretelui celular de 24,88±1,7 nm. Pentru S., izolatul capitis, grosimea peretelui celular a fost de 19,33±1,8, iar pentru cele două izolate S. hominis valorile au fost de 17,68±2,1 și 24,92±1,5. Pentru comparație, folosit de referință tulpini de S. epidermidis ATCC 12228 și S. hemolyticus ATCC29970 arătat celule grosimi de perete de, respectiv, 14.61±1.2 și 14.73±0.7 nm. Compararea tulpinilor studiate împotriva controalele au arătat valori mai mari, variind de la 17nm să 24.92 nm, cu o singură excepție S. epidermidis izola, care a prezentat o valoare mai mică comparativ cu lotul martor (Fig. 2).,
Contra bacteriemie evoluție
evoluția posibilă a bacteriemie la alte infecții, cum ar fi sepsis, pneumonie, infecții ale tractului urinar, meningita, peritonita, enterocolita necrozanta, omfalita, și abces cerebral, a fost urmat în 52 de pacienți internați în secțiile de neonatologie. Dintre aceștia, la 25 (46,3%) pacienți, același CoNS izolat din cultura de sânge a fost confirmat ca agent etiologic al infecției. În șase (11,1%), contra a fost agentul posibil al infecției, iar în 23 (42,6%) contra nu a fost legat de infecția pacientului (Fig. 3).,
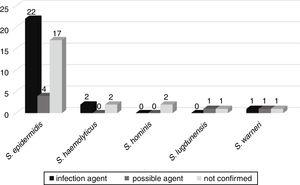
corelarea CoNS izolate din culturi de sânge ca posibili agenți etiologici ai infecțiilor cauzate la pacienții neonatali.
genei mecA a fost detectat în 33 (61.1%) din aceste Contra, cu 20 (60.6%) Contra asociate cu infecții mai severe sau posibil agenți de aceste infecții.
discuție
Contra sunt considerate una dintre principalele cauze ale bacteriemiei., Importanța acestor bacterii a crescut în mediul spitalicesc în ultimii ani, în mare parte datorită rezistenței antimicrobiene. În lucrarea de față au fost studiate 300 de tulpini CoNS izolate din culturi de sânge ale pacienților internați la Spitalul clinicilor din Botucatu, pe o perioadă de 20 de ani. Aceste izolate au fost caracterizate în ceea ce privește susceptibilitatea lor antimicrobiană.detectarea mecA a determinat rezistența la oxacilină în 78,5% din CoNS, iar valoarea MIC50 (2µg/mL) a indicat rezistența la acest medicament, confirmând susceptibilitatea scăzută a acestor bacterii la agenții β–lactamici., Lucrările anterioare au demonstrat că, începând cu anii 1970, izolatele CoNS au prezentat rate mai mari de rezistență la oxacilină decât S. aureus.14,15 ratele de rezistență la β-lactam s-au dovedit a varia de la 65% la 95% în spitalele din Brazilia și din alte țări.2,16,17 Cele mai mari rate de oxacilină au fost găsite în S. epidermidis, urmată de S. hemolyticus, S. hominis, și S. capitis. Rezultate similare au fost descrise în studiile anterioare, care au arătat rezistență la oxacilină în 97% din S. epidermidis între 1999 și 2001 într-o unitate de terapie intensivă neonatală (NICU),18 în 96% din S., hemolyticus izolat în Brazilia, 19 și în 100% din S. hominis izolat într-un NICU din Spania.20 în ceea ce privește S. capitis, rezultatele discrepante au fost găsite în studiile efectuate de Caierão et al.21
deși la o frecvență mai mică, gena mecA a fost detectată la S. warneri și S. lugdunensis. S. warneri a fost descris cu tarife de 33,3% din oxacilină în NICUs,22 și prima descriere a mecA în S. lugdunensis a fost în studiul realizat de Kawaguchi et al.23 În ciuda ratelor scăzute de rezistență, 24 determinarea susceptibilității antimicrobiene a S., lugdunensis este important, nu numai datorită implicațiilor sale clinice, deoarece această specie este cea mai agresivă dintre contra, dar și pentru stabilirea unui tratament precoce cu antimicrobiene adecvate și rezultate clinice bune.25
caracterizarea SCCmec a arătat prezența de tipurile I-IV, izolate, cu SCCmecIII fiind cel mai frecvent detectat în tulpinilor studiate, în principal în S. epidermidis, singura specie care a efectuat de tip IV., SCCmec de tip III este cel mai mare dintre toate, codifică pentru mai multe gene asociate rezistenței și este cel mai frecvent izolat Contra din specimene de spital. S. epidermidis este principalul colonizator al pielii umane și cel mai frecvent detectat în locurile de infecție. Presiunea selectivă în mediul spitalicesc conduce la diseminarea tulpinilor SCCmec III, care sunt asociate cu infecții grave.26 SCCmec de tip IV a fost asociat cu Staphylococcus spp., și a fost descris pentru prima dată într-o tulpină S. epidermidis, fapt care implică transferul său de la S., epidermidis către S. aureus. Un transfer de cost redus al SCCmec IV datorită dimensiunilor mici ar duce probabil la o incidență mai mare a infecțiilor cauzate de transportatorii SCCmec IV.12,27 SCCmecII a prezentat o asociere cu S. hemolyticus, similar cu constatările lui Machado și colab.,12 a căror activitate a detectat doar tipul II la această specie.alternativa pentru tratamentul stafilococilor rezistenți la oxacilină este vancomicina, o glicopeptidă utilizată pentru prima dată în 1958 în infecțiile invazive. Există totuși descrieri ale rezistenței și susceptibilității reduse la acest medicament,6 deși instabile.,28 rezultatele lucrării actuale au arătat că, cu excepția oxacilinei, vancomicina a fost medicamentul cu cele mai mari valori ale MIC50 și MIC90. În ciuda susceptibilității complete a colecției, valorile CMI au fost cele mai mari în perioada de 20 de ani, iar susceptibilitatea redusă a fost detectată la unele tulpini S. epidermidis, S. hemolyticus, S. hominis și S. capitis. În studiile efectuate de Natoli et al., 29 susceptibilitatea redusă la vancomicină a fost detectată cu o frecvență de 5,4% în rândul izolatelor CoNS, la speciile S. epidermidis și S. hemolyticus., Potrivit acelorași autori, Staphylococcus coloniile crescute pe vancomicină agar poate duce la glicopeptide heteroresistance, care poate fi un precursor al glicopeptide rezistență, provocând infecții complicate și eșecul tratamentului. Acest lucru trebuie luat în considerare în deciziile terapeutice.30
creșterea proporției de contra rezistente la oxacilină și scăderea sensibilității lor la vancomicină subliniază importanța studiilor care implică alte alegeri terapeutice., Tigeciclina, un Gram-pozitive și negative spectru larg semisintetic glicilciclinelor, este considerat un medicament cu activitate excelentă împotriva oxacilină sensibile și rezistente Contra,14,29, în ciuda datele noastre arată ratele de 8,3% din rezistență, de cele mai multe ori în S. hemolyticus, urmată de S. hominis, S. lugdunensis și S. epidermidis. Rezultate similare ale MIC90 au fost descrise pentru tigeciclină, fără nicio diferență între contra rezistente la oxacilină și contra sensibile.31 În studiile efectuate de Natoli et al.29 tigeciclina a demonstrat o activitate bună împotriva contra., Potrivit acestor autori, tigeciclina nu este recomandată pentru tratamentul bacteriemiei, iar utilizarea acesteia ar trebui limitată pentru a menține activitatea împotriva bacteriilor Gram-negative multirezistente. Mutațiile genei ribozomale S10 și ale genelor rpsJ și mepA par a fi asociate cu rezistența la tigeciclină.32,33
Quinupristin/dalfopristin este un streptogramin aparținând macrolide-lincosamide-streptogramin grup., Combinația dintre quinupristin și dalfopristin este sinergică și, de obicei, bactericidă atunci când acești agenți sunt comparați singuri sau comparați cu antimicrobiene macrolide similare.34 În această lucrare, în ciuda prezentarea excelentă eficacitate în majoritatea studiat Contra, rezistență intermediară la acest medicament a fost detectat în două S. epidermidis și one S. hemolyticus. În studiul realizat de Mendes și colab.,35 quinupristin/dalfopristin demonstrat excelenta eficacitate Contra, tulpini au fost pe deplin sensibile, cu CMI90 valori de 0,38 µg/mL pentru oxacilină-tulpini sensibile și 0.,75 µg/mL pentru tulpinile rezistente la oxacilină. În plus, Venkatesh și colab.36 a descris eficacitatea bună a quinupristinei / dalfopristinei pentru tulpinile rezistente și sensibile la oxacilină.Daptomicina, un antimicrobian studiat de zeci de ani, a fost readus în uz în 2006, pentru tratamentul bacteriemiei și endocarditei cauzate de stafilococ.37 în studiul de față, daptomicina a demonstrat o eficacitate excelentă pentru tulpinile izolate CoNS, cu valori mici ale MIC50. Olivares și colab.37 a verificat, de asemenea, susceptibilitatea tuturor contra la daptomicină, cu o variație scăzută a valorilor CMI., Într-o lucrare care studiază 1126 contra, realizat de Critchley et al.,38 daptomicina a fost activă pe un interval MIC de la 0, 015 la 2, 0 µg/mL, iar MIC90 a fost de 0, 5 µg/mL. Potrivit acestor autori, cei mai activi agenți în aceste analize au fost daptomicină și quinupristin/dalfopristin, care subliniază relevanța acestor substanțe antimicrobiene în tratamentul infecțiilor cauzate de CoNS.Linezolid, o oxazolidinonă sintetică potențial activă împotriva mai multor bacterii, este un alt medicament care a demonstrat o eficacitate bună împotriva contra.,39 Linezolid a devenit important pentru tratamentul terapeutic al infecțiilor cronice prin contra, în ciuda descrierii rezistenței. În Brazilia, primul caz de linezolid rezistență a fost descris în anul 2006, la o clinică izola de MRSA40 și, printre Deținuți, în S. epidermidis, S. hominis, și S. hemolyticus.41 în lucrarea realizată de Olivares și colab., 37 în ciuda detectării a șapte tulpini rezistente la linezolid, acest medicament a prezentat valori CMI eficiente în tulpinile CoNS. Pe de altă parte, un focar de s rezistent la linezolid., au fost raportate clone epidermidis care conțin mutații în proteinele ribozomale L3 și L4, precum și plasmida cfr, identificată recent în Franța.42
S. hemolyticus a fost specia care a prezentat cele mai mari valori ale mic oxacilinei și au fost necesare concentrații mai mari de 256 µg/mL pentru a inhiba 50% din izolate. La fel ca și pentru oxacilină, această specie a prezentat valori mai mari ale CMI pentru tigeciclină și pentru majoritatea antimicrobienelor testate. Mai multe lucrări prezintă rate ridicate de rezistență la antimicrobienele utilizate pentru tratamentul infecțiilor cauzate de S., hemolyticus, în special meticilina și glicopeptidele. Unii autori descriu o prevalență ridicată de gene codifică rezistența la β-lactamice și aminoglicozide agenți, precum și un procent semnificativ de tulpini cu MICROFON valori apropiate de rezistența breakpoint,43,44 subliniind importanța S. hemolyticus ca un multirezistente patogen.
asociației de MICROFON gama cu SCCmec tipuri demonstrat mai mare Microfoane pentru vancomicină, linezolid, daptomicina, și quinupristin/dalfopristin în S. epidermidis realizarea SCCmecIV., Genele legate de rezistența la aceste antimicrobiene sunt mediate de plasmide, găsite mai ales în tulpini rezistente la meticilină cu origine spitalicească.45 SCCmec IV este caracteristic izolatelor comunitare, în special datorită dimensiunii sale și costului redus de adaptare. Studiile sugerează că achiziționarea genelor de rezistență are o origine non-clinică ecologică, având în vedere diversitatea mare a purtătorilor de gene de rezistență în mediul natural.46,47 mai mult, SCCmecIV a fost detectat doar în S. epidermidis, care, ca cea mai frecventă specie din pielea umană, este cea mai influențată de presiunea selectivă., CMI mai mari comparativ cu alte antimicrobiene pot fi, de asemenea, legate de presiunea selectivă, deoarece nivelul de expunere la aceste medicamente în mediul spitalicesc ar influența selecția susceptibilității reduse și a tulpinilor rezistente, deoarece sunt necesare mai multe evenimente de mutație, recombinare genetică și modificări în fiziologia microbiană pentru a genera modificări fenotipice.,48
modificări metabolice și fiziologice legate de presiunea selectivă au putut fi observate la tulpinile crescute pe Agar de vancomicină 8µg/mL, deoarece îngroșarea peretelui celular a fost găsită în majoritatea izolatelor CoNS datorită sintezei crescute a peptidoglicanului. Acest mecanism este mai avantajos pentru contra decât achiziționarea van operon, care este un mediator al rezistenței la vancomicină. Van operon este dobândit prin transfer de gene orizontal și expresia sa este stimulată numai în prezența glicopeptidei., Acest stimul provoacă un cost adaptiv foarte ridicat în prezența vancomicinei, fiind dezavantajos pentru contra într-un mediu de vancomicină.48,49 în ceea ce privește achiziționarea altor gene de rezistență în Contra, cum ar fi gena mecA, costul adaptiv inițial este atenuat prin mutații suplimentare compensatorii pentru „costurile”de rezistență. Recent, mutațiile punctuale ale genelor, cum ar fi vraR, s-au dovedit a fi asociate cu o sensibilitate redusă la vancomicină și îngroșarea peretelui celular la stafilococi.,50
acest studiu A arătat o rată înaltă de bacteriemie cauzată de Contra în neonatologie și pediatrie unități, care implică copii sub varsta de un an, principalii agenți fiind S. epidermidis, S. hemolyticus, S. hominis, S. lugdunensis și S. warneri. S. capitis nu au fost izolați în aceste unități, fiind agenți ai bacteriemiei la adulții internați în secția de medicină internă, gastroenterologie, neurologie și camera de urgență.,deoarece studiul a implicat bacteriemie cauzată de stafilococi izolați pe mai mult de 30 de ani, o mare parte din datele asociate cu dosarele medicale ale pacienților nu au putut fi recuperate, astfel încât nu a fost posibil să se asocieze rezultatul infecției tuturor pacienților, ceea ce reprezintă o limitare a studiului actual. Datele obținute de la pacienții din unitățile neonatale au indicat importanța clinică a bacteriemiei contra, care poate progresa spre boli care necesită îngrijiri specializate.cunoașterea rezistenței antimicrobiene este de mare importanță pentru tratamentul corect al infecțiilor cauzate de contra., Mai mult, factorii de virulență ai acestor bacterii și imunitatea pacienților sunt factori care contribuie la capacitatea microorganismului de a provoca infecții mai grave.rezultatele studiului nostru de 20 de ani au arătat o frecvență ridicată a rezistenței antimicrobiene în contra, ceea ce reflectă utilizarea excesivă a acestor medicamente., În plus metabolice și fiziologice, modificări care ar putea conduce la reducerea sensibilității la antimicrobiene, starea lor umane ca bacterii comensale le face ideale transportatorii eficient și un rezervor de gene de rezistență, în special low-cost de elemente, cum ar fi SCCmec.45 substanțele antimicrobiene care au oferit cele mai bune rezultate trebuie utilizate astfel încât să își păstreze eficacitatea și să prevină rezistența.,
conflicte de interese
autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.