pe 13 aprilie, 2017, prin NCI Personal
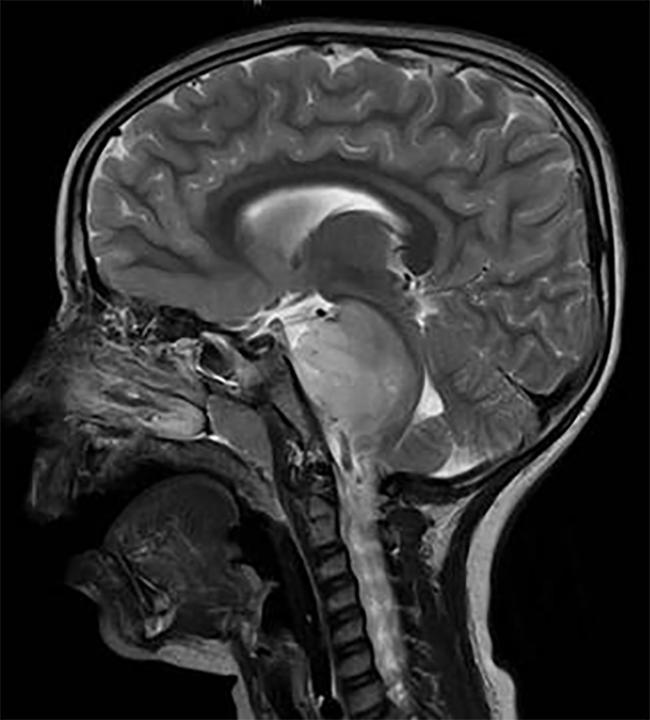
scanare a Creierului unui copil cu o DIPG tumorii, situat în trunchiul cerebral.
Două studii separate au identificat potențiale ținte terapeutice într-un inoperabil pediatrie tumoare pe creier, glioblastom difuz intrinsec (DIPG). Blocarea acestor ținte cu medicamente experimentale a încetinit creșterea tumorii în modelele animale de DIPG.DIPG, o tumoare care se află în tulpina creierului, este aproape uniform fatală.,
„Ca o de pediatrie neurooncologist,”e una dintre cele mai devastatoare tumori vom vedea”, a spus Pratiti Bandopadhayay, M. B., B. S., Ph. d., de la Dana-Farber/Copii din Boston”e Cancer si boli de Sange Centru, care nu a fost implicat în studii. „Nu avem deloc tratamente curative pentru aceste tumori.în timp ce majoritatea tumorilor DIPG poartă o mutație genetică specifică, nu a fost clar anterior Ce rol, dacă există, proteina mutantă joacă în dezvoltarea tumorii și dacă funcția sa ar putea fi vizată de terapii.,pentru ambele studii noi, echipele de cercetare au investigat biologia celulelor DIPG umane cu această mutație și au identificat caracteristici care le pot face vulnerabile la tratament. În comparație cu tratamentele de control, au descoperit, medicamente cunoscute sub numele de prc2 și inhibitori ai BET au redus tumorile DIPG la modelele de șoarece și au prelungit viața șoarecilor.rezultatele ambelor studii, unul de la un grup de cercetare de la Universitatea Northwestern și altul de la un grup de la Universitatea din Copenhaga din Danemarca, au fost publicate pe 27 Februarie în Nature Medicine.,
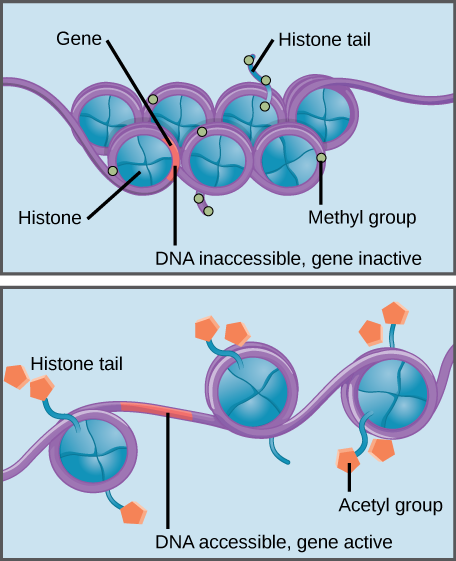
Histone metilare întărește histone–interacțiunea ADN-ul, ceea ce face asociate gene inaccesibile pentru expresia genelor (inactiv). Acetilarea histonei slăbește interacțiunea, făcând genele asociate accesibile pentru expresia genelor (active).
Identifică o Țintă
Aproximativ 5 ani în urmă, cercetătorii lucrează la Sf., Proiectul genomului cancerului Pediatric al Universității Jude–Washington a descoperit că aproape 80% din tumorile DIPG au o mutație specifică a genei pentru o proteină numită histone H3.
Că un astfel de procent ridicat de tumori au aceeași mutație a venit ca o surpriză pentru DIPG comunitatea de cercetare, a declarat Ali Shilatifard, Ph. d., de la Universitatea Northwestern Feinberg Scoala de Medicina, investigatorul principal pentru unul dintre studii.histonele sunt o familie de proteine care ajută la ambalarea ADN-ului în structuri compacte., Secțiuni scurte ale ADN-ului vânt în jurul proteinelor histone ca firul pe o bobină și mii de histone învelite în ADN (numite nucleozomi) alcătuiesc fiecare cromozom.
modificările specifice ale histonelor pot promova sau preveni expresia genelor. De exemplu, atașarea compușilor chimici numiți grupări acetil la histone slăbește interacțiunea lor cu ADN-ul, promovând expresia genelor. Pe de altă parte, adăugarea grupărilor metil la histone face de obicei vântul ADN mai strâns în jurul histonelor, împiedicând expresia genelor.,identificarea prezenței unei mutații histone H3 la pacienții cu DIPG a fost primul pas, a spus Dr.Bandopadhayay. „Dar pentru a putea trata tumorile cu această modificare, trebuie să înțelegeți ce face mutația”, a adăugat ea.într-un studiu anterior, Dr.Shilatifard și colegii săi au folosit muște de fructe pentru a studia funcția genei histone H3 mutante. În comparație cu muștele care aveau proteine histone H3 normale, muștele cu versiunea mutantă au avut mai multe histone care au fost împânzite cu grupări acetil (acetilat)., La rândul lor, aceste histone acetilate au fost legate de molecule numite proteine care conțin bromodomain (BRD), care reglează expresia genelor.
pentru studiul lor actual, care a fost finanțat parțial de NCI, cercetătorii din nord-vest au dorit să determine dacă histona mutantă avea aceeași funcție în celulele umane. Într-adevăr, au descoperit că cancerul de colon uman sau celulele canceroase de rinichi modificate pentru a exprima gena histonă H3 mutantă au avut mai multe histone acetilate decât celulele care au exprimat gena histonă H3 normală.
primul autor, Andrea Piunti, Ph. d.,, apoi a examinat toate histonele mutante H3 situate în genomul celulelor tumorale DIPG de la trei pacienți. Analiza sa a arătat că mulți nucleozomi care conțin histone mutante au fost acetilați și legați de proteinele BRD.experimentele suplimentare au arătat că proteinele BRD pot juca un rol direct în creșterea tumorii DIPG. Tratarea celulelor DIPG umane cu medicamente experimentale care blochează proteinele BRD, numite inhibitori ai BET, a încetinit creșterea celulelor DIPG comparativ cu un tratament de control., Și în studiile efectuate pe șoareci cu celule DIPG umane implantate în tulpinile creierului lor, cei tratați cu inhibitori de BET au avut tumori mai mici și au trăit mai mult decât șoarecii tratați cu tratamentul de control.aceste experimente „sugerează că inhibitorii BET oferă o abordare terapeutică potențială pentru DIPG”, a spus Dr.Shilatifard. Studiile preclinice au arătat că mai multe tipuri diferite de cancer—inclusiv leucemie și glioblastom—sunt, de asemenea, sensibile la inhibitorii BET, a adăugat el.,
Un alt Obiectiv
Nord-grup”s analiza umane DIPG celulele tumorale cu mutant histone H3, de asemenea, a arătat că, în plus față de mai histone H3 acetilare, multe histone au fost decorate cu grupuri de metil (metilic). Mai mult, au descoperit că o enzimă numită PRC2—care leagă grupările metil de proteinele histone H3—a fost prezentă în apropierea multor dintre aceste histone.
aceste rezultate i-au determinat pe cercetătorii de la Northwestern să analizeze în continuare activitatea PRC2., Ei au descoperit ca blocarea PRC2 activitate—fie genetic sau cu o PRC2 inhibitor numit tazemetostat—a redus DIPG de creștere a celulelor.”în mod neașteptat, aceste rezultate demonstrează un rol pentru funcția PRC2 în menținerea creșterii DIPG”, a scris grupul Northwestern.grupul de la Copenhaga a găsit, de asemenea, dovezi care susțin rolul PRC2 în promovarea creșterii tumorilor DIPG. Ei au observat că tazemetostat și un alt PRC2 inhibitor redus de creștere de mouse-ul celulele creierului uman sau DIPG celule mutant cu histone, întrucât controlul de tratament nu a făcut.,și când au implantat celule ale creierului de șoarece cu histone mutante în creierul șoarecilor sau șoarecilor normali în care PRC2 a fost blocat genetic, cei care nu aveau activitate PRC2 au trăit mai mult.în schimb ,un studiu separat realizat de un grup de cercetare din Germania a constatat că celulele de la diferiți pacienți cu DIPG nu erau sensibile la tazemetostat, chiar dacă tumorile lor aveau mutația histone H3.
Un Pas Înainte
zeci de ani de studii clinice au arătat că DIPG tumori sunt insensibile la chimioterapia tradițională, a explicat Dr. Bandopadhayay., Și, deși radiațiile pot atenua simptomele, nu sunt curative, iar majoritatea copiilor cu DIPG mor în decurs de 2 ani de la diagnosticare.
În 2015, un consorțiu internațional de DIPG cercetători s-au unit pentru a studia toate disponibile DIPG probe de celule. Studiul lor a arătat că DIPG celulele colectate de la mai multe diferite de pacienți au fost uciși de un histone-modificarea medicament numit panobinostat (Farydak®). Panobinostatul blochează enzimele care adaugă grupări acetil la histone., Acum, cercetătorii, care fac parte din consorțiul tumorii cerebrale pediatrice susținute de NCI, testează siguranța și cea mai bună doză de panobinostat pentru copiii cu DIPG într-un studiu clinic de fază I.acum, rezultatele din ambele studii indică noi strategii de tratament potențial promițătoare, a spus Dr. Shilatifard.”vrem să mutăm inhibitorii BET într-un studiu de fază I pentru tratamentul DIPG, iar colegii noștri de la Ann & Spitalul de copii Robert H. Lurie din Chicago se împing cu aceste studii”, a spus el.,în plus, mai multe studii clinice în curs de desfășurare testează tazemetostat, inhibitorul PRC2, atât la pacienții adulți, cât și la cei pediatrici cu diferite tipuri de cancer. Cu toate acestea, niciun studiu actual nu investighează în mod specific tazemetostat la copiii cu DIPG.există încă multe întrebări fără răspuns, a spus Dr. Bandopadhayay, inclusiv dacă aceste medicamente experimentale au capacitatea de a traversa bariera hemato–encefalică și de a ajunge la tumori cerebrale umane.
Dr., Bandopadhayay și colegii ei învață, de asemenea, mai multe despre biologia DIPG studiind celulele tumorale obținute din biopsii, pe lângă cele obținute din autopsii. Obținerea probelor de biopsie a fost posibilă doar recent prin îmbunătățiri majore ale tehnicilor neurochirurgicale, a explicat ea.
„este un moment interesant”, a spus ea. „Există o mulțime de lucru în curs de desfășurare chiar acum. Scopul final este de a putea trata acești copii, astfel încât să aibă șansa de a se vindeca cu efecte secundare minime.”