Úvod
Koaguláza-negativní stafylokoky (CoNS), členové skupiny stafylokoků, jsou charakterizovány jako Gram-pozitivní koky, prezentovány jako jednotlivé buňky nebo nepravidelné dispozice, a jsou imobilní, non-výtrus tvořící, kataláza-pozitivní, většinou fakultativně anaerobní bakterie, a nedostatek enzymu koaguláza.,1 nevýhody jsou součástí lidské mikrobioty, považované za oportunní patogeny, způsobující infekce většinou u předčasně narozených dětí a imunokompromitovaných a protetických pacientů.2
vzestup antimikrobiální rezistence v posledních letech měl velký dopad na nemocniční infekce způsobené nevýhodami. Oxacilin je polosyntetický penicilin používaný v testu citlivosti pro detekci rezistence na meticilin a léčbu stafylokokových infekcí. V konzervativních izolátech však byla pozorována míra od 66% do 95% rezistence na oxacilin.,2 Oxacilin rezistence je často zprostředkován mecA genu, který kóduje doplňkové penicilin-vázající protein (PBP2a) s nízkou afinitou k polosyntetické peniciliny.3 mecA gen je umístěn na mobilní genetický element známý jako Stafylokokové Chromozomové Kazety mec (SCCmec), která obsahuje mec komplex, který se skládá z mecA gen a jeho regulační geny mecI a mecRI, ccr komplex, zodpovědný za integraci a excisi SCCmec, a J regionu, který není nezbytný pro SCCmec formace, ale může s sebou nést non-β–laktamová rezistence geny.,4 dosud bylo popsáno 13 typů SCCmec založených na kombinaci typů genů ccr a tříd genového komplexu MEC. Podtypy byly definovány J regionovými polymorfismy ve stejné kombinaci komplexů mec a ccr.5
vznik oxacilin rezistentních izolátů vedlo ke konečnému využití alternativních antimikrobiálních látek pro léčbu Nevýhody infekce, jako je glykopeptidová vankomycin. Mezitím byly v posledních desetiletích hlášeny popisy snížené citlivosti a rezistence na vankomycin.,6 snížená náchylnost k vankomycinu může souviset s metabolickými modifikacemi, jako je zrychlení syntézy peptidoglykanu, což má za následek zhrubnutí buněčné stěny. V tomto procesu není vankomycin schopen inhibovat syntézu peptidoglykanu, protože je vyčerpán kvůli vyšší dostupnosti míst D-alanyl-D-alaninu.,7.
Vzhledem k vzestupu v nemocnici infekce způsobené Nevýhody, tato studie zaměřené charakterizovat oxacilin rezistentních kmenů a stanovení antimikrobiální citlivosti 20-rok odběru krve kultura Nevýhody izolátů z Botucatu Nemocnice das Clínicas hospitalizovaných pacientů.
materiál a metodystrainy
tři sta kmenů CoNS bylo izolováno z krevních kultur od hospitalizovaných pacientů nemocnice Botucatu das Clínicas – Paulista State University (UNESP)., Izoláty byly shromážděny od roku 1990 do roku 2009 a uchovávány v laboratoři sběru kultury oddělení mikrobiologie a imunologie Botucatu Biosciences Institute – UNESP. Výběrová kritéria považovala za průměrnou prevalenci událostí 35% s chybou 5% a intervalem spolehlivosti 95%.
kmeny byly izolovány podle Koneman et al.8 Krevní agar izoláty byly podrobeny Gramovo barvení pro pozorování morfologie kolonie a katalasy byla zkouška provedena za potvrzení rodu Staphylococcus., Stafylokokové kmeny byly předloženy koaguláza test pro diferenciaci koaguláza-negativních a koaguláza-pozitivní skupiny. Koagulázově negativní izoláty byly podrobeny biochemickým testům pro fenotypovou identifikaci druhů. Na genotypová identifikace byla provedena pomocí primerů byly nad konzervované sekvence přilehlé k 16S a 23S geny, podle ITS-PCR (vnitřní přepisována spacer–polymerázová řetězová reakce), popsal Couto et al.9 účinnost zesílení byla sledována elektroforézou v 3% agaróze metafory a obarvena SYBR Safe., The following lineages of international reference were used: S. auricularis ATCC 33753, S. capitis subsp. capitis ATCC 27843, S. capitis subsp. urealyticus ATCC 49325, S. caprae ATCC 35538, S. cohnii ATCC 49330, S. cohnii subsp. cohnii ATCC 29974, S. epidermidis ATCC 12228, S. epidermidis ATCC 35983, S. hemolyticus ATCC 29970, S. hominis ATCC 27844, S. hominis subsp. novobiosepticus ATCC 700237, S. lentus ATCC 700403, S. lugdunensis ATCC 700328, S. saprophyticus ATCC 15305, S. schleiferi subsp. schleiferi ATCC 43808, S. sciuri subsp. sciuri ATCC 29062, S. simulans ATCC 27851, S., xylosus ATCC 29979 a s. warneri ATCC 10209.
extrakce DNA
Sada Illusta (GE Healthcare) byla použita pro extrakci DNA. Kroky zahrnovaly počáteční trávení stafylokokových buněk lysozymem (10 mg/mL) a proteinázou K (20 mg/mL). Další, 500µL extrakčního pufru bylo přidáno do směsi, která byla centrifugována při 10 000 x g po dobu 4min. Supernatant byl přenesen do sloupce a centrifugován na 5 000 g po dobu 1 minuty. Kapalina byla zlikvidována a do sloupce bylo přidáno 500 µl extrakčního pufru., Po centrifugaci a vyřazení z odebrané tekutiny, 500µL z promývacího pufru byly přidány do sloupce, který byl předložen centrifugace na 20 000 g po dobu 3min. Další kolony byl převeden do 1,5 mL zkumavky a eluce byla provedena pomocí 200µL ohřátého MilliQ vody na 70°C.
mecA genu, detekce
PCR byla provedena pro detekci mecA genu. Reakce byly provedeny pomocí protokolu popsaného Murakami et al.10 účinnost zesílení byla monitorována elektroforézou v 2% agarózovém gelu obarveném SYBR Safe.,
stanovení SCCmec
Typ SCCmec byl stanoven na Meca-pozitivních kmenech. Reakce byly provedeny pomocí protokolu popsaného Oliveira et al.11 a upraven Machado et al.12
multiplex PCR byl proveden v 50µl reakčního objemu s 1x enzymovým pufrem, 1.,25 U Taq polymerase DNA, 200 μM dNTP Mix, and the following primers: 10pmol of RIF2 F2 (TTCGAGTTGCTGATGAAGAAGG) and CIF2 R2 (ATTTACCACAAGGACTACCAGC), 6pmol of KDP F1 (AATCATCTGCCATTGGTGATGC) and KDP R1 (CGAATGAAGTGAAAGAAAGTGG), 5pmol of DCS F2 (CATCCTATGATAGCTTGGTC) and DSC R1 (CTAAATCATAGCCATGACCG), 5pmol of RIF4 F3 (GTGATTGTTCGAGATATGTGG), and RIF4 R9 (CGCTTTATCTGTATCTATCGC). For each reaction, 10μL DNA was added. The cycle sequencing reactions were performed at 92°C for 3min, followed by 30 cycles of 92°C for 1min, 56°C for 1min, and 72°C for 1min and 30s., Účinnost zesílení byla monitorována elektroforézou v 2% agarózovém gelu obarveném SYBR Safe.
Stanovení minimální inhibiční koncentrace (MIC) E-test
in vitro citlivosti Nevýhody kmenů byla testována pro tyto antimikrobiální látky: Oxacilin, Vankomycin, Daptomycin, Linezolid, Quinupristin/Dalfopristin, Tigecyklin. Mikrofon těchto léků byl určen E-testem. Kritéria použitá pro klasifikaci citlivosti byla: oxacilin
µg / mL (citlivý) pro nevýhody, s výjimkou s., lugdunensis (citlivé ≤2 µg/mL a rezistentní ≥4µg/mL), Vankomycin µg/mL (citlivé), 8–16µg/mL (středně rezistentní), a >32µg/mL (rezistentní); Linezolid ≤4µg/mL (citlivé); Daptomycin ≤1µg/mL; Quinupristin/Dalfopristin ≤1µg/mL (citlivé), 2 µg/mL (intermediární) a ≥4µg/mL (rezistentní); Tigecyklin ≤0,5 µg/mL.,13Screening test pro detekci sníženou citlivostí na vankomycin
s cílem odhalit sníženou citlivostí na vankomycin, promítání agar test připraven s Brain Heart Infusion (BHI) Agar a 4µg/mL, 6µg/mL, 8µg/mL, a 16µg/mL vankomycinu byl použit. Referenční kmen S. aureus ATCC 29213, citlivé na vankomycin, byl použit jako negativní kontrola, a kmen E. faecalis ATCC 51299, rezistentní k vankomycinu, jako pozitivní kontrola. Skvrny 2.,0 McFarland inokulum byly přidány do agarové desky a inkubovány při 35 ° C po dobu 24 hodin a pěstování alespoň jedné kolonie bylo považováno za pozitivní výsledek.
analýza tloušťky buněčné stěny
kmeny CoNS, které vykazovaly sníženou náchylnost k vankomycinu, byly předloženy přenosové elektronické mikroskopii pro analýzu tloušťky buněčné stěny. Kmeny byly kultivovány v BHI bujónu a inkubovány při 37° C po dobu 24 hodin. V mikrozkumavky, 1000µL o Nevýhody kultury vývar byly centrifugovány jednu minutu při 12 000 rpm. Po vyřazení supernatantu byly kmeny fixovány v Karnovském roztoku (2.,5% glutaraldehyd ve fosfátovém pufru 0,1 M) po dobu čtyř hodin. Vzorky byly odstraněny ze fixátoru a promyty třikrát po dobu pěti minut v destilované vodě. Další vzorky byly ponořeny do 0,5% oxidem osmičelým na 40min, předtím, než je umýt třikrát po dobu 10 min v destilované vodě. Vzorky byly dehydratovány za použití zvyšujících se koncentrací alkoholu: dvakrát po dobu 10 minut v 7.,5% alkoholu; dvakrát za 10min v 15% alkoholu; dvakrát za 10min v 30% alkoholu; dvakrát za 10min v 50% alkoholu; třikrát za 15min v 70% alkoholu; dvakrát za 15min v 90% alkoholu; dvakrát za 10min ve 100% alkoholu. Po dehydrataci byly pahýly namontovány a vzorky metalizovány. Analýzy byly provedeny v elektronické mikroskopii společnosti Tecnai Spirit Fei a snímky byly získány při zvětšení 30000×.,
ResultsIdentification izolátů
Tabulka 1 představuje zdroj Nevýhody druhů izolátů, stejně jako demografické údaje pacientů s bacteremia.
detekce genu mecA a charakteristika stanovení minimální inhibiční koncentrace SCCmec (MIC)
mikrofony antimikrobiálních látek používaných k léčbě infekcí CoNS byly stanoveny E-testem. Oxacilin odpor byl nalezen v 206 (68.7%) Nevýhody kmenů a 25 byly tigecyklin odolné (8.3%). Rezistence na tigecyklin byla zjištěna u 4, 5% s. epidermidis, 13, 8% s. hemolyticus, 13% s., hominis a 11,1% s. lugdunensis. Pro quinupristin/dalfopristin, one S. epidermidis izolovat představila střední odpor s MIC 2 µg/mL, a one S. epidermidis a jeden. S. hemolyticus s Mikrofony z 3µg/mL. Citlivost a specifičnost oxacilin MIC u E-testu ve srovnání s přítomností mecA byli, respektive, 87.4% a 82.3%.
pokud jde o druhy CoNS, distribuce parametrů MIC50 a MIC90 odhalila vysokou míru rezistence oxacilinu u s.hemolyticus., To bylo jediné Nevýhody, druhy, pro které minimální koncentrace pro inhibici 50% izolátů bylo >256µg/mL, což odráží vysoká míra rezistence S. hemolyticus k oxacilinu (Tabulka 3).
rozsah MIC každého antimikrobiálního přípravku byl porovnán s typem SCCmec. Izoláty zadali jako SCCmecI prezentovány vyšší tigecyklin Mikrofony a těch, které jsou klasifikovány jako SCCmecII představil nejvyšší oxacilin Mikrofony. Kmeny SCCmecIV vykazovaly nejvyšší hodnoty MIC pro vankomycin, linezolid, daptomycin a chinupristin/dalfopristin (Tabulka 4).
Determination of the MIC range according to SCCmec.
| MIC range (μg/ml) | ||||
|---|---|---|---|---|
| Antimicrobial | SCCmec I | SCCmec II | SCCmec III | SCCmec IV |
| Oxacillin | 0.094≥256 | 6≥256 | 0.,125≥256 | 0.125≥256 |
| Vancomycin | 0.25–2 | 0.38–2 | 0.125–2 | 0.75–2 |
| Linezolid | 0.064–1 | 0.19–0.5 | 0.047–0.75 | 0.064–1 |
| Daptomycin | 0.016–025 | 0.016–0.094 | 0.019–0.5 | 0.047–0.75 |
| Quinupristin/Dalfopristin | 0.025–1.5 | 0.094–0.5 | 0.064–1 | 0.125–2 |
| Tigecycline | 0.016–2 | 0.023–0.75 | 0.016–0.75 | 0.,032-1 |
MIC Minimální Inhibiční Koncentrace.
vyhodnocení bylo provedeno na oxacilin a vankomycin Mic po dobu 20 let, rozdělené do tří časových období podle rozdělení oxacilin a vankomycin MIC se pohybuje. U oxacilinu byly v prvním období (1990-2001) pozorovány vyšší hodnoty MIC, ale stále naznačují náchylnost., V ostatních obdobích (2002-2006 a 2007-2009) byl pozorován pokles hodnot MIC, což stále naznačuje citlivost, stejně jako zvýšení rychlosti odporu. Pokud jde vankomycin, stejné hodnocení ukázaly významné rozdíly ve třech obdobích mezi kmeny s Mic od 0.047 µg/mL na 0,38 µg/mL a 0,5 µg/mL do 2,0 µg/mL (Obr. 1).
Určení sníženou citlivostí na vankomycin
růst 214 (71.3%) kmenů byla pozorována na BHI deska s 4µg/mL vankomycinu, 89 (29.7%) na desce s 6µg/mL vankomycinu, a 8 (2.,6%) izoluje na desce vankomycinu 8µg / ml. Žádný z izolátů nerostl v médiu s 16µg / mL vankomycinu. Nebyly žádné významné rozdíly v Mic mezi kmeny, které předložen žádný růst na talíři, doplněné vankomycin a ty, které rostly na 4µg/mL vankomycinu desky. Mezi těmi, které vykazovaly růst na médiu s 6µg/mL vankomycinu, byl rozsah MIC 0,5-2µg / ml. Mezi těmi, které rostly na 8µg/mL vankomycinu, byl rozsah MIC 0,75-24µg / ml. Kmeny pěstované na 8µg / mL Vancomycinu byly čtyři s. epidermidis, jeden s. hemolyticus, dva s. hominis a jeden s., capitis, všechny rezistentní na oxacilin a s. epidermidis a s. capitis jsou nositeli SCCmec III, s. hominis SCCmec I a s.hemolyticus s non-typed SCCmec.
Analýza buněčné stěny tloušťky kmenů se sníženou citlivostí na vankomycin
mobilní tloušťku stěny v rámci dělení buněk byla měřena v osm kmenů (hodnoty jsou uvedeny v nanometrech, průměr±SD). Čtyři kmeny s. epidermidis představovaly průměrné hodnoty 21.66±1.4, 20.12±0.9, 24.24±1.3, a 14,20±1,3 nm. Izolát s. hemolyticus vykazoval tloušťku buněčné stěny 24,88±1,7 nm. Pro S., capitis izolovat, buněčné stěny tloušťka byla 19.33±1,8, a pro dva. S. hominis izoluje hodnoty byly 17.68±2.1 a 24.92±1.5. Pro srovnání, použity referenční kmeny S. epidermidis ATCC 12228 a. S. hemolyticus ATCC29970 ukázal buněčné stěny tloušťky, respektive 14.61±1.2 a 14.73±0.7 nm. Srovnání studovaných kmenů proti kontrol ukázala vyšší hodnoty, od 17nm do 24.92 nm, s výjimkou jednoho S. epidermidis izolovat, která předložila nižší hodnoty ve srovnání s kontrolami (Obr. 2).,
Zápory bakteriémie evolution
možný vývoj bakteriémie, aby jiné infekce, jako je sepse, pneumonie, infekce močových cest, meningitida, zánět pobřišnice, nekrotizující enterokolitida, omphalitis, a absces mozku, následoval v 52 pacientů přijatých na novorozeneckém oddělení. Z toho u 25 (46,3%) pacientů byly stejné nevýhody izolované z krevní kultury potvrzeny jako etiologické činidlo infekce. V šest (11.1%), CoNS bylo možné původce infekce, a ve 23 (42.6%) Nevýhody není příbuzný“s infekci (Obr. 3).,
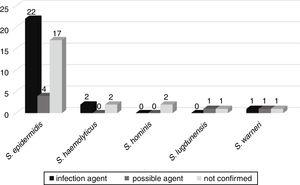
korelace CoNS izolovaných z krevních kultur jako možných etiologických činidel infekcí způsobených u pacientů s novorozeneckou jednotkou.
mecA genu byla detekována v 33 (61.1%) z těchto Nevýhody, s 20 (60.6%) Nevýhody spojené s více závažné infekce nebo možných původců těchto infekcí.
diskuse
nevýhody jsou považovány za jednu z hlavních příčin bakterémie., Význam těchto bakterií se v posledních letech zvýšil v nemocničním prostředí, většinou kvůli antimikrobiální rezistenci. V současné práci bylo studováno 300 kmenů CoNS izolovaných z krevních kultur hospitalizovaných v nemocnici Klinik Botucatu po dobu 20 let. Tyto izoláty byly charakterizovány jejich antimikrobiální citlivostí.
mecA detekce stanovena oxacilin odpor v 78,5% Zápory, a MIC50 hodnoty (2 µg/mL) byla orientační rezistence k tomuto léku, což potvrzuje nízkou citlivost těchto bakterií na β–laktamová agens., Předchozí práce prokázaly, že od roku 1970 izoláty CoNS představovaly vyšší míru rezistence oxacilinu než s.aureus.14,15 bylo prokázáno, že míra rezistence β–laktamu se pohybuje od 65% do 95% v nemocnicích v Brazílii a v jiných zemích.2,16,17 nejvyšší míra rezistence na oxacilin byla nalezena u s. epidermidis, následovaná s. hemolyticus, s. hominis a s.capitis. Podobné výsledky byly popsány v předchozí studie, které ukázaly, oxacilin odpor v 97% S. epidermidis v letech 1999 a 2001 v novorozenecké jednotce intenzivní péče (NICU),18 v 96%., hemolyticus izolovaný v Brazílii, 19 a ve 100% s. hominis izolovaný v NICU ze Španělska.20 pokud jde o s.capitis, byly zjištěny nesrovnalosti ve studiích provedených Caierão et al.21
i když při nižší frekvenci byl gen mecA detekován u s.warneri a s. lugdunensis. S. warneri byl popsán s sazby z 33,3% oxacilin odpor v NICUs,22 a první popis mecA, v. S. lugdunensis byl ve studii provedené Kawaguchi et al.23 navzdory nízkým rychlostem rezistence, 24 stanovení antimikrobiální citlivosti s., lugdunensis je důležité, nejen kvůli jeho klinické důsledky, neboť tento druh je nejvíce agresivní Nevýhody, ale také pro stanovení časné léčby s adekvátní antimikrobiální látky a dobré klinické výsledky.25
charakteristika SCCmec prokázala přítomnost typy I-IV v izolátů, s SCCmecIII je nejčastěji zjištěných na studovaných kmenů, především u S. epidermidis, jediný druh, který nesl typu IV., SCCmec typ III je největší ze všech, kodifikuje pro několik genů souvisejících s rezistencí a je nejčastěji izolovanými nevýhodami z nemocničních vzorků. S. epidermidis je hlavním kolonizátorem lidské kůže a nejčastěji detekovaným v místech infekce. Selektivní tlak v nemocničním prostředí vede k šíření kmenů SCCmec III, které jsou spojeny se závažnými infekcemi.26 SCCmec typ IV byl spojen s Staphylococcus spp spojeným s komunitou., a byl poprvé popsán v kmeni s. epidermidis, což je skutečnost, která znamená jeho přenos z S., epidermidis s. aureus. Snížený nákladový přenos SCCmec IV kvůli jeho malé velikosti by pravděpodobně vedl k vyššímu výskytu infekcí způsobených nosiči SCCmec IV.12,27 SCCmecII představil spojení s s. hemolyticus, podobně jako zjištění Machado et al.,12, jehož práce u tohoto druhu detekovala pouze typ II.
alternativou k léčbě stafylokoků rezistentních na oxacilin je vankomycin, glykopeptid poprvé používaný v roce 1958 při invazivních infekcích. Existují však popisy rezistence a snížené náchylnosti k tomuto léku, 6 ačkoli nestabilní.,28 výsledky současné práce ukázaly, že s výjimkou oxacilinu byl vankomycin lékem s nejvyššími hodnotami MIC50 a MIC90. I přes plnou citlivost kolekce, hodnoty MIC byly nejvyšší v období 20 let, a sníženou citlivost byla zjištěna v některých S. epidermidis, S. hemolyticus, S. hominis, S. capitis kmenů. Ve studiích prováděných Natoli et al., Byla zjištěna 29 snížená náchylnost k vankomycinu s frekvencí 5, 4% U izolátů CoNS, u druhů s.epidermidis a s. hemolyticus., Podle stejných autorů, Staphylococcus kolonií pěstovaných na vancomycin agar může vést k glykopeptidová heteroresistance, která může být předstupněm glykopeptidová rezistence, což způsobuje komplikované infekce a selhání léčby. To je třeba vzít v úvahu při terapeutických rozhodnutích.30
zvýšení podílu záporů rezistentních na oxacilin a snížení jejich náchylnosti k vankomycinu zdůrazňují důležitost studií zahrnujících další terapeutické volby., Tigecyklin, Gram-pozitivní a negativní širokospektrální semisyntetický glycylcycline, je považován za lék s vynikající aktivitu proti oxacilin citlivé a rezistentní Proti,14,29 i přes naše data ukazují, sazby 8,3% odporu, většinou v. S. hemolyticus, následuje S. hominis, S. lugdunensis a S. epidermidis. Podobné výsledky MIC90 byly popsány u tigecyklinu, bez rozdílu mezi rezistentními na oxacilin a vnímavými nevýhodami.31 ve studiích prováděných Natoli et al.29 tigecyklin prokázal dobrou aktivitu proti nevýhodám., Podle těchto autorů se tigecyklin nedoporučuje k léčbě bakterémie a jeho použití by mělo být omezeno, aby se zachovala aktivita proti Multi-rezistentním gramnegativním bakteriím. Zdá se, že mutace genů ribozomálního genu S10 a rpsj a mepA jsou spojeny s rezistencí na tigecyklin.32,33
Chinupristin / dalfopristin je streptogramin patřící do skupiny makrolid-linkosamid-streptogramin., Kombinace chinupristinu a dalfopristinu je synergická a obvykle baktericidní, pokud jsou tyto látky porovnávány jednotlivě nebo ve srovnání s podobnými makrolidovými antimikrobiálními látkami.34 v této práci, navzdory vynikající účinnosti u většiny studovaných nevýhod, byla střední rezistence vůči tomuto léku zjištěna u dvou s. epidermidis a jednoho s.hemolyticus. Ve studii provedené Mendesem et al.,35 quinupristin/dalfopristin prokázal vynikající účinnost za Nevýhody, kmeny byly plně citlivé, s MIC90 hodnoty 0.38 µg/mL pro oxacilin citlivé kmeny a 0.,75µg / mL pro kmeny rezistentní na oxacilin. Kromě toho Venkatesh et al.36 popsal dobrou účinnost chinupristinu / dalfopristinu pro rezistentní a citlivé kmeny oxacilinu.
Daptomycin, antimikrobiální studovány po celá desetiletí, byl přinesen zpět do užívání v roce 2006, k léčbě bakteriemie a endokarditidou způsobenou Staphylococcus.37 v této studii daptomycin vykazoval vynikající účinnost pro izoláty CoNS s nízkými hodnotami MIC50. Olivares et al.37 také ověřila náchylnost všech nevýhod k daptomycinu s nízkou variabilitou hodnot MIC., V práci studovat 1126 nevýhody, provádí Critchley et al., 38 daptomycin byl aktivní v rozmezí MIC od 0, 015 do 2, 0 µg/mL a MIC90 byl 0, 5 µg/ml. Podle těchto autorů, nejvíce aktivních látek v těchto analýzách byly daptomycin a quinupristin/dalfopristin, která klade důraz na význam těchto antimikrobiálních látek při léčbě infekcí způsobených Nevýhody.
Linezolid, syntetický oxazolidinone potenciálně účinné proti řadě bakterií, je další lék, který prokázal dobrou účinnost proti Nevýhody.,39 Linezolid se stal důležitým pro terapeutickou léčbu chronických infekcí nevýhody, a to navzdory popisu rezistence. V Brazílii, první případ linezolid rezistence byla popsána v roce 2006, na klinickém izolátu z MRSA40 a, mezi Zápory, S. epidermidis, S. hominis, a. S. hemolyticus.41 v práci Olivares et al., 37 navzdory detekci sedmi kmenů rezistentních na linezolid tento lék vykazoval účinné hodnoty MIC v kmenech CoNS. Na druhé straně vypuknutí linezolid rezistentní s., byly hlášeny klony epidermidis obsahující mutace ribozomálních proteinů L3 a L4, stejně jako cfr plasmid, nedávno identifikovaný ve Francii.42
S. hemolyticus byl druh, který předložil nejvyšší hodnoty MIC oxacilinu, a koncentrace vyšší než 256µg/mL byly nutné k inhibici 50% izolátů. Kromě oxacilinu tento druh vykazoval vyšší hodnoty MIC pro tigecyklin a většinu testovaných antimikrobiálních látek. Několik prací vykazuje vysokou míru odolnosti vůči antimikrobiálním látkám používaným k léčbě infekcí způsobených S., hemolyticus, zejména meticilin a glykopeptidy. Někteří autoři popisují vysoký výskyt geny kódující rezistenci k β-laktamová a aminoglykosidová agenti, stejně jako významný podíl izolátů s MIC hodnotami blízko k odporu zarážky,43,44 s důrazem na význam S. hemolyticus jako multirezistentních patogenů.
sdružení MIC rozsah s SCCmec typů prokázána vyšší Mic pro vankomycin, linezolid, daptomycin, a quinupristin/dalfopristin v S. epidermidis nesoucí SCCmecIV., Geny související s rezistencí na tyto antimikrobiální látky jsou zprostředkovány plazmidy, které se vyskytují většinou v kmenech rezistentních na meticilin s nemocničním původem.45 SCCmec IV je charakteristický pro izoláty komunity, zejména díky své velikosti a nízkým adaptivním nákladům. Studie naznačují, že získání genů rezistence má neklinický původ v životním prostředí, vzhledem k vysoké rozmanitosti nosičů genů rezistence v přírodním prostředí.46,47 kromě toho byl SCCmecIV detekován pouze u s. epidermidis, který jako nejběžnější druh v lidské kůži je nejvíce ovlivněn selektivním tlakem., Vyšší Mikrofony ve srovnání s jinými antimikrobiálních látek může být také v souvislosti s selektivní tlak, protože úroveň expozice, aby se tyto léky v nemocnici prostředí by zaujatost výběru snížené citlivosti a rezistentních kmenů, od několika mutace události, genetické rekombinace a změny v mikrobiální fyziologii jsou potřeba generovat fenotypické změny.,48
Metabolické a fyziologické změny související s selektivní tlak může být pozorována u kmenů pěstovaných na 8µg/mL vancomycin agar, jako buněčné stěny zahušťování byl nalezen ve většině Nevýhody izolátů v důsledku zvýšené peptidoglykanů. Tento mechanismus je výhodnější pro nevýhody než získání van operonu, který je mediátorem rezistence vankomycinu. Van operon je získán horizontálním přenosem genů a jeho exprese je stimulována pouze v přítomnosti glykopeptidu., Tato stimulace způsobuje velmi vysokou adaptivní náklady v přítomnosti vankomycin, je nevýhodný pro CoNS v vankomycinu střední.48,49 pokud jde o získání dalších genů rezistence v nevýhodách, jako je gen mecA, počáteční adaptivní náklady jsou změkčeny kompenzačními dodatečnými mutacemi pro „náklady na rezistenci“. V poslední době se ukázalo, že přesné mutace genů, jako je vraR, jsou spojeny se sníženou náchylností k vankomycinu a zahušťování buněčné stěny u stafylokoků.,50
tato studie ukázala vysoký výskyt bakteriémie způsobené Nevýhody v neonatální a pediatrické jednotky, týkající se dětí pod jeden rok věku, hlavním činitelům, které S. epidermidis, S. hemolyticus, S. hominis, S. lugdunensis, S. warneri. S. capitis nebyly izolovány v těchto jednotkách, jsou agenti bakteriémie u dospělých přijat na interní lékařství oddělení, gastroenterologie, neurologie, a pohotovost.,
Jako do studie bylo zapojeno bakteriémie způsobené stafylokoky izolované přes více než 30 let, mnoho údajů souvisejících s lékařské záznamy pacientů se nepodařilo získat, takže to nebylo možné přiřadit infekci výsledek u všech pacientů, což je omezení současné studie. Údaje získané od pacientů v novorozeneckých jednotkách naznačovaly klinický význam bakterémie CoNS, která může postupovat k nemocem, které vyžadují specializovanou péči.
Znalost antimikrobiální rezistence má velký význam pro správnou léčbu infekce způsobené Nevýhody., Faktory virulence těchto bakterií a imunita pacientů jsou navíc faktory, které přispívají ke schopnosti mikroorganismu způsobit závažnější infekce.
výsledky naší studie trvající 20 let ukázaly vysokou frekvenci antimikrobiální rezistence na nevýhody, což odráží nadměrné užívání těchto léků., Kromě toho, metabolické a fyziologické změny, které by mohly vést ke snížení citlivosti na antimikrobiální látky, jejich stav jako lidské komenzálních bakterií z nich dělá ideální transportéry a efektivní zásobárnu genů odolnosti, a to zejména v low-cost prvků, jako SCCmec.45 antimikrobiální látky, které nabízejí nejlepší výsledky, by měly být používány tak, aby byla zachována jejich účinnost a aby se zabránilo rezistenci.,
střety zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.