Gen p53 byl poprvé objeven v roce 1979. Protein byl identifikován v Simian virus 40-transformované myší buňky (SV40) imunoprecipitací s anti-T séra; tento protein byl nazýván protein p53 . Ve stejném roce, Kress a další vědci našli novou třídu proteinů s molekulovou hmotností v rozmezí od 50-60kda. Tento druh proteinu byl pak identifikován jako p53 . Protein p53 lze také identifikovat z různých transformovaných buněčných linií imunoprecipitací., Podobný výsledek mají i Lane a Linzer v roce 1979. Jiné doklady pro identifikaci p53 je, že p53 byl vyjádřen ve všech testovaných transformované buňky myši; tyto zkoušky zahrnují chemicky indukované sarkomy, transformované fibroblasty a leukémie, zatímco v normálních buňkách, p53 nebyla vyjádřena. Navíc byla ve většině transformovaných buněk zjištěna vysoká hladina p53 bez ohledu na to, jak byly buňky transformovány, buď spontánně nebo spontánně ., To bylo do značné míry způsobeno zvýšenou stabilitou p53, avšak v embryonálních karcinoových buňkách F9 vyjádřila vysokou hladinu p53, což bylo způsobeno množstvím přeložené p53 mRNA .
poté, co byl protein p53 objeven v roce 1979, se stal populárním pro jeho analýzu. Nicméně, v té době, protože to byl nově objevený protein, a tam nebyl bývalý název pro to, různé instituce používaly různé názvy a publikované papíry s různými jmény., Za účelem vyřešení tohoto problému, v roce 1983, v průběhu 1. Mezinárodní p53 workshopu, který se konal v Oxted, velké BRITÁNII, vědci z různých výzkumných skupin v různých zemích dostal společně diskutovat o společné nomenklatury pro tento nově objevený protein. Na tomto setkání se „p53″ stalo jeho jménem a od té doby se používá. Předpokládalo se, že důvodem, proč vědci nazývají protein p53, je to, že molekulární hmotnost tohoto proteinu je 53kDa, která je založena na jeho migraci v SDS gelu. Později se ukázalo, že molekulová hmotnost je špatná a správná molekulová hmotnost by měla být 43.,7kda protože p53 obsahuje region bohatý na prolin a tato oblast může snížit migraci p53 v SDS gelu. Ale jméno “ p53 „zůstalo.
během 80. let se předpokládá, že protein p53 se podílí na buněčném cyklu a hraje roli v replikaci DNA. Později, v letech 1982 až 1994, lidé zjistili, že některé virové onkoproteiny se mohly vázat na p53 a vytvořit komplex. V roce 1982, Sarnow et al. bylo zjištěno, že adenovirus E1b (58kDa) může interagovat s proteinem 54kda, který je přítomen ve výše uvedených myších buňkách transformovaných na SV40., Podle výsledků imunologických specifik t protilátek a peptidových map proteinu 54kda je tento protein 54kda identifikován jako p53 . Ve stejném roce, vědci zjistili, že pokud jsou injekčně p53 protilátek do Swiss 3T3 myších buněk, to by inhibují buňky vstupují do S fáze buněčného cyklu, nicméně; pod stejnou situaci, p53 protilátek nemá vliv SV40 nebo adenovirem indukována syntéza DNA .,
Později v roce 1984, vědci zkoumali vliv p53 na non transformována 3T3 fibroblastů; analyzovali rychlosti syntézy proteinu p53 v různých časových bodech, a zjistil, že v pozdní G1 fázi, syntéza míra a úroveň proteinu p53 a jeho související zvýšení mRNA. Tento výsledek naznačuje, že protein p53 inhibuje buňky vstupující do dělící fáze z mezifáze . Maltzman W et al. udělal další experiment ve stejném roce. Neproměněnou myší buňku ošetřili UV světlem a UV-mimetickým chemickým karcinogenem 4nqo a zjistili vysokou hladinu p53., Výsledek ukázal, že zvýšená exprese p53 není jen symbolem, který označuje buněčný cyklus, ale také důležitější složkou, která se podílí na syntéze DNA a proliferaci buněk . V roce 1987, při studiu komplexu T antigen opičí virus 40 a DNA polymerázy α, Gannone, a další vědci našli podobné změny v antigen když se váže na p53 a polymerázy α. Zjistili také, že při určité koncentraci tří složek mohou tvořit speciální trimerní komplex, který zahrnuje t antigen, p53 a DNA polymerázu α., Protože se antigen T podílí na replikaci virové DNA a buněčné transformaci, tento výsledek naznačuje, že p53 hraje roli při kontrole buněčného cyklu a replikace DNA .
jak ukázal experiment výše, p53 má schopnost zvěčnit buňky. V roce 1984, Eliyahu D et al. zjistil, že p53 a produkt onkogene myc sdílí některé podobné vlastnosti. Oba mají schopnost vázat se na jiné proteiny a podílejí se na buněčném cyklu a oba se hromadí v jádrech transformovaných buněk ., Bienz, Pennica a Oren analyzoval sekvencí aminokyselin proteinu p53 a produkt myc, a zjistili, že dvě bílkoviny vykazují podobnosti v molekulární struktuře a pozici speciální nabité zbytky. Pak vědci navrhli, že p53 může působit jako onkogen. Na základě této hypotézy Eliyahu D et al. udělal nějaké experimenty. Jako primární embryonální fibroblasty mohou být transformovány zapojení obou myc produktu a Ha-ras, primární dítě krysa ledvinových buněk může být též transformován spolupráci Ha-ras a adenovirus brzy regionu 1A , Eliyahu D et al., rozhodl se použít tento druh biologického testovacího systému k identifikaci onkogenní funkce p53. Léčili normální embryonální buňky p53 a aktivovali Ha-ras. Výsledek ukázal, že cílové buňky se setkávají se změnami morfologie a produkují vysoké hladiny p53, Eliyahu D et al. myslel jsem, že transformace embryonálních fibroblastů p53 a Ha-ras vysvětlila, že gen p53 je onkogen ., V roce 1985, Jenkins navrhuje, že p53 může prodloužit životnost buněk, zvýšení efektivity transformace tím, že přeskupí své kódující sekvence, které by mohly způsobit tvorbu stabilních proteinů .
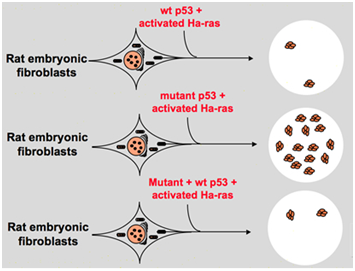
na konci 80. let si však vědci začali uvědomovat, že p53 je gen potlačující nádor místo onkogenu. Zjistili, že p53 s normální funkcí nelze detekovat u mnoha nádorů a zjistili, že při transformaci buněk je nutná ztráta exprese a funkce genu divokého typu p53., Ty zvyšují možnost, že gen divokého typu p53 může inhibovat neoplastickou progresi . Pak jsou formulována druhá hypotéza: the clone genu p53 použity v předchozích experimentů obsahuje dominantní negativní mutace ve vysoce konzervované doméně občas, což vede k opačné výsledky experimentu . V roce 1988, Ben a další vědci zaznamenali obrovské množství předělaný p53 v myších erytroleukémie buněčných linií–DP20-1 a CB3, které jsou odvozeny ze slezin myší infikovaných s Přítelem leukémie virus ., V roce 1989 Eliyahu, který poukázal na to, že p53 je onkogen, změnil názor a předpokládal, že gen divokého typu p53 může inhibovat buněčnou transformaci. Eliyahu a další vědci studovali účinek wild-type p53 proteinu kódované plasmidy a mutant p53 na schopnost vyvolat primární embryonální fibroblasty transformace různých onkogenu kombinace in vitro. Například mutant p53 Plus ras a myc Plus ras., Výsledek ukázal, že wild-type p53 vést k obrovské snížení transformována ložisek způsobené mutant p53 plus ras; mutant p53 ukázal č. inhibice transformována na ložiska způsobené myc plus ras, zatímco myc plus ras-zprostředkované transformace je velmi citlivý na expresi wild-type p53. Obrázek 1 ukazuje tento experiment stručně. Ukázalo se, že ve srovnání s mutantem p53 vykazuje divoký typ p53 zjevně inhibiční účinek na buněčnou transformaci. Účinek pozitivně souvisí s expresní úrovní divokého typu p53 a negativně souvisí s expresní úrovní mutantu p53., Tento experiment naznačil, že divoký typ p53 může mít ve srovnání s mutantem p53 skutečně opačnou funkci a může inhibovat tumorigenezi . V současné době je p53 rozpoznán jako gen potlačující nádor. Odhaduje se, že přibližně polovina nádorů je způsobena p53. Je to jeden z nejčastěji mutovaných genů u lidí a nejčastěji analyzovaný Gen po celém světě .
během prvních několika let 80. let nebyla biochemická cesta p53 a účinek mutace p53 jasná. V roce 1991 Kern a další vědci zjistili, že sekvence DNA párů 33 se specificky váže na divoký typ p53 in vitro. Zjistili také, že protein p53 obsahuje dvě mutace, které se obvykle vyskytují u lidských nádorů, které se nemohou vázat na tuto specifickou oblast DNA. Takže se předpokládá, že funkce p53 je závislá na jeho schopnosti vázat specifické sekvence DNA, a tato schopnost je změněn mutací v lidských nádorech., Předpokládají také, že tato sekvence DNA 33-base pair nemusí být jedinou sekvencí, která má schopnost se specificky vázat na p53 u lidí; může však pomoci lidem lépe porozumět funkci p53 . Později bylo zjištěno, že p53 hraje roli během buněčného cyklu, opravy DNA, diferenciace, iniciace apoptózy a angiogeneze. Rotter V et al. zjistil, že p53 up-reguluje diferenciaci buněk. Například vysoká hladina proteinu p53 byla detekována v několika klíčových krocích během diferenciace B-buněk. Zvýšené p53 lze také detekovat během spermatogeneze., Mezitím lze v některých orgánech dospělých myší detekovat pouze velmi nízkou hladinu proteinu p53 .
v roce 1990 byl příležitostně objeven užitečný nástroj. Jedná se o teplotně citlivý mutant p53, nazývaný p53val135. Může působit jako skutečný divoký typ p53 při teplotě 32,5 oC, potlačující transformaci a může také působit jako jiný mutovaný p53 při teplotě 37,5 oC nebo nad 48oc, což vyvolává transformaci. Navíc pro transformované buňky exprimující p53val135 je jeho proliferace řízena při přípustné teplotě a tento druh kontroly je reverzibilní., Použitím tohoto mutantu p53val135 bylo zjištěno, že divoký typ p53 indukuje zástavu buněčného cyklu při G1 nebo G2 / m. V roce 1991 Elisheva et al. bylo zjištěno, že p53val135 citlivý na teplotu vykonával jinou funkci v buněčné linii myeloidní leukémie. Po reaktivaci p53val135 na několik dní zemřely všechny buňky a tato smrt vykazuje některé vlastnosti apoptózy . O rok později podobný výsledek získal Shaw. Divoký typ p53 byl přeměněn na buněčnou linii EB odvozenou od nádoru lidského tlustého střeva., Buňky byly zkoumány pod světelným a elektronovým mikroskopem a zjistil, že vykazují některé vlastnosti apoptózy . V roce 1990 Scheffner et al. a další vědci zjistili, že E6, že stimuluje zničení hostitelské buňky regulační proteiny jsou kódovány onkogenních typů lidského papilomaviru 16 a 18, a to může tvořit komplex s wild-type p53 in vitro, což způsobuje degradaci proteinu p53 .
v roce 1992 byl objeven klíčový protein MDM2, protože se pevně váže na p53 a inhibuje transaktivaci zprostředkovanou p53., Molekulová hmotnost MDM2 je 90kDa a tvoří komplex s mutovaným i divokým typem p53 . Ve stejném roce, Livingstone RL et al. zkoumal, zda buňka ztratila jednu nebo obě kopie alel divokého typu p53 a zda to stačilo k vyvolání amplifikace genu. Genová amplifikace byla detekována většinou v transformovaných buňkách, ale ne v normálních fibroblastech. Výsledek ukázal, že buňky, které ztrácejí jednu kopii alel p53, působí jako divoký typ p53, zatímco buňky, které ztrácejí obě kopie alel divokého typu p53, vykazují vyšší frekvenci zesílení . Další experiment provedený Yin y et al., ukázal podobný výsledek .
v roce 1993 byl identifikován cílový Gen p53 nazvaný CDKN1A. Kóduje protein p21, což je inhibitor cyklin-dependentní kinázy, který inhibuje cyklin-CDK2 a CDK1 vazbou na ně. V roce 1993 Szekely zjistil, že jaderný antigen viru Epstein-Barr 5(EBNA-5) je kódován virem Epstein-Barr a může infikovat lidskou B lymfoblastoidní buňku. 66 aminokyselinový dlouhý peptid je zodpovědný za tvorbu komplexního EBNA-5-p53, bodové mutace p53 neovlivnily jeho vazebnou schopnost EBNA-5., Inhibuje však své formace komplexů s jinými molekulami . V roce 1994 Cho a jeho spolupracovníci poprvé popsali krystalovou strukturu komplexu p53-DNA. Tato doména vázající DNA byla také nazývána doménou jádra. Obsahuje zbytky 102-292 a skládá se z beta sendviče. Demonstrovali také podrobnou strukturu základní domény . Také v roce 1994, Wang XW et al. interakce mezi proteinem viru hepatitidy B X (HBX) a proteinem divokého typu p53 u lidí., Zjistili, že HBX může inhibovat schopnost p53 vázat se na jiné sequence-specific DNA poté, co je vázán na p53, a to může také inhibovat asociace p53 s transkripčními faktory .
v roce 1997, Honda R et al. první předpokládal, že MDM2 může vyvolat p53 ubiquitylation a vést k degradaci p53 pomocí ubiquitin-proteazomový systém. Poukázali na to, že MDM2 se váže na doménu N-terminal (NTD) p53 a působí jako ubiquitin ligase E3 . Také v roce 1997 byly objeveny dvě nové rodiny proteinů, p63 a p73, které sdílejí podstatnou homologii s p53., p73, také nazývaný nádorový protein 73, je kódován genem umístěným v 1p36. Místo je často odstraněno u neuroblastomu a jiných nádorů. p73 může aktivovat cílové geny p53 a interaguje s p53 . Yang et al. zjistil, že gen p63 je umístěn v 3q27 – 29 a může být detekován v různých myších a lidských buňkách. Stejně jako p73 může p63 významně tranaktivovat cílové geny p53, může také vyvolat apoptózu. Jednou z charakteristik p63 je, že většina p63 postrádá n-konec ., Ve stejném roce, Serrano a spolupracovníci zjistili, že primární myší fibroblasty mohou být transformovány ras v nepřítomnosti p53 nebo p16, a neaktivní p53 nebo p16 může usnadnit proces zvěčnění lidských buněk. Tato zjištění naznačují, že p53 hraje roli v buněčné senescenci . V roce 1997 bylo zjištěno, že p53 hraje roli při zahájení apoptózy. Když buňky přicházejí do šíření fáze, telomer na konci každého chromozomu by zkrátit po každém kole replikace DNA v důsledku nekompletní replikace jednovláknové DNA na konci DNA stojanu ., Aktivovaný Gen potlačující nádor p53 omezuje počet případů, kdy může dojít k dělení buněk. Wynford TD zjistil, že se ztrátou funkce divokého typu p53 unikají všechny fibroblasty z apoptózy. Také tranaktivační funkce p53 může být zapnuta apoptózou . Wynford TD navrhl, že existují tři možnosti, jak je aktivován p53. První je post-translační modifikace fosforylací, druhá je up-reguluje transkripční kofaktory jako p33ING1, poslední je dolů-reguluje inhibitory p53, jako je MDM2 .
v roce 2000, Brodsky MH et al., studoval transkripční cíle p53 v Drosophile. Existují důkazy, které ukazují, Drosophila oči displej těžké drsné oční fenotyp pod výrazem lidského p53, který indukuje apoptózu oční imaginární disk buněk, což způsobuje ztrátu pigmentu buněk, a konečně, že inhibuje vývoj očí Octomilek , tak Drosophila může být zvířecí model pro studium funkce p53. Brodsky zjistil, že gen rpr obsahuje konsensuální vazebné místo p53, které se nachází v cis-regulační oblasti rpr, a je také aktivátorem apoptózy., S dalšími důkazy Brodsky tvrdil, že rpr je jedním transkripčním cílem p53 . V roce 2001, Derry a spolupracovníci zjistili, že C. elegans nemají gen p53, ale skutečně obsahují gen, cep-1, který kóduje bílkoviny, které mají podobnou sekvenci s proteinem p53. Tento gen C. elegans kóduje protein CEP – 1, který má schopnost indukovat apoptózu genotoxickým stresem a je nezbytnou složkou během meiózy .
v roce 2002 Tyner a spolupracovníci navrhli, že p53 hraje roli při regulaci stárnutí organismů., Za účelem studia funkce p53, oni vytvořili geneticky upravené myši s mutovaný p53 odstraněním exons 1-6 a těžební oblast wild-type p53 (p53+/+), tzv. p53+/m. To působí jako wild-type p53 a má zvýšenou odolnost vůči spontánní nádory, lepší než wild type p53. V experimentu sledovali myši obsahující p53+/m, p53+/+ a p53+/ -. p53+ / – znamená, že myši ztratí jednu kopii genu divokého typu p53., Výsledky ukázaly, že žádná z myší p53+/m vyvinul život ohrožující nádory, nicméně, více než 80% myší p53+/- a více než 45% myší p53+/+ vyvinuli tyto druhy nádorů. Při pohledu dovnitř nádoru, lokalizované nádorové léze byly pozorovány u 2 z 35 p53+/m myši, v kontrastu, různé nádory jako lymfomy, rakovina kostí byly nalezeny v p53+/- a p53+/+ myší. Během tohoto experimentu také zjistili, že střední věk p53+ / m byl 96 týdnů, zatímco střední věk p53+ / m byl 116 až 118 týdnů., Tyner a spolupracovníci také zkoumali možnost, že kratší životnost p53+ / m byla spojena se stárnutím. Zjistili, že po 18 měsících začaly myši p53+/m zhubnout a energicky, stejně jako u myší p53+/m byly ve věku 30-36 měsíců pozorovány snížené hmotnosti. myši p53 + /m také vykazují lordokyfózu. V závislosti na rentgenové analýze vykazovaly myši p53+/m sníženou hustotu kostí ve věku 12 měsíců a ve věku 18 měsíců se stanou závažnými. Jedná se o symbol osteoporózy a osteoporóza je markerem stárnutí u lidí a myší . Tyner et al., také testoval toleranci stresu, protože tato schopnost je také markerem stárnutí . Provedli 3 mm punčové biopsie v zadní kůži starých a mladých anestetizovaných p53+/m a p53+/+ myší. Jejich výsledky ukázaly, že mnoho starých myší p53+/m zemřelo po injekci standardní dávky Avertinu, což naznačuje, že staré myši p53+/m byly méně tolerantní ke stresu .
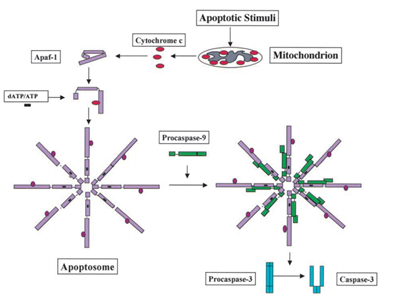
V roce 1991, bylo zjištěno, že p53 má schopnost indukovat apoptózu, zatímco v roce 2003; Mihara a další vědci zjistili, že p53 má také roli apoptózy v mitochondriích ., Protože některé mitochondriální proteiny mají schopnost aktivovat buněčnou apoptózu buď aktivní caspases nebo neutralizační cytosolový inhibitory. V příkladu cytochromu c indukované kaspázy, po obdržení apoptózy signál, cytochrom c je uvolněn z mezimembránového prostoru mitochondrií, a pak se zase váže k Apf-1, který existuje jako neaktivní monomer, vyvolává jeho konformační změnu, a zvyšuje jeho vazebnou afinitu pro dATP/ATP o 10-krát než Apaf-1 váže dATP/ATP na pokoji. Pak se komplex Apaf-1-cytochromu c váže na dATP / ATP, tvoří apoptosom., Poté caspase recruitment doména (karta) Apaf-1 vystavena v apoptosome, rekrutovat procaspase-9, a pak autoaktivovat sami. Konečný komplex pak štěpí a aktivuje další caspases, jako jsou kaspázy-3, které zase následně štěpí důležité molekuly v buňce, což způsobuje kondenzaci chromatinu, fragmentaci DNA a konečně vedoucí k apoptóze . Obrázek 2 ukazuje cestu aktivace kaspázy indukované cytochromem C.
Mihara m et al. vědci zjistili, že gen divokého typu p53 lze rychle translokovat na mitochondriální povrch nádorových buněk. V experimentu, zjistili, že někteří stres-indukované wild-type p53 protein má schopnost přemístit do mitochondrií z thymocytů v lidských nebo myších buněk po apoptózy v důsledku poškození DNA a hypoxie. Pak tyto proteiny divokého typu p53 indukují permeabilizaci mitochondrií a způsobují řadu změn, ke kterým dochází v mitochondriích, jako je uvolňování cytochromu c vytvořením komplexu s Bcl2 a BclXL .,
jako dobrý klinický výsledek s malým vedlejším účinkem je populární genová terapie. Do konce roku 2005 bylo v databázi Journal of Gene Medicine 1020 studií genové terapie. Mezi těmito zkouškami bylo provedeno 66% genových terapií u pacientů s rakovinou a 58 studií tohoto použitého rAd-p53, rekombinantního adenoviru kódujícího lidský gen p53. V dubnu 2004 byla formálně zahájena rekombinantní injekce lidského adenoviru-p53 (Gendicin). Gendicin se používá k léčbě spinocelulárního karcinomu hlavy a krku a byl schválen státní správou potravin a léčiv v Číně v říjnu. 16, 2003., Stala se prvním produktem genové terapie na světě, který schválila čínská vláda .
Gen p53 byl objeven k regulaci metabolismu v roce 2005. Pro přenos z G1 do S fáze musí mít buňky dostatečnou podporu surovin pro syntézu DNA, organel a bílkovin. K regulaci tohoto procesu jsou nutné některé kontrolní body. Jedním z nich je glukózo-dependentní kontrolního bodu v G1/S. To je upraveno AMP-aktivované protein kinázy (AMPK). Po vyčerpání glukózy může AMPK fosforylovat protein p53, který zase indukuje zástavu buněk a zabraňuje buněčné smrti., Buňky, které se setkávají se zástavou závislou na p53, znovu vstoupí do buněčného cyklu, pokud je dostatečná glukóza .
je známo, že inaktivace p53 je nezbytná pro tvorbu nádorů. Bykov et al. VJ a Snydel EL et al. poukázat na to, že nesprávné fungování p53 může vést k proliferaci existujícího nádoru . Ventura a jeho spolupracovníci provedli několik experimentů, aby tuto hypotézu otestovali. Obnovili funkci endogenního p53 u primárních autochtonních nádorů, aby prozkoumali důsledek reaktivace p53., Výsledek ukázal, že reaktivace p53 byla zodpovědná za regresi autochtonních nádorů. To znamená, že inaktivovaný protein p53 může vést k rozvoji nádoru . Xue a další vědci také provedli experiment, který testoval důsledek reaktivace p53 na nádorech. Použili reverzibilní RNA interferenci (RNAi) k regulaci exprese endogenního p53 u myší s rakovinou jater. V experimentu se doxycyklin (Dox) používá k reaktivaci p53, protože exprese p53 je zcela potlačena, když Dox chybí a rychle se obnoví, když je přidán DOX., Při léčbě Dox byl vypnut p53 miRNA, což způsobuje zvýšenou expresi p53. Výsledek ukázal, že nádory u myší léčených DOX se po 12 dnech nezjistily, zatímco nádory u neléčených myší rychle rostly. Pro testování důsledků přechodné reaktivace p53 léčili myši DOX po dobu 4 dnů a poté se zastavili. Výsledek ukázal, že i dvoudenní léčba může způsobit regresi nádorů a 4 dny léčby mohou způsobit úplné regrese nádorů., Poukázali také na to, že během regrese nádoru může přechodně reaktivovaný p53 vyvolat buněčnou senescenci, nikoli apoptózu. Ve stejném roce Hu zjistila, že embryonální implantace u myší p53-/- samice je regulována inhibičním faktorem leukémie (LIF). LIF je vylučovaný cytokin a je důležitý pro implantaci blastocysty. Gen kódující LIF je identifikován jako cílový Gen p53 a vazebné místo p53 je umístěno v intronu 1 u lidí i myší .