13. dubna 2017, podle NCI Zaměstnanců
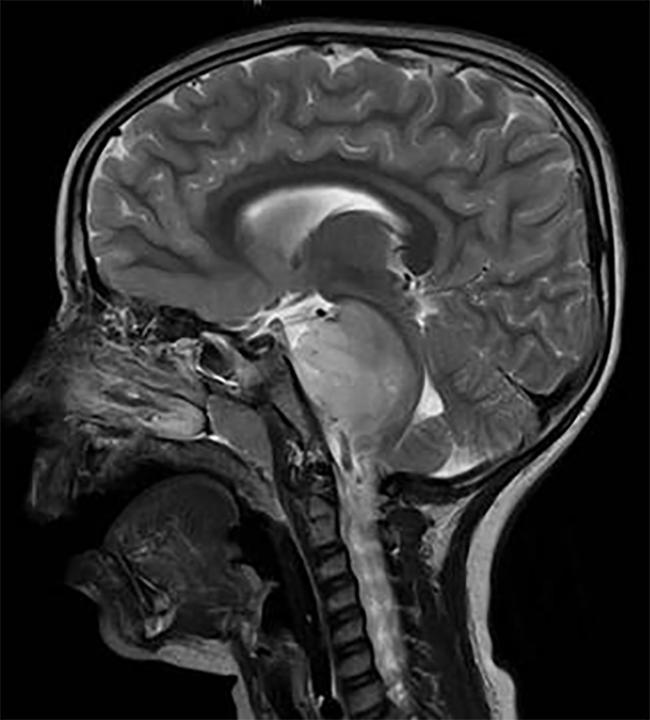
skenování Mozku dítěte s DIPG nádor, který se nachází v mozkovém kmeni.
Dvě samostatné studie identifikovali potenciální terapeutické cíle v neoperovatelné pediatrické nádor na mozku, difúzní intrinsický gliom (DIPG). Blokování těchto cílů vyšetřovacími léky zpomalilo růst nádorů u zvířecích modelů DIPG.
DIPG, nádor, který se nachází v mozkovém kmeni, je téměř rovnoměrně fatální.,
„Jako dětské neurooncologist, to“s jedním z nejvíce zničující nádory vidíme,“ řekl Pratiti Bandopadhayay, M. B. B. S., Ph.d., z Dana-Farber/Boston Dětí“s Rakovinou a Krevní Poruchy Center, který nebyl zapojen do studie. „U těchto nádorů nemáme žádné léčebné ošetření.“
Zatímco většina DIPG nádory nesou určité genetické mutace, bylo již jasné, jakou roli, pokud vůbec, mutantní protein hraje v rozvoji nádoru, a to, zda jeho funkce by mohla být cílem terapie.,
pro obě nové studie zkoumaly výzkumné týmy biologii lidských DIPG buněk s touto mutací a identifikovaly charakteristiky, které je mohou učinit zranitelnými vůči léčbě. Ve srovnání s kontrolní léčby, zjistili, léky známé jako PRC2 a inhibitory BET zmenšily DIPG nádory v myších modelech a prodloužily životy myší.
výsledky obou studií, jedné z výzkumné skupiny na Northwestern University a druhé ze skupiny na Kodaňské univerzitě v Dánsku, byly publikovány 27.února v Nature Medicine.,
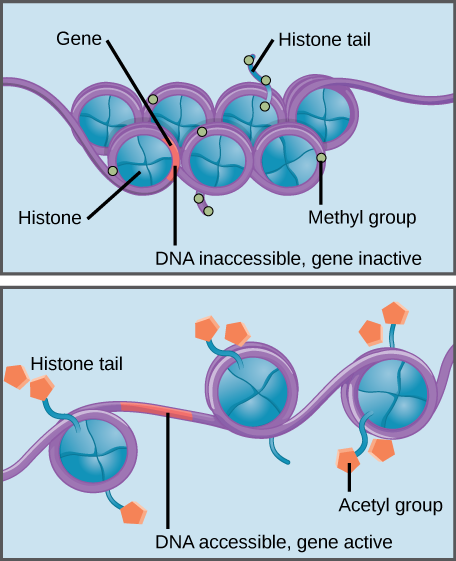
Histonů metylace posiluje histon–DNA interakce, což souborům geny nepřístupné genové exprese (neaktivní). Acetylace histonu oslabuje interakci a zpřístupňuje přidružené geny pro genovou expresi (aktivní).
Určení Cíle
Asi před 5 lety, vědci pracují na Sv., Projekt dětského rakovinového genomu Jude-Washington University zjistil, že téměř 80% nádorů DIPG má specifickou mutaci v genu pro protein zvaný histone H3.
Že tak vysoké procento nádorů mají stejnou mutaci přišel jako překvapení pro DIPG výzkumu společenství, řekl Ali Shilatifard, Ph.d., z Northwestern University Feinberg School of Medicine, hlavní vyšetřovatel pro jednu ze studií.
histony jsou rodina proteinů, které pomáhají balení DNA do kompaktních struktur., Krátké úseky DNA vítr kolem histonů, proteiny, jako nit na cívce, a tisíce DNA–zabalené histony (tzv. nucleosomes), aby se každý chromozom.
specifické modifikace histonů mohou podpořit nebo zabránit genové expresi. Například připojení chemických sloučenin nazývaných acetylové skupiny k histonům oslabuje jejich interakci s DNA a podporuje genovou expresi. Na druhou stranu, přidání methylové skupiny na histony obvykle dělá DNA vítr více těsně kolem histonů, brání genové exprese.,
identifikace přítomnosti mutace histonu H3 u pacientů s DIPG byla prvním krokem, řekl Dr. Bandopadhayay. „Abyste však mohli léčit nádory touto změnou, musíte pochopit, co mutace dělá,“ dodala.
v dřívější studii Dr. Shilatifard a jeho kolegové použili ovocné mušky ke studiu funkce genu mutant histone H3. Ve srovnání s mouchami, které měly normální histonové H3 proteiny, mouchy s mutovanou verzí měly více histonů, které byly poseté acetylovými skupinami (acetylovanými)., Na druhé straně byly tyto acetylované histony vázány molekulami nazývanými proteiny obsahujícími bromodomain (BRD), které regulují genovou expresi.
pro svou současnou studii, která byla částečně financována NCI, chtěli severozápadní vědci zjistit, zda mutantní Histon má stejnou funkci v lidských buňkách. Ve skutečnosti, zjistili, že lidské rakoviny tlustého střeva nebo rakoviny ledvin buňky změněné vyjádřit zmutoval histonu H3 gen měl více acetylované histony, než buňky, které vyjádřil normální histonu H3 gen.
první autor, Andrea Piunti, Ph.D.,, pak zkoumal všechny mutantní histony H3 umístěné v genomech nádorových buněk DIPG od tří pacientů. Jeho analýza odhalila, že mnoho nukleosomů, které obsahovaly mutantní histony, bylo acetylováno a vázáno Brd proteiny.
další experimenty ukázaly, že BRD proteiny mohou hrát přímou roli v růstu nádoru DIPG. Léčba lidských DIPG buněk vyšetřovacími léky, které blokují BRD proteiny, nazývané inhibitory BET, zpomalila růst DIPG buněk ve srovnání s kontrolní léčbou., A ve studiích myší s lidskými DIPG buňkami implantovanými do jejich mozkových stonků měli ti, kteří byli léčeni inhibitory BET, menší nádory a žili déle než myši léčené kontrolní léčbou.
tyto experimenty „naznačují, že inhibitory BET poskytují potenciální terapeutický přístup k DIPG,“ řekl Dr. Shilatifard. Preklinické studie ukázaly, že několik různých typů rakoviny—včetně leukémie a glioblastomu—je také citlivé na inhibitory BET, dodal.,
Další Cíl
Severozápadní skupiny“analýza lidských DIPG nádorových buněk s mutantní histonu H3 také odhalil, že kromě více histonů acetylace H3, mnoho histony byly zdobeny methyl skupiny (denaturovaným). Kromě toho zjistili, že v blízkosti mnoha těchto histonů byl přítomen enzym zvaný PRC2—který váže methylové skupiny na proteiny histonu H3.
tyto výsledky přiměly severozápadní vědce, aby se dále zabývali činností PRC2., Zjistili, že blokování aktivity PRC2-buď geneticky nebo inhibitorem PRC2 zvaným tazemetostat-snižuje růst DIPG buněk.
„neočekávaně tyto výsledky prokazují roli funkce PRC2 při udržování růstu DIPG,“ napsala skupina Northwestern.
Kodaňská skupina také našla důkazy podporující roli PRC2 při podpoře růstu nádoru na DIPG. Pozorovali, že tazemetostat a další inhibitor PRC2 snížily růst mozkových buněk myší nebo lidských DIPG buněk mutantními histony, zatímco kontrolní léčba ne.,
A když se myši implantované mozkové buňky s mutantní histony do mozků běžných myší nebo myší, ve kterém PRC2 byl geneticky blokován, ty, které postrádal PRC2 aktivity žil déle.
V kontrastu, nicméně, samostatné studie výzkumné skupiny v Německu zjistili, že buňky z různých pacientů s DIPG nebyly citlivé na tazemetostat, i když jejich nádory měl histonu H3 mutace.
krok vpřed
desetiletí klinických studií ukázaly, že nádory na DIPG jsou necitlivé na tradiční chemoterapii, vysvětlil Dr. Bandopadhayay., A ačkoli záření může zmírnit příznaky, není to léčebné a většina dětí s DIPG zemře do 2 let od diagnózy.
V roce 2015, mezinárodní konsorcium DIPG vědci spojili, aby studovat všechny dostupné DIPG buněčných vzorků. Jejich studie odhalila, že DIPG buňky získané z několika různých pacientů byl zabit histonů modifikující lék s názvem panobinostat (Farydak®). Panobinostat blokuje enzymy, které přidávají acetylové skupiny do histonů., Nyní vědci, kteří jsou součástí NCI-podporované Dětské Nádor na Mozku Konsorcia, testování bezpečnosti a nejlepší dávka panobinostat pro děti s DIPG ve fázi I klinického hodnocení.
nyní výsledky obou studií ukazují na potenciálně slibné nové léčebné strategie, řekl Dr. Shilatifard.
„chceme se pohybovat VSADIT inhibitory do studie fáze I pro léčbu DIPG, a naši kolegové v Ann & Robert H. Lurie Children“s Hospital of Chicago se tlačí dopředu se těchto studií,“ řekl.,
kromě toho několik probíhajících klinických studií testuje tazemetostat, inhibitor PRC2, u dospělých i dětských pacientů s různými druhy rakoviny. Žádná současná studie však konkrétně nezkoumá tazemetostat u dětí s DIPG.
stále existuje mnoho nezodpovězených otázek, řekl Dr. Bandopadhayay, včetně toho, zda tyto vyšetřovací léky mají schopnost překročit hematoencefalickou bariéru a dosáhnout lidských mozkových nádorů.
Dr., Bandopadhayay a její kolegové se také učí více o biologii DIPG studiem nádorových buněk získaných z biopsií, kromě těch, které byly získány z pitev. Získání vzorků biopsie bylo umožněno teprve nedávno významnými vylepšeními neurochirurgických technik, vysvětlila.
„je to vzrušující čas,“ řekla. „Právě teď probíhá spousta práce. Konečným cílem je být schopen léčit tyto děti tak, aby měly šanci na vyléčení s minimálními vedlejšími účinky.“