Einführung
Posterior reversible Enzephalopathie-Syndrom (PRES), erstmals beschrieben von Hinchey et al. im Jahr 1996 stellt eine neurologische Störung mit unterschiedlicher klinischer Darstellung und typischen bildgebenden Befunden des parieto-occipitalen vorherrschenden Musters vasogener Ödeme dar (1, 2). Es gibt zahlreiche dokumentierte Ursachen für PRES, wobei Fälle zuerst in der Einstellung von erhöhtem arteriellen Druck beschrieben werden., Beispiele für klinische Szenarien, in denen PRES gesehen werden kann, sind unter anderem: hypertensiver Notfall, (Prä -) Eklampsie, Nierenerkrankungen, Autoimmunerkrankungen und zytotoxische Medikamente (3, 4) (Tabelle 1). PRES kann in jeder Altersgruppe auftreten und hat eine höhere Vorkommensrate bei weiblichen Patienten (7, 8). Obwohl die aktuelle Literatur im Vergleich zur erwachsenen Bevölkerung relativ spärlich ist, sollte insbesondere die PRES bei pädiatrischen Patienten erwähnt werden., Pädiatrische Patienten haben eine ähnliche klinische Darstellung wie die erwachsene Bevölkerung, wobei Bluthochdruck, Krampfanfälle und ein veränderter psychischer Status häufige Krankheitserscheinungen sind (9). Trotz der meisten Fälle von pädiatrischen PRES, die bei onkologischen Patienten berichtet wurden, insbesondere bei Patienten nach Stammzelltransplantation (10, 11), eine Studie von Gupta et al. (12) festgestellt, dass Nierenerkrankungen vielleicht die häufigste Ursache für PRES bei pädiatrischen Patienten war. In ihrer Studie hatten pädiatrische Patienten tendenziell mehr atypische bildgebende Befunde (62, 5%), einschließlich der Beteiligung des Frontallappens (56%).,
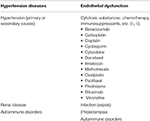
Tabelle 1. Hauptkrankheitszustände im Zusammenhang mit PRES.
Klinische Manifestationen sind akut bis subakut und reichen von Kopfschmerzen und Sehstörungen bis hin zu Bewusstseinsstörungen und Krampfanfällen in schwereren Fällen (1). Die Behandlung zielt im Allgemeinen darauf ab, auf die zugrunde liegende Ursache abzuzielen, wobei in den meisten Fällen im Allgemeinen reversible Symptome und bildgebende Befunde vorliegen (8)., Obwohl die Ergebnisse bei richtiger Behandlung im Allgemeinen günstig sind, wurden schlechte klinische Ergebnisse mit vorbestehendem Diabetes mellitus und Beteiligung des Corpus callosum in Verbindung gebracht; Derzeit fehlen jedoch andere zuverlässige bildgebende Biomarker für die Prognose (13). Die neuroradiologische Bildgebung spielt eine grundlegende Rolle bei der Diagnose von PRES mit den typischen bildgebenden Merkmalen, die bei der Magnetresonanztomographie (MRT) am besten geschätzt werden (2).
Pathophysiologie
Die genauen pathophysiologischen Mechanismen hinter PRES sind noch nicht vollständig geklärt und bleiben umstritten (3)., Derzeit gibt es zwei wichtige vorgeschlagene Mechanismen für die Pathophysiologie von PRES (Abbildung 1). Die erste Theorie schlägt erhöhte arterielle Drücke als primären Faktor vor (8). Ein schneller Anstieg des Blutdrucks überwindet schließlich die autoregulatorischen Fähigkeiten des zerebralen Gefäßsystems, was zu Gefäßleckagen und daraus resultierenden vasogenen Ödemen führt (14). Es gibt eine eventuelle Blut-Hirn-Schranke (BBB) – Dysfunktion mit Proteinen, die durch die enge Verbindung gehen (15)., Die von der hinteren Zirkulation zugeführten Bereiche (Wirbelarterien, Basilararterien und hintere Hirnarterien) sind im Vergleich zur vorderen Zirkulation (innere Halsschlagadern, mittlere Hirnarterien und vordere Hirnarterien) aufgrund des fehlenden sympathischen Tonus des Gefäßsystems der Basilararterie einem außergewöhnlichen Risiko ausgesetzt (8)., Eine verwandte Theorie, die von einigen Postulaten vorgeschlagen wurde, dass extreme Hypertonie zu Vasospasmus und lokaler Ischämie führt, die einen BBB-Abbau und ein daraus resultierendes vasogenes Ödem verursacht, wie dies bei Patienten beobachtet wurde, die mit Immunsuppressiva behandelt wurden Cyclosporin A und FK-506 (16). Die Störung in der BBB verursacht die typischen Befunde eines vasogenen Ödems vs. eines zytotoxischen Ödems (was bei der Einstellung eines akuten Infarkts zu sehen ist und einen erhöhten intrazellulären Wassergehalt aufgrund des Verlusts des üblichen osmotischen Gradienten bei der Einstellung des Zelltodes darstellt (17).,
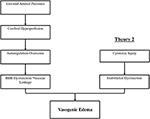
Abbildung 1. Zwei Haupttheorien der Pathophysiologie von PRES. Theorie 1 ist die hypertensive und zerebrale Hyperperfusionstheorie und Theorie 2 ist die Theorie der endothelialen Dysfunktion.
Die zweite Haupttheorie befasst sich mit der Tatsache, dass bis zu 30% der Patienten mit PRES nicht den erhöhten arteriellen Druck aufweisen, der erforderlich ist, um die autoregulatorische Kontrolle des zerebralen Gefäßsystems zu überschreiten (18, 19)., Diese Theorie legt nahe, dass die endotheliale Dysfunktion der Hauptschuldige ist, der durch verschiedene endogene oder exogene Toxine verursacht werden kann (20). Diese Theorie kann die Ergebnisse von PRES erklären, die bei Patienten mit Immunsuppressiva und/oder Chemotherapie sowie bei Patienten mit Sepsis beobachtet wurden (21, 22). In diesem Modell verursachen zirkulierende Toxine Gefäßverletzungen mit der daraus resultierenden Entwicklung von vasogenen Ödemen. Der Endothelschaden verursacht eine weitere Freisetzung von vasokonstriktiven und immunogenen Wirkstoffen, die Vasospasmus und/oder erhöhte Gefäßpermeabilität verursachen können., Letztendlich ist die endotheliale Dysfunktion, die vaskuläre Leckagen und vasogene Ödeme zulässt, der treibende Faktor für PRES, unabhängig von der primären Abnormalität des zerebralen Gefäßsystems (im Falle einer arteriellen Hypertonie) oder sekundär zu zirkulierenden Toxinen. Eine Zusammenfassung dieser beiden Theorien sowie eine Liste der zuvor berichteten Chemotherapeutika und anderen Immunsuppressiva ist in Abbildung 2 dargestellt.
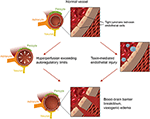
Abbildung 2. Illustration der beiden Haupttheorien der zugrunde liegenden Pathophysiologie von PRES., Danksagung: Mit freundlicher Genehmigung von Caroline O “ Driscoll, MA (Sie hat dies selbst illustriert und ist Angestellte unserer Universität).
Klinische Manifestationen hängen von der betroffenen Region (en) des Gehirns ab; Daher kann die Präsentation breit sein. Zum Beispiel kann die primäre Beteiligung der Okzipitallappen zu Sehstörungen/Halluzinationen führen. Fokale neurologische Defizite, die dem Ort fokaler Läsionen entsprechen, treten bei ~5-15% der Patienten mit PRES auf (23)., In seltenen Fällen kann eine Beteiligung des Rückenmarks zu klinischen Anzeichen und Symptomen einer Myelopathie oder Lähmung führen (24).
Bildgebung
Wie der Name schon sagt, manifestiert sich PRES typischerweise in Bildgebungsstudien als posterior vorherrschendes vasogenes Ödem der weißen Substanz. Die parietalen und okzipitalen Lappen sind fast universell involviert und die Befunde sind typischerweise symmetrisch und bilateral (1). Die Beteiligung der Frontallappen, insbesondere angrenzend an die oberen Frontal Sulci, ist ebenfalls häufig zu sehen., Vasogenes Ödem, obwohl es die zerebrale graue Substanz betreffen kann, wird oft leichter in der subkortikalen weißen Substanz geschätzt. Die CT-Untersuchung ist häufig der erste bildgebende Test bei akuten neurologischen Symptomen und kann eine Hypoattenuation der weißen Substanz in den betroffenen Regionen nachweisen (25) (Abbildung 3: CT von PRES). Insgesamt werden die Befunde am besten durch MRT dargestellt, das im Vergleich zur CT eine erhöhte Empfindlichkeit und eine bessere anatomische Charakterisierung aufweist (26). Darüber hinaus kann die MRT helfen, andere pathologische Zustände zu unterscheiden, die sich klinisch ähnlich wie PRES manifestieren können., Insbesondere die T2-gewichteten und T2-FLAIR-Sequenzen (Fluid-Attenuated Inversion Recovery) sind am nützlichsten, um vasogene Ödeme an der MRT zu erkennen (Abbildung 4: MR von PRES; Abbildung 5: MR von PRES Coronal).
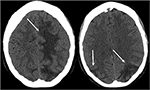
Abbildung 3. Patient mit systemischem Lupus erythematodes und schnell fortschreitender Glomerulonephritis mit Krampfanfall. Nicht-Kontrast-CT-Bilder des Kopfes zeigen vasogene Ödeme in den bilateralen Parietal – und Okzipitallappen, links größer als rechts, sowie Ausdehnung in den linken Frontallappen.,
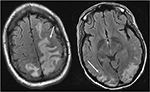
Abbildung 4. Patient mit systemischem Lupus erythematodes und schnell fortschreitender Glomerulonephritis mit Krampfanfall. T2-Flairbilder des Kopfes zeigen vasogene Ödeme in den bilateralen parietalen und okzipitalen Lappen, links größer als rechts, sowie Ausdehnung in den linken Frontallappen. Beachten Sie, dass bei dem vasogenen Ödemmuster eine Signalanomalie im Kortex geschont wird.
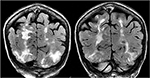
Abbildung 5., Patient mit einer Geschichte von primären Myelofibrose und Knochenmarktransplantation auf Tacrolimus präsentiert mit ersten Krampfanfall. Koronale T2-FLAIR-Sequenzen zeigen eine ausgedehnte Signalanomalie im bilateralen Okzipital-und Parietallappen, wie sie bei PRES typisch ist.
Die Differentialdiagnose für PRES ist breit gefächert und umfasst Entitäten mit ähnlicher konfluenter T2-Hyperintensität weißer Substanz., Beispiele hierfür sind: Ischämie / Infarkt (insbesondere posteriorer Kreislauf), demyelinisierende Erkrankungen, infektiöse Ätiologien (Meningitis, Enzephalitis), progressive multifokale Leukoenzephalopathie (PML), Vaskulitis und verschiedene Stoffwechselstörungen (27). Es wird angenommen, dass eine klinisch verwandte Entität namens reversibles zerebrales Vasokonstriktionssyndrom (RCVS) durch Veränderungen des zerebralen Gefäßtonus verursacht wird, die zu einer Vasokonstriktion führen., RCVS manifestiert sich als wiederkehrende Thunderclap-Kopfschmerzen, Krampfanfälle, Schlaganfälle und nicht-aneurysmatische Subarachnoidalblutungen (28), die klinisch mit PRES verwechselt werden können. Diese Entität tritt typischerweise in der postpartalen Phase oder nach Exposition gegenüber adrenergen oder serotonergen Medikamenten auf. RCVS können typischerweise mit angiographischen Studien diagnostiziert werden, die multifokale Bereiche der Verengung der Hirnarterien zeigen (29). Diese Diagnose kann mit der Tatsache verwechselt werden, dass RCVS und PRES häufig gleichzeitig auftreten, was dem Neuroradiologen bewusst sein sollte, um Fehldiagnosen zu vermeiden (30).,
PRES kann typischerweise von akuter Ischämie unterschieden werden, da letztere ausnahmslos zytotoxische Ödeme und Diffusionsrestriktionen aufweist. Eine eingeschränkte Diffusion bei akuter Ischämie kann leicht bei diffusionsgewichteter Bildgebung (DWI) und scheinbarem Diffusionskoeffizienten (ADC) als hyperintensives Signal bei DWI mit entsprechend verringertem Signal bei ADC (aufgrund der relativ verringerten Bewegung intrazellulärer Wassermoleküle) nachgewiesen werden., Vasogenes Ödem bei der Einstellung von PRES kann andererseits ein Hyperintense-Signal auf DWI zeigen, das nicht von einem entsprechenden verminderten Signal auf ADC begleitet wird (31). Darüber hinaus neigt die akute Ischämie dazu, einseitig und innerhalb eines singulären vaskulären Territoriums zu sein. Während die Beurteilung der Diffusionsrestriktion zur Unterscheidung von PRES von ischämischer Anomalie im Allgemeinen zuverlässig ist, gibt es seltene Fälle von PRES, die mit Bereichen der Diffusionsrestriktion in Verbindung gebracht werden können, die Bereichen des klassischeren isolierten vasogenen Ödems überlagert sind.,
„Erweitert“ bildgebende Verfahren in der PRES haben vor kurzem beschrieben, wie ein Zusatz-tool in schwierigen und zweideutigen Fällen. Diese fortschrittlichen Bildgebungstechniken umfassen: CT / MR-Perfusion, MR-Spektroskopie (MRS), suszeptibilitätsgewichtete Bildgebung (SWI) und nuklearmedizinische Techniken, einschließlich Einzelphotonenemissionstomographie (SPECT) und Positronenemissionstomographie (PET) mit unterschiedlichen Radiotracern. Obwohl eine vollständige Diskussion über den Rahmen dieser Überprüfung hinausgeht, kann eine Vielzahl von bildgebenden Befunden zu diesen fortschrittlichen Techniken gesehen werden, um eine Diagnose von PRES vorzuschlagen., Hyperperfusion kann in CT / MR-Perfusionsstudien beobachtet werden, die durch erhöhten zerebralen Blutfluss und Blutvolumen mit reduzierter Perfusionszeit und mittlerer Transitzeit (32) nachgewiesen wurden, obwohl Fälle von Hypoperfusion berichtet wurden (33). Bei MRS kommt es im Allgemeinen zu einer Verringerung des N-Acetylapartat – (NAA)/Kreatin – (Cr) und NAA/Cholin – (Chol) – Verhältnisses, was auf eine Störung der normalen Synapsen und der neuroaxonalen Funktion hindeutet (34). SWI kann helfen, das Vorhandensein von Blutungen in PRES mit höherer Empfindlichkeit als GRE-Bildgebung zu identifizieren (35)., Die SPECT / PET-Bildgebung zeigt typischerweise entweder Hyperperfusion oder Hypoperfusion (ähnlich CT/MR-Perfusionsstudien) mit niedrigem Metabolismus durch FDG-PET (36).
Zusätzlich kann PRES von anderen Zuständen wie Autoimmunenzephalitis im Rahmen der akuten disseminierten Enzephalomyelitis (ADEM) durch das erstere diffuse bilaterale, aber asymmetrische vasogene Ödem (37) unterschieden werden., PML kann im Vergleich zu PRES ein ähnliches Aussehen haben und eine parieto-okzipitale Dominanz aufweisen, kann sich jedoch durch eine einseitige oder asymmetrische Beteiligung sowie eine Vorliebe für subkortikale weiße Substanz auszeichnen (38).
Atypische Bildgebungsmerkmale
Atypische Merkmale von PRES umfassen Bereiche der Kontrastverstärkung, Blutung oder Diffusionsrestriktion (39)., Obwohl die parietalen und okzipitalen Lappen im Allgemeinen beteiligt sind, können atypische Bereiche der Beteiligung gesehen werden, einschließlich: Hirnstamm, Kleinhirn, Corpus callosum und andere zerebrale Bereiche, mit häufigeren Bereichen einschließlich der Frontallappen (in bis zu 68% gesehen) und unteren Temporallappen (bis zu 40%) (23, 40) (Abbildung 6: Kleinhirn; Abbildung 7: Hirnstamm).
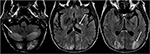
Abbildung 6. Patient mit Lebertransplantation 6 Wochen früher. Der Patient wurde nach Lebertransplantation mit Tacrolimus begonnen., T2-FLAIR Bilder des Gehirns zeigen Signalanomalie in den Okzipitallappen. Es gibt auch eine ausgedehnte Signalanomalie in den bilateralen Kleinhirnhemisphären und im Thalami. Diese Befunde lösten sich nach dem Absetzen des Tacrolimus schnell auf.
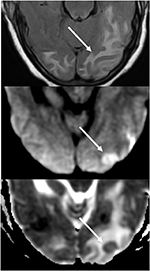
Abbildung 7. Patient mit unkontrollierter Hypertonie präsentiert mit Veränderung des psychischen Status. T2-FLAIR (oben) Bild zeigt Ödeme in den Okzipitallappen., DWI (mitte) und ADC karte (unten) bilder zeigt eine kleine pfeil von begrenzte diffusion, mit hyperintense signal auf DWI und entsprechende hypointensity auf die ADC karte.
Zusätzlich umfasst ein früher Befund von PRES, der dem typischen parieto-okzipitalen Ödem vorausgehen kann, eine leichte Sulcal FLAIR-Hyperintensität und eine leptomeningeale Verstärkung bei T1-gewichteten Bildern nach Kontrast, wie von Nakagawa et al. (41). Benziada-Boudour et al., (42) beschrieb eine gleichzeitige Entwicklung eines zytotoxischen Ödems, das zu einer eingeschränkten Diffusion führte (Abbildung 8: Diffusionsrestriktion). Inhärent im Namen des Krankheitsprozesses, Die Befunde im Zusammenhang mit PRES sind in der Regel reversibel, mit Normalisierung der klinischen und bildgebenden Befunde, sobald das anstiftende Problem behandelt wird. In einigen Fällen können jedoch Bereiche mit eingeschränkter Diffusion letztendlich zu einer dauerhaften Verletzung des Hirnparenchyms führen (Abbildung 9: Laminare Nekrose)., Blutungen treten seltener bei PRES auf und treten in 5-30% der Fälle auf, sollten jedoch erkannt werden, dass dieser Befund nicht mit einer anderen pathologischen Entität im geeigneten klinischen Umfeld von PRES verwechselt wird (39). Bildgebende Befunde bei Blutungen können umfassen: fokales Hämatom, petechiale Mitralblutung und/oder Subarachnoidalblutung (43) (Abbildung 10: Blutung).
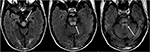
Abbildung 8. Patient mit einer Geschichte von Lebertransplantation zwei Wochen früher auf Tacrolimus., T2-FLAIR-Bilder zeigen Signalanomalien im Mittelhirn, Pons und oberen Kleinhirnstielen.
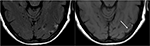
Abbildung 9. T2-FLAIR (links) Bild bei einem Patienten mit unkontrollierter Hypertonie und vorheriger Bildgebung, die PRES anzeigt (siehe Abbildung 6), jetzt kontrolliert und 6 Wochen später, zeigt die Auflösung des zuvor gesehenen Ödems. Kleine Bereiche der Gliose aufgrund von Verletzungen sind im linken Temporallappen zu sehen. Axiale Nicht-Kontrast T1 zeigt krummlinige kortikale laminare Nekrose im Zusammenhang mit der vorherigen Verletzung im Zusammenhang mit PRES., Während PRES im Allgemeinen vollständig reversibel ist, kann es in einigen Situationen zu dauerhaften Verletzungen kommen.
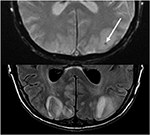
Abbildung 10. Patient mit einer früheren Lebertransplantation auf Tacrolimus. T2 Gradient von Echo (oben) zeigt einen fokalen Bereich der Blutung innerhalb des vasogenen Ödems im linken Okzipitallappen. T2-FLAIR zeigt den typischeren Befund im Zusammenhang mit PRES mit Signalanomalie in den bilateralen Okzipitallappen.,
Behandlung
Die Behandlung von PRES zielt typischerweise darauf ab, die primäre Ätiologie zu kontrollieren, die PRES verursacht (44). Zum Beispiel zielt die Behandlung bei erhöhtem arteriellen Druck darauf ab, den erhöhten Blutdruck in einer kontrollierten Umgebung zu korrigieren, ähnlich dem Ansatz für hypertensive Dringlichkeit/ Notfall (45). Typischerweise wird versucht, eine nicht schnelle Blutdrucksenkung zu vermeiden, um das Risiko einer ischämischen Hirnerkrankung infolge einer drastischen Blutdrucksenkung zu vermeiden (46)., Gelegentlich werden antikonvulsive Medikamente als Zusatztherapie verwendet, obwohl die optimalen Mittel, der Zeitpunkt und die Dauer der Behandlung umstritten bleiben (4) (Abbildung 11: Vorher und nachher).
Abbildung 11. Patient mit einer Vorgeschichte von primärer Myelofibrose und Knochenmarktransplantation auf Tacrolimus. Axiale T2-FLAIR-Bilder zeigen die Bereiche der Signalanomalie im Parietal-und Okzipitallappen sowie im rechten Frontallappen (linke Bilder)., Der Tacrolimus wurde gestoppt und die Folgebilder (rechte Bilder) wurden 6 Wochen nach den ersten Bildern erhalten.
Bei (Prä -) Eklampsie zielt die Behandlung auf die rechtzeitige Entbindung des Fötus sowie auf Blutdruckmanagement und Magnesiumsulfat zur Anfallsprophylaxe ab (47). Bei der Einstellung der durch chemotherapeutische oder andere Immunsuppressiva induzierten PRES hat sich das Verjüngen oder absolute Absetzen des Arzneimittels sowohl klinisch als auch radiologisch verbessert (48) (Abbildung 12: Eklampsie)., Hypomagnesiämie ist ein häufiger Befund bei PRES und ein möglicher ätiologischer Faktor. Daher haben die Autoren vorgeschlagen, dass eine Magnesiumergänzung eine nützliche Ergänzung beim PRES-Management sein kann (49).
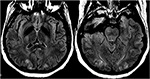
Abbildung 12. Patient mit Eklampsie und Patienten mit Anfall. Axiale T2-FLAIR-Bilder zeigen eine symmetrische Signalanomalie in den bilateralen Okzipitallappen.,
PRES ist eine einzigartige Einheit mit charakteristischen klinischen und neuroradiologischen Befunden, zusätzlich zu unzähligen gut dokumentierten Ursachen. Obwohl der genaue pathophysiologische Mechanismus(die genauen pathophysiologischen Mechanismen) hinter PRES noch nicht geklärt ist (und in der Tat auf eine Kombination miteinander verbundener Prozesse zurückzuführen sein kann), ist der allgemein akzeptierte Mechanismus eine Dysfunktion der Blut-Hirn-Schranke, die zu vasogenen Ödemen mit posteriorem Kreislauf führt Vorherrschaft., Bildgebende Merkmale werden am besten an flüssigkeitsempfindlichen MR-Sequenzen bewertet, die parieto-okzipitale vorherrschende weiße Substanz und Hyperintensitäten aufdecken, obwohl viele atypische bildgebende Merkmale zu sehen sind und bei der Bewertung herausfordernder Fälle berücksichtigt werden sollten. Verschiedene fortschrittliche Bildgebungswerkzeuge stehen zur Verfügung, um in schwierigen oder zweideutigen Fällen zu helfen. Die Behandlung zielt darauf ab, die zugrunde liegende Ursache mit besonderem Augenmerk auf die Blutdrucküberwachung und mögliche Anfallsprophylaxe zu behandeln.,
Autor Beiträge
Interessenkonflikt
Die Autoren erklären, dass die Forschung wurde in Abwesenheit von kommerziellen oder finanziellen Beziehungen ausgelegt werden könnte, als ein potenzieller Interessenkonflikt.
1. Bartynski WS. Posterior reversible Enzephalopathie-Syndrom, Teil 1: grundlegende Bildgebung und klinische Merkmale. Am J Neuroradiol. (2008) 29:1036–42. doi: 10.3174/ajnr.,A0928
CrossRef Full Text | Google Scholar
3. Bartynski WS. Posterior reversible encephalopathy syndrome, Part 2: controversies surrounding pathophysiology of vasogenic edema. Am J Neuroradiol. (2008) 29:1043–9. doi: 10.3174/ajnr.A0929
CrossRef Full Text | Google Scholar
5. Singer S, Grommes C, Reiner AS, Rosenblum MK, DeAngelis LM. Posterior reversible encephalopathy syndrome in patients with cancer., Oncologist. (2015) 20:806–11. doi: 10.1634/theoncologist.2014-0149
PubMed Abstract | CrossRef Full Text | Google Scholar
6. How J, Blattner M, Fowler S, Wang-Gillam A, Schindler SE. Chemotherapy-associated posterior reversible encephalopathy syndrome: a case report and review of the literature. Neurologist. (2016) 21:112–7. doi: 10.1097/NRL.,0000000000000105
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Habetz K, Ramakrishnaiah R, Raina SK, Fitzgerald RT, Hinduja A. Posterior reversible encephalopathy syndrome: a comparative study of pediatric versus adult patients. Pediatr Neurol. (2016) 65:45–51. doi: 10.1016/j.pediatrneurol.2016.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Fugate JE, Rabinstein AA., Posterior reversible encephalopathy syndrome: clinical and radiological manifestations, pathophysiology, and outstanding questions. Lancet Neurol. (2015) 14:914–25. doi: 10.1016/S1474-4422(15)00111-8
CrossRef Full Text | Google Scholar
9. Zama, D, Gasperini P, Berger M, Petris M, De Pasquale MD, et al. A survey on hematology-oncology pediatric AIEOP centres: the challenge of posterior reversible encephalopathy syndrome. Eur J Haematol. (2018) 100:75–82. doi: 10.1111/ejh.,12984
CrossRef Full Text | Google Scholar
12. Gupta V, Bhatia V, Khandelwal N, Singh P, Singhi P. Imaging findings in pediatric posterior reversible encephalopathy syndrome (PRES): 5 years of experience from a tertiary care center in India. J Child Neurol. (2016) 31:1166–73. doi: 10.1177/0883073816643409
PubMed Abstract | CrossRef Full Text | Google Scholar
13., Hinduja Ein, Habetz K, Raina S, Ramakrishnaiah R, Fitzgerald RT. Prädiktoren für ein schlechtes Ergebnis bei Patienten mit posterioren reversiblen Enzephalopathie-Syndrom. Int J Neurosci. (2017) 127:134–44. doi: 10.3109/00207454.2016.1152966
PubMed Abstract | CrossRef Full Text | Google Scholar
15. MacKenzie ET, Strandgaard S, Graham DI, Jones JV, Harper ‚ BIN, Farrar JK. Auswirkungen der akut induzierten Hypertonie bei Katzen auf das Kaliber pial arteriolar, den lokalen zerebralen Blutfluss und die Blut-Hirn-Schranke. Circ Res., (1976) 39:33–41. doi: 10.1161/01.RES.39.1.33
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bartynski WS, Zeigler Z, Spearman MP, Lin L, Shadduck RK, Lister J. Etiology of cortical and white matter lesions in Cyclosporin-A and FK-506 neurotoxicity. Am J Neuroradiol. (2001) 22:1901–14.
PubMed Abstract | Google Scholar
21. Bartynski WS, Boardman JF, Zeigler ZR, Shadduck RK, Lister J., Posterior reversible encephalopathy syndrome in infection, sepsis, and shock. Am J Neuroradiol. (2006) 27:2179–90.
PubMed Abstract | Google Scholar
22. Mayama M, Uno K, Tano S, Yoshihara M, Ukai M, Kishigami Y, et al. Incidence of posterior reversible encephalopathy syndrome in eclamptic and patients with preeclampsia with neurologic symptoms. Am J Obstet Gynecol. (2016) 215:239.e1–e5. doi: 10.1016/j.ajog.2016.02.,039
PubMed Abstract | CrossRef Full Text | Google Scholar
23. McKinney AM, Short J, Truwit CL, McKinney ZJ, Kozak OS, SantaCruz KS, et al. Posterior reversible encephalopathy syndrome: incidence of atypical regions of involvement and imaging findings. Am J Roentgenol. (2007) 189:904–12. doi: 10.2214/AJR.07.2024
PubMed Abstract | CrossRef Full Text | Google Scholar
24., de Havenon A, Joos Z, Longenecker L, Shah L, Ansari S, Digre K. Posterior reversible encephalopathy syndrome with spinal cord involvement. Neurology. (2014) 83:2002–6. doi: 10.1212/WNL.0000000000001026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Dandoy CE, Linscott LL, Davies SM, Leach JL, Myers KC, El-Bietar J, et al., Clinical utility of computed tomography and magnetic resonance imaging for diagnosis of posterior reversible encephalopathy syndrome after stem cell transplantation in children and adolescents. Biol Blood Marrow Transplant. (2015) 21:2028–32. doi: 10.1016/j.bbmt.2015.07.023
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Noda K, Fukae J, Fujishima K, Mori K, Urabe T, Hattori N, et al., Reversible cerebral vasoconstriction syndrome presenting as subarachnoid hemorrhage, reversible posterior leukoencephalopathy, and cerebral infarction. Intern Med. (2011) 50:1227–33. doi: 10.2169/internalmedicine.50.4812
CrossRef Full Text | Google Scholar
31. Doelken M, Lanz S, Rennert J, Alibek S, Richter G, Doerfler A, et al. Differentiation of cytotoxic and vasogenic edema in a patient with reversible posterior leukoencephalopathy syndrome using diffusion-weighted MRI. Diagn Interv Radiol., (2007) 13:125–8.
Google Scholar
32. Wartenberg KE, Parra A. CT and CT-perfusion findings of reversible leukoencephalopathy during triple-H therapy for symptomatic subarachnoid hemorrhage-related vasospasm. J Neuroimaging. (2006) 16:170–5. doi: 10.1111/j.1552-6569.2006.00031.x
CrossRef Full Text | Google Scholar
33. Vanacker P, Matias G, Hagmann P, Michel P., Cerebral hypoperfusion in posterior reversible encephalopathy syndrome is different from transient ischemic attack on CT perfusion. J Neuroimaging. (2015) 25:643–6. doi: 10.1111/jon.12158
CrossRef Full Text | Google Scholar
34. Lee SY, Kim SH, Lee SH, Baek HJ, Shon HS, Kim SS. Serial MR spectroscopy in relapsing reversible posterior leukoencephalopathy syndrome. Neurologist. (2009) 15:338–41. doi: 10.1097/NRL.,0b013e3181914af6
PubMed Abstract | CrossRef Full Text | Google Scholar
35. McKinney AM, Sarikaya B, Gustafson C, Truwit CL. Detection of microhemorrhage in posterior reversible encephalopathy syndrome using susceptibility-weighted imaging. Am J Neuroradiol. (2012) 33:896–903. doi: 10.3174/ajnr.A2886
PubMed Abstract | CrossRef Full Text | Google Scholar
38., Berger JR, Aksamit AJ, Clifford DB, Davis L, Koralnik IJ, Sejvar JJ, et al. PML-Diagnose-Kriterien: consensus statement der AAN neuroinfectious Erkrankung Abschnitt. Neurologie. (2013) 80:1430-8. doi: 10.1212/WNL.0b013e31828c2fa1
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Aracki-Trenkić Und, Stojanov D, Trenkić M, Radovanovic Z, Ignjatovic J, Ristic S, et al., Atypical presentation of posterior reversible encephalopathy syndrome: clinical and radiological characteristics in eclamptic patients. Bosn J Basic Med Sci. (2016) 16:180–6. doi: 10.17305/bjbms.2016.1201
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Bartynski WS, Boardman JF. Distinct imaging patterns and lesion distribution in posterior reversible encephalopathy syndrome. Am J Neuroradiol. (2007) 28:1320–7. doi: 10.3174/ajnr.,A0549
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Brickman AM, Reitz C, Luchsinger JA, Manly JJ, Schupf N, Muraskin J, et al. Long-term blood pressure fluctuation and cerebrovascular disease in an elderly cohort. Arch Neurol. (2010) 67:564–9. doi: 10.1001/archneurol.2010.70
PubMed Abstract | CrossRef Full Text | Google Scholar
47., Cozzolino M, Bianchi C, Mariani G, Marchi L, Fambrini M, Mecacci F. Therapy and differential diagnosis of posterior reversible encephalopathy syndrome (PRES) during pregnancy and postpartum. Arch Gynecol Obstet. (2015) 292:1217–23. doi: 10.1007/s00404-015-3800-4
PubMed Abstract | CrossRef Full Text | Google Scholar
48. Masetti R, Cordelli DM, Zama D, Vendemini F, Biagi C, Franzoni E, et al. PRES in children undergoing hematopoietic stem cell or solid organ transplantation. Pediatrics., (2015) 135:890–901. doi: 10.1542/peds.2014-2325
CrossRef Full Text | Google Scholar