Einführung
Koagulase-negative Staphylokokken (CoNS), Mitglieder der Staphylokokkengruppe, sind als grampositive Kokken gekennzeichnet, die als einzelne Zellen oder mit unregelmäßiger Disposition dargestellt werden und unbeweglich sind, nicht sporenbildende, Katalase-negative Staphylokokken.-positive, meist fakultative Anaerobier und fehlt das Enzym Koagulase.,1 Nachteile sind Teil der menschlichen Mikrobiota, die als opportunistische Krankheitserreger gelten und Infektionen hauptsächlich bei Frühgeborenen sowie immungeschwächten und prothetischen Patienten verursachen.2
Der Anstieg der Antibiotikaresistenz in den letzten Jahren hatte große Auswirkungen auf Krankenhausinfektionen, die durch Nachteile verursacht wurden. Oxacillin ist ein halbsynthetisches Penicillin, das im Anfälligkeitstest zum Nachweis von Methicillinresistenz und zur Behandlung von Staphylokokkeninfektionen verwendet wird. In den klinischen Isolaten wurden jedoch Raten von 66% bis 95% der Oxacillinresistenz beobachtet.,2 Oxacillinresistenz wird häufig durch das mecA-Gen vermittelt, das ein ergänzendes Penicillin-bindendes Protein (PBP2a) mit geringer Affinität zu halbsynthetischen Penicillinen kodiert.3 Das mecA-Gen befindet sich auf einem mobilen genetischen Element, das als Staphylokokken-Kassetten–Chromosom mec (SCCmec) bekannt ist und den mec-Komplex enthält, der aus dem mecA-Gen und seinen Regulatorgenen mecI und mecRI, dem ccr-Komplex, besteht, der für die Integration und Exzision des SCCmec verantwortlich ist, und J-Region, die für die SCCmec-Bildung nicht wesentlich ist, aber nicht β-Lactam-Resistenzgene tragen kann.,4 Bisher wurden 13 SCCmec-Typen beschrieben, basierend auf der Kombination von ccr-Genkomplextypen und mec-Genkomplexklassen. Die Subtypen wurden durch J-Region-Polymorphismen in der gleichen Kombination von mec-und ccr-Komplexen definiert.5
Das Auftreten oxacillinresistenter Isolate hat letztendlich zur Verwendung alternativer antimikrobieller Mittel zur Behandlung von Virusinfektionen wie dem Glykopeptid Vancomycin geführt. In der Zwischenzeit wurden in den letzten Jahrzehnten Beschreibungen einer verringerten Anfälligkeit und Resistenz gegen Vancomycin berichtet.,6 Eine verringerte Anfälligkeit für Vancomycin kann mit metabolischen Modifikationen wie einer Beschleunigung der Peptidoglycansynthese zusammenhängen, was zu einer Verdickung der Zellwand führt. In diesem Prozess ist Vancomycin nicht in der Lage, die Peptidoglycansynthese zu hemmen, da es aufgrund der höheren Verfügbarkeit von D-Alanyl-D-Alanin-Stellen erschöpft ist.,7
Angesichts des Anstiegs der Krankenhausinfektionen, der durch Nachteile verursacht wurde, zielte diese Studie darauf ab, die Oxacillin-resistenten Stämme zu charakterisieren und die antimikrobielle Anfälligkeit einer 20-jährigen Sammlung von Blutkulturkons-Isolaten von Botucatu Hospital das Clínicas zu bestimmen stationäre Patienten.
Material und Methodenstrains
Dreihundert CoNS-Stämme wurden aus Blutkulturen von stationären Patienten des Botucatu Hospital das Clínicas – Paulista State University (UNESP) isoliert., Die Isolate wurden von 1990 bis 2009 gesammelt und im Kultursammellabor der Abteilung für Mikrobiologie und Immunologie des Botucatu Biosciences Institute – UNESP aufbewahrt. Die Auswahl der Kriterien als eine mittlere Prävalenz von Veranstaltungen von 35%, mit eine Marge von Fehler von 5% und 95% Konfidenzintervall.
Die Stämme isoliert wurden, nach Koneman et al.8 Blut-Agar-Isolate wurden zur Beobachtung der Koloniemorphologie einer Gram-Färbung unterzogen und der Katalase-Test zur Bestätigung der Gattung Staphylococcus durchgeführt., Staphylokokkenstämme wurden dem Koagulase-Test zur Differenzierung der Koagulase-negativen und koagulase-positiven Gruppen vorgelegt. Koagulase-negative Isolate wurden biochemischen Tests zur phänotypischen Identifizierung von Arten unterzogen. Die genotypische Identifizierung wurde unter Verwendung von Primern durchgeführt, die über konservierte Sequenzen neben 16S-und 23S-Genen gezogen wurden, durch ITS-PCR (interne transkribierte Spacer–Polymerase-Kettenreaktion), beschrieben von Couto et al.Die Amplifikationseffizienz wurde durch Elektrophorese in 3% metaphorischer Agarose überwacht und mit SYBRELLA gefärbt., The following lineages of international reference were used: S. auricularis ATCC 33753, S. capitis subsp. capitis ATCC 27843, S. capitis subsp. urealyticus ATCC 49325, S. caprae ATCC 35538, S. cohnii ATCC 49330, S. cohnii subsp. cohnii ATCC 29974, S. epidermidis ATCC 12228, S. epidermidis ATCC 35983, S. hemolyticus ATCC 29970, S. hominis ATCC 27844, S. hominis subsp. novobiosepticus ATCC 700237, S. lentus ATCC 700403, S. lugdunensis ATCC 700328, S. saprophyticus ATCC 15305, S. schleiferi subsp. schleiferi ATCC 43808, S. sciuri subsp. sciuri ATCC 29062, S. simulans ATCC 27851, S., xylosus ATCC 29979, und S. warneri ATCC 10209.
DNA-Extraktion
Für die DNA-Extraktion wurde das Illustra Kit (GE Healthcare) verwendet. Die Schritte umfassten eine anfängliche Verdauung von Staphylokokkenzellen mit Lysozym (10 mg/ml) und Proteinase K (20 mg/ml). Als nächstes wurden 500µL des Extraktionspuffers zu der Mischung gegeben, die bei 10.000 x g für 4min zentrifugiert wurde. Der Überstand wurde in eine Kolonne überführt und 1 min bei 5.000 g zentrifugiert. Die Flüssigkeit wurde verworfen und 500µL Extraktionspuffer in die Säule gegeben., Nach der Zentrifugation und dem Wegwerfen der gesammelten Flüssigkeit wurden 500µL Waschpuffer zu der Säule gegeben, die 3min lang bei 20.000 g zentrifugiert wurde. Anschließend wurde die Säule in ein 1,5-ml-Röhrchen überführt und die Elution mit 200µL erwärmtem MilliQ-Wasser bei 70°C durchgeführt.
Der mecA-Gennachweis
PCR wurde zum Nachweis des mecA-Gens durchgeführt. Reaktionen wurden unter Verwendung eines Protokolls durchgeführt, das von Murakami et al.10 Die Amplifikationseffizienz wurde durch Elektrophorese in einem mit SYBRELLA gefärbten 2% igen Agarosegel überwacht.,
Bestimmung von SCCmec
Der SCCmec-Typ wurde an mecA-positiven Stämmen bestimmt. Reaktionen wurden unter Verwendung eines von Oliveira et al. beschriebenen Protokolls durchgeführt.11 und modifiziert von Machado et al.12
Multiplex PCR wurde in 50µL Reaktionsvolumen mit 1X Enzympuffer, 1 durchgeführt.,25 U Taq polymerase DNA, 200 μM dNTP Mix, and the following primers: 10pmol of RIF2 F2 (TTCGAGTTGCTGATGAAGAAGG) and CIF2 R2 (ATTTACCACAAGGACTACCAGC), 6pmol of KDP F1 (AATCATCTGCCATTGGTGATGC) and KDP R1 (CGAATGAAGTGAAAGAAAGTGG), 5pmol of DCS F2 (CATCCTATGATAGCTTGGTC) and DSC R1 (CTAAATCATAGCCATGACCG), 5pmol of RIF4 F3 (GTGATTGTTCGAGATATGTGG), and RIF4 R9 (CGCTTTATCTGTATCTATCGC). For each reaction, 10μL DNA was added. The cycle sequencing reactions were performed at 92°C for 3min, followed by 30 cycles of 92°C for 1min, 56°C for 1min, and 72°C for 1min and 30s., Die Amplifikationseffizienz wurde durch Elektrophorese in einem mit SYBRELLA gefärbten 2% igen Agarosegel überwacht.
Bestimmung der minimalen inhibitorischen Konzentration (MIC) durch den E-Test
Die In vitro-Anfälligkeit von CoNS-Stämmen wurde auf folgende antimikrobielle Mittel getestet: Oxacillin, Vancomycin, Daptomycin, Linezolid, Chinupristin/Dalfopristin und Tigecyclin. Die Wirksamkeit dieser Medikamente wurde durch den E-Test bestimmt. Die Kriterien für die Anfälligkeitsklassifizierung waren: Oxacillin
µg / ml (anfällig) für Nachteile, außer S., lugdunensis (anfällig ≤2µg/mL und resistent ≥4µg/mL), Vancomycin µg/mL (anfällig), 8–16µg/mL (zwischen-resistent), und >32µg/mL (widerstandsfähig); Linezolid ≤4µg/mL (anfällig); Daptomycin ≤1µg/mL; Quinupristin/Dalfopristin ≤1µg/mL (anfällig), 2µg/mL (intermediate), und ≥4µg/mL (widerstandsfähig); Tigecyclin ≤0,5 µg/mL.,13Screening-Test zum Nachweis einer verringerten Anfälligkeit für Vancomycin
Zum Nachweis einer verringerten Anfälligkeit für Vancomycin wurde ein Screening-Agar-Test mit Brain Heart Infusion (BHI) Agar und 4µg/ml, 6µg/mL, 8µg/ml und 16µg/ml Vancomycin verwendet. Der für Vancomycin anfällige Referenzstamm S. aureus ATCC 29213 wurde als Negativkontrolle und der gegen Vancomycin resistente Stamm E. faecalis ATCC 51299 als Positivkontrolle verwendet. Flecken von a 2.,0 McFarland-Inokulum wurden der Agarplatte zugesetzt und 24 Stunden lang bei 35°C inkubiert, und das Wachstum von mindestens einer Kolonie wurde als positives Ergebnis betrachtet.
Analyse der Zellwanddicke
Die CoNS-Stämme, die eine verringerte Anfälligkeit für Vancomycin zeigten, wurden der elektronischen Transmissionsmikroskopie zur Analyse der Zellwanddicke vorgelegt. Die Stämme wurden in BHI-Brühe kultiviert und 24 Stunden lang bei 37° C inkubiert. In einer Mikroröhre wurden 1000µL einer BHI-Kulturbrühe für eine Minute bei 12.000 U / min zentrifugiert. Nach dem Abwerfen des Überstands wurden Stämme in einer Karnovsky-Lösung fixiert (2.,5% Glutaraldehyd in Phosphatpuffer 0,1 M) für vier Stunden. Die Proben wurden aus dem Fixierer entfernt und fünf Minuten lang dreimal in destilliertem Wasser gewaschen. Als nächstes wurden die Proben 40 Minuten lang in 0,5% Osmiumtetroxid eingetaucht, bevor sie 10 Minuten lang dreimal in destilliertem Wasser gewaschen wurden. Die Proben wurden mit zunehmenden Alkoholkonzentrationen dehydriert: zweimal für 10 Minuten in 7.,5% Alkohol; zweimal für 10min in 15% Alkohol; zweimal für 10min in 30% Alkohol; zweimal für 10min in 50% Alkohol; dreimal für 15min in 70% Alkohol; zweimal für 15min in 90% Alkohol; zweimal für 10min in 100% Alkohol. Nach der Dehydrierung wurden die Stubs montiert und Proben metallisiert. Die Analysen wurden in einer elektronischen Mikroskopie Tecnai Spirit Fei Unternehmen durchgeführt und die Bilder wurden bei einer Vergrößerung von 30000×erhalten.,
ResultsIdentification of isolates
Tabelle 1 stellt die Quelle der verschiedenen Spezies Isolate, sowie die demographischen Daten der Patienten mit Bakteriämie.
Nachweis des mecA-Gens und Charakterisierung von SCCmec Bestimmung der minimalen inhibitorischen Konzentration (MIC)
Durch den E-Test wurden die Mikrofone der zur Behandlung von Virusinfektionen verwendeten antimikrobiellen Mittel bestimmt. Oxacillinresistenz wurde in 206 (68,7%) CoNS-Stämmen gefunden und 25 waren tigecyclinresistent (8,3%). Resistenz gegen Tigecyclin wurde in 4,5% von S. epidermidis, 13,8% von S. hemolyticus, 13% von S. nachgewiesen., hominis, und 11.1% von S. lugdunensis. Für Quinupristin / Dalfopristin zeigte ein S. epidermidis-Isolat eine intermediäre Resistenz mit einem MIC von 2µg/ml und ein S. epidermidis und ein S. hemolyticus mit MICs von 3µg / ml. Die Empfindlichkeit und Spezifität des Oxacillin-MIC durch den E-Test im Vergleich zum Vorhandensein von mecA betrug 87,4% bzw.
In Bezug auf diese Spezies zeigte die Parameterverteilung von MIC50 und MIC90 hohe Oxacillinresistenzraten bei S. hemolyticus., Dies war die einzige CoNS-Spezies, für die die minimale Konzentration zur Hemmung von 50% der Isolate >256µg/ml betrug, was die hohe Resistenzrate von S. hemolyticus gegenüber Oxacillin widerspiegelte (Tabelle 3).
Der MIC-Bereich jedes antimikrobiellen Mittels wurde mit dem SCCmec-Typ verglichen. Die als SCCmecI typisierten Isolate wiesen höhere Tigecyclin-Mikrofone auf, und diejenigen, die als SCCmecII klassifiziert wurden, wiesen die höchsten Oxacillin-Mikrofone auf. Die SCCmecIV-Stämme zeigten die höchsten MIC-Werte für Vancomycin, Linezolid, Daptomycin und Chinupristin/Dalfopristin (Tabelle 4).
Determination of the MIC range according to SCCmec.
| MIC range (μg/ml) | ||||
|---|---|---|---|---|
| Antimicrobial | SCCmec I | SCCmec II | SCCmec III | SCCmec IV |
| Oxacillin | 0.094≥256 | 6≥256 | 0.,125≥256 | 0.125≥256 |
| Vancomycin | 0.25–2 | 0.38–2 | 0.125–2 | 0.75–2 |
| Linezolid | 0.064–1 | 0.19–0.5 | 0.047–0.75 | 0.064–1 |
| Daptomycin | 0.016–025 | 0.016–0.094 | 0.019–0.5 | 0.047–0.75 |
| Quinupristin/Dalfopristin | 0.025–1.5 | 0.094–0.5 | 0.064–1 | 0.125–2 |
| Tigecycline | 0.016–2 | 0.023–0.75 | 0.016–0.75 | 0.,032-1 |
MIC Minimale Inhibitorische Konzentration.
Es wurde eine Auswertung der Oxacillin-und Vancomycin-Mikrofone über einen Zeitraum von 20 Jahren durchgeführt, aufgeteilt in drei Zeiträume entsprechend der Verteilung der Oxacillin-und Vancomycin-Mikrofone. Für Oxacillin wurden in der ersten Periode (1990-2001) höhere MIC-Werte beobachtet, was jedoch immer noch auf eine Anfälligkeit hinweist., In den anderen Perioden (2002-2006 und 2007-2009) wurde eine Abnahme der MIC-Werte beobachtet, was immer noch auf eine Anfälligkeit sowie einen Anstieg der Widerstandsraten hinweist. In Bezug auf Vancomycin zeigte die gleiche Auswertung signifikante Unterschiede in den drei Perioden zwischen Stämmen mit Mikrofonen von 0,047 µg / ml bis 0,38 µg/ml und von 0,5 µg/ml bis 2,0 µg / ml (Abb. 1).
Bestimmung der verminderten Vancomycin-Anfälligkeit
Auf der BHI-Platte wurde ein Wachstum von 214 (71,3%) Stämmen mit 4µg/ml Vancomycin, 89 (29,7%) auf der Platte mit 6µg/ml Vancomycin und 8 (2 beobachtet.,6%) Isolate auf der 8µg/ml Vancomycinplatte. Keines der Isolate wuchs im Medium mit 16µg/ml Vancomycin. Es gab keine signifikanten Unterschiede in den Mikrofonen zwischen Stämmen, die kein Wachstum auf der mit Vancomycin ergänzten Platte zeigten, und solchen, die auf der 4µg/ml-Vancomycin-Platte wuchsen. Unter denen, die ein Wachstum auf dem Medium mit 6µg/ml Vancomycin zeigten, betrug der MIC–Bereich 0,5-2µg/ml. Unter denen, die auf 8µg/ml Vancomycin wuchsen, betrug der MIC-Bereich 0,75-24µg / ml. Die Stämme, die auf 8µg/ml Vancomycin gezüchtet wurden, waren vier S. epidermidis, ein S. hemolyticus, zwei S. hominis und ein S., capitis, alle resistent gegen Oxacillin, und S. epidermidis und S. capitis sind Träger von SCCmec III, S. hominis von SCCmec I und S. hemolyticus mit nicht typisierten SCCmec.
Analyse der Zellwanddicke von Stämmen mit verminderter Anfälligkeit für Vancomycin
Die Zellwanddicke unter Zellteilung wurde in acht Stämmen gemessen (Werte sind in Nanometern dargestellt, Mittelwert±SD). Die vier S. epidermidis-Stämme vorgestellt Mittelwerte 21.66±1.4, 20.12±0.9, 24.24±1.3, und 14.20±1,3 nm. Das S. hemolyticus Isolat zeigte eine Zellwanddicke von 24,88±1,7 nm. Für den S., capitis isolieren, die Zellwand-Dicke 19.33±1.8, und für die beiden S. hominis Isolate waren die Werte 17.68±2.1 und 24.92±1.5. Zum Vergleich zeigten die verwendeten Referenzstämme S. epidermidis ATCC 12228 und S. hemolyticus ATCC29970 Zellwanddicken von jeweils 14,61±1,2 und 14,73±0,7 nm. Der Vergleich der untersuchten Stämme mit Kontrollen zeigte höhere Werte im Bereich von 17 nm bis 24, 92 nm, mit Ausnahme eines S. epidermidis-Isolats, das im Vergleich zu den Kontrollen einen niedrigeren Wert aufwies (Abb. 2).,
CoNS Bakteriämie Evolution
Die mögliche Entwicklung von Bakteriämie zu anderen Infektionen, wie Sepsis, Lungenentzündung, Harnwegsinfektion, Meningitis, Peritonitis, nekrotisierende Enterokolitis, Omphalitis und Hirnabszess, wurde bei 52 Patienten verfolgt, die zu den Neugeborenenstationen zugelassen wurden. Von diesen wurde bei 25 (46,3%) Patienten die gleiche Substanz, die aus der Blutkultur isoliert wurde, als ätiologischer Infektionserreger bestätigt. In sechs (11.1%), Nachteile war das möglich agent der Infektion, und in 23 (42.6%) Nachteile nicht im Zusammenhang mit der Patienten – „s-Infektion (Abb. 3).,
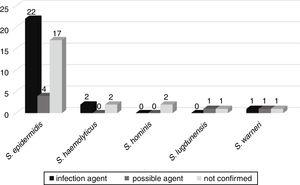
Korrelation der aus Blutkulturen isolierten Nachteile als mögliche ätiologische Erreger von Infektionen, die bei Neugeborenen-Patienten verursacht werden.
Das mecA-Gen wurde in 33 (61,1%) dieser Nachteile nachgewiesen, wobei 20 (60,6%) Nachteile mit schwereren Infektionen oder möglichen Erregern dieser Infektionen verbunden waren.
Diskussion
Die Nachteile gelten als eine der Hauptursachen für Bakteriämie., Die Bedeutung dieser Bakterien hat in den letzten Jahren in der Krankenhausumgebung zugenommen, hauptsächlich aufgrund der antimikrobiellen Resistenz. In der vorliegenden Arbeit wurden 300 verschiedene Stämme untersucht, die über einen Zeitraum von 20 Jahren aus Blutkulturen stationärer Patienten im Krankenhaus der Kliniken von Botucatu isoliert wurden. Diese Isolate wurden hinsichtlich ihrer antimikrobiellen Anfälligkeit charakterisiert.
Der mecA-Nachweis bestimmte die Oxacillinresistenz in 78,5% der Fälle, und der MIC50–Wert (2µg/ml) zeigte eine Resistenz gegen dieses Arzneimittel an, was die geringe Anfälligkeit dieser Bakterien für β-Lactam-Mittel bestätigte., Frühere Arbeiten haben gezeigt, dass die CONS-Isolate seit den 1970er Jahren höhere Oxacillin-Resistenzraten aufweisen als S. aureus.14,15 Es wurde gezeigt, dass die β–Lactam-Resistenzraten in Krankenhäusern in Brasilien und in anderen Ländern zwischen 65% und 95% liegen.2,16,17 Die höchsten Oxacillin-Resistenzraten wurden bei S. epidermidis festgestellt, gefolgt von S. hemolyticus, S. hominis und S. capitis. Ähnliche Ergebnisse wurden in früheren Studien beschrieben, die Oxacillinresistenz in 97% der S. epidermidis zwischen 1999 und 2001 auf einer neonatalen Intensivstation (NICU) zeigten, 18 in 96% von S., hemolyticus isoliert in Brasilien, 19 und in 100% von S. hominis isoliert in einer NICU aus Spanien.20 In Bezug auf S. capitis wurden in den von Caierão et al. durchgeführten Studien diskrepante Ergebnisse gefunden.21
Obwohl bei einer niedrigeren Frequenz, wurde das mecA-Gen in S. warneri und S. lugdunensis nachgewiesen. S. warneri wurde mit Raten von 33,3% der Oxacillinresistenz in NICUs beschrieben, 22 und die erste Beschreibung von mecA in S. lugdunensis war in der Studie von Kawaguchi et al.23 Trotz der geringen Resistenzraten, 24 Bestimmung der antimikrobiellen Anfälligkeit von S., lugdunensis ist nicht nur aufgrund seiner klinischen Implikationen wichtig, da diese Art die aggressivste der Nachteile ist, sondern auch für die frühzeitige Behandlung mit adäquaten antimikrobiellen Mitteln und guten klinischen Ergebnissen.25
Die Charakterisierung des SCCmec zeigte das Vorhandensein von Typen I-IV in den Isolaten, wobei SCCmecIII die am häufigsten in den untersuchten Stämmen nachgewiesenen Stämme waren, hauptsächlich in S. epidermidis, der einzigen Spezies, die Typ IV trug., SCCmec Typ III ist der größte von allen, kodifiziert für mehrere resistenzassoziierte Gene und ist der am häufigsten isolierte Typ aus Krankenhausproben. S. epidermidis ist der Hauptkolonisator der menschlichen Haut und der am häufigsten an Infektionsstellen nachgewiesene. Der selektive Druck im Krankenhausumfeld führt zur Verbreitung von SCCmec III-Stämmen, die mit schweren Infektionen einhergehen.26 SCCmec Typ IV wurde mit Community-assoziierten Staphylococcus spp., und wurde zum ersten Mal in einem S. epidermidis Stamm beschrieben, eine Tatsache, die seine Übertragung von S impliziert., epidermidis S. aureus. Ein reduzierter Kostentransfer von SCCmec IV aufgrund seiner geringen Größe würde wahrscheinlich zu einer höheren Inzidenz von Infektionen führen, die durch SCCmec IV-Träger verursacht werden.12,27 SCCmecII präsentierte eine Assoziation mit S. hemolyticus, ähnlich den Befunden von Machado et al.,12, deren Arbeit nur Typ II bei dieser Spezies nachgewiesen hat.
Die Alternative zur Behandlung von Oxacillin-resistenten Staphylokokken ist Vancomycin, ein Glykopeptid, das erstmals 1958 bei invasiven Infektionen eingesetzt wurde. Es gibt jedoch Beschreibungen von Resistenz und verminderter Anfälligkeit für dieses Medikament,6 obwohl instabil.,28 Die Ergebnisse der aktuellen Arbeit zeigten, dass Vancomycin mit Ausnahme von Oxacillin das Medikament mit den höchsten Werten von MIC50 und MIC90 war. Trotz der vollen Anfälligkeit der Sammlung waren die MIC-Werte im Zeitraum von 20 Jahren am höchsten, und bei einigen Stämmen von S. epidermidis, S. hemolyticus, S. hominis und S. capitis wurde eine verringerte Anfälligkeit festgestellt. In den Studien von Natoli et al., 29 eine verringerte Anfälligkeit für Vancomycin wurde mit einer Häufigkeit von 5, 4% bei CoNS-Isolaten bei S. epidermidis-und S. hemolyticus-Arten nachgewiesen., Denselben Autoren zufolge können Staphylokokkenkolonien, die auf Vancomycin-Agar gezüchtet werden, zu einer Glykopeptid-Heteroresistanz führen, die ein Vorläufer der Glykopeptidresistenz sein kann und komplizierte Infektionen und Behandlungsversagen verursacht. Dies sollte bei therapeutischen Entscheidungen berücksichtigt werden.30
Die Zunahme des Anteils Oxacillin-resistenter Patienten und die Abnahme ihrer Anfälligkeit für Vancomycin unterstreichen die Bedeutung von Studien mit anderen therapeutischen Entscheidungen., Tigecyclin, ein grampositives und negatives halbsynthetisches Breitspektrum-Glycylcyclin, gilt als Arzneimittel mit ausgezeichneter Aktivität gegen Oxacillin-anfällige und resistente Viren,14,29 trotz unserer Daten mit Resistenzraten von 8, 3%, am häufigsten bei S. hemolyticus, gefolgt von S. hominis, S. lugdunensis und S. epidermidis. Ähnliche MIC90-Ergebnisse wurden für Tigecyclin beschrieben, ohne Unterschied zwischen Oxacillin-resistenten und anfälligen CoNS.31 In den Studien von Natoli et al.29 Tigecyclin zeigte eine gute Aktivität gegen Nachteile., Diesen Autoren zufolge wird Tigecyclin nicht zur Behandlung von Bakteriämie empfohlen, und seine Verwendung sollte begrenzt sein, um die Aktivität gegen multiresistente gramnegative Bakterien zu erhalten. Mutationen in den ribosomalen Genen S10 und rpsJ und mepA scheinen mit Tigecyclinresistenz assoziiert zu sein.32,33
Quinupristin / Dalfopristin ist ein Streptogramin, das zur Makrolid-Lincosamid-Streptogramin-Gruppe gehört., Die Kombination von Chinupristin und Dalfopristin ist synergistisch und normalerweise bakterizid, wenn diese Mittel einzeln oder im Vergleich zu ähnlichen antimikrobiellen Makrolidmitteln verglichen werden.34 In dieser Arbeit wurde trotz hervorragender Wirksamkeit in der Mehrzahl der untersuchten Studien eine intermediäre Resistenz gegen dieses Medikament bei zwei S. epidermidis und einem S. hemolyticus nachgewiesen. In der Studie von Mendes et al., 35 Chinupristin / Dalfopristin zeigte eine ausgezeichnete Wirksamkeit für CoNS, die Stämme waren vollständig anfällig, mit MIC90-Werten von 0,38 µg / ml für die Oxacillin-anfälligen Stämme und 0.,75µg / ml für die Oxacillin-resistenten Stämme. Darüber hinaus Venkatesh et al.36 beschrieb eine gute Wirksamkeit von Chinupristin / Dalfopristin für Oxacillin-resistente und anfällige Stämme.
Daptomycin, ein seit Jahrzehnten untersuchtes antimikrobielles Mittel, wurde 2006 wieder zur Behandlung von Bakteriämie und Endokarditis durch Staphylokokken eingesetzt.37 In der vorliegenden Studie zeigte Daptomycin eine ausgezeichnete Wirksamkeit für CoNS-Isolate mit niedrigen MIC50-Werten. Olivares et al.37 überprüfte auch die Anfälligkeit aller CoNS für Daptomycin mit geringen Schwankungen der MIC-Werte., In einer Arbeit, die 1126 Nachteile untersucht, durchgeführt von Critchley et al., 38 Daptomycin war in einem MIC-Bereich von 0,015 bis 2,0 µg/ml aktiv, und der MIC90 betrug 0,5 µg/ml. Diesen Autoren zufolge waren Daptomycin und Chinupristin/Dalfopristin die wirksamsten Wirkstoffe in diesen Analysen, was die Relevanz dieser antimikrobiellen Mittel bei der Behandlung von durch CoNS verursachten Infektionen unterstreicht.
Linezolid, ein synthetisches Oxazolidinon, das möglicherweise gegen mehrere Bakterien wirksam ist, ist ein weiteres Medikament, das eine gute Wirksamkeit gegen CoNS gezeigt hat.,39 Linezolid ist trotz der Beschreibung der Resistenz wichtig für die therapeutische Behandlung chronischer Infektionen durch Nachteile geworden. In Brasilien wurde der erste Fall von Linezolidresistenz 2006 auf einem klinischen Isolat von MRSA40 und unter anderem in S. epidermidis, S. hominis und S. hemolyticus beschrieben.41 In der Arbeit von Olivares et al., 37 trotz des Nachweises von sieben Linezolid-resistenten Stämmen präsentierte dieses Medikament wirksame MIC-Werte in CoNS-Stämmen. Auf der anderen Seite, ein Ausbruch von Linezolid resistent S., epidermidis-Klone, die Mutationen in ribosomalen Proteinen L3 und L4 sowie das kürzlich in Frankreich identifizierte CFR-Plasmid enthalten, wurden berichtet.42
S. hemolyticus war die Spezies, die die höchsten Oxacillin-MIC-Werte aufwies, und Konzentrationen von mehr als 256 µg/ml wurden benötigt, um 50% der Isolate zu hemmen. Neben Oxacillin zeigte diese Art höhere MIC-Werte für Tigecyclin und die meisten der getesteten antimikrobiellen Mittel. Mehrere Arbeiten zeigen eine hohe Resistenz gegen die zur Behandlung von Infektionen durch S verwendeten antimikrobiellen Mittel., hämolyticus, insbesondere Methicillin und Glykopeptide. Einige Autoren beschreiben eine hohe Prävalenz von Genen, die für eine Resistenz gegen β-Lactam-und Aminoglykosid-Wirkstoffe kodieren,sowie einen signifikanten Anteil von Isolaten mit MIC-Werten nahe dem Resistenzbruchpunkt,43, 44, die die Bedeutung von S. hemolyticus als multiresistenten Erreger betonen.
Die Assoziation des MIC-Bereichs mit den SCCmec-Typen zeigte höhere Mikrofone für Vancomycin, Linezolid, Daptomycin und Chinupristin/Dalfopristin bei S. epidermidis und SCCmecIV., Die Gene, die mit der Resistenz gegen diese antimikrobiellen Mittel zusammenhängen, werden durch Plasmide vermittelt, die hauptsächlich in methicillinresistenten Stämmen mit Krankenhausursprung vorkommen.45 SCCmec IV ist charakteristisch für Gemeinschaftsisolate, insbesondere aufgrund seiner Größe und seiner geringen adaptiven Kosten. Studien legen nahe, dass der Erwerb von Resistenzgenen aufgrund der hohen Vielfalt von Resistenzgenträgern in der natürlichen Umgebung nichtklinischen Ursprungs ist.46,47 Darüber hinaus wurde SCCmecIV nur bei S. epidermidis nachgewiesen, die als häufigste Spezies in der menschlichen Haut am stärksten durch selektiven Druck beeinflusst wird., Die höheren Mikrofone im Vergleich zu anderen antimikrobiellen Mitteln können auch mit dem selektiven Druck zusammenhängen, da die Exposition gegenüber diesen Arzneimitteln in der Krankenhausumgebung die Auswahl reduzierter Anfälligkeit und resistenter Stämme beeinträchtigen würde, da mehrere Mutationsereignisse, genetische Rekombination und Modifikationen in der mikrobiellen Physiologie erforderlich sind, um phänotypische Veränderungen zu erzeugen.,48
Metabolische und physiologische Veränderungen im Zusammenhang mit selektivem Druck konnten bei Stämmen beobachtet werden, die auf 8µg/ml Vancomycin-Agar gezüchtet wurden, da die Zellwandverdickung in den meisten CoNS-Isolaten aufgrund einer erhöhten Peptidoglycansynthese gefunden wurde. Dieser Mechanismus ist für CoNS vorteilhafter als der Erwerb des Van Operons, der ein Vermittler der Vancomycinresistenz ist. Das Van-Operon wird durch horizontalen Gentransfer erworben und seine Expression wird nur in Gegenwart von Glykopeptid stimuliert., Dieser Stimulus verursacht in Gegenwart von Vancomycin sehr hohe adaptive Kosten, was für die Nachteile in einem Vancomycin-Medium nachteilig ist.48,49 In Bezug auf den Erwerb anderer Resistenzgene in CoNS, wie dem mecA-Gen, werden die anfänglichen adaptiven Kosten durch kompensatorische zusätzliche Mutationen für die Resistenzkosten gemildert. Kürzlich wurde gezeigt, dass pünktliche Mutationen in Genen wie vraR mit einer verringerten Anfälligkeit für Vancomycin und einer Verdickung der Zellwand bei Staphylokokken assoziiert sind.,50
Die vorliegende Studie zeigte eine hohe Rate von Bakteriämie, die durch Nachteile bei Neugeborenen und pädiatrischen Einheiten verursacht wurde und Kinder unter einem Jahr betraf, wobei die Hauptwirkstoffe S. epidermidis, S. hemolyticus, S. hominis, S. lugdunensis und S. warneri waren. S. capitis wurde in diesen Einheiten nicht isoliert, da es sich bei Erwachsenen, die in die Abteilung für Innere Medizin, Gastroenterologie, Neurologie und Notaufnahme eingeliefert wurden, um Bakteriämie-Erreger handelte.,
Da es sich bei der Studie um eine Bakteriämie handelte, die durch Staphylokokken verursacht wurde, die über mehr als 30 Jahre isoliert wurden, konnten viele der mit den Patientenakten verbundenen Daten nicht abgerufen werden, so dass es nicht möglich war, das Infektionsergebnis aller Patienten in Verbindung zu bringen, was eine Einschränkung der aktuellen Studie darstellt. Daten von Patienten in Neugeborenen-Einheiten zeigten die klinische Bedeutung der CONS-Bakteriämie, die zu Krankheiten fortschreiten kann, die eine spezielle Pflege erfordern.
Die Kenntnis der antimikrobiellen Resistenz ist von großer Bedeutung für die korrekte Behandlung von Infektionen durch CoNS., Darüber hinaus sind die Virulenzfaktoren dieser Bakterien und die Immunität der Patienten Faktoren, die zur Fähigkeit des Mikroorganismus beitragen, ernstere Infektionen zu verursachen.
Die Ergebnisse unserer 20-jährigen Studie zeigten eine hohe Häufigkeit von antimikrobiellen Resistenzen bei Kindern, was den übermäßigen Gebrauch dieser Medikamente widerspiegelt., Neben den metabolischen und physiologischen Veränderungen, die zu einer verminderten Anfälligkeit für antimikrobielle Mittel führen könnten, machen sie ihren Zustand als menschliche kommensale Bakterien zu idealen Transportern und zu einem effizienten Reservoir an Resistenzgenen, insbesondere den kostengünstigen Elementen wie SCCmec.45 Die antimikrobiellen Mittel, die die besten Ergebnisse erzielten, sollten so eingesetzt werden, dass ihre Wirksamkeit erhalten und Resistenzen vorgebeugt werden.,
Interessenkonflikte
Die Autoren erklären, dass die Forschung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.