a p53 gén általános információit először 1979-ben fedezték fel. A Simian vírus 40-transzformált egérsejtjeiben (SV40) egy fehérjét azonosítottak az anti-t szérummal végzett immunoprecipitációval; ezt a fehérjét p53 proteinnek hívták . Ugyanebben az évben Kress és más tudósok egy új, 50-60 km-es molekulatömegű fehérjeosztályt találtak. Ezt a fajta fehérjét ezután p53-ként azonosították . A p53 fehérje különböző transzformált sejtvonalakból is azonosítható immunprecipitációval., Lane és Linzer is hasonló eredményt ért el 1979-ben. Más bizonyíték azonosító p53, hogy a p53 fejezte ki minden tesztelt átalakult egér sejtek; ezek a vizsgálatok között kémiailag indukált szarkóma, átalakult fibroblasztok, valamint leukémia, míg a normális sejtek, p53 nem volt kifejezett. Ezenkívül a legtöbb transzformált sejtben magas p53 szintet észleltek, függetlenül attól, hogy a sejtek hogyan alakultak át, spontán vagy nem spontán módon ., Ez nagyrészt a p53 megnövekedett stabilitásának köszönhető, azonban az F9 embrionális carcinoa sejtekben magas p53 szintet fejezett ki, ennek oka a lefordított p53 mRNS mennyisége volt .
miután 1979-ben felfedezték a p53 fehérjét, népszerűvé vált annak elemzése. Abban az időben azonban, mivel ez egy újonnan felfedezett fehérje volt, és nem volt korábbi neve, a különböző intézmények különböző neveket használtak, és különböző nevekkel publikálták a papírokat., A probléma megoldása érdekében 1983-ban, az Egyesült Királyságban, Oxtedben tartott 1.Nemzetközi p53 workshop során a különböző országok különböző kutatócsoportjainak tudósai összegyűltek, hogy megvitassák az újonnan felfedezett fehérje közös nómenklatúráját. Ezen a találkozón a” p53 ” lett a neve, és azóta is használják. Úgy gondolták, hogy az oka annak, hogy a tudósok a p53 fehérjét hívták, az, hogy ennek a fehérjének a molekulatömege 53kda, amely az SDS gélben történő migrációján alapul. Később kiderült, hogy a molekulatömeg hibás, és a megfelelő molekulatömegnek 43-nak kell lennie.,7kDa mivel a p53 prolinban gazdag régiót tartalmaz, és ez a régió csökkentheti a p53 migrációját az SDS gelben. De a “p53” név maradt .
Az 1980-as években úgy vélték, hogy a p53 fehérje részt vesz a sejtciklusban, valamint szerepet játszik a DNS-replikációban. Később, 1982-1994-ben az emberek azt találták, hogy néhány vírusos onkoprotein képes kötődni a p53-hoz, komplexet alkotva. 1982-ben Sarnow et al. megállapította, hogy az adenovírus E1B (58kDa) kölcsönhatásba léphet egy 54KDA fehérjével, amely jelen van a fent említett SV40-transzformált egérsejtekben., A T antitestek immunológiai sajátosságainak eredményei és az 54kDa fehérje peptidtérképei alapján ezt az 54kDa fehérjét p53-ként azonosítják . Ugyanebben az évben a tudósok azt találták, hogy ha a p53 antitestet Svájci 3T3 egérsejtekbe injektálják, akkor gátolja a sejtciklus S fázisába belépő sejteket; ugyanebben a helyzetben a p53 antitest nem befolyásolta az SV40 vagy az adenovírus által kiváltott DNS-szintézist .,
később, 1984-ben a tudósok megvizsgálták a p53 hatását a nem transzformált 3T3 fibroblasztokra; elemezték a p53 fehérje szintézis sebességét különböző időpontokban, és megállapították, hogy a késői G1 fázisban a szintézis sebessége és a p53 fehérje szintje, valamint annak kapcsolódó mRNS növekedése. Ez az eredmény azt sugallja, hogy a p53 fehérje gátolja az osztófázisba belépő sejteket az interfázisból . Maltzman W et al. ugyanebben az évben újabb kísérletet tett. A nem transzformált egérsejtet UV-fénnyel és UV-mimetikus kémiai karcinogén 4nqo-val kezelték, és magas p53-as szintet mutattak ki., Az eredmény azt mutatta, hogy a p53 emelkedett expressziója nem csak egy szimbólum, amely a sejtciklust jelzi, hanem még fontosabb egy olyan összetevő, amely részt vesz a DNS szintézisében és a sejtproliferációban . 1987-ben a simian virus 40 t antigén komplexének, valamint az α, Gannon DNS polimeráz és más tudósok vizsgálata során hasonló változást találtak az antigénben, amikor p53-hoz és α polimerázhoz kötődtek. Azt is megállapították, hogy a három komponens egy bizonyos koncentrációjánál speciális trimer komplexet képezhetnek, amely magában foglalja a T antigént, a p53-at és az α DNS-polimerázt., T antigén részt vesz a vírus DNS-replikáció, valamint a sejtek átalakulás, ez az eredmény azt jelzi, hogy a p53 szerepet játszik az irányítást a sejt ciklus DNS replikáció .
amint azt a kísérlet fentebb mutatta, a p53 képes halhatatlanná tenni a sejteket. 1984-ben Eliyahu D et al. megállapította,hogy a p53 és a termék onkogén myc megosztott néhány hasonló tulajdonságokkal. Mindkettő képes kötődni más fehérjékhez, részt vesz a sejtciklusban, és mindkettő felhalmozódik a transzformált sejtek magjában ., Bienz, Pennica és Oren elemezték a p53 fehérje aminosav-szekvenciáit és a myc termékét, és megállapították, hogy a két fehérje hasonlóságot mutat a molekuláris szerkezetben és a speciális töltésű maradványok helyzetében. Ezután a tudósok azt javasolták, hogy a p53 onkogénként működhet. E hipotézis alapján Eliyahu D et al. kísérletezett. Mivel az elsődleges embrionális fibroblasztok mind a myc termék, mind a Ha-ras bevonásával átalakíthatók, az elsődleges patkány vesesejteket a Ha-ras és az adenovírus korai régiójának 1A , Eliyahu D et al együttműködésével is át lehet alakítani., úgy döntött, hogy ezt a fajta biológiai vizsgálati rendszert használja a p53 onkogén funkciójának azonosítására. Normál embrionális sejteket kezeltek p53-mal és aktiválták a Ha-ras-t. Az eredmény azt mutatta, hogy a célsejtek találkozik morfológiai változások és magas szintű p53, Eliyahu D et al. úgy vélte, hogy az embrionális fibroblasztok p53 és Ha-ras általi átalakulása magyarázza, hogy a p53 gén onkogén ., 1985-ben Jenkins azt javasolta, hogy a p53 gén meghosszabbíthatja a sejtek élettartamát, fokozhatja az átalakulás affektivitását azáltal, hogy átrendezi kódolási szekvenciáját, amely stabil fehérjék termelését okozhatja .
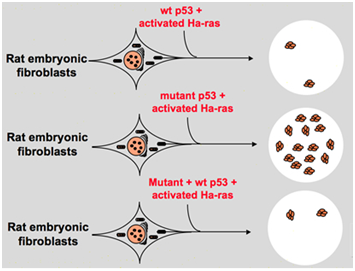
Az 1980-as évek végén azonban a tudósok rájöttek, hogy a p53 tumorszuppresszor gén az onkogén helyett. Megfigyelték, hogy a normál működésű p53 számos daganatban nem mutatható ki, és azt találták, hogy a sejtátalakítás során a vad típusú p53 gén expressziójának és funkciójának elvesztése szükséges., Ezek növelik annak a lehetőségét, hogy a vad típusú p53 gén gátolhatja a neoplasztikus progressziót . Aztán megfogalmaztak egy másik hipotézist: a korábbi kísérletekben használt p53 klón gén alkalmanként domináns negatív mutációkat tartalmaz a magasan megőrzött doménben, amelyek ellentétes kísérlet eredményekhez vezetnek . 1988-ban Ben és más tudósok hatalmas mennyiségű átrendezett p53-at fedeztek fel a Murin erythroleukemia sejtvonalakban–DP20-1 és CB3, amelyek a Friend leukémia vírussal fertőzött Murin spleenséből származnak ., 1989-ben Eliyahu, aki rámutatott, hogy a p53 egy onkogén, meggondolta magát, és feltételezte, hogy a vad típusú p53 gén gátolhatja a sejtek átalakulását. Eliyahu és más tudósok tanulmányozták a hatását vad típusú p53 fehérje által kódolt plazmidok és mutáns p53 a képesség, hogy kiváltják az elsődleges ráta embrió fibroblaszt transzformáció különböző onkogén kombináció in vitro. Például mutáns p53 plus ras, és myc plus ras., Az eredmény azt mutatta, hogy a vad típusú p53 a mutáns p53 plus ras által okozott transzformált gócok hatalmas csökkenéséhez vezet; a mutáns p53 nem mutatott gátlást a myc plus ras által okozott transzformált gócokon, míg a myc plus Ras által közvetített transzformáció nagyon érzékeny a vad típusú p53 kifejezésére. Az 1. ábra tömören mutatja ezt a kísérletet. Azt mutatta, hogy a mutáns p53-hoz képest a vad típusú p53 nyilvánvalóan gátló hatást fejt ki a sejttranszformációra. A hatás pozitívan kapcsolódik a vad típusú p53 expressziós szintjéhez, negatívan kapcsolódik a mutáns p53 expressziós szintjéhez., Ez a kísérlet arra utalt, hogy a vad típusú p53 valóban ellentétes funkcióval rendelkezik a mutáns p53-hoz képest, és gátolhatja a tumorigenesist . Jelenleg a p53-at tumorszuppresszor génként ismerik el. Becslések szerint a tumorok körülbelül felét a p53 okozza. Ez az egyik leggyakrabban mutált gén az emberekben, a leggyakrabban elemzett gén a világ minden tájáról .
az 1980-as évek első néhány évében a p53 biokémiai útja és a p53 mutáció hatása nem volt egyértelmű. 1991-ben Kern és más tudósok megállapították, hogy egy 33 bázisú pár DNS-szekvencia kifejezetten a vad típusú p53-hoz kötődik in vitro. Azt is megállapították, hogy a p53 fehérje két mutációt tartalmaz, amelyek általában olyan emberi daganatokban találhatók, amelyek nem kötődnek ehhez a specifikus DNS-régióhoz. Tehát azt feltételezték, hogy a p53 funkciója attól függ, hogy képes-e megkötni a specifikus DNS-szekvenciákat, és ezt a képességet megváltoztatják az emberi daganatokban található mutációk., Azt is feltételezik, hogy ez a 33-bázisú pár DNS-szekvencia nem lehet az egyetlen szekvencia, amely képes kifejezetten a p53-hoz kötődni az emberekben; ez azonban segíthet az embereknek jobban megérteni a p53 funkcióját . Később kiderült, hogy a p53 szerepet játszik a sejtciklus, a DNS-javítás, a differenciálódás, az apoptózis és az angiogenezis kialakulásában. Rotter V et al. megállapította, hogy a p53 up-szabályozza a sejtek differenciálódását. Például a p53 fehérje magas szintjét több kulcsfontosságú lépésben észlelték a B-sejt differenciálódása során. A spermatogenezis során emelkedett p53 is kimutatható., Eközben a felnőtt egerek egyes szerveiben csak nagyon alacsony a p53 fehérje szintje .
1990-ben alkalmanként hasznos eszközt fedeztek fel. Ez egy hőmérséklet-érzékeny mutáns p53, az úgynevezett p53val135. Valódi vad típusú p53-ként működhet 32,5 oC hőmérsékleten, elnyomva az átalakulást, és más mutált p53-ként is működhet 37,5 oC vagy 48oc feletti hőmérsékleten, ami átalakulást vált ki. Ezenkívül a p53val135-öt expresszáló transzformált sejtek esetében a proliferációt megengedő hőmérsékleten szabályozzák, ez a fajta kontroll reverzibilis., Ezzel a p53val135 mutáns, vad típusú p53 fedezték fel, hogy indukálja sejt ciklus letartóztatás vagy G1 vagy G2 / M . 1991-ben Elisheva et al. megállapította, hogy a hőmérséklet-érzékeny p53val135 más funkciót végzett a Murin myeloid leukaemia sejtvonalában. A p53val135 reaktiválása után néhány napig minden sejt meghalt, ez a halál az apoptózis néhány tulajdonságát mutatja . Egy évvel később hasonló eredményt kapott Shaw. A vad típusú p53-at humán vastagbél tumorból származó EB sejtvonalba transzfektálták., A sejteket fény-és elektronmikroszkóppal vizsgálták, és megállapították, hogy az apoptózis bizonyos tulajdonságai vannak. 1990-ben Scheffner et al. más tudósok azt találták, hogy az E6, amely serkenti a pusztulását gazdasejt szabályozó fehérjék által kódolt onkogén humán papillomavírus típusú 16 és 18, és képezhet egy komplex vad típusú p53 in vitro, ami viszont okozza a lebomlása fehérje p53 .
1992-ben egy kulcsfontosságú mdm2 fehérjét fedeztek fel, mivel szorosan kötődik a p53-hoz, és gátolja a p53 által közvetített transzaktivációt., Az MDM2 molekulatömege 90kDa, komplexet képez mind mutált, mind vad típusú p53-mal . Ugyanebben az évben, Livingstone RL et al. megvizsgálták, hogy a sejt elvesztette-e a vad típusú p53 allélok egyik vagy mindkét példányát, és ez elegendő volt-e a gén amplifikációjához. A gén amplifikációt többnyire transzformált sejtekben észlelték, de nem a normál fibroblasztokban. Az eredmény azt mutatta, hogy a p53 allélok egy példányát elveszítő sejtek vad típusú p53-ként működnek, míg a vad típusú p53 allélok mindkét példányát elvesztő sejtek nagyobb amplifikációs gyakorisággal mutatnak . Egy másik kísérlet, amelyet Yin y et al., hasonló eredményt mutatott .
1993-ban egy CDKN1A nevű p53 célgént azonosítottak. Kódolja a P21 fehérjét, amely egy ciklinfüggő kináz inhibitor, amely a ciklin-CDK2-t és a CDK1-et a hozzájuk való kötődéssel gátolja. 1993-ban Székely megállapította, hogy az Epstein-Barr vírus nukleáris antigén 5 (EBNA-5) az Epstein-Barr vírus kódolja, és megfertőzheti az emberi B limfoblasztoid sejtet. Egy 66 aminosav hosszú peptid felelős a komplex EBNA-5-p53 kialakulásáért, a p53 pontmutációi nem befolyásolták az EBNA-5 kötődési képességét., Azonban gátolja a komplexek képződését más molekulákkal . 1994-ben Cho és munkatársai először leírták a komplex p53-DNS kristályszerkezetét. Ezt a DNS-kötő domént magtartománynak is nevezték. 102-292 maradékanyagot tartalmaz, és béta szendvicsből áll. Bemutatták a magtartomány részletes szerkezetét is . Szintén 1994-ben, Wang XW et al. a hepatitis B vírus x fehérje (HBX) és a vad típusú p53 fehérje közötti kölcsönhatás emberben., Megállapították, hogy a HBX gátolja a p53 azon képességét, hogy más szekvencia-specifikus DNS-hez kötődjön, miután p53-hoz kötődik, és gátolja a p53 transzkripciós faktorokkal való társulását is .
1997-ben, Honda R et al. először feltételezték, hogy az MDM2 kiválthatja a p53 ubiquitilációt, és a p53 lebomlásához vezethet egy ubiquitin-proteaszóma rendszerrel. Rámutattak, hogy az MDM2 kötődik a p53 N-terminális tartományához (NTD), és ubiquitin ligáz E3-ként működik . 1997-ben két új fehérjecsaládot, a P63-at és a P73-at is felfedeztek, amelyek jelentős homológiával rendelkeznek a p53-mal., a P73, más néven tumorfehérje 73, az 1p36-ban található gén kódolja. A helyet gyakran törlik neuroblasztómában és más daganatokban. a p73 aktiválhatja a p53 célgéneket és kölcsönhatásba léphet a p53-mal . Yang et al. megállapították, hogy a P63 gén a 3q27-29-ben található, és különböző egér-és humán sejtekben kimutatható. A p73-hoz hasonlóan a p63 jelentősen képes transzaktiválni a p53 célgéneket, apoptózist is kiválthat. A p63 egyik jellemzője, hogy a P63 többségének nincs N-terminusa ., Ugyanebben az évben a Serrano és munkatársai megállapították, hogy az elsődleges Murin fibroblasztok p53 vagy p16 hiányában a ras által átalakíthatók, az inaktív p53 vagy p16 pedig megkönnyítheti az emberi sejtek halhatatlanná válását. Ezek az eredmények arra utalnak, hogy a p53 szerepet játszik a celluláris szeneszcenciában . Aztán 1997-ben kiderült, hogy a p53 szerepet játszik az apoptózis megindításában. Amikor a sejtek bejutnak a proliferációs fázisba, az egyes kromoszómák végén lévő telomerek a DNS-replikáció minden egyes fordulója után lerövidülnek, mivel a DNS-állvány végén az egyszálú DNS hiányos replikációja következik be ., Az aktivált tumorszuppresszor gén p53 korlátozza a sejtosztódás előfordulásának számát. Wynford TD megállapította, hogy a vad típusú p53 funkciójának elvesztésével minden fibroblaszt elmenekül az apoptózisból. A p53 transzaktivációs funkcióját apoptózis is bekapcsolhatja . A Wynford TD azt javasolta, hogy a p53 aktiválásának három lehetősége van. Az első a foszforiláció utáni transzlációs módosítás, a második pedig felfelé-szabályozza a transzkriptív kofaktorokat, mint például a p33ING1, az utolsó pedig lefelé-szabályozza a p53 inhibitorokat, mint például az MDM2 .
2000-ben, Brodsky MH et al., tanulmányozta a p53 transzkripciós céljait Drosophilában. Bizonyíték van arra, hogy megmutassa Drosophila szeme kijelző súlyos, durva szem fenotípus alatt a kifejezés az emberi p53 hogy rábírja apoptózis szem képzeletbeli lemez sejtek, ami a veszteséget a pigment sejtek, végül gátolja a szem fejlődését, Drosophila , így Drosophila modell lehet állatokat tanulmányozza a funkció a p53. Brodsky megállapította, hogy az RPR gén konszenzusos p53 kötőhelyet tartalmaz, amely az RPR cis-szabályozó régiójában található, valamint az apoptózis aktivátora is., Más bizonyítékokkal Brodsky azt állította, hogy az rpr a p53 egyik transzkripciós célpontja . 2001-ben Derry és munkatársai megállapították, hogy a C. elegansnak nincs p53 génje, de valóban tartalmaz egy cep-1 gént, amely olyan fehérjéket kódol, amelyek hasonló szekvenciával rendelkeznek a p53 fehérjével. Ez a C. elegans gén kódolja a CEP-1 fehérjét, amely genotoxikus stressz hatására képes apoptózist kiváltani, és a meiózis során szükséges összetevő .
2002-ben Tyner és munkatársai azt javasolták, hogy a p53 szerepet játszik az organizmusok öregedésének szabályozásában., A p53 funkciójának tanulmányozása érdekében géntechnológiával módosított egereket hoztak létre mutált p53-mal az 1-6 exonok és a vad típusú p53 gén (p53+/+) upstream régiójának törlésével, p53+/m néven. vad típusú p53-ként működik, és jobban ellenáll a spontán daganatoknak,mint a vad típusú p53. A kísérlet során megfigyelték a p53+/m, p53+/+ és p53+/-tartalmú egereket. p53+ / – azt jelenti, hogy az egerek elvesztik a vad típusú p53 gén egy példányát., Az eredmények azt mutatták, hogy a p53+/m-es egerek egyike sem fejlesztett ki életveszélyes daganatokat, azonban a p53+/- es egerek több mint 80% – ánál, a p53+/+ – os egerek több mint 45% – ánál alakult ki ilyen típusú daganatok. A tumorok belsejében lokalizált tumorelváltozásokat figyeltek meg a 35 p53+/m Egerből 2-ben, ezzel szemben különböző daganatokat, például limfómákat, valamint osteosarcomákat találtak p53+/- és p53+/+ egerekben. A kísérlet során azt is megfigyelték, hogy a p53+/m medián életkora 96 hét volt, míg a p53+/m medián életkora 116-118 hét., Tyner és munkatársai azt is megvizsgálták, hogy a p53+/m rövidebb élettartama összefügg-e az öregedéssel. Megállapították, hogy 18 hónap elteltével a p53+/m egerek fogyni kezdtek, és a p53+/m egerekhez hasonlóan csökkent súlyokat figyeltek meg 30-36 hónapos korban. p53 + / m egerek is mutatnak lordokyphosis. A röntgenvizsgálattól függően a p53 + / m egerek 12 hónapos korban csökkent csontsűrűséget mutattak, 18 hónapos korban pedig súlyossá válik. Ez a csontritkulás szimbóluma, az oszteoporózis pedig az öregedés markere az emberekben és az egerekben . Tyner et al., a stressz toleranciáját is tesztelték, mivel ez a képesség az öregedés markere is . 3 mm-es lyukasztó biopsziát végeztek az idős és fiatal altatott p53+/m és p53+/+ egerek hátsó bőrén. Eredményeik azt mutatták, hogy sok régi p53+/m egér halt meg az Avertin standard adagjának beadása után, jelezve, hogy a régi p53+/m egerek kevésbé tolerálták a stresszt .
1991-ben azt találták, hogy a p53 képes apoptózist kiváltani, míg 2003-ban; Mihara és más tudósok azt találták, hogy a p53 apoptózis szerepet játszik a mitokondriumokban is ., Mivel egyes mitokondriális fehérjék képesek aktiválni a celluláris apoptózist aktív kaszpázokkal vagy semlegesítő citoszol inhibitorokkal. A példában a citokróm c-indukált kaszpáz, miután megkapta az apoptózis jel, a citokróm c megjelent a intermembrane tér, a mitokondrium, aztán viszont kötődik Apf-1, ami létezik, mint egy inaktív monomer, serkenti a reakcióelegy, növeli affinitással dATP/ATP által 10-szeres, mint Apaf-1 kötődik dATP/ATP egyedül. Ezután az apaf-1 – citokróm C komplex kötődik a dATP / ATP – hez, alkotja az apoptoszómát., Ezután az Apaf-1 caspase toborzási tartománya (kártya) az apoptoszómában van kitéve, toborozza a procaspase-9-et, majd autoaktiválja magát. A végső komplex ezután hasítja és aktiválja más kaszpázokat, például a kaszpáz-3-at, amelyek később fontos molekulákat hasítanak a sejtben, kromatin kondenzációt, DNS fragmentációt okozva, végül apoptózishoz vezetve . A 2. ábra a citokróm C-indukálta kaszpáz aktiválási útvonalat mutatja.
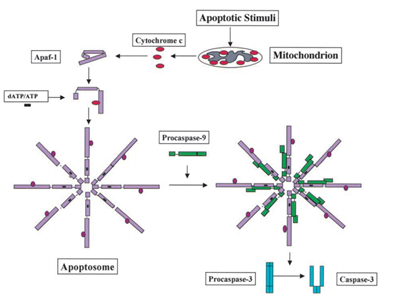
Mihara M et al. a tudósok azt találták, hogy a vad típusú p53 gén gyorsan áttelepíthető a tumorsejtek mitokondriális felületére. A kísérletben azt találták, hogy néhány stressz által kiváltott vad típusú p53 fehérje képes áttelepíteni a timociták mitokondriumába az emberi vagy egérsejtekben az apoptózis után a DNS-károsodás és a hipoxia miatt. Ezek a vad típusú p53 fehérjék a mitokondriumok permeabilizációját indukálják, és a mitokondriumokban bekövetkező változások sorozatát okozzák, mint például a citokróm c felszabadítása bcl2 és BclXL komplex képződésével .,
jó klinikai eredmény, kevés mellékhatással, a génterápia népszerű. 2005 végére 1020 génterápiás vizsgálat volt a Journal of Gene Medicine adatbázisában. Ezek közül a vizsgálatok közül a génterápiák 66%-át rákos betegeken végezték, 58 vizsgálatban pedig a humán p53 gént kódoló rekombináns adenovírust, a RAD-p53-at alkalmazták. 2004 áprilisában hivatalosan elindították a rekombináns humán adenovírus-p53 injekciót (Gendicine). A gendicint fej-és nyaki laphámsejtes karcinóma kezelésére használják, és azt a kínai állami élelmiszer-és Gyógyszerügyi Hivatal hagyta jóvá okt. 16, 2003., Ez lett az első génterápiás termék a világon, amelyet a kínai kormány hagyott jóvá .
a p53 gént 2005-ben fedezték fel, hogy szabályozza az anyagcserét. A G1-ről s-fázisra történő átálláshoz a sejteknek elegendő nyersanyagforrással kell rendelkezniük a DNS, az organellák és a fehérjeszintézis számára. Ennek a folyamatnak a szabályozásához néhány ellenőrző pont szükséges. Az egyik a G1/S glükózfüggő ellenőrzőpont.ezt az AMP-aktivált protein kináz (AMPK) szabályozza. Amikor a glükóz kimerült, az AMPK foszforilálhatja a p53 fehérjét, ami viszont sejtmegállást idéz elő, és elkerüli a sejtek halálát., Azok a sejtek, amelyek találkoznak a p53-függő letartóztatással, újra belépnek a sejtciklusba, amikor a glükóz elegendő .
ismeretes, hogy a p53 inaktiválása szükséges a daganatok kialakulásához. Bykov et al. VJ és Snydel el et al. rámutat arra, hogy a p53 nem megfelelő működése egy meglévő daganat proliferációjához vezethet . Ventura és munkatársai kísérleteztek, hogy teszteljék ezt a hipotézist. Visszaállították az endogén p53 funkcióját az elsődleges autochtonous daganatokban, hogy megvizsgálják a p53 reaktiváció következményeit., Az eredmény azt mutatta, hogy a p53 reaktiváció felelős az autochthonous daganatok regressziójáért. Ez azt jelenti, hogy az inaktivált p53 fehérje tumorfejlődéshez vezethet . Xue és más tudósok is kísérleteztek, hogy teszteljék a p53 újraaktiválásának következményeit a daganatokon. Reverzibilis RNS interferenciát (RNAi) alkalmaztak az endogén p53 expressziójának szabályozására májrákos egerekben. A kísérletben a doxiciklin (Dox) a p53 újraaktiválására szolgál, mivel a p53 expressziója teljesen elnyomódik, amikor a Dox hiányzik, és Dox hozzáadása után gyorsan helyreáll., Dox-kezelés esetén a p53 miRNA-t kikapcsolták, ami viszont a p53 fokozott expresszióját okozza. Az eredmény azt mutatta, hogy a DOX-szal kezelt egerekben a daganatok 12 nap elteltével észrevehetetlenek, míg a kezeletlen egerekben a daganatok gyorsan növekedtek. A p53 átmeneti újraaktiválásának következményeinek tesztelésére 4 napig kezelték az egereket Dox – szal, majd abbahagyták. Az eredmény azt mutatta, hogy még egy kétnapos kezelés is okozhat a tumorok regresszióját, 4 napos kezelés pedig a daganatok teljes regresszióját okozhatja., Rámutattak arra is, hogy a tumor regresszió során az átmenetileg újraaktivált p53 sejtes szeneszcenciát válthat ki, nem apoptózist. Ugyanebben az évben a Hu megállapította, hogy a p53-/- nőstény egerekben az embrionális implantációt a Leukaemia gátló tényező (LIF) szabályozza. A LIF egy szekretált citokin, amely fontos a blasztociszta beültetéséhez. A LIF-et kódoló gént p53 célgénként azonosítják, a p53 kötőhely pedig az intron 1-ben található mind emberekben, mind egerekben .