Bevezető
Malacka mortalitás egyik fő kiválasztása jelleg a sertés tenyésztés, illetve befolyásolja a koca, a malacok, a környezet. Ezért a malac mortalitás összetett fenotípus, és attól függ, hogy a koca képes-e utódainak nevelésére, de a születési súly, a kezelés és a kiválasztás függvénye is (Knol et al., 2002)., Ugyanakkor a monogén recesszív hibák is hozzájárulnak a malac mortalitásához, bár a múltban csak néhány példát jelentettek (Murgiano et al., 2012; Matika et al., 2019). Még azokban az esetekben is, amikor a mutáció hatása súlyos, az ilyen mutáció elleni hatékony választást az alacsony gyakoriság akadályozza. Sok súlyos hiba esetén a zigóták nagyon korán halnak meg a terhesség alatt ,nem hagyva nyomot más, mint a homozigóta hiánya a lakosságban (Derks et al., 2019).,
a kereskedelmi sertéspopulációk beltenyésztési hatásait általában szelektív tenyésztéssel ellenőrzik a malacok mortalitásának csökkentése érdekében, mind az anyai képességek, mind a malac életképességének javításával (Olijslagers, 2018). A recesszív monogén defektusok alapjául szolgáló variánsok azonban a tenyésztési értékeken belül nem jól rögzülnek, és az intenzív szelekció eredményeként potenciálisan magasabb frekvenciákra sodródnak (Georges et al., 2019). Ezenkívül ezek a változatok fenntarthatók a heterozigóta állapotban Korrelált pozitív hatás kiegyenlítésének eredményeként is (Derks et al., 2018).,
recesszív hibák csak kis mértékben járulnak hozzá az Általános malacpusztuláshoz (Alonso-Spilsbury et al., 2007). Mindazonáltal a malacok mortalitását befolyásoló változatok nagy jelentőséggel bírnak, mivel ezek a változatok közvetlenül befolyásolják a termelést és az állatjóllétet (Baxter et al., 2013; Rutherford et al., 2013). Az állatpopuláció kezelésében azonban a hibák alacsony gyakoriságú előfordulását általában rosszul dokumentálják (gyakran nagyon általános kifejezéseket használnak), és a szindrómákat gyakran csak akkor ismerik fel, ha elérték a magas frekvenciát., Ez különösen fontos olyan szindrómák esetében, amelyek nem vezetnek nagyon eltérő fenotípusokhoz. Ezért még a kereskedelmi tenyésztési populációkban is kevés nyomon követést lehet végezni bizonyos szindrómákon, ezért a specifikus alacsony frekvenciájú szindrómák elleni hatékony választáshoz új megközelítésekre van szükség.
ebben a munkában egy kereskedelmi sertéspopulációban egy rendkívül legyengítő szindróma felfedezését írjuk le egy kombinált közepes sűrűségű SNP tömbök és teljes genom szekvenálás (WGS) alapján végzett felmérésen keresztül., A felmérés az SPTBN4 gén 16-bp frameshift deléciójának azonosításához vezetett, a homozigóták várható egyértelmű fenotípusos következményeivel. A vivőfrekvencia a vizsgált populációban körülbelül 9%, ami a népesség almainak körülbelül 0, 81% – át érinti. A gyakoriság elég alacsony volt ahhoz, hogy ismeretlen legyen, hogy genetikai alapja legyen, sőt gyakorlatilag egyáltalán nem ismerik fel specifikus szindrómaként. A felmérés végrehajtása során egy vemhes kocát azonosítottak egy hordozó vaddisznó által., Az érintett malacok szenved, izomkárosodás, de nem gyalog, általában ami a halál után pár órával a szülés után, teljesen összhangban van a becsült patológia összehasonlítva hasonló emberi egér esetekben.
anyag és módszerek
állatok, genotípusok és előfeldolgozás
az adatkészlet 31 839 állatból áll, nagy fehér háttérrel rendelkező szintetikus vaddisznóvonalból. A vonalat Topigs Norsvin nucleus gazdaságokban tartják fenn és tenyésztik, elsősorban a termelési és egészségügyi jellemzők alapján., Az állatokat az Illumina GeneSeek custom 50K SNP chipen (Lincoln, NE, USA) genotipizálták. A > 0, 15-ös genotípusú állatokat eltávolították. Mi dobni markerek, hogy nem feleltek meg a következő szűrési feltételek: minimális hívás mértéke 0.85, egy kisebb allél gyakorisága > 0.01, valamint a Hardy-Weinberg, az arányok pontos teszt p-érték P < 10-12. Ezenkívül az Sscrofa11.1 genomszerkezeten ismeretlen helyen lévő markereket eldobták, így a szűrés után 41 573 markeret hagytak., Minden lépést végeztünk Plink v1.90B3.30 (Purcell et al., 2007).
Egy Fokozatos, illetve Azonosítása SSC6 Egy
végeztünk egy fokozatos, illetve pótlása hiányzó helyek Beagle5.0 a paraméter a hatékony populáció mérete készlet 100, egyéb beállítások alapértelmezett (Browning et al., 2018). A várható homozigótákat a haplotípus gyakorisága alapján becsülték meg, a Hardy-Weinberg elv alapján. Pontos binomiális tesztet alkalmaztak a megfigyelt homozigóták számának vizsgálatára a várható homozigóták számával., A haplotípust szignifikánsan kimerültnek tekintették, ha P < 5 × 10-3.
az SSC6 Haplotípushoz kapcsolódó fenotípusos hatásokat
megvizsgáltuk az SSC6 haplotípusát az összesen 9666 alom született, halva született, mumifikált malacok, ellés túlélése és laktációs túlélése (túlélés körülbelül 21 napos korig) nyilvántartásában. Felsoroltuk ezeket a fenotípusokat az összes CXC-re, és a cxn-almokat azonosítottuk. A Welch t-tesztjét használtuk annak felmérésére, hogy a CXC almokból származó fenotípusok jelentősen különböznek-e a CxN almoktól. P-érték < 0.,A 05-öt jelentősnek tekintették.
teljes genom szekvenáló Analízis és jelölt variáns azonosítás
az adatkészlet 71 teljes genomszekvenált egyedből áll a vizsgált populációból. Mind a 71 mintákat is jelen voltak az adatkészlet a 31,839 állatok genotyped az 50K. A 71 minták egy teljes mennyisége 1.93 Tbp (tera bázispár) a 14.16 milliárd 150-bp párosított-end olvas (Táblázat S3). A mintákat az Illumina HiSeq 2000-en szekvenálták. A szekvenciákat az Sscrofa11.1 genomépítéshez igazítottuk a BWA-MEM 0.7 verziójával.,15 (Li és Durbin, 2009), átlagos leképezhetősége 98,9% és a minta lefedettsége 8,8-14,8 x (10,9 x átlag). A SAMBLASTER-t a PCR másolatok eltávolítására használták (Faust and Hall, 2014). Samtools használták rendezni, egyesítése, és index bam fájlok (Li et al., 2009). A térképészeti és minőségstatisztikákat a Qualimap (Okonechnikov et al., 2016). Variant calling végeztünk Freebayes v1.1. 0 a következő beállításokat: –min-bázis-minőség 10 –min-alternatív-frakció 0,2 –haplotípus-hossza 0 –min-alternatív-count 2 (Garrison and Marth, 2012)., A Phred quality score < 20 variánsokat elvetették (Li et al., 2009). A változatokat az Ensembl variant effect predictor (VEP, 96.kiadás) (Mclaren et al., 2016). A missense variánsok hatását a tolerant (SIFT) (Kumar et al., 2009). Az LD analízist Plink v1.90B3.30 (Purcell et al., 2007) a következő beállításokkal –chr-set 18, –r2, ld-window-r2 0.8.
SPTBN4 protein Igazítás
a fehérje igazítását a vad típusú és mutáns fehérje között ClustalO (Madeira et al.,, 2019) és az ESPript 3 segítségével (Robert and Gouet, 2014). További vizualizációs és validációs végeztünk a jbrowse Genom viewer verzió 1.12.1 (Skinner et al., 2009).
Érvényesítése ok-Okozati 16 bp SPTBN4 Törlés
PCR történt a 60 ng a genomiális DNS-0,4 µm az egyes alapozó, 1.8 mM MgCl2-ot, 25 egység/ml OneTaq® DNS-Polimeráz (OneTaq® 2X Mester Mix Standard Puffer, New England Biolabs) a gyártó PCR puffer végső térfogata 12 µl., A kezdeti denaturációt 1 percig 95°C-on 35 ciklus 95°C-on 30 s-On, 55°C-on 45 s-on, 72°C-on 90 s-On, majd 5 perc hosszabbítás 72°C-on követte.az SPTBN4 PCR primerjei tcaagggtgcaggcttctttc forward és GGTAGGTAGGAAGCTCGAAGTGGG reverse. A forward primert festék-jelölt vagy 6-FAM, hogy készítsen egy fluoreszcens jelölt PCR termék kimutatható ABI 3730 DNS sequencer (alkalmazott Biosystems). A töredékméreteket az ABI GeneMapper software 5 segítségével határoztuk meg.,
szövettani vizsgálat
két, 1 hétnél fiatalabb érintett malacot küldtek a királyi Állategészségügyi (Deventer) patológiai osztályába vizsgálatra. Makroszkóposan minden megfigyelés normál határokon belül volt. Az elülső rész vázizomzatát, a hátsó izomzatot és mindkét állat hátsó lábszárát a szokásos H&e festés és PTAH festés céljából mintavételezték. Az izomszövetet külön üvegekben tároltuk, formaldehid oldatban 4% – ban rögzítettük, puffereltük (=formalin oldat 10%, pufferolva)., Ezt követően a szövetet paraffinba ágyazták, majd a szokásos működési eljárás (SOP RAH) szerint 2 µm-re szeletelték. Ezt követően a diákat a hematoxilin és az eozin (H&E) esetében depaffinizálták és rutinszerűen megfestették egy automatikus színes gépben. Egyidejűleg további, 2 µm izomszövetből álló diákat, valamint az izomszövet pozitív kontrollcsúszdáját is elkészítették a “foszfotungstinsav hematoxilin”, rövidítve PTAH. Ez a festés előnyös a vázizom keresztcsíkjainak bemutatására.,
tenyésztési értékek és asszociációs analízis
ebben a vizsgálatban 63, a tenyésztési programban használt tulajdonságot vizsgáltunk. A Deregressed becsült tenyésztési értékeket (DEBV) válaszváltozóként használták minden vizsgált tulajdonság esetében. Az összes értékelt tulajdonság becsült tenyésztési értékét (EBV) a Garrick et al. (2009). Az egyes állatok EBV-jét egy kereskedelmi tenyésztési program (Topigs Norsvin) rutin genetikai értékeléséből nyerték állati modell segítségével., A deregresszió céljára állatonkénti megbízhatóságokat a tier and Meyer (2004) módszertanán alapuló genetikai értékelésből nyerték ki. A deregresszióhoz használt heritabilitásokat a rutin genetikai értékelésből is kivonták. Végül Garrick et al szerint a DEBV becsült megbízhatóságán alapuló súlyozási tényezőket is becsülték. (2009) 0,5 értéket alkalmazva a skalárra c. A DEBV minőségének biztosítása érdekében csak a nullánál nagyobb súlyozási tényezővel rendelkező állatok és a DEBV megbízhatósága nagyobb, mint 0.,Az egyesület elemzéseiben 20-at használtak. A DEBV megbízhatóságát Garrick et al. (2009).
asszociációs elemzéseket az ASREML (Gilmour et al., A 2009) alkalmazása a következő lineáris kevert állati modell:
amennyiben DEBVij a megfigyelt DEBV az állat j, w súlyozási tényező a maradék, μ a teljes DEBV a lakosság, Ri a hordozó állapot (gróf a káros allél) a 4 mutáció én, aj az additív genetikai hatás becsült segítségével törzskönyv-alapú átlagos kapcsolat mátrix, a fennmaradó hiba. Az ötnél nagyobb a −log10(p érték) asszociációkat jelentősnek nyilvánították.
eredmények
A 1.,5 Mb szegmens a 6. kromoszómán befolyásolja a laktáció túlélését sertésekben
31 638 állatot elemeztünk egyetlen fajtatiszta vaddisznóvonalból (szintetikus vonal nagy fehér háttérrel), genotipizálva a sertés 50K SNP chipen (Sscrofa11.1 build) (Warr et al., 2019). Az elemzés 1,5 Mb-os szegmenst mutatott ki a 6.kromoszómán (SSC6:48,75–50,25), amely a csökkent laktációs túléléshez társuló homozigozitás hiányát mutatta (1. és 2. táblázat). A haplotípus a vizsgált populációban 4,5% – os (9,0% – os vivőfrekvencia) mérsékelt allél gyakorisággal szegregálódik., A haplotípus gyakorisága az elmúlt évtizedben ingadozott, de csökkent az elmúlt 3 évben (S1 ábra). Megvizsgáltuk, hogy a frekvenciát heterozigóta előnyhatás vezérelte-e. Azonban többnyire negatív asszociációkat találtunk fontos szelekciós vonásokkal, kivéve a löszmélységet és a vemhesség hosszát (3. táblázat), ami arra utal, hogy a gyakoriság pusztán a genetikai sodródás eredménye.

1.táblázat SSC6 haplotípus jellemzők.,

2.táblázat Carrier-by-carrier almok a laktációs túlélés 24%-os csökkenését mutatják a carrier-by non-carrier almokhoz képest. A jelentős eredményeket félkövérrel jelöljük.

3.táblázat az SPTBN4 deléció heterozigóta hordozóival szignifikánsan összefüggő tulajdonságok.
az 52 hordozó-hordozó (CXC) almok nem mutatnak szignifikáns csökkenést a Született vagy élő állatok teljes számában., A laktációs túlélés azonban a CXC-almokban körülbelül 24%-kal csökken, mint a carrier-by-noncarrier (CxN) érleléseknél, ami azt jelzi, hogy a homozigóta malacok a laktációs időszakban halnak meg (2.táblázat). Ezután megvizsgáltuk a CXC almok mortalitásának idejét és okát. Ez azt mutatta, hogy a legtöbb malacot, amely a születés utáni első 24 órában halt meg. Ezeknek a malacoknak a többségét a gazdálkodók többnyire ” gyenge malacként írták le születéskor.,”
Teljes Genom Szekvencia Elemzés Feltárja a 16-bp Olvasási Törlés a SPTBN4, mint a Legvalószínűbb Kiváltó Változat
azonosítani az ok-okozati mutáció, megvizsgáltuk az egész genom szekvencia adatokat a 71 állatok a lakosság szerinti vizsgálat alapján, öt hordozó állatok. A kapcsolat egyensúlyhiány (LD) elemzése 267 SNP és indel variánst mutatott ki magas LD-ben (r2 > 0.8) az SSC6 haplotípusával (S1 táblázat), a többség tökéletes LD-ben (247 változat) volt., Csak öt változat befolyásolhatja a kódolási sorrendet (három missense, egy frameshift, egy splice-akceptor). A három missense variánst várhatóan a szitálás tolerálja (score > 0,18, S1 táblázat), míg a splice-akceptor variáns egy ismeretlen függvény 28 bp peptidjét kódoló gént érint, amely valószínűleg okozati. A haplotípusú teljes LD (r2 = 1) egyik változata azonban nagy hatással volt; az SPTBN4 gén exon 26-jában 16-bp frameshift deléció (6:g.48801280delgacggtgtacgccggt) (1A, B ábra)., A frameshift deléció (ENSSSCP0000031537:P.Arg1902fs) 30 új aminosavat és egy korai stop kodont vezet be, ami károsodott és csonka spectrin béta nem eritrocitikus 4 fehérjét (SPTBN4) eredményez. Mutánsok hiányzik a végső 662 aminosavak a vad típusú fehérje (ábra 1C), beleértve a pleckstrin homológia (PH) domain szükséges fehérje szállítás membránok (Wang et al., 2018). Az SPTBN4 fehérje a béta-spektrin fehérjék tagja, aktin, amely összeköti a sejtmembránt az aktin citoszkeletonnal., Az SPTBN4 mutációk megzavarják a myelinizált idegekben az ioncsatornák megfelelő lokalizációját szabályozó, motoros neuropathiákat (Parkinson et al., 2001; Wang et al., 2018).

1.ábra (a) sptbn4 génmodell. Az érintett 26. exon helyét piros színnel jelzik. B) A 16 bp-es törlés illusztrációja. Az ábrán vad típus és mutáns exon látható. C) A Mutáns (Mt) és a vad típusú (WT) SPTBN4 fehérje szekvencia összehangolása. A mutáció 30 új aminosavat és egy korai stop kodont idéz elő.,
öt CXC alom genotipizálása megerősíti az SPTBN4 törlését, mint valószínű bűnös
öt CXC almot genotipizáltunk a 16-bp törléshez, amelynek legalább két malaca volt (2-6 tartomány), amelyek a születés utáni első 48 órában haltak meg. Az öt alom 53 malacot termelt, ebből 19 homozigóta volt a 16 bp törléshez (4.táblázat). Mind a 19 homozigóta malac a születés után 48 órán belül (18 24 órán belül) halt meg. A fennmaradó 34 malacból (8 vad típus és 26 hordozó) csak 1 halt meg 48 órán belül, valószínűleg más (környezeti) tényezők miatt.,

4. táblázat a valószínű okozati 16-bp SPTBN4 frameshift törlés öt hordozónként. A genotípusosztályonkénti összeg félkövérrel van jelölve.
Malacok Homozigóta a SPTBN4 Törlés Szenved, Izomkárosodás, valamint Hátsó Végtag Bénulás
megfigyeltük egy közelmúltbeli CxC alom (fialás dátum: április 28. 2019) előállított hat egészséges, két érintett (minta: 9912, 9916) (2A Ábra), valamint három halva született malacok., Megerősítettük a homozigóta SPTBN4 törlési állapotát a két érintett malacra (S2 táblázat). Ezenkívül négy heterozigóta hordozót és két homozigóta vad típusú malacot figyeltünk meg az egészséges egyének között. Az egyik halva született malac (minta: 9921) szintén homozigóta volt a törléshez, míg a másik kettő heterozigóta volt. Az érintett malacok szenvednek extrém izomgyengeség (ábra 2B, C), bénulás a hátsó végtagok, remegés (S1 videó). Ezért a malacok nem tudtak járni vagy inni.,
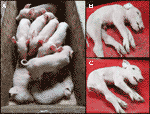
2.ábra a) két érintett malacot (élve), valamint hat egészséges szemetestársat. A malacok 2019.április 28-án egy CxC párzásból származnak. B) érintett hím malac 9912. C) érintett női malac 9916.
Érintett Malacok Hiánya Kereszt Barázdák a Háti és Hátsó Végtag Harántcsíkolt Izmok
Kórszövettani vizsgálat feltárta, szétszórt degeneráció az izomrostok mind a malacok, s focally nekrózis, valamint vasculitis a háti izmok a malacok (ID = 9912)., Sőt, phosphotungstic sav hematoxylin (PTAH) festés mutatja eltérő színezés a harántcsíkolt izomrostok, jelezve, csökken a határokon barázdák, különösen az izmok, a háti, majd lábait az érintett állatok (3B Ábra), míg az elülső lábak úgy tűnik, nem befolyásolja (3A Ábra). A keresztcsíkok csökkenését abnormális színezés és az izomrostok térfogatának általános csökkenése jelzi (3b ábra). A hátsó lábakban és a hátsó izmokban a kórszövettanilag megfigyelt változások izomdisztrófiára utalnak.,

3.ábra A) a vázizom keresztmetszete az elülső lábról. A fekete nyíl az izomrostok normál színezését (sötét) jelzi, jelezve a keresztcsíkok jelenlétét. PTAH Bar = 50 µm. B) a vázizom keresztmetszete a hátsó lábról. A fekete nyíl az izomrostok rendellenes színezését (rózsaszín) jelzi, jelezve a keresztcsíkok hiányát. A sárga nyíl normál színezést és keresztcsíkok jelenlétét jelzi. PTAH Bar = 50 µm.,
Vita
ebben a munkában egy új veleszületett hibát jelentünk, amely valószínűleg az SPTBN4 gén 16 bp frameshift deléciója miatt okozza a malac mortalitást. A malacok extrém izomgyengeségben (myopathiában) szenvednek, és a születést követő néhány órán belül elpusztulnak. A deléció várhatóan a spectrin béta, nem eritrocitikus 4 fehérje teljes funkcióvesztését eredményezi. Az SPTBN4 a spektrin gének családjának tagja, és a Ranvier csomópontjaiban az ioncsatornák klaszterezéséhez szükséges, ami befolyásolja az akciós potenciált (Devaux, 2010)., A mutációk megzavarják az ioncsatornák megfelelő lokalizációját és az axonális domének működését szabályozó citoszkeletális gépeket, elsősorban az axon kezdeti szegmenseiben (AIS) és a Ranvier csomópontjaiban (Wang et al., 2018). Pontosabban, az SPTBN4 érintett C-terminális tartománya döntő fontosságú a Kcnq2 csatorna kereskedelme és izgatottsága szempontjából a Ranvier csomópontjaiban (Devaux, 2010).
a későbbi nyomonkövetési kutatások olyan emberi és egéres eseteket azonosítottak, amelyek azt mutatták, hogy az ezt követő szindróma valószínűleg nem azonnal halálos, hanem súlyos myopathiát okoz., Közepes sűrűségű SNP genotípus adatok alapján, amelyek a tenyészpopulációban lévő összes állatra rendelkezésre állnak (N = 31 839), a hordozók azonosíthatók. A hordozók között volt egy koca, amely az azonosítás idején körülbelül félidős volt a terhesség alatt, egy vaddisznó, amely szintén hordozó volt. A tenyészgazdaság értesítették, hogy dokumentálja az alom születéskor. Az érintett malacok megfigyelt fenotípusa (myopathia, hátsó végtagbénulás, remegés) teljesen megegyezett azzal, amit az SPTBN4 gén homozigóta funkcióvesztéssel vagy összetett heterozigóta mutációkkal rendelkező humán betegeknél figyeltek meg (OMIM: 606214)., A humán betegek közül kettőnek funkcióvesztés-mutációja van a PH-tartományon belül (Wang et al., 2018), alátámasztva, hogy a sertések PH-tartományának elvesztése valószínűleg az SPTBN4 fehérje teljes funkcióvesztéséhez vezetne. Emberben hasonló mutációk súlyos veleszületett myopathiához vezetnek, amelyet az I. típusú izomrostok, neuropathia és süketség hiánya okoz (Knierim et al., 2017; Wang et al., 2018). Wang et al. (2018) motoros axonális neuropathiát is megfigyeltek több betegnél, akiket veleszületett hipotónia, mély gyengeség és mély ínreflexek elvesztése jellemez a korai gyermekkorban., Ezenkívül az idegbiopsziák csökkent nodalis Na+ csatornákat és nodalis kcnq2 k+ csatornákat tártak fel, feltárva az idegrendszer diszfunkcióját okozó molekuláris patológiát. Ezért arra a következtetésre jutunk, hogy ez a frameshift variáns a valószínű ok-okozati mutáció, amely a populációban a homozigóta genotípus megfigyelt fenotípusához és kimerüléséhez vezet. A jövőbeli tanulmányok arra összpontosíthatnak, hogy in vivo kiütést hajtsanak végre az SPTBN4 génben sertésben, hogy részletesebben tanulmányozzák a szindrómát és a kapcsolódó fenotípust.,
nem figyeltük meg az izomrostok degenerálódását az elülső lábakban, míg a hátsó és hátsó láb izomrostjai egyértelműen érintettek voltak. Ez a megfigyelés részben megmagyarázhatja a hátsó végtag bénulását, míg az elülső lábakat nem érinti. Az eltérés az első és a hátsó lábak izomrostok is leírták remegő egerek, amelyben SPTBN4 veszteség-off-funkció mutációk okoznak motoros neuropathia, hátsó végtag bénulás, remegés, és a központi süketség (Parkinson et al., 2001; Komada és Soriano, 2002). Parkinson et al., (2001) írja le az egerek ülőidegeinek csökkent idegvezetési sebességét, remegő allélokkal, amelyek a perifériás hátsó végtag neuropátiáját okozzák. Az sptbn4 kifejeződése egerekben az agyra, a gerincvelőre és az ülőidegekre korlátozódik, és nem figyelhető meg a vázizomban, tehát ez a betegség elsősorban neuronális hiba. Összességében továbbra sem világos, hogy melyik mechanizmus okozza a tünetek hiányát a mellső végtagokban. Ez a” természetes kiütés ” a sertésekben hasznos erőforrás lehet az emberi betegség tanulmányozására,mivel a sertések általában jobb modell az emberi betegség tanulmányozására, mint a rágcsáló Fajok., Ezenkívül az SPTBN4 funkció elvesztésének következménye részletesebben tanulmányozható.
a vizsgált fajta tényleges populációs mérete (Ne) becslések szerint körülbelül 100 (Hidalgo et al., 2016). Az állattenyésztésben az alacsony Ne növeli annak kockázatát,hogy a káros allélok véletlenszerűen emelkedjenek. Ezenkívül korábbi tanulmányok kimutatták, hogy a recesszív halálos allélokat a heterozigóták előnyös hatásai vezérelhetik (Derks et al., 2018; Matika et al., 2019). Matika et al.,, 2019 recesszív stop-gained mutációt talált az mstn génben, amely a heterozigóták izommélységének jelentős növekedésével jár. Tanulmányunkban azonban nem találunk bizonyítékot heterozigóta előnyökre. A jelenlegi genomikai technikák most már azonosítani káros allélek sodródó, hogy a magasabb frekvenciákat, valamint figyelemmel kíséri a megjelenése regény káros allélek pontosan, így hatékonyabb a karbantartás. Ezenkívül az ilyen típusú vizsgálatok eredménye nagymértékben javítja a “rejtett” genetikai hibák tudatosságát mind a tenyésztő, mind a mezőgazdasági termelő szintjén., Előzetes információk nélkül a ritka születési rendellenességeket gyakran “gyenge malacként” rögzítik.”A specifikus szindrómák további megkülönböztetése nélkül további fellépés nem lehetséges. A legtöbb esetben nem ismert, hogy van-e genetikai alap, vagy lehetnek más zavaró hatások. A korábbi genomikai információk alapján a szindróma más esetekhez képest azonosítható, és azonosítható hordozók, amelyek cselekvésre alkalmas információkhoz vezetnek.
a malacok elhullása nagy gazdasági és állatjóléti jelentőséggel bír., Ezért az SPTBN4 mutáció felfedezése azonnali végrehajtást eredményezett a tenyésztési programban, hogy minimalizálják a hordozó-hordozó matings gyakoriságát. Ez lehetővé teszi az érintett személyek születésének elkerülését, ezáltal javítva az állatjóllétet és csökkentve a gazdasági veszteségeket.
következtetés
ebben a tanulmányban egy új veleszületett hibát jelentünk, amelyet valószínűleg az SPTBN4 gén recesszív frameshift deléciója okozott sertésekben. Az eredményeket az SPTBN4-hez társuló szindrómás fenotípusokkal való szembetűnő hasonlóságok támasztják alá emberekben és egerekben., A tanulmány lehetővé teszi a káros allél monitorozását és tisztítását a lakosságtól. A fuvarozói keresztezések megelőzhetők, kizárva az érintett személyeket, ezáltal csökkentve a gazdasági veszteségeket, és javítva az állatjólétet. Végül, ezek a” természetes knockouts ” nyert a tenyésztési ipar nyújthat egy modell az emberi betegség, és növeli a megértést a gén működését az emlős klád, és egy potenciális modell az emberi betegség.,
adatelérési nyilatkozat
etikai nyilatkozat
etikai felülvizsgálat és jóváhagyás nem volt szükséges az állatkísérlethez, mivel az ebben a vizsgálatban használt adatokat a Topigs Norsvin tenyésztési programokból származó rutin adatgyűjtés részeként nyerték el, és nem kifejezetten e projekt céljára. Ezért az Etikai Bizottság jóváhagyása nem volt kötelező. A mintavétel és az adatgyűjtés szigorúan az állatvédelemről és állatjólétről szóló holland törvény (Gezondheids – en welzijnswet voor dieren) szerint történt., A tulajdonosoktól írásbeli tájékozott beleegyezést kaptak állataik részvételére ebben a tanulmányban.
szerzői hozzájárulások
MG, H-JM és MD megfogalmazták és megtervezték a tanulmányt. A BH feladata volt a Topigs Norsvinnel és a gazdákkal való általános szervezés és kommunikáció. Az MD és az ML elvégezte az adatelemzést. A BD és a KL laboratóriumi munkát végzett. SG-V elvégezte a kóros elemzést. MD írta a kéziratot. H-JM, MG, BH, SG-V, BD, KL, és ML hasznos megjegyzéseket és javaslatokat tett, és segített a kézirat kidolgozásában. A fenotípusos adatokat az ML elemezte., Minden szerző elolvasta és jóváhagyta a végleges kéziratot.
finanszírozás
ezt a kutatást az STW-Breed4Food partnerség finanszírozta, a projekt száma 14283: a szekvenciától a fenotípusig: a funkcionalitás előrejelzésével káros variációk észlelése. A tanulmányt anyagilag támogatta az NWO-TTW és a Breed4Food partners, A Cobb Europe, a CRV, a Hendrix Genetics és a Topigs Norsvin. Ezenkívül ezt a tanulmányt a KÉPPROJEKT támogatta (Horizon 2020, no.677353). A finanszírozóknak nem volt szerepük a tanulmánytervezésben, az adatgyűjtésben és az elemzésben, a kézirat közzétételében vagy elkészítésében., A HPC klaszter használatát a CATAgroFood (megosztott kutatási létesítmények Wageningen UR) tette lehetővé.
Az ebben a tanulmányban használt adatokat a Topigs Norsvin tenyésztési programokból származó rutin adatgyűjtés részeként szerezték be, nem kifejezetten a projekt céljára. Ezért az Etikai Bizottság jóváhagyása nem volt kötelező. A mintavétel és az adatgyűjtés szigorúan az állatvédelemről és állatjólétről szóló holland törvény (Gezondheids – en welzijnswet voor dieren) szerint történt.,
összeférhetetlenség
ML és a BH a Topigs Norsvin Research Center, az egyik finanszírozóhoz szorosan kapcsolódó Kutatóintézet (Topigs Norsvin) alkalmazottai.
az összes többi szerző kijelenti, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
a másik Breed4Food partner, a Cobb Europe, a CRV, a Hendrix Genetics, kijelenti,hogy nincs versenytársa a tanulmányért.,
A szerzők köszönetet mondanak Frank Van Haarennek és Toon Jansssennek a gazdasággal való kommunikáció megszervezéséért. Köszönjük Manon Houbennek, hogy hozzájárult a kóros vizsgálatokhoz. Köszönjük Mout Villernek, hogy a szülés után videót és képeket készített az érintett és egészséges malacokról. Köszönjük Jürgen Harliziusnak, hogy gondoskodott a malacokról az átadás után. Köszönjük Gerda van Eldik-nek a mintagyűjtést. Köszönjük Egbert Knolnak és Egiel Hanenbergnek a Topigs-Norsvin általános támogatását és útmutatását.,
Kiegészítő anyag
Video S1 / videó, amely mindkét érintett személyt mutatja a születés után.
S1 táblázat / genomikus variáció nagy LD-ben az SSC6 haplotípussal.
táblázat S2 / a CXC alom genotipizálása két érintett személlyel együtt (ellés dátuma: 2019. április 28.). A táblázat homozigóta del / del állapotot mutat a két érintett malacra 9912,9916.
táblázat S3 / leképezés és lefedettség statisztikák WGS minták.
ábra S1 / SPTBN4 deléciós vivőfrekvencia 2007-2019 között.