Introduction
Posterior reverzibilis encephalopathia syndrome (Pres), first descripted by Hinchey et al. 1996-ban jelent neurológiai rendellenesség, változatos klinikai bemutatása tipikus képalkotó vizsgálat eredményeit parieto-okcipitális uralkodó minta vasogenic ödéma (1, 2). Számos dokumentált oka van a PRES-nek, az eseteket először az emelkedett artériás nyomás beállításában írják le., Példák a klinikai forgatókönyvekre, amelyekben a PRES látható lehet: hipertóniás vészhelyzet, (pre)eclampsia, vesebetegség, autoimmun betegségek és citotoxikus gyógyszerek, többek között (3, 4) (1.táblázat). A PRES bármely korcsoportban előfordulhat, és nőbetegeknél magasabb a előfordulási arány (7, 8). Bár a jelenlegi szakirodalom viszonylag ritka, mint a felnőtt populációk, különös figyelmet kell fordítani a PRES a gyermekgyógyászati beteg., A gyermekgyógyászati betegek klinikai megjelenése hasonló, mint a felnőtt populációé, magas vérnyomással, görcsrohammal és megváltozott mentális állapotukkal a betegség gyakori megnyilvánulásai (9). Annak ellenére, hogy a legtöbb esetben a gyermekgyógyászati PRES jelentett onkológiai betegek, különösen a poszt-őssejt transzplantált betegek (10, 11), Egy tanulmány szerint Gupta et al. (12) megállapította, hogy a vesebetegség talán a PRES leggyakoribb oka a gyermekgyógyászati betegben. Tanulmányukban a gyermekgyógyászati betegek inkább atipikus képalkotó eredményeket mutattak (62, 5%), beleértve a frontális lebeny bevonását (56%).,
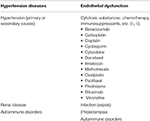
1.táblázat. A PRES-hez kapcsolódó fő betegségállapotok.
Klinikai tünetei vagy akut, hogy szubakut, valamint a tartomány a fejfájás, látászavarok, hogy megváltozott szintű tudatosság, valamint roham súlyosabb esetekben (1). A kezelés általában a kiváltó ok megcélzására irányul, általában reverzibilis tünetekkel és képalkotó vizsgálatokkal a legtöbb esetben (8)., Bár az eredmények általában kedvezőek a megfelelő kezelés, rossz klinikai eredmények összefüggésbe hozták a már meglévő diabetes mellitus, és bevonása a corpus callosum; azonban más megbízható képalkotó biomarkerek prognosztikai jelenleg hiányzik (13). A Neuroradiológiai képalkotás alapvető szerepet játszik a PRES diagnosztizálásában a mágneses rezonancia képalkotás (MRI) (2) során legjobban értékelt tipikus képalkotó jellemzőkkel.
patofiziológia
a PRES mögött álló pontos patofiziológiai mechanizmus(ok) még nem teljesen tisztázott, és továbbra is ellentmondásos (3)., Jelenleg két fő javasolt mechanizmus létezik a PRES patofiziológiájára (1.ábra). Az első elmélet a megnövekedett artériás nyomást javasolja elsődleges tényezőként (8). A vérnyomás gyors emelkedése végül legyőzi az agyi érrendszer autoregulációs képességeit, ami vaszkuláris szivárgást és vazogén ödémát okoz (14). A vér-agy gát (BBB) diszfunkciója van a szoros csomóponton áthaladó fehérjékkel (15)., A hátsó keringés (vertebralis artériák, basilaris artériák és posterior agyi artériák) által biztosított területek kivételes kockázatnak vannak kitéve az elülső keringéshez képest (belső carotis artériák, középső agyi artériák és elülső agyi artériák) a basilaris artéria érrendszerének szimpatikus tónusának hiánya miatt (8)., Egyes posztulátumok által javasolt kapcsolódó elmélet szerint az extrém magas vérnyomás vasospazmust és helyi ischaemiát eredményez, amely BBB lebomlást és vazogén ödémát okoz, amint azt az immunszuppresszív szerekkel kezelt betegeknél megfigyelték ciklosporin A és FK-506 (16). A zavar a BBB okozza a tipikus megállapítások vasogén ödéma vs citotoxikus ödéma (ami látható a Beállítás akut infarktus, ami fokozott intracelluláris víztartalom elvesztése miatt a szokásos ozmotikus gradiens a Beállítás sejthalál (17).,
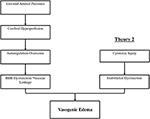
1.ábra. A PRES patofiziológiájának két fő elmélete. Az 1. elmélet a hipertóniás és agyi hiperperfúziós elmélet, a 2. elmélet pedig az endothel diszfunkcióelmélet.
a második fő elmélet arra a tényre irányul, hogy a PRES-ben szenvedő betegek legfeljebb 30% – ánál nem mutatnak olyan magas artériás nyomást, amely meghaladja az agyi érrendszer autoregulációs kontrollját (18, 19)., Ez az elmélet azt javasolja, hogy az endothel diszfunkció az elsődleges bűnös, amelyet különböző endogén vagy exogén toxinok okozhatnak (20). Ez az elmélet megmagyarázhatja az immunszuppresszív gyógyszereket és/vagy kemoterápiát kapó betegeknél, valamint a szepszisben szenvedő betegeknél (21, 22) észlelt PRES eredményeit. Ebben a modellben a keringő toxinok érrendszeri sérülést okoznak vazogén ödéma kialakulásával. Az endoteliális károsodás érösszehúzó és immunogén szerek további felszabadulását okozza, ami érgörcsöt és/vagy fokozott vaszkuláris permeabilitást okozhat., Végső soron, endothel diszfunkció, amely lehetővé teszi a vaszkuláris szivárgás, vasogén ödéma a hajtóerő mögött PRES, függetlenül attól, hogy az elsődleges agyi érrendszer rendellenesség (abban az esetben, artériás magas vérnyomás), vagy másodlagos keringő toxinok. E két elmélet összefoglalását, valamint a korábban jelentett kemoterápiák és más immunszuppresszánsok listáját a 2.ábra mutatja.
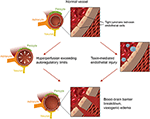
2.ábra. A PRES alapjául szolgáló patofiziológia két fő elméletének illusztrációja., Köszönetnyilvánítás: jóvoltából Caroline O ” Driscoll, MA (ő illusztrálta ezt a saját, valamint egy alkalmazottja egyetemünk).
a klinikai tünetek az agy érintett régiójától(régióitól) függenek; így a prezentáció széles lehet. Például az occipitális lebenyek elsődleges bevonása látási zavarokat/hallucinációkat okozhat. A fokális elváltozások helyének megfelelő fokális neurológiai deficit a PRES-ben szenvedő betegek ~5-15% – ánál fordul elő (23)., Ritkán a gerincvelő érintettsége klinikai tüneteket és myelopathia vagy bénulás tüneteit okozhatja (24).
Imaging
ahogy a neve is sugallja, a PRES jellemzően a képalkotó vizsgálatokban nyilvánul meg, mint a hátsó-domináns fehér Anyag vazogén ödémája. A parietális és az occipitalis lebenyek szinte egyetemesen érintettek, és az eredmények jellemzően szimmetrikusak és bilaterálisak (1). Gyakran megfigyelhető az elülső lebenyek bevonása, különösen a felső frontális sulci mellett., A vazogén ödéma, bár magában foglalhatja az agyi szürkeállományt, gyakran könnyebben értékelik a szubkortikális fehérállományban. A CT-vizsgálat gyakran az akut neurológiai tünetek kezdeti képalkotó vizsgálata, amely az érintett régiókban fehér Anyag hypoattenuációját mutathatja (25) (3. ábra: PRES CT). Összességében az eredményeket legjobban az MRI mutatja, amely fokozott érzékenységet és jobb anatómiai jellemzést mutat a CT-hez képest (26). Ezenkívül az MRI segíthet megkülönböztetni más kóros állapotokat, amelyek klinikailag hasonlóan manifesztálódhatnak a PRES-hez., A T2-súlyozott és T2 FLAIR (folyadék-attenuált inverziós helyreállítás) szekvenciák különösen a leghasznosabbak a vasogén ödéma kimutatására az MRI-n (4.ábra: PRES Úr; 5. ábra: a PRES koronális MR).
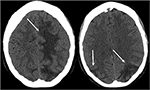
3.ábra. Szisztémás lupus erythematosusban és rohamosan progresszív glomerulonephritisben szenvedő beteg. A fej nem kontrasztos CT képei vasogén ödémát mutatnak a kétoldalú parietális és occipitális lebenyekben, balra nagyobb, mint jobbra, valamint a bal elülső lebenybe történő kiterjesztést.,
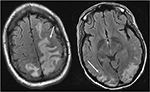
4.ábra. Szisztémás lupus erythematosusban és rohamosan progresszív glomerulonephritisben szenvedő beteg. A fej T2-FLAIR képei vasogén ödémát mutatnak a kétoldali parietális és occipitális lebenyekben, balra nagyobb, mint jobbra, valamint a bal elülső lebenybe történő kiterjesztést. Ne feledje, hogy az ödéma vazogén mintájával a kéregben a jel rendellenessége megmarad.
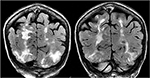
5.ábra., Olyan beteg, akinek a kórelőzményében primer myelofibrosis és csontvelő-transzplantáció szerepel Takrolimuszon, és első alkalommal görcsrohamot kapott. A koronális T2-FLAIR szekvenciák kiterjedt jel rendellenességet mutatnak a bilaterális occipital és parietális lebenyekben, ahogy az a PRES esetében jellemző.
a PRES differenciáldiagnózisa széles, és hasonló összefolyó T2 fehér Anyag hiperintenzitással rendelkező entitásokat tartalmaz., Példák: ischaemia / infarktus(különösen a hátsó keringés), demielinizáló betegségek, fertőző etiológiák (meningitis, encephalitis), progresszív multifokális leukoencephalopathia (PML), vasculitis és különböző anyagcserezavarok (27). Úgy gondolják, hogy a reverzibilis agyi érösszehúzódási szindrómának (rcvs) nevezett klinikailag kapcsolódó entitást az agyi érrendszeri tónus megváltozása okozza, ami érösszehúzódást eredményez., RCVS nyilvánul visszatérő thunderclap fejfájás, roham, stroke, és nem aneurysma subarachnoidalis vérzés (28), amely lehet összetéveszteni PRES klinikai alapon. Ez az entitás általában a partum utáni időszakban vagy az adrenerg vagy szerotonerg gyógyszereknek való kitettség után fordul elő. Az RCV – ket általában angiográfiás vizsgálatokkal lehet diagnosztizálni, amelyek az agyi artériákat érintő szűkület multifokális területeit mutatják (29). Ez a diagnózis összetéveszthető azzal a ténnyel, hogy az RCV-k és a PRES gyakran egyidejűleg fordulnak elő, amit a neuroradiológusnak tudnia kell a téves diagnózis elkerülése érdekében (30).,
a PRES jellemzően megkülönböztethető az akut ischaemiától, mivel ez utóbbi mindig citotoxikus ödémát és diffúziós korlátozást mutat. Az akut ischaemia korlátozott diffúziója könnyen kimutatható a diffúzióval súlyozott képalkotáson (DWI) és a látszólagos diffúziós együtthatón (ADC) a DWI hiperintenzív jeleként, az ADC megfelelő csökkent jelével (az intracelluláris vízmolekulák viszonylag csökkent mozgása miatt)., A vasogén ödéma a PRES beállításában viszont hiperintenzív jelet mutathat a DWI-n, amelyet nem kísér az ADC (31) megfelelő csökkent jel. Ezenkívül az akut ischaemia általában egyoldalú, egy egyedülálló érrendszeri területen belül. Míg értékelése a diffúziós korlátozás, hogy különbséget PRES ischaemiás a rendellenesség általában megbízható, vannak ritka esetekben a PRES, hogy lehet, kapcsolódó területek a diffúziós korlátozás egymásra után területeken a több, klasszikusan láttam elszigetelt vasogenic ödéma.,
“Advanced” képalkotó technikák PRES nemrég le, mint egy kiegészítő eszköz nehéz vagy kétértelmű esetekben. Ezek a fejlett képalkotó technikák a következők: CT/MR perfúzió, Mr spektroszkópia (MRS), érzékenységgel súlyozott képalkotás (SWI) és Nukleáris Medicina technikák, beleértve az egy foton emissziós tomográfiát (SPECT) és a pozitron emissziós tomográfiát (PET) különböző radiotracerekkel. Bár a teljes vita túlmutat a felülvizsgálat hatókörén, számos képalkotó eredmény látható ezeken a fejlett technikákon, amelyek segítenek a PRES diagnózisának javasolásában., Hyperperfusion lehet látni a CT/MR perfúziós vizsgálatok azt mutatták, a megnövekedett véráramlás, s vér mennyisége csökken, ideje, hogy perfúziós de a tranzit idő (32), bár az esetek hypoperfusion számoltak be (33). MRS esetén általában csökken az N-acetil-aszpartát (NAA)/kreatin (Cr) és a Naa/Kolin (Chol) arány, ami a normál szinapszisok és a neuroaxonális funkció megzavarására utal (34). Az SWI segíthet azonosítani a vérzés jelenlétét a PRES-ben, nagyobb érzékenységgel, mint a GRE képalkotás (35)., A SPECT / PET képalkotás jellemzően HIPERPERFÚZIÓT vagy hypoperfúziót mutat (hasonlóan a CT/MR perfúziós vizsgálatokhoz), alacsony metabolizmussal az FDG-PET által (36).
továbbá, Pres lehet különböztetni más körülmények között, mint például az autoimmun encephalitis a Beállítás akut disszeminált encephalomyelitis (ADEM) A korábbi diffúz kétoldalú, de aszimmetrikus vasogén ödéma (37)., A PML hasonló megjelenésű lehet a PRES-hez képest, parieto-occipital túlsúlyban, de megkülönböztethető az egyoldalú vagy aszimmetrikus bevonása, valamint a szubkortikális fehér Anyag előszeretete (38).
atipikus képalkotó funkciók
a PRES atipikus jellemzői közé tartoznak a kontrasztnövelés, a vérzés vagy a diffúziós korlátozás területei (39)., Bár akarta, nyakszirti lebeny általában benne, atipikus területek bevonása lehet látni, többek között: az agytörzsi, kisagy, corpus callosum, illetve más agyi területeken, több közös területeken, beleértve a frontális lebeny (láttam, hogy a 68%), valamint a gyengébb temporális lebeny (akár 40%) (23, 40) (6. Ábra: a Kisagy; 7. Ábra: az Agytörzsi).
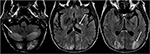
6.ábra. Májtranszplantált beteg 6 héttel korábban. A beteg májtranszplantáció után takrolimuszt kapott., Az agy T2-FLAIR képei jel rendellenességet mutatnak az occipitális lebenyekben. A bilaterális cerebelláris féltekén és a thalamiban is kiterjedt jel rendellenesség figyelhető meg. Ezek az eredmények a takrolimusz leállítása után gyorsan megszűntek.
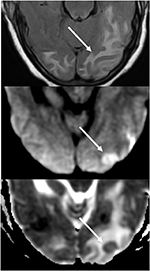
7.ábra. Kontrollálatlan magas vérnyomásban szenvedő beteg, aki a mentális állapot megváltozásával jár. A T2-FLAIR (felső) kép az occipitális lebenyek ödémáját mutatja., DWI (középső) és ADC térkép (alsó) a képek egy korlátozott diffúziós kis nyilat mutatnak, a DWI hiperintenzív jelével, valamint az ADC térkép megfelelő hipointenzitásával.
ezenkívül a PRES korai megállapítása, amely megelőzheti a tipikus parieto-occipital ödémát, enyhe sulcal FLAIR hiperintenzitást és leptomeningeális fokozást jelent a kontraszt utáni T1 súlyozott képeken, Nakagawa et al. (41). Benziada-Boudour et al., (42) a citotoxikus ödéma egyidejű kialakulását írta le, ami korlátozott diffúziót eredményez (8.ábra: diffúziós korlátozás). A PRES – szel kapcsolatos megállapítások általában reverzibilisek, a klinikai és képalkotó eredmények normalizálódásával, amint az uszító problémát kezelik. Bizonyos esetekben azonban a korlátozott diffúziós területek végül az agyi parenchyma állandó sérülését eredményezhetik (9.ábra: lamináris nekrózis)., A vérzés ritkábban láttam PRES, előforduló 5-30% – ában, de kell ismerni, hogy nem hiba, ez a megállapítás még egy kóros szervezet a megfelelő klinikai környezetben, PRES (39). Képalkotó eredmények vérzés lehetnek: fokális vérömleny, petechiális gyral vérzés,és / vagy subarachnoidealis vérzés (43) (10. ábra: vérzés).
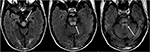
8.ábra. Olyan beteg, akinek kórtörténetében májtranszplantáció szerepel két héttel korábban takrolimusszal., T2-FLAIR képek mutatják jel rendellenesség belül a középagy, pons, valamint superior kisagyi kocsánytól.
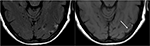
9.ábra. T2-FLAIR (bal) kép kontrollálatlan magas vérnyomásban szenvedő és PRES-t jelző előzetes képalkotó (Lásd 6.ábra) betegen, most kontrollált és 6 héttel később, a korábban látott ödéma felbontását mutatja. A bal oldali temporális lebenyben a sérülés miatti gliosis kis területei láthatók. Az axiális nem kontrasztos T1 a PRES-szel kapcsolatos korábbi sérüléshez kapcsolódó görbületi kortikális lamináris nekrózist mutat., Míg a PRES általában teljesen reverzibilis, bizonyos helyzetekben tartós sérülést okozhat.
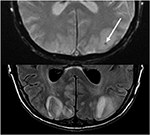
10.ábra. Takrolimusz-kezelés előtt májtranszplantáción átesett beteg. A T2 gradiens emlékeztetett echo (top) a vérzés fókuszpontját mutatja a bal nyakszirti lebeny vazogén ödémáján belül. A T2-FLAIR bemutatja a PRES-hez kapcsolódó jellemzőbb megállapítást, amely a bilaterális occipitális lebenyekben jel rendellenességgel rendelkezik.,
kezelés
a PRES kezelése általában a PRES-t okozó elsődleges etiológia szabályozására irányul (44). Például emelkedett artériás nyomás esetén a kezelés célja az emelkedett vérnyomás korrigálása ellenőrzött környezetben, hasonlóan a hipertóniás sürgősség / vészhelyzet megközelítéséhez (45). Jellemzően a vérnyomás nem gyors csökkenése arra törekszik, hogy elkerülje az iszkémiás agyi betegség kialakulásának kockázatát a drasztikus vérnyomáscsökkentés következtében (46)., Időnként antikonvulzív gyógyszereket alkalmaznak kiegészítő terápiaként, bár az optimális szer(ek), Az időzítés és a kezelés időtartama továbbra is ellentmondásos (4) (11.ábra: előtt és után).
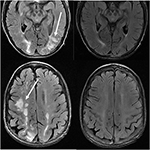
11.ábra. Olyan beteg, akinek a kórelőzményében primer myelofibrosis és csontvelő transzplantáció szerepel Takrolimuszon. Axiális T2-FLAIR képek bizonyítják a területek jel rendellenesség a parietális és occipital lebeny, és a jobb frontális lebeny (bal kép)., A Tacrolimust leállították, és a követési képeket (jobb képeket) az első képek után 6 héttel kapták meg.
(pre)eclampsia esetén a kezelés célja a magzat időben történő szállítása, valamint a vérnyomáskezelés és a magnézium-szulfát a rohamok megelőzésére (47). Kemoterápiás vagy más immunszuppresszív szerek által kiváltott PRES-ek beállításakor a gyógyszer elvékonyodása vagy abszolút abbahagyása mind klinikai, mind radiológiai javulást mutatott (48) (12.ábra: Eclampsia)., A Hypomagnesemia gyakori megállapítás a PRES-ben, valamint egy lehetséges etiológiai tényező. Ezért a szerzők azt sugallták, hogy a magnézium-kiegészítés hasznos kiegészítő lehet a PRES kezelésében (49).
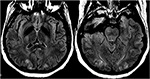
12.ábra. Beteg eclampsia és bemutató roham. Az axiális T2-FLAIR képek szimmetrikus jel rendellenességet mutatnak a bilaterális occipitális lebenyekben.,
következtetés
a PRES egyedülálló entitás, jellegzetes klinikai és Neuroradiológiai eredményekkel, a számtalan jól dokumentált ok mellett. Bár a PRES mögött álló pontos patofiziológiai mechanizmus(ok) még nem tisztázott (sőt, az egymással összefüggő folyamatok kombinációjának tudható be), az általánosan elfogadott mechanizmus a vér-agy gát diszfunkciója, ami vazogén ödémát eredményez, hátsó keringés túlsúlyával., A képalkotó funkciókat leginkább a folyadékérzékeny MR-szekvenciákon lehet értékelni, amelyek a parieto-occipital domináns fehérállomány T2 hiperintenzitását mutatják, bár számos atipikus képalkotó funkció látható, és szem előtt kell tartani a kihívást jelentő esetek értékelésekor. Különböző fejlett képalkotó eszközök állnak rendelkezésre, amelyek segítenek nehéz vagy kétértelmű esetekben. A kezelés célja a kiváltó ok kezelése, különös tekintettel a vérnyomás-monitorozásra és a rohamok esetleges megelőzésére.,
szerzői hozzájárulások
összeférhetetlenség
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
1. Bartynski WS. Posterior reverzibilis encephalopathia szindróma, 1. rész: alapvető képalkotás és klinikai jellemzők. Am J Neuroradiol. (2008) 29:1036–42. doi: 10.3174 / ajnr.,A0928
CrossRef Full Text | Google Scholar
3. Bartynski WS. Posterior reversible encephalopathy syndrome, Part 2: controversies surrounding pathophysiology of vasogenic edema. Am J Neuroradiol. (2008) 29:1043–9. doi: 10.3174/ajnr.A0929
CrossRef Full Text | Google Scholar
5. Singer S, Grommes C, Reiner AS, Rosenblum MK, DeAngelis LM. Posterior reversible encephalopathy syndrome in patients with cancer., Oncologist. (2015) 20:806–11. doi: 10.1634/theoncologist.2014-0149
PubMed Abstract | CrossRef Full Text | Google Scholar
6. How J, Blattner M, Fowler S, Wang-Gillam A, Schindler SE. Chemotherapy-associated posterior reversible encephalopathy syndrome: a case report and review of the literature. Neurologist. (2016) 21:112–7. doi: 10.1097/NRL.,0000000000000105
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Habetz K, Ramakrishnaiah R, Raina SK, Fitzgerald RT, Hinduja A. Posterior reversible encephalopathy syndrome: a comparative study of pediatric versus adult patients. Pediatr Neurol. (2016) 65:45–51. doi: 10.1016/j.pediatrneurol.2016.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Fugate JE, Rabinstein AA., Posterior reversible encephalopathy syndrome: clinical and radiological manifestations, pathophysiology, and outstanding questions. Lancet Neurol. (2015) 14:914–25. doi: 10.1016/S1474-4422(15)00111-8
CrossRef Full Text | Google Scholar
9. Zama, D, Gasperini P, Berger M, Petris M, De Pasquale MD, et al. A survey on hematology-oncology pediatric AIEOP centres: the challenge of posterior reversible encephalopathy syndrome. Eur J Haematol. (2018) 100:75–82. doi: 10.1111/ejh.,12984
CrossRef Full Text | Google Scholar
12. Gupta V, Bhatia V, Khandelwal N, Singh P, Singhi P. Imaging findings in pediatric posterior reversible encephalopathy syndrome (PRES): 5 years of experience from a tertiary care center in India. J Child Neurol. (2016) 31:1166–73. doi: 10.1177/0883073816643409
PubMed Abstract | CrossRef Full Text | Google Scholar
13., Hinduja A, Habetz K, Raina S, Ramakrishnaiah R, Fitzgerald RT. előrejelzői rossz eredmény betegeknél posterior reverzibilis encephalopathia szindróma. Int J Neurosci. (2017) 127:134–44. doi: 10.3109/00207454.2016.1152966
PubMed Abstract | CrossRef teljes szöveg | Google Scholar
15. MacKenzie ET, Strandgaard S, Graham DI, Jones JV, Harper AM, Farrar JK. Az akutan indukált magas vérnyomás hatása macskáknál a pialis arterioláris kaliberre, a helyi agyi véráramra és a véragy gátjára. Circ Res., (1976) 39:33–41. doi: 10.1161/01.RES.39.1.33
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bartynski WS, Zeigler Z, Spearman MP, Lin L, Shadduck RK, Lister J. Etiology of cortical and white matter lesions in Cyclosporin-A and FK-506 neurotoxicity. Am J Neuroradiol. (2001) 22:1901–14.
PubMed Abstract | Google Scholar
21. Bartynski WS, Boardman JF, Zeigler ZR, Shadduck RK, Lister J., Posterior reversible encephalopathy syndrome in infection, sepsis, and shock. Am J Neuroradiol. (2006) 27:2179–90.
PubMed Abstract | Google Scholar
22. Mayama M, Uno K, Tano S, Yoshihara M, Ukai M, Kishigami Y, et al. Incidence of posterior reversible encephalopathy syndrome in eclamptic and patients with preeclampsia with neurologic symptoms. Am J Obstet Gynecol. (2016) 215:239.e1–e5. doi: 10.1016/j.ajog.2016.02.,039
PubMed Abstract | CrossRef Full Text | Google Scholar
23. McKinney AM, Short J, Truwit CL, McKinney ZJ, Kozak OS, SantaCruz KS, et al. Posterior reversible encephalopathy syndrome: incidence of atypical regions of involvement and imaging findings. Am J Roentgenol. (2007) 189:904–12. doi: 10.2214/AJR.07.2024
PubMed Abstract | CrossRef Full Text | Google Scholar
24., de Havenon A, Joos Z, Longenecker L, Shah L, Ansari S, Digre K. Posterior reversible encephalopathy syndrome with spinal cord involvement. Neurology. (2014) 83:2002–6. doi: 10.1212/WNL.0000000000001026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Dandoy CE, Linscott LL, Davies SM, Leach JL, Myers KC, El-Bietar J, et al., Clinical utility of computed tomography and magnetic resonance imaging for diagnosis of posterior reversible encephalopathy syndrome after stem cell transplantation in children and adolescents. Biol Blood Marrow Transplant. (2015) 21:2028–32. doi: 10.1016/j.bbmt.2015.07.023
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Noda K, Fukae J, Fujishima K, Mori K, Urabe T, Hattori N, et al., Reversible cerebral vasoconstriction syndrome presenting as subarachnoid hemorrhage, reversible posterior leukoencephalopathy, and cerebral infarction. Intern Med. (2011) 50:1227–33. doi: 10.2169/internalmedicine.50.4812
CrossRef Full Text | Google Scholar
31. Doelken M, Lanz S, Rennert J, Alibek S, Richter G, Doerfler A, et al. Differentiation of cytotoxic and vasogenic edema in a patient with reversible posterior leukoencephalopathy syndrome using diffusion-weighted MRI. Diagn Interv Radiol., (2007) 13:125–8.
Google Scholar
32. Wartenberg KE, Parra A. CT and CT-perfusion findings of reversible leukoencephalopathy during triple-H therapy for symptomatic subarachnoid hemorrhage-related vasospasm. J Neuroimaging. (2006) 16:170–5. doi: 10.1111/j.1552-6569.2006.00031.x
CrossRef Full Text | Google Scholar
33. Vanacker P, Matias G, Hagmann P, Michel P., Cerebral hypoperfusion in posterior reversible encephalopathy syndrome is different from transient ischemic attack on CT perfusion. J Neuroimaging. (2015) 25:643–6. doi: 10.1111/jon.12158
CrossRef Full Text | Google Scholar
34. Lee SY, Kim SH, Lee SH, Baek HJ, Shon HS, Kim SS. Serial MR spectroscopy in relapsing reversible posterior leukoencephalopathy syndrome. Neurologist. (2009) 15:338–41. doi: 10.1097/NRL.,0b013e3181914af6
PubMed Abstract | CrossRef Full Text | Google Scholar
35. McKinney AM, Sarikaya B, Gustafson C, Truwit CL. Detection of microhemorrhage in posterior reversible encephalopathy syndrome using susceptibility-weighted imaging. Am J Neuroradiol. (2012) 33:896–903. doi: 10.3174/ajnr.A2886
PubMed Abstract | CrossRef Full Text | Google Scholar
38., Berger JR, Aksamit AJ, Clifford DB, Davis L, Koralnik IJ, Sejvar JJ, et al. PML diagnosztikai kritériumok: konszenzus nyilatkozat az aan neuroinfectious disease szakaszból. Neurológia. (2013) 80:1430-8. doi: 10.1212 / WNL.0b013e31828c2fa1
PubMed Abstract / CrossRef teljes szöveg | Google Scholar
39. Aracki-Trenkić és, Sztojanov D, Trenkić M, Radovanovic Z, Ignjatovic J, Ristic S, et al., Atypical presentation of posterior reversible encephalopathy syndrome: clinical and radiological characteristics in eclamptic patients. Bosn J Basic Med Sci. (2016) 16:180–6. doi: 10.17305/bjbms.2016.1201
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Bartynski WS, Boardman JF. Distinct imaging patterns and lesion distribution in posterior reversible encephalopathy syndrome. Am J Neuroradiol. (2007) 28:1320–7. doi: 10.3174/ajnr.,A0549
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Brickman AM, Reitz C, Luchsinger JA, Manly JJ, Schupf N, Muraskin J, et al. Long-term blood pressure fluctuation and cerebrovascular disease in an elderly cohort. Arch Neurol. (2010) 67:564–9. doi: 10.1001/archneurol.2010.70
PubMed Abstract | CrossRef Full Text | Google Scholar
47., Cozzolino M, Bianchi C, Mariani G, Marchi L, Fambrini M, Mecacci F. Therapy and differential diagnosis of posterior reversible encephalopathy syndrome (PRES) during pregnancy and postpartum. Arch Gynecol Obstet. (2015) 292:1217–23. doi: 10.1007/s00404-015-3800-4
PubMed Abstract | CrossRef Full Text | Google Scholar
48. Masetti R, Cordelli DM, Zama D, Vendemini F, Biagi C, Franzoni E, et al. PRES in children undergoing hematopoietic stem cell or solid organ transplantation. Pediatrics., (2015) 135:890–901. doi: 10.1542/peds.2014-2325
CrossRef Full Text | Google Scholar