Bevezető
a Koaguláz-negatív staphylococcusok (CoNS), tagjai a staphylococcus baktériumok csoport jellemzi, mint a Gram-pozitív cocci, úgy bemutatni, mint egyetlen sejtek vagy szabálytalan hajlam, s mozdulatlan, nem spore alkotó, kataláz pozitív, többnyire fakultatív anaeroboktól, de hiányzik az az enzim, koaguláz.,1 hátrányok része a humán mikrobiota, tekinthető opportunista kórokozók, ami fertőzések többnyire koraszülöttek, valamint immunhiányos és protézis betegek.2
az antimikrobiális rezisztencia növekedése az elmúlt években nagy hatással volt a hátrányok által okozott kórházi fertőzésekre. Az Oxacillin egy félszintetikus penicillin, amelyet a meticillin rezisztencia kimutatására és a staphylococcus fertőzések kezelésére szolgáló érzékenységi tesztben alkalmaznak. A CoNS klinikai izolátumokban azonban az oxacillin-rezisztencia 66-95% – át figyelték meg.,2 az Oxacillin rezisztenciát gyakran a mecA gén közvetíti, amely egy kiegészítő penicillin-kötő fehérjét (PBP2a) kódol, alacsony affinitással a félszintetikus penicillinekhez.3 A mecA gén található, egy mobil genetikai elem ismert, mint a Staphylococcus Kazetta Kromoszóma mec (SCCmec), amely tartalmazza a mec komplex, áll a mecA gén, valamint a szabályozó gének mecI, valamint mecRI, a ccr-komplex, felelős integráció, kimetszés, a SCCmec, J régió, amely nem alapvető fontosságú a SCCmec kialakulását, de lehet, hogy nálam nem-β–laktám rezisztencia gének.,4 A mai napig 13 SCCmec típust írtak le a ccr génkomplex típusok és a mec génkomplex osztályok kombinációja alapján. Az altípusokat J region polimorfizmusok határozták meg a mec és ccr komplexek azonos kombinációjában.5
az oxacillin-rezisztens izolátumok kialakulása alternatív antimikrobiális szerek végső alkalmazását eredményezte a CoNS fertőzések, például a glikopeptid vankomicin kezelésére. Időközben a vankomicinnel szembeni csökkent érzékenységről és rezisztenciáról is beszámoltak az elmúlt évtizedekben.,6 A vankomicinre való csökkent érzékenység összefügghet a metabolikus módosításokkal, például a peptidoglikán szintézis gyorsulásával, ami sejtfal megvastagodást eredményez. Ebben a folyamatban a vankomicin nem képes gátolni a peptidoglikán szintézist, mivel a D-alanil-d-alanin helyek nagyobb rendelkezésre állása miatt kimerült.,7
tekintettel a hátrányok által okozott kórházi fertőzések fellendülésére, ez a tanulmány az oxacillin-rezisztens törzsek jellemzésére és a 20 éves vérkultúra-gyűjtemény antimikrobiális érzékenységének meghatározására szolgál, elkülönítve a Botucatu Hospital das Clínicas inpatients-től.
A Botucatu Hospital das Clínicas-Paulista Állami Egyetem (UNESP) betegeinek vérkultúráiból háromszáz konzerv törzset izoláltak., Az izolátumokat 1990 – től 2009-ig gyűjtötték, majd a Botucatu Biosciences Institute-UNESP mikrobiológiai és immunológiai osztályának Kultúragyűjtő laboratóriumában tartották. A kiválasztási kritériumok az események átlagos előfordulási gyakoriságát tekintették 35% – nak, 5% – os hibahatárral és 95% – os konfidencia intervallummal.
a törzseket koneman et al.8 vér-agar izolátumot Gram-foltnak vetettek alá a kolónia morfológiájának megfigyelésére, a kataláz tesztet pedig a Staphylococcus nemzetség megerősítésére végezték., A koaguláz-negatív és koaguláz-pozitív csoportok differenciálódását célzó koaguláz-teszthez staphylococcus törzseket nyújtottak be. A koaguláz-negatív izolátumokat biokémiai vizsgálatoknak vetették alá a fajok fenotípusos azonosítására. A genotípusos azonosítást a 16-os és 23–as génekkel szomszédos konzervált szekvenciákon áthúzott primerekkel, annak-PCR-jével (belső átírt távtartó-polimeráz láncreakció) végezték, Couto et al.9 az amplifikációs hatékonyságot elektroforézissel 3% – os agarózban ellenőrizték, és SYBR Safe-vel festették., The following lineages of international reference were used: S. auricularis ATCC 33753, S. capitis subsp. capitis ATCC 27843, S. capitis subsp. urealyticus ATCC 49325, S. caprae ATCC 35538, S. cohnii ATCC 49330, S. cohnii subsp. cohnii ATCC 29974, S. epidermidis ATCC 12228, S. epidermidis ATCC 35983, S. hemolyticus ATCC 29970, S. hominis ATCC 27844, S. hominis subsp. novobiosepticus ATCC 700237, S. lentus ATCC 700403, S. lugdunensis ATCC 700328, S. saprophyticus ATCC 15305, S. schleiferi subsp. schleiferi ATCC 43808, S. sciuri subsp. sciuri ATCC 29062, S. simulans ATCC 27851, S., xylosus ATCC 29979, és S. warneri ATCC 10209.
DNS extrakció
az Illustra kit (GE Healthcare) DNS extrakcióhoz használták. A lépések közé tartozott a sztafilokokkusz sejtek kezdeti emésztése lizozimmal (10 mg/mL) és K Proteinázzal (20 mg/mL). Ezután 500 µl extrakciós puffert adtunk a keverékhez, amelyet 10 000 x G-on centrifugáltunk 4 percig. A felülúszót átvisszük egy oszlopba, és 5000 g-ra centrifugáljuk 1 percig. A folyadékot kidobták, és 500 µl extraháló puffert adtak az oszlophoz., Az összegyűjtött folyadék centrifugálása és visszadobása után 500 µl mosópuffert adtak az oszlophoz, amelyet 20 000 g-os centrifugáláshoz adtak 3 percig. Ezután az oszlopot átvisszük egy 1,5 mL-es csőbe, majd az elúciót 200 µl melegített MilliQ vízzel végeztük 70°C-on.
a mecA gén detektálása
PCR-t végeztünk a mecA gén kimutatására. A reakciókat a Murakami et al által leírt protokoll segítségével hajtották végre.10 az amplifikációs hatékonyságot elektroforézissel ellenőriztük egy 2% – os agaróz gélben, amelyet SYBR Safe-vel festettünk.,
SCCmec
meghatározása az SCCmec típust mecA-pozitív törzseken határozták meg. A reakciókat Oliveira et al.11 és módosította: Machado et al.12
Multiplex PCR-t 50 µl reakciótérfogatban végeztünk 1x enzimpufferrel, 1.,25 U Taq polymerase DNA, 200 μM dNTP Mix, and the following primers: 10pmol of RIF2 F2 (TTCGAGTTGCTGATGAAGAAGG) and CIF2 R2 (ATTTACCACAAGGACTACCAGC), 6pmol of KDP F1 (AATCATCTGCCATTGGTGATGC) and KDP R1 (CGAATGAAGTGAAAGAAAGTGG), 5pmol of DCS F2 (CATCCTATGATAGCTTGGTC) and DSC R1 (CTAAATCATAGCCATGACCG), 5pmol of RIF4 F3 (GTGATTGTTCGAGATATGTGG), and RIF4 R9 (CGCTTTATCTGTATCTATCGC). For each reaction, 10μL DNA was added. The cycle sequencing reactions were performed at 92°C for 3min, followed by 30 cycles of 92°C for 1min, 56°C for 1min, and 72°C for 1min and 30s., Az amplifikációs hatékonyságot elektroforézissel ellenőriztük egy 2% – os agaróz gélben, amelyet SYBR Safe-vel festettünk.
a minimális gátló koncentráció (MIC) meghatározása e-teszttel
a CoNS törzsek in vitro érzékenységét a következő antimikrobiális szerekre vizsgálták: Oxacillin, vankomicin, daptomicin, Linezolid, Kinupristin/Dalfopristin és tigeciklin. Ezeknek a gyógyszereknek a mikrofonját az E-teszt határozta meg. Az érzékenységi besorolás kritériumai a következők voltak: Oxacillin
µg/mL (érzékeny) a hátrányokra, kivéve S., lugdunensis (érzékeny ≤2µg/mL és rezisztens ≥4µg/mL), vankomicin µg/mL (érzékeny), 8–16µg/mL (közbenső rezisztens), és >32µg/mL (rezisztens); Linezolid ≤4µg/mL (érzékeny); daptomicin ≤1µg/mL; Quinupristin/Dalfopristin ≤1µg/mL (érzékeny), 2 g/mL ml (köztes) és ≥4 µg/mL (rezisztens); tigeciklin ≤0,5 µg/ml.,13Screening kimutatására csökkent érzékenység vankomicin
ahhoz, hogy észlelni csökkent érzékenység vancomycin, egy vetítésre, agar-agar tesztet készíteni, Agy, Szív, Infúzió (BHI) Agar-Agar, valamint 4µg/mL, 6µg/mL, 8µg/mL, 16µg/mL, a vankomicin használták. A vankomicinre érzékeny S. aureus ATCC 29213 referenciatörzset negatív kontrollként, a vankomicinre rezisztens E. faecalis ATCC 51299 törzset pedig pozitív kontrollként alkalmazták. Foltok a 2.,0 McFarland inokulumot adtak az Agar lemezhez, és 35°C-on inkubálták 24 órán át, és legalább egy kolónia termesztését pozitív eredménynek tekintették.
A sejtfalvastagság elemzése
a vankomicinre csökkent érzékenységet mutató CoNS törzseket a sejtfalvastagság elemzésére szolgáló transzmissziós elektronikus mikroszkópiához nyújtották be. Törzsek voltak, kulturált a BHI táplevesben, valamint keresztül 37° C-on 24 órás. A microtube, 1000µL egy CoNS kultúra húsleves volt centrifugált egy percig, a 12 000 fordulat / perc. A felülúszó visszadobása után a törzseket Karnovsky-oldatban rögzítették (2.,5% glutáraldehid 0,1 M foszfát pufferben) négy órán keresztül. A mintákat kivették a rögzítőből, és háromszor öt percig desztillált vízben mosták. Ezután a mintákat 40 percig 0,5% ozmium-tetroxidba merítettük, mielőtt háromszor 10 percig desztillált vízben mossuk. A mintákat dehidratálták növekvő alkoholkoncentrációkkal: kétszer 10 perc alatt 7-ben.,5% alkohol; kétszer 10 perc 15% alkohol; kétszer 10 perc 30% alkohol; kétszer 10 perc 50% alkohol; háromszor 15 perc 70% alkohol; kétszer 15 perc 90% alkohol; kétszer 10 perc 100% alkohol. A kiszáradás után a csonkokat szerelték fel, majd a mintákat metalizálták. Az elemzéseket a Tecnai Spirit Fei cég elektronikus mikroszkóppal végezte, a képeket 30000×nagyítással készítették.,
Eredményekaz izolátumok azonosítása
az 1. táblázat bemutatja a CoNS Fajok izolátumainak forrását, valamint a bakteremiában szenvedő betegek demográfiai adatait.
a mecA gén kimutatása és az SCCmec jellemzése A minimális gátló koncentráció (MIC) meghatározása
a CoNS fertőzések kezelésére használt antimikrobiális szerek Mic-jét az E-teszt határozta meg. Az Oxacillin rezisztencia 206 (68,7%) CoNS törzsben és 25 tigeciklin rezisztens (8,3%) volt. A tigeciklinnel szembeni rezisztenciát az S. epidermidis 4,5% – ában, az S. hemolyticus 13,8% – ában, az S. 13% – ában észlelték., hominis és 11,1% S. lugdunensis. A quinupristin / dalfopristin esetében az egyik S. epidermidis izolátum közepes rezisztenciát mutatott 2 µg/mL-es mikrofonnal, egy S. epidermidis és egy S. hemolyticus pedig 3 µg/mL-es mikrofonnal. Az oxacillin MIC érzékenysége és specificitása az e-teszt során a mecA jelenlétéhez képest 87,4%, illetve 82,3% volt.
a CoNS fajok tekintetében a mic50 és a MIC90 paramétereloszlása az oxacillin rezisztencia magas arányát mutatta az S. hemolyticus-ban., Ez volt az egyetlen CoNS faj, amelynél az izolátumok 50% – át gátló minimális koncentráció >256µg/mL volt, ami tükrözi az S. hemolyticus oxacillinnel szembeni nagy ellenállási sebességét (3.táblázat).
az egyes antimikrobiális szerek MIC tartományát az SCCmec típushoz hasonlították. Az Sccmecii-ként beírt izolátumok magasabb tigeciklin-Mic-ket mutattak, az SCCmecII-ként besorolt izolátumok pedig a legmagasabb oxacillin-Mic-ket mutatták be. Az SCCmecIV törzsek a vankomicin, a linezolid, a daptomicin és a quinupristin/dalfopristin legmagasabb MIC-értékeit mutatták (4.táblázat).
Determination of the MIC range according to SCCmec.
| MIC range (μg/ml) | ||||
|---|---|---|---|---|
| Antimicrobial | SCCmec I | SCCmec II | SCCmec III | SCCmec IV |
| Oxacillin | 0.094≥256 | 6≥256 | 0.,125≥256 | 0.125≥256 |
| Vancomycin | 0.25–2 | 0.38–2 | 0.125–2 | 0.75–2 |
| Linezolid | 0.064–1 | 0.19–0.5 | 0.047–0.75 | 0.064–1 |
| Daptomycin | 0.016–025 | 0.016–0.094 | 0.019–0.5 | 0.047–0.75 |
| Quinupristin/Dalfopristin | 0.025–1.5 | 0.094–0.5 | 0.064–1 | 0.125–2 |
| Tigecycline | 0.016–2 | 0.023–0.75 | 0.016–0.75 | 0.,032-1 |
MIC, minimális gátló koncentráció.
az oxacillint és a vancomycin Mic-ket 20 év alatt értékelték, három időszakra osztva az oxacillin és a vancomycin MIC-tartományok eloszlása szerint. Az oxacillin esetében az első időszakban (1990-2001) magasabb MIC értékeket figyeltek meg, de még mindig érzékenységet jeleztek., A többi időszakban (2002-2006 és 2007-2009) a MIC értékek csökkenését figyelték meg, még mindig jelezve az érzékenységet, valamint a rezisztencia arányának növekedését. Kapcsolatban vancomycin, az azonos értékelés kimutatta, hogy jelentős különbségek a három időszak között törzsek Mic-a 0.047 µg/mL 0,38 µg/mL, 0,5 µg/mL 2,0 µg/mL (Ábra. 1). Meghatározása a csökkent érzékenység vankomicin
A növekedés 214 (71.3%) törzsek volt megfigyelhető a BHI a tányért, 4µg/mL, a vankomicin, 89 (29.7%) a lemez 6µg/mL, a vankomicin, illetve 8 (2.,6%) izolátumok a 8µg / mL vankomicin lemezen. Egyik izolátum sem nőtt a közegben 16µg / mL vankomicinnel. Nem volt szignifikáns különbség a Mic-k között olyan törzsek között, amelyek nem mutattak növekedést a lemezen, kiegészítve a vankomicinnel, valamint azok között, amelyek a 4µg/mL vankomicin lemezen nőttek. Azok között, amelyek 6 µg/mL vankomicinnel növekedtek a közegben, a MIC tartomány 0,5–2 µg/mL volt. Azok között, amelyek 8 µg/mL vankomicinre nőttek, a MIC tartomány 0,75-24 µg/mL volt. A vankomicin 8 µg/mL-en termesztett törzsek négy S. epidermidis, egy S. hemolyticus, két S. hominis és egy S. voltak., az oxacillinnel szemben ellenálló capitis, valamint az S. epidermidis és az S. capitis az SCCmec III, Az S. hominis az SCCmec I és az S. hemolyticus hordozói, nem gépelt SCCmec-kel.
a vankomicinre csökkent érzékenységű törzsek sejtfalvastagságának elemzése
a sejtfalvastagságot a sejtosztódás alatt nyolc törzsben mértük (az értékeket nanométerben, átlag±SD-ben mutatjuk be). A négy S. epidermidis törzs az alábbi átlagos értékeket mutatta 21.66±1.4, 20.12±0.9, 24.24±1.3, és 14,20±1,3 nm. Az S. hemolyticus izolátum 24,88±1,7 nm sejtfalvastagságot mutatott. Az S., capitis izolátum, a sejtfal vastagsága 19,33±1,8 volt, a két S. hominis izolátum esetében pedig 17,68±2,1 és 24,92±1,5 értékek voltak. Összehasonlításképpen, a használt S. epidermidis ATCC 12228 és S. hemolyticus ATCC29970 referenciatörzsek 14,61±1,2, illetve 14,73±0,7 nm sejtfalvastagságot mutattak. A vizsgált törzsek kontrollokkal való összehasonlítása magasabb értékeket mutatott, 17nm-től 24, 92 nm-ig, kivéve egy S. epidermidis izolátumot,amely alacsonyabb értéket mutatott a kontrollokhoz képest (ábra. 2)., CoNS bacteriaemia evolúció
A lehetséges alakulása bacteriaemia, hogy egyéb fertőzések, például szepszis, tüdőgyulladás, húgyúti fertőzés, agyhártyagyulladás, peritonitis, nekrotizáló enterocolitis, omphalitis, valamint a tályog miatt, követte 52 betegek elismerte, hogy az újszülött osztályokon. Ezek közül 25 (46, 3%) betegnél igazolták, hogy a vérkultúrából izolált ugyanazon hátrányok a fertőzés etiológiai ágensei. Hatban (11,1%) a CoNS volt a fertőzés lehetséges kórokozója, 23-ban (42,6%) a hátrányok nem kapcsolódtak a beteg fertőzéséhez (1.ábra). 3).,
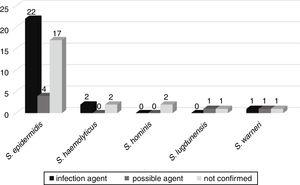
A Vérkultúrákból izolált hátrányok korrelációja az újszülött egységben szenvedő betegeknél okozott fertőzések lehetséges etiológiai ágensei.
A mecA gén volt kimutatható 33 (61.1% – a) ezek a Hátrányok, 20 (60.6%) CoNS társul, súlyosabb fertőzések, vagy lehetséges ügynökök ezek a fertőzések.
Vita
a hátrányok a bakterémia egyik fő oka., Ezeknek a baktériumoknak a fontossága nőtt a kórházi környezetben az elmúlt években, főként az antimikrobiális rezisztencia miatt. A jelenlegi munkában a Botucatu klinikáinak kórházában a betegek vérkultúráiból izolált 300 CoNS törzset tanulmányozták 20 év alatt. Ezeket az izolátumokat antimikrobiális érzékenységük szempontjából jellemezték.
a mecA kimutatása az oxacillin rezisztenciát a hátrányok 78, 5% – ában határozta meg, a MIC50 érték (2 µg/mL) pedig a gyógyszerrel szembeni rezisztenciát jelezte, megerősítve ezen baktériumok β–laktám szerekre való alacsony érzékenységét., Korábbi munkák kimutatták, hogy az 1970-es évek óta a CoNS izolátumok magasabb oxacillin-rezisztencia arányt mutattak, mint az S. aureus.14,15 kimutatták, hogy a β–laktám rezisztencia aránya 65% és 95% között mozog Brazíliában és más országokban.2,16,17 az oxacillin rezisztencia legmagasabb arányát S. epidermidisben találták, ezt követte S. hemolyticus, S. hominis és S. capitis. Hasonló eredményeket írtak le korábbi vizsgálatokban,amelyek oxacillin rezisztenciát mutattak az S. epidermidis 97% – ában 1999 és 2001 között egy újszülött intenzív osztályon (NICU), 18-ban az S 96% – ában., hemolyticus izolált Brazíliában, 19 és 100% – A S. hominis izolált egy NICU Spanyolországból.20 Az S. capitis tekintetében ellentmondó eredményeket találtak a caierão et al.21
bár alacsonyabb gyakorisággal, a mecA gént S. warneri és S. lugdunensisben mutatták ki. S. warneri leírták aránya 33,3% oxacillin rezisztencia NICUs, 22 és az első leírása mecA S. lugdunensis volt a tanulmány által végzett Kawaguchi et al.23 az alacsony ellenállási arány ellenére 24 az S antimikrobiális érzékenységének meghatározása., lugdunensis fontos, nem csak azért, mert a klinikai következményei, mivel ez a faj a legagresszívabb a hátránya, hanem a létesítmény a korai kezelés megfelelő antimikrobiális és jó klinikai eredményeket.25
az SCCmec jellemzése Az I-IV típusok jelenlétét mutatta az izolátumokban, mivel az SCCmecIII a leggyakrabban kimutatható a vizsgált törzsekben, elsősorban az S. epidermidisben, az egyetlen olyan fajban, amely IV.típust hordoz., Az SCCmec III-as típus a legnagyobb közülük, több rezisztenciával összefüggő gént kódol, és a kórházi példányokból a leggyakrabban izolált hátrányok. Az S. epidermidis az emberi bőr fő kolonizátora, amely a leggyakrabban kimutatható a fertőzés helyén. A kórházi környezetben a szelektív nyomás az SCCmec III törzsek terjesztéséhez vezet, amelyek súlyos fertőzésekkel járnak.26 a IV. típusú SCCmec kapcsolatban állt a közösséghez kapcsolódó Staphylococcus spp., és először egy S. epidermidis törzsben írták le, ami azt jelenti, hogy S-ből származik., epidermidis hívja S. aureust. Az SCCmec IV csökkentett költségátadása kis mérete miatt valószínűleg az SCCmec IV hordozók által okozott fertőzések magasabb előfordulásához vezetne.12,27 SCCmecII bemutatott társulás S. hemolyticus, hasonló a megállapítások Machado et al., 12, amelynek munkája csak II. típust észlelt ebben a fajban.
az oxacillin-rezisztens staphylococcusok kezelésének alternatívája a vankomicin, egy glikopeptid, amelyet először 1958-ban alkalmaztak invazív fertőzésekben. Vannak azonban leírások rezisztencia és csökkent érzékenység ez a gyógyszer, 6 bár instabil.,28 a jelenlegi munka eredményei azt mutatták, hogy az oxacillin kivételével a vankomicin volt a legmagasabb mic50 és MIC90 értékű gyógyszer. A gyűjtemény teljes érzékenysége ellenére a MIC értékek 20 év alatt voltak a legmagasabbak, és csökkent érzékenységet mutattak ki egyes S. epidermidis, S. hemolyticus, S. hominis és S. capitis törzsekben. A Natoli et al.Az S. epidermidis és az S. hemolyticus fajokban a vankomicinre való csökkent fogékonyság 29% – os gyakorisággal, 5,4% – os gyakorisággal volt kimutatható., Ugyanezen szerzők szerint a vankomicin agaron termesztett Staphylococcus kolóniák glikopeptid heterorezistenciához vezethetnek, amely a glikopeptid rezisztencia előfutára lehet, ami komplikált fertőzéseket és kezelési kudarcot okozhat. Ezt figyelembe kell venni a terápiás döntésekben.30
az oxacillin-rezisztens hátrányok arányának növekedése és a vankomicinre való hajlamuk csökkenése hangsúlyozza az egyéb terápiás választásokkal járó vizsgálatok fontosságát., Tigeciklin, egy Gram-pozitív és negatív széles spektrumú félszintetikus glicilciklin, tartják a gyógyszer kiváló aktivitást oxacillin érzékeny és rezisztens hátrányok, 14, 29 annak ellenére, hogy az adatok azt mutatják, aránya 8,3% – a rezisztencia, leggyakrabban S. hemolyticus, majd S. hominis, S. lugdunensis, és S. epidermidis. Hasonló MIC90-es eredményeket írtak le a tigeciklinre vonatkozóan, nincs különbség az oxacillin-rezisztens és a fogékony hátrányok között.31 A Natoli et al.29 a tigeciklin jó aktivitást mutatott a hátrányok ellen., E szerzők szerint a tigeciklin nem ajánlott bakteriémia kezelésére, alkalmazását korlátozni kell a multirezisztens Gram-negatív baktériumok elleni aktivitás megőrzése érdekében. Úgy tűnik, hogy az S10 riboszómális gén, valamint az rpsJ és a mepA gének mutációi összefüggenek a tigeciklin rezisztenciával.A 32,33
Quinupristin / dalfopristin a makrolid-linkozamid-streptogramin csoportba tartozó streptogramin., A kinuprisztin és a dalfoprisztin kombinációja szinergikus és általában baktericid hatású, ha ezeket a szereket külön-külön hasonlítják össze, vagy hasonló makrolid antimikrobiális szerekkel hasonlítják össze.34 ebben a munkában, annak ellenére, hogy a vizsgált hátrányok többségében kiváló hatékonyságot mutattak, a gyógyszerrel szembeni közbenső rezisztenciát két S. epidermidisben és egy S. hemolyticus-ban észlelték. A tanulmány által végzett Mendes et al., 35 a quinupristin/dalfopristin kiváló hatékonyságot mutatott a hátrányok szempontjából, a törzsek teljesen fogékonyak voltak, a MIC90 értékek 0, 38 µg/mL az oxacillinra érzékeny törzsek esetében és 0.,75 µg/mL az oxacillin-rezisztens törzsek esetében. Ezen kívül Venkatesh et al.36 a quinupristin/dalfopristin jó hatásosságát írta le oxacillin rezisztens és fogékony törzsek esetén.
a Daptomicint, egy évtizedek óta vizsgált antimikrobiális szert 2006-ban hozták vissza a Staphylococcus által okozott bakteriémia és endocarditis kezelésére.37 a jelen vizsgálatban a daptomicin kiváló hatékonyságot mutatott a CoNS izolátumok esetében, alacsony MIC50 értékekkel. Olivares et al.37 továbbá ellenőrizte az összes hátrány érzékenységét a daptomicinre, a MIC-értékek alacsony változásával., Egy munka tanul 1126 CoNS, által vezetett Critchley et al.,38 a daptomicin 0, 015-2, 0 µg/mL MIC tartományban volt aktív, a MIC90 pedig 0, 5 µg/mL volt. E szerzők szerint ezekben az elemzésekben a legaktívabb hatóanyagok a daptomicin és a quinupristin/dalfopristin voltak, ami hangsúlyozza ezen antimikrobiális szerek relevanciáját a hátrányok által okozott fertőzések kezelésében.
a Linezolid, egy szintetikus oxazolidinon, amely potenciálisan több baktérium ellen aktív, egy másik gyógyszer, amely jó hatékonyságot mutatott a hátrányok ellen.,39 a Linezolid a rezisztencia leírása ellenére fontos szerepet játszik a krónikus fertőzések terápiás kezelésében. Brazíliában a linezolid rezisztencia első esetét 2006-ban írták le, az MRSA40 klinikai izolátumán, a hátrányok között pedig S. epidermidisben, S. hominisben és S. hemolyticus-ban.41 Az Olivares et al. által végzett munkában.,37 hét linezolid rezisztens törzs kimutatása ellenére ez a gyógyszer hatékony MIC értékeket mutatott a CoNS törzsekben. Másrészt a linezolid rezisztens s kitörése., beszámoltak az epidermidis klónokról, amelyek mutációkat tartalmaznak az L3 és L4 riboszomális fehérjékben, valamint a Franciaországban nemrégiben azonosított cfr plazmidról.42
S. a hemolyticus volt az a faj, amely a legmagasabb oxacillin MIC értékeket mutatta, és a 256µg/mL-nél magasabb koncentrációkra volt szükség az izolátumok 50% – ának gátlásához. Az oxacillin mellett ez a faj magasabb MIC-értékeket mutatott a tigeciklinre és a vizsgált antimikrobiális szerek többségére. Számos mű magas ellenállóképességet mutat az S által okozott fertőzések kezelésére használt antimikrobiális szerekkel szemben., hemoliticus, különösen a meticillin és a glikopeptidek. Egyes szerzők leírják a β-laktám és aminoglikozid hatóanyagokkal szembeni rezisztenciát kódoló gének magas prevalenciáját,valamint az ellenállási törésponthoz közeli MIC-értékekkel rendelkező izolátumok jelentős részét,43, 44, hangsúlyozva az S. hemolyticus mint multirezisztens kórokozó fontosságát.
a MIC-tartománynak az SCCmec-típusokkal való társulása a vankomicin, a linezolid, a daptomicin és a quinupristin/dalfopristin esetében magasabb Mic-ket mutatott az sccmeciv-t hordozó S. epidermidisben., Az ezekkel az antimikrobiális szerekkel szembeni rezisztenciával kapcsolatos géneket plazmidok közvetítik, amelyek többnyire kórházi eredetű meticillin-rezisztens törzsekben találhatók.A 45 SCCmec IV a közösségi izolátumokra jellemző, különösen annak mérete és alacsony adaptív költsége miatt. A tanulmányok azt sugallják, hogy a rezisztencia gének megszerzése környezeti, nem klinikai eredetű, tekintettel a rezisztenciagén-hordozók nagy sokféleségére a természetes környezetben.46,47 továbbá, SCCmecIV csak kimutatható S. epidermidis, amely a leggyakoribb faj az emberi bőr a leginkább befolyásolja a szelektív nyomás., A magasabb Mikrofon képest más antimikrobiális is lehet, hogy köze a szelektív nyomás, mint az expozíció mértékét, hogy ezek a gyógyszerek, a kórházi környezet, az elfogultság, a kiválasztási csökkent érzékenység, illetve a rezisztens törzsek, mivel több mutáció események, genetikai rekombináció, illetve módosításának a mikrobiális élettani van szükség, hogy létrehoz fenotípusos változások.,48
a szelektív nyomáshoz kapcsolódó metabolikus és fiziológiai változások figyelhetők meg a 8 µg/mL vankomicin agaron termesztett törzsekben, mivel a sejtfal megvastagodása a legtöbb CoNS izolátumban a megnövekedett peptidoglikánszintézis miatt következett be. Ez a mechanizmus előnyösebb a hátrányok számára, mint a van operon megszerzése, amely a vankomicin rezisztencia mediátora. A van operont horizontális géntranszferrel szerezzük be, expresszióját csak glikopeptid jelenlétében stimuláljuk., Ez az inger nagyon magas adaptív költséget okoz a vankomicin jelenlétében, ami hátrányos a vankomicin közegben lévő hátrányok számára.48,49 más rezisztencia gének, például a mecA gén megszerzésével kapcsolatban a kezdeti adaptív költségeket kompenzáló további mutációk enyhítik a rezisztencia “költségeire”. A közelmúltban kimutatták, hogy az olyan gének pontos mutációi, mint a vraR, csökkent érzékenységgel járnak a vankomicinre és a sejtfal megvastagodására a staphylococcusokban.,50
a jelen vizsgálat azt mutatta, hogy az újszülött és gyermekgyógyászati egységekben előforduló hátrányok által okozott bakteriémia magas, egy évnél fiatalabb gyermekek bevonásával, a fő szerek az S. epidermidis, S. hemolyticus, S. hominis, S. lugdunensis és S. warneri. S. capitis nem volt elszigetelt ezeket az egységeket, hogy az ügynökök a bacteriaemia a felnőttek elismerte, hogy a belgyógyászati osztályon, gasztroenterológia, neurológia, valamint ügyeletre.,
Mint a vizsgálatban részt vevő bacteriaemia okozza staphylococcus baktériumok elszigetelt több mint 30 éve, nagy a kapcsolódó adatok a beteg orvosi adatait nem lehet letölteni, így nem lehetett társítani a fertőzés eredménye mind a betegek, amely korlátozás a jelen vizsgálatban. Az újszülött egységekben szenvedő betegektől kapott adatok a CoNS bacteremia klinikai jelentőségét mutatták, amely speciális ellátást igénylő betegségekhez vezethet.
az antimikrobiális rezisztencia ismerete nagy jelentőséggel bír a hátrányok által okozott fertőzések helyes kezelésében., Ezen túlmenően ezeknek a baktériumoknak a virulencia tényezői, valamint a betegek immunitása olyan tényezők, amelyek hozzájárulnak a mikroorganizmus azon képességéhez, hogy súlyosabb fertőzéseket okozzon.
20 évig tartó Vizsgálatunk eredményei nagy gyakorisággal mutattak antimikrobiális rezisztenciát a Hátrányokban, ami tükrözi ezeknek a gyógyszereknek a túlzott használatát., Emellett az anyagcsere -, illetve fiziológiás módosításokat vezethet csökkent érzékenység antimikrobiális, az állapotuk, mint az emberi kommenzális baktériumok ideálisak a szállítmányozók, valamint egy hatékony víztározó rezisztencia gének, különösen az alacsony költségű elemek, mint például a SCCmec.45 a legjobb eredményeket kínáló antimikrobiális szereket úgy kell alkalmazni, hogy megőrizzék hatásosságukat és megelőzzék a rezisztenciát.,
összeférhetetlenség
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.