2017.április 13-án, az NCI személyzete
egy olyan gyermek agyi szkennelése, akinek a DIPG tumor található az agytörzsben.
két különálló vizsgálat azonosított potenciális terápiás célokat egy működésképtelen gyermek agydaganat, diffúz intrinsic pontine glioma (DIPG). Ezeknek a céloknak a vizsgálati gyógyszerekkel történő blokkolása lelassította a tumor növekedését a DIPG állati modelljeiben.
DIPG, az agytörzsben található daganat szinte egyenletesen halálos.,
“gyermekgyógyászati neurooncológusként ez az egyik legpusztítóbb daganat, amelyet látunk” – mondta Prati Bandopadhayay, M. B. B. S., Ph. D., A Dana-Farber/Boston Children rák – és vérrendellenességek központja, aki nem vett részt a vizsgálatokban. “Ezeknek a daganatoknak egyáltalán nincs gyógyító kezelésünk.”
míg a DIPG tumorok többsége specifikus genetikai mutációt hordoz, korábban nem volt világos, hogy a mutáns fehérje milyen szerepet játszik a tumor fejlődésében, és hogy funkcióját terápiák célozhatják-e meg.,
mindkét új tanulmány esetében a kutatócsoportok megvizsgálták az emberi DIPG sejtek biológiáját ezzel a mutációval, és azonosítottak olyan jellemzőket, amelyek sebezhetővé tehetik őket a kezeléssel szemben. A kontrollkezelésekhez képest azt találták, hogy a prc2 és BET inhibitorok néven ismert gyógyszerek egérmodellekben összezsugorították a DIPG tumorokat, és meghosszabbították az egerek életét.
mindkét tanulmány eredményeit, az egyik a Northwestern Egyetem kutatócsoportjából, a másik a dán Koppenhágai Egyetem egy csoportjából, február 27-én tették közzé a Nature Medicine-ben.,
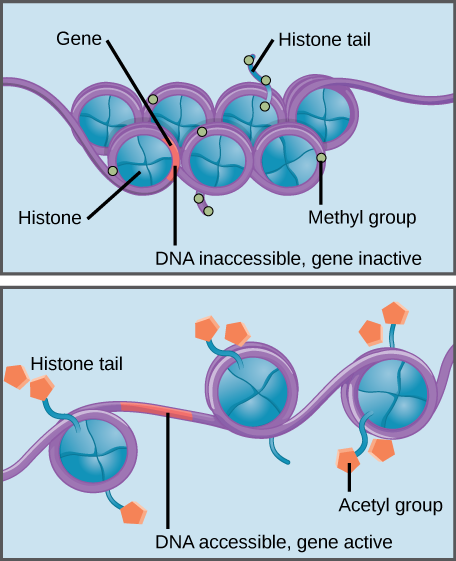
a hiszton metiláció erősíti a hiszton–DNS kölcsönhatást, így a kapcsolódó gének hozzáférhetetlenek a gén expresszióhoz (inaktív). A hiszton-acetiláció gyengíti az interakciót, így a kapcsolódó gének hozzáférhetők a gén expressziójához (aktív).
célpont azonosítása
körülbelül 5 évvel ezelőtt a St., A Jude-Washington Egyetem Gyermekrák Genomprojektje felfedezte, hogy a DIPG tumorok közel 80% – ának specifikus mutációja van a hiszton H3 nevű fehérje génjében.
az, hogy a daganatok ilyen magas aránya ugyanolyan mutációval rendelkezik, meglepetés volt a DIPG kutatóközösségnek, mondta Ali Shilatifard, Ph.D., A Northwestern University Feinberg Orvostudományi iskolája, az egyik tanulmány vezető kutatója.
a hisztonok olyan fehérjék családja, amelyek segítik a DNS-t kompakt struktúrákba csomagolni., A DNS rövid szakaszai a hisztonfehérjék körül keringenek, mint a szál a tekercsen, és több ezer DNS-csomagolt hiszton (úgynevezett nukleoszómák) alkotja az egyes kromoszómákat.
a hisztonok specifikus módosításai elősegíthetik vagy megakadályozhatják a gén expresszióját. Például az acetilcsoportoknak a hisztonokhoz való kötődése gyengíti a DNS-vel való kölcsönhatásukat, elősegítve a gén expresszióját. Másrészről, a metilcsoportok hozzáadása a hisztonokhoz általában a DNS-szeletet szorosabbá teszi a hisztonok körül, megakadályozva a gén expresszióját.,
a hiszton H3 mutáció jelenlétének azonosítása DIPG-ben szenvedő betegeknél volt az első lépés – mondta Dr. Bandopadhayay. “De ahhoz, hogy a daganatokat ezzel a változással kezelhessük, meg kell értenünk, hogy mit csinál a mutáció” – tette hozzá.
egy korábbi vizsgálatban Dr. Shilatifard és kollégái gyümölcslegyeket használtak a mutáns hiszton H3 gén működésének tanulmányozására. Összehasonlítva a normál hiszton H3 fehérjékkel rendelkező legyekkel, a mutáns változattal rendelkező legyeknek több hisztonja volt, amelyeket acetilcsoportokkal (acetilezett) vontak be., Ezeket az acetilezett hisztonokat viszont bromodomain tartalmú (BRD) fehérjéknek nevezett molekulák kötötték, amelyek szabályozzák a gén expresszióját.
a jelenlegi vizsgálatukhoz, amelyet részben az NCI finanszírozott, az Északnyugati kutatók meg akarták határozni, hogy a mutáns hiszton ugyanolyan funkcióval rendelkezik-e az emberi sejtekben. Valójában azt találták, hogy a mutált hiszton H3 gén expresszálására megváltozott emberi vastagbélrák vagy vese rákos sejtek több acetilált hisztont tartalmaztak, mint a normál hiszton H3 gént expresszáló sejtek.
az első Szerző, Andrea Piunti, Ph. D., ezután megvizsgáltuk az összes mutáns H3 hisztont, amely a DIPG tumorsejtek genomjaiban található három betegből. Elemzéséből kiderült, hogy a mutáns hisztonokat tartalmazó nukleoszómák közül sok acetilált és BRD-fehérjékhez kötött.
további kísérletek azt mutatták, hogy a BRD fehérjék közvetlen szerepet játszhatnak a DIPG tumor növekedésében. Az emberi DIPG-sejtek kezelése olyan vizsgálati gyógyszerekkel, amelyek blokkolják a BRD-fehérjéket, az úgynevezett BET-gátlókat, lelassította a DIPG-sejtek növekedését a kontroll kezeléshez képest., Az agytörzsükbe beültetett emberi DIPG-sejtekkel rendelkező egereken végzett vizsgálatok során a BET-gátlókkal kezelteknek kisebb daganataik voltak, és hosszabb ideig éltek, mint a kontrollkezeléssel kezelt egerek.
Ezek a kísérletek “azt sugallják, hogy a BET-gátlók potenciális terápiás megközelítést biztosítanak a DIPG számára” – mondta Dr. Shilatifard. Preklinikai vizsgálatok kimutatták, hogy számos különböző ráktípus—köztük a leukémia és a glioblasztóma-is érzékeny a BET-gátlókra-tette hozzá.,
egy további cél
Az Északnyugati csoport elemzése humán DIPG tumorsejtek mutáns hiszton H3 is kiderült, hogy amellett, hogy több hiszton H3 acetiláció, sok hisztonok voltak díszített metil-csoportok (metilezett). Továbbá azt találták, hogy egy prc2 nevű enzim—amely metilcsoportokat köt a hiszton H3 fehérjékhez—jelen volt ezen hisztonok sokasága közelében.
ezek az eredmények arra késztették az Északnyugati kutatókat, hogy tovább vizsgálják a PRC2 tevékenységet., Megállapították, hogy a PRC2 aktivitásának blokkolása—akár genetikailag, akár egy TAZEMETOSZTÁT nevű PRC2 inhibitorral—csökkentette a DIPG-sejtek növekedését.
“váratlanul ezek az eredmények a PRC2 funkció szerepét mutatják a DIPG növekedés fenntartásában” – írta a Northwestern csoport.
a Koppenhágai csoport bizonyítékokat is talált, amelyek alátámasztják a PRC2 szerepét a DIPG tumor növekedésének előmozdításában. Megfigyelték, hogy a tazemetosztát és egy másik PRC2 inhibitor csökkentette az egér agysejtek vagy humán DIPG sejtek növekedését mutáns hisztonokkal, míg a kontroll kezelés nem.,
és amikor mutáns hisztonokkal rendelkező egér agysejteket ültettek a normál egerek vagy egerek agyába, amelyekben a PRC2 genetikailag blokkolt volt, azok, akiknek nem volt PRC2 aktivitása, hosszabb ideig éltek.
ezzel szemben egy németországi kutatócsoport külön tanulmánya megállapította, hogy a DIPG-ben szenvedő különböző betegek sejtjei nem voltak érzékenyek a tazemetosztátra, annak ellenére, hogy tumoraik hiszton H3 mutációval rendelkeztek.
egy lépés előre
Több évtizedes klinikai vizsgálatok kimutatták, hogy a DIPG tumorok érzéketlenek a hagyományos kemoterápiára, magyarázta Dr. Bandopadhayayay., És bár a sugárzás enyhítheti a tüneteket, nem gyógyító hatású, és a DIPG-ben szenvedő gyermekek többsége a diagnózistól számított 2 éven belül meghal.
2015-ben a DIPG kutatók nemzetközi konzorciuma összefogott az összes rendelkezésre álló DIPG sejtmintának tanulmányozására. Tanulmányuk kimutatta, hogy a több különböző betegből gyűjtött DIPG-sejteket egy hisztonmódosító szer, a panobinosztát (Farydak®) ölte meg. A panobinosztát blokkolja azokat az enzimeket, amelyek acetilcsoportokat adnak a hisztonokhoz., Most a kutatók, akik az NCI által támogatott gyermekgyógyászati agydaganat konzorcium részét képezik, egy I. fázisú klinikai vizsgálatban tesztelik a panobinosztát biztonságosságát és legjobb adagját DIPG-vel rendelkező gyermekek számára.
most mindkét tanulmány eredményei arra utalnak, hogy potenciálisan ígéretes új kezelési stratégiákat mutatnak-mondta Dr. Shilatifard.
” A Bet-inhibitorokat egy DIPG-kezelés I. fázisú vizsgálatába akarjuk áthelyezni, és kollégáink az Ann & Robert H. Lurie Children”Chicagói kórházában előrehaladnak ezekkel a tanulmányokkal” – mondta.,
ezenkívül számos folyamatban lévő klinikai vizsgálat vizsgálja a TAZEMETOSZTÁTOT, a PRC2 inhibitort, mind felnőtt, mind gyermekgyógyászati betegeknél, különféle rákos megbetegedésekben. Azonban egyetlen jelenlegi tanulmány sem vizsgálja kifejezetten a TAZEMETOSZTÁTOT DIPG-ben szenvedő gyermekeknél.
még mindig sok megválaszolatlan kérdés van-mondta Dr. Bandopadhayay, beleértve azt is, hogy ezek a vizsgálati gyógyszerek képesek–e átjutni a vér-agy gáton, és elérni az emberi agydaganatokat.
Dr., Bandopadhayay és kollégái a boncolásokból nyert tumorsejtek tanulmányozásával a DIPG biológiáról is többet tanulnak. A biopsziás minták beszerzését csak a közelmúltban tették lehetővé az idegsebészeti technikák jelentős javulásával – magyarázta.
“Ez egy izgalmas idő,” azt mondta,. “Van egy csomó munka folyamatban van most. A végső cél az, hogy képesek legyenek kezelni ezeket a gyerekeket, hogy minimális mellékhatásokkal gyógyulhassanak.”