Introduzione
Posterior reversible encephalopathy syndrome (PRES), descritta per la prima volta da Hinchey et al. nel 1996, rappresenta un disturbo neurologico con vari presentazione clinica e risultati tipici di imaging del modello predominante parieto-occipitale di edema vasogenico (1, 2). Ci sono numerose cause documentate di PRES, con casi descritti per la prima volta nell’impostazione di pressioni arteriose elevate., Esempi di scenari clinici in cui PRES possono essere visti includono: emergenza ipertensiva, (pre)eclampsia, malattia renale, malattie autoimmuni e farmaci citotossici, tra gli altri (3, 4) (Tabella 1). La PRES può verificarsi in qualsiasi gruppo di età e ha un tasso di occorrenza più elevato nelle pazienti di sesso femminile (7, 8). Sebbene la letteratura attuale sia relativamente scarsa rispetto alle popolazioni adulte, particolare menzione dovrebbe essere fatta di PRES nel paziente pediatrico., I pazienti pediatrici hanno una presentazione clinica simile a quella della popolazione adulta, con ipertensione, convulsioni e stato mentale alterato che sono manifestazioni comuni della malattia (9). Nonostante la maggior parte dei casi di PRES pediatrici segnalati in pazienti oncologici, in particolare i pazienti post-trapianto di cellule staminali (10, 11), uno studio condotto da Gupta et al. (12) ha scoperto che la malattia renale era forse la causa più comune di PRES nel paziente pediatrico. Nel loro studio, i pazienti pediatrici tendevano ad avere risultati di imaging più atipici (62,5%), incluso il coinvolgimento del lobo frontale (56%).,
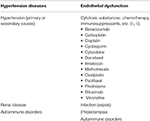
Tabella 1. Principali stati di malattia associati a PRES.
Le manifestazioni cliniche sono da acute a subacute e vanno da mal di testa e disturbi visivi a livelli alterati di coscienza e convulsioni nei casi più gravi (1). Il trattamento è generalmente mirato a colpire la causa sottostante, con sintomi generalmente reversibili e risultati di imaging nella maggior parte dei casi (8)., Anche se i risultati sono generalmente favorevoli con una corretta gestione, scarsi risultati clinici sono stati associati a diabete mellito preesistente e coinvolgimento del corpo calloso; tuttavia, altri biomarcatori di imaging affidabili per la prognosticazione sono attualmente carenti (13). L’imaging neuroradiologico svolge un ruolo fondamentale nella diagnosi di PRES con le caratteristiche tipiche dell’imaging meglio apprezzate sulla risonanza magnetica (MRI) (2).
Fisiopatologia
I meccanismi fisiopatologici precisi dietro PRES devono ancora essere completamente chiariti e rimangono controversi(3)., Ci sono attualmente due principali meccanismi proposti per la fisiopatologia del PRES (Figura 1). La prima teoria propone un aumento della pressione arteriosa come fattore primario (8). I rapidi aumenti della pressione sanguigna alla fine superano le capacità autoregolatorie della vascolarizzazione cerebrale causando perdite vascolari e conseguente edema vasogenico (14). Esiste un’eventuale disfunzione della barriera emato-encefalica (BBB) con proteine che passano attraverso la giunzione stretta (15)., Le aree fornite dalla circolazione posteriore (arterie vertebrali, arteria basilare e arterie cerebrali posteriori) sono a rischio eccezionale rispetto alla circolazione anteriore (arterie carotidi interne, arterie cerebrali medie e arterie cerebrali anteriori) a causa della mancanza di tono simpatico della vascolarizzazione dell’arteria basilare (8)., Una teoria correlata proposta da alcuni postula che l’ipertensione estrema provoca vasospasmo e ischemia locale che causa la rottura di BBB e l’edema vasogenico risultante, come è stato osservato nei pazienti trattati con agenti immunosoppressori ciclosporina A e FK-506 (16). L’interruzione nel BBB provoca i tipici risultati di edema vasogenico contro edema citotossico (che può essere visto nell’impostazione di infarto acuto e rappresenta un aumento del contenuto di acqua intracellulare a causa della perdita del solito gradiente osmotico nell’impostazione della morte cellulare (17).,
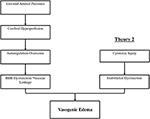
Figura 1. Due principali teorie della fisiopatologia del PRES. La teoria 1 è la teoria dell’iperperfusione ipertensiva e cerebrale e la teoria 2 è la teoria della disfunzione endoteliale.
La seconda teoria principale riguarda il fatto che fino al 30% dei pazienti con PRES non presentano le pressioni arteriose elevate necessarie per superare il controllo autoregulatorio della vascolarizzazione cerebrale (18, 19)., Questa teoria propone che la disfunzione endoteliale sia il colpevole principale, che può essere causato da varie tossine endogene o esogene (20). Questa teoria può spiegare i risultati di PRES osservati in pazienti che ricevono farmaci immunosoppressivi e / o chemioterapia e anche in quei pazienti con sepsi (21, 22). In questo modello, le tossine circolanti causano lesioni vascolari con conseguente sviluppo di edema vasogenico. Il danno endoteliale provoca un ulteriore rilascio di agenti vasocostrittori e immunogenici, che possono causare vasospasmo e / o aumento della permeabilità vascolare., In definitiva, la disfunzione endoteliale che consente perdite vascolari ed edema vasogenico è il fattore trainante dietro PRES, indipendentemente dall’anomalia vascolare cerebrale primaria (nel caso dell’ipertensione arteriosa) o secondaria alle tossine circolanti. Una sintesi di queste due teorie, nonché un elenco di chemioterapici precedentemente riportati e altri immunosoppressori è mostrato in Figura 2.
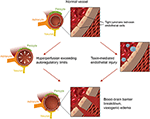
Figura 2. Illustrazione delle due principali teorie della fisiopatologia di base del PRES., Riconoscimento: Per gentile concessione di Caroline O ” Driscoll, MA (Ha illustrato questo da sola ed è un dipendente della nostra università).
Le manifestazioni cliniche dipendono dalle regioni coinvolte del cervello; quindi, la presentazione può essere ampia. Ad esempio, il coinvolgimento primario dei lobi occipitali può causare disturbi visivi/allucinazioni. I deficit neurologici focali corrispondenti alla posizione delle lesioni focali si verificano in ~5-15% dei pazienti con PRES (23)., Raramente, il coinvolgimento del midollo spinale può causare segni clinici e sintomi di mielopatia o paralisi (24).
Imaging
Come suggerisce il nome, PRES si manifesta tipicamente negli studi di imaging come edema vasogenico della sostanza bianca predominante sul retro. I lobi parietali e occipitali sono quasi universalmente coinvolti e i risultati sono tipicamente simmetrici e bilaterali (1). Il coinvolgimento dei lobi frontali, particolarmente adiacente al sulci frontale superiore, è anche comunemente visto., L’edema vasogenico, sebbene possa coinvolgere la materia grigia cerebrale, è spesso più facilmente apprezzato nella sostanza bianca sottocorticale. L’esame CT è spesso il test di imaging iniziale nell’impostazione dei sintomi neurologici acuti e può dimostrare ipoattenuazione della sostanza bianca nelle regioni colpite (25) (Figura 3: CT di PRES). Nel complesso, i risultati sono meglio rappresentati dalla risonanza magnetica che mostra una maggiore sensibilità e una migliore caratterizzazione anatomica rispetto alla TC (26). Inoltre, la risonanza magnetica può aiutare a distinguere altri stati patologici che possono manifestarsi clinicamente in modo simile a PRES., Le sequenze T2-weighted e T2 FLAIR (fluid-attenuated inversion recovery), in particolare, sono più utili per rilevare l’edema vasogenico sulla risonanza magnetica (Figura 4: MR di PRES; Figura 5: MR di PRES Coronal).
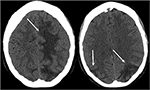
Figura 3. Paziente con lupus eritematoso sistemico e glomerulonefrite rapidamente progressiva che si presenta con convulsioni. Le immagini CT non a contrasto della testa dimostrano edema vasogenico nei lobi parietali e occipitali bilaterali, sinistra maggiore di destra, nonché estensione nel lobo frontale sinistro.,
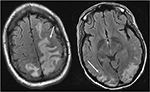
Figura 4. Paziente con lupus eritematoso sistemico e glomerulonefrite rapidamente progressiva che si presenta con convulsioni. Le immagini T2-FLAIR della testa dimostrano l’edema vasogenico nei lobi parietali e occipitali bilaterali, a sinistra maggiore di destra, così come l’estensione nel lobo frontale sinistro. Si noti che con il modello vasogenico di edema, si risparmia l’anomalia del segnale nella corteccia.
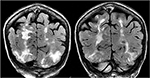
Figura 5., Paziente con anamnesi di mielofibrosi primaria e trapianto di midollo osseo in trattamento con Tacrolimus che presenta una prima crisi convulsiva. Le sequenze coronali T2-FLAIR dimostrano un’ampia anomalia del segnale nei lobi occipitali e parietali bilaterali, come è tipico con PRES.
La diagnosi differenziale per PRES è ampia e include entità con iperintensità simile alla sostanza bianca confluente T2., Gli esempi includono: ischemia / infarto (in particolare circolazione posteriore), malattie demielinizzanti, eziologie infettive (meningite, encefalite), leucoencefalopatia multifocale progressiva (PML), vasculite e vari disturbi metabolici (27). Si ritiene che un’entità clinicamente correlata chiamata sindrome da vasocostrizione cerebrale reversibile (RCVS) sia causata da alterazioni del tono vascolare cerebrale con conseguente vasocostrizione., RCVS manifesta come ricorrenti thunderclap mal di testa, convulsioni, ictus, e non-aneurismatica emorragia subaracnoidea (28), che potrebbe essere scambiato per PRES su base clinica. Questa entità si verifica tipicamente nel periodo post-partum o dopo l’esposizione a farmaci adrenergici o serotoninergici. RCVS può in genere essere diagnosticata con studi angiografici che dimostrano aree multifocali di restringimento che coinvolgono le arterie cerebrali (29). Questa diagnosi può essere confusa con il fatto che RCVS e PRES spesso si verificano in concomitanza, che il neuroradiologo dovrebbe essere a conoscenza per evitare diagnosi errate (30).,
La PRES può essere tipicamente distinta dall’ischemia acuta perché quest’ultima dimostra invariabilmente l’edema citotossico e la restrizione della diffusione. La diffusione limitata nell’ischemia acuta può essere facilmente rilevata su imaging ponderato per diffusione (DWI) e coefficiente di diffusione apparente (ADC) come segnale iperintenso su DWI con corrispondente segnale diminuito su ADC (a causa del movimento relativamente diminuito delle molecole d’acqua intracellulari)., L’edema vasogenico nell’impostazione di PRES, d’altra parte, può mostrare un segnale iperintenso su DWI che non è accompagnato da un corrispondente segnale diminuito su ADC (31). Inoltre, l’ischemia acuta tende ad essere unilaterale e all’interno di un territorio vascolare singolare. Mentre la valutazione per la restrizione di diffusione per differenziare PRES dall’anomalia ischemica è generalmente affidabile, ci sono rari casi di PRES che possono essere associati ad aree di restrizione di diffusione sovrapposte ad aree dell’edema vasogenico isolato più classicamente visto.,
Le tecniche di imaging”avanzate” in PRES sono state recentemente descritte come uno strumento aggiuntivo in casi difficili o equivoci. Queste tecniche avanzate di imaging includono: perfusione CT / MR, spettroscopia MR (MRS), Susceptibility weighted imaging (SWI) e tecniche di medicina nucleare, tra cui la tomografia a emissione di fotoni singoli (SPECT) e la tomografia a emissione di positroni (PET) con radiotraccianti variabili. Anche se una discussione completa è oltre lo scopo di questa recensione, una varietà di risultati di imaging può essere visto su queste tecniche avanzate per aiutare a suggerire una diagnosi di PRES., L ‘ iperperfusione può essere osservata in studi di perfusione TC / RM dimostrati da un aumento del flusso ematico cerebrale e del volume ematico con riduzione del tempo di perfusione e del tempo medio di transito (32) sebbene siano stati riportati casi di ipoperfusione (33). Sulla MRS, c’è generalmente una riduzione del rapporto N-acetilaspartato (NAA)/creatina (Cr) e NAA/colina (Chol), indicativo di un’interruzione delle normali sinapsi e della funzione neuroassonale (34). SWI può aiutare a identificare la presenza di emorragia in PRES, con maggiore sensibilità rispetto a GRE imaging (35)., L’imaging SPECT/PET in genere dimostra iperperfusione o ipoperfusione (simile agli studi di perfusione CT / MR) con basso metabolismo da parte di FDG-PET (36).
Inoltre, PRES può essere distinto da altre condizioni come l’encefalite autoimmune nell’ambito dell’encefalomielite acuta disseminata (ADEM) dall’edema vasogenico diffuso bilaterale ma asimmetrico del primo (37)., La PML può avere un aspetto simile rispetto alla PRES, avendo una predominanza parieto-occipitale, ma può essere distinta dal suo coinvolgimento più unilaterale o asimmetrico, nonché dalla predilezione per la sostanza bianca sottocorticale (38).
Caratteristiche di imaging atipico
Le caratteristiche atipiche di PRES includono aree di aumento del contrasto, emorragia o restrizione della diffusione (39)., Sebbene i lobi parietali e occipitali siano generalmente coinvolti, possono essere osservate aree atipiche di coinvolgimento, tra cui: tronco cerebrale, cervelletto, corpo calloso e altre aree cerebrali, con aree più comuni tra cui i lobi frontali (visti fino al 68%) e lobi temporali inferiori (fino al 40%) (23, 40) (Figura 6: Cervelletto; Figura 7: Tronco cerebrale).
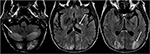
Figura 6. Paziente con trapianto di fegato 6 settimane prima. Il paziente ha iniziato il trattamento con Tacrolimus dopo il trapianto di fegato., Le immagini T2-FLAIR del cervello dimostrano un’anomalia del segnale nei lobi occipitali. C’è anche un’ampia anomalia del segnale osservata negli emisferi cerebellari bilaterali e all’interno del talami. Questi risultati si sono risolti rapidamente dopo la sospensione di Tacrolimus.
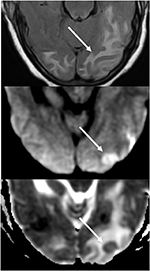
Figura 7. Paziente con ipertensione non controllata che si presenta con alterazione dello stato mentale. L’immagine T2-FLAIR (in alto) dimostra l’edema nei lobi occipitali., Le immagini DWI (al centro) e ADC map (in basso) mostrano una piccola freccia di diffusione limitata, con segnale iperintenso su DWI e ipointensità corrispondente sulla mappa ADC.
Inoltre, una scoperta precoce di PRES, che può precedere il tipico edema parieto-occipitale include una lieve iperintensità del FLAIR sulcal e un miglioramento leptomeningeo su immagini ponderate T1 post-contrasto, come descritto da Nakagawa et al. (41). Benziada-Boudour et al., (42) ha descritto uno sviluppo concomitante di edema citotossico, con conseguente diffusione limitata (Figura 8: Restrizione della diffusione). Inerente al nome del processo patologico, i risultati relativi alla PRES sono generalmente reversibili, con normalizzazione dei risultati clinici e di imaging una volta trattato il problema di incitamento. Tuttavia, in alcuni casi, aree di diffusione limitata possono alla fine provocare lesioni permanenti al parenchima cerebrale (Figura 9: Necrosi laminare)., L’emorragia è meno comunemente osservata in PRES, che si verifica nel 5-30% dei casi, ma dovrebbe essere riconosciuta per non confondere questo risultato con un’altra entità patologica nell’impostazione clinica appropriata di PRES (39). I risultati di imaging nell’emorragia possono includere: ematoma focale, emorragia girale petecchiale e/o emorragia subaracnoidea (43) (Figura 10: Emorragia).
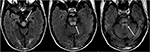
Figura 8. Paziente con una storia di trapianto di fegato due settimane prima su Tacrolimus., T2-FLAIR immagini mostrano anomalia del segnale all’interno del mesencefalo, pons, e peduncoli cerebellari superiori.
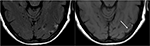
Figura 9. L’immagine T2-FLAIR (a sinistra) in un paziente con ipertensione non controllata e precedente imaging che indica PRES (vedi Figura 6), ora controllata e 6 settimane dopo, dimostra la risoluzione dell’edema precedentemente visto. Piccole aree di gliosi a causa di lesioni sono visibili nel lobo temporale sinistro. T1 assiale senza contrasto mostra necrosi laminare corticale curvilinea correlata alla lesione precedente correlata alla PRES., Mentre PRES generalmente è completamente reversibile, può provocare lesioni permanenti in alcune situazioni.
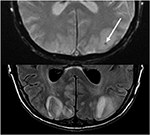
Figura 10. Paziente con un precedente trapianto di fegato su Tacrolimus. T2 gradiente richiamato eco (in alto) dimostra un’area focale di emorragia all’interno dell’edema vasogenico nel lobo occipitale sinistro. T2-FLAIR dimostra il reperto più tipico relativo al PRES con anomalia del segnale nei lobi occipitali bilaterali.,
Trattamento
Il trattamento del PRES è tipicamente finalizzato al controllo dell’eziologia primaria che causa PRES (44). Ad esempio, nei casi di pressione arteriosa elevata, il trattamento ha lo scopo di correggere la pressione sanguigna elevata in un ambiente controllato, simile all’approccio per l’urgenza/ emergenza ipertensiva (45). Tipicamente, si cerca una riduzione non rapida della pressione sanguigna per evitare il rischio di causare una malattia cerebrale ischemica a causa di un drastico abbassamento della pressione sanguigna (46)., Occasionalmente, i farmaci anticonvulsivanti sono usati come terapia aggiuntiva, sebbene l’agente(i) ottimale (i), i tempi e la durata del trattamento rimangano controversi (4) (Figura 11: Prima e dopo).
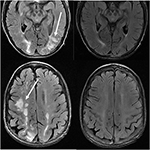
Figura 11. Paziente con anamnesi di mielofibrosi primaria e trapianto di midollo osseo in trattamento con Tacrolimus. Le immagini assiali T2-FLAIR dimostrano le aree di anomalia del segnale nei lobi parietale e occipitale e nel lobo frontale destro (immagini a sinistra)., Il Tacrolimus è stato interrotto e le immagini di follow-up (immagini a destra) sono state ottenute 6 settimane dopo le immagini iniziali.
Nei casi di (pre)eclampsia, il trattamento è finalizzato alla consegna tempestiva del feto, nonché alla gestione della pressione sanguigna e al solfato di magnesio per la profilassi delle convulsioni (47). Nell’ambito della PRES indotta da chemioterapici o altri agenti immunosoppressivi, la riduzione o l’interruzione assoluta del farmaco ha mostrato un miglioramento sia clinico che radiologico (48) (Figura 12: Eclampsia)., L’ipomagnesiemia è un risultato comune in PRES e un possibile fattore eziologico. Quindi, gli autori hanno suggerito che la supplementazione di magnesio può essere un utile complemento nella gestione PRES (49).
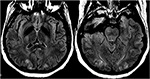
Figura 12. Paziente con eclampsia e con convulsioni. Le immagini assiali T2-FLAIR dimostrano un’anomalia simmetrica del segnale nei lobi occipitali bilaterali.,
Conclusione
PRES è un’entità unica con risultati clinici e neuroradiologici caratteristici, oltre a una miriade di cause ben documentate. Anche se il preciso meccanismo fisiopatologico(s) dietro PRES deve ancora essere chiarito (e in effetti può essere dovuto a una combinazione di processi correlati), il meccanismo generalmente accettato è disfunzione della barriera emato-encefalica con conseguente edema vasogenico con predominanza posteriore-circolazione., Le caratteristiche di imaging sono valutate al meglio su sequenze MR fluide-sensibili che rivelano iperintensioni predominanti della sostanza bianca T2 parieto-occipitale, sebbene molte caratteristiche di imaging atipiche possano essere viste e dovrebbero essere tenute a mente quando si valutano casi impegnativi. Sono disponibili vari strumenti di imaging avanzati per aiutare in casi difficili o equivoci. Il trattamento è finalizzato alla gestione della causa sottostante con particolare attenzione al monitoraggio della pressione arteriosa e all’eventuale profilassi convulsiva.,
Contributi dell’autore
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
1. Bartynski WS. Sindrome da encefalopatia reversibile posteriore, Parte 1: imaging fondamentale e caratteristiche cliniche. Am J Neuroradiol. (2008) 29:1036–42. doi: 10.3174 / ajnr.,A0928
CrossRef Full Text | Google Scholar
3. Bartynski WS. Posterior reversible encephalopathy syndrome, Part 2: controversies surrounding pathophysiology of vasogenic edema. Am J Neuroradiol. (2008) 29:1043–9. doi: 10.3174/ajnr.A0929
CrossRef Full Text | Google Scholar
5. Singer S, Grommes C, Reiner AS, Rosenblum MK, DeAngelis LM. Posterior reversible encephalopathy syndrome in patients with cancer., Oncologist. (2015) 20:806–11. doi: 10.1634/theoncologist.2014-0149
PubMed Abstract | CrossRef Full Text | Google Scholar
6. How J, Blattner M, Fowler S, Wang-Gillam A, Schindler SE. Chemotherapy-associated posterior reversible encephalopathy syndrome: a case report and review of the literature. Neurologist. (2016) 21:112–7. doi: 10.1097/NRL.,0000000000000105
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Habetz K, Ramakrishnaiah R, Raina SK, Fitzgerald RT, Hinduja A. Posterior reversible encephalopathy syndrome: a comparative study of pediatric versus adult patients. Pediatr Neurol. (2016) 65:45–51. doi: 10.1016/j.pediatrneurol.2016.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Fugate JE, Rabinstein AA., Posterior reversible encephalopathy syndrome: clinical and radiological manifestations, pathophysiology, and outstanding questions. Lancet Neurol. (2015) 14:914–25. doi: 10.1016/S1474-4422(15)00111-8
CrossRef Full Text | Google Scholar
9. Zama, D, Gasperini P, Berger M, Petris M, De Pasquale MD, et al. A survey on hematology-oncology pediatric AIEOP centres: the challenge of posterior reversible encephalopathy syndrome. Eur J Haematol. (2018) 100:75–82. doi: 10.1111/ejh.,12984
CrossRef Full Text | Google Scholar
12. Gupta V, Bhatia V, Khandelwal N, Singh P, Singhi P. Imaging findings in pediatric posterior reversible encephalopathy syndrome (PRES): 5 years of experience from a tertiary care center in India. J Child Neurol. (2016) 31:1166–73. doi: 10.1177/0883073816643409
PubMed Abstract | CrossRef Full Text | Google Scholar
13., Hinduja A, Habetz K, Raina S, Ramakrishnaiah R, Fitzgerald RT. Predittori di scarso esito in pazienti con sindrome da encefalopatia reversibile posteriore. Int J Neurosci. (2017) 127:134–44. doi: 10.3109/00207454.2016.1152966
PubMed Abstract | CrossRef Full Text | Google Scholar
15. MacKenzie ET, Strandgaard S, Graham DI, Jones JV, Harper AM, Farrar JK. Effetti dell’ipertensione acutamente indotta nei gatti sul calibro arteriolare piale, sul flusso sanguigno cerebrale locale e sulla barriera emato-encefalica. Circ Res., (1976) 39:33–41. doi: 10.1161/01.RES.39.1.33
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bartynski WS, Zeigler Z, Spearman MP, Lin L, Shadduck RK, Lister J. Etiology of cortical and white matter lesions in Cyclosporin-A and FK-506 neurotoxicity. Am J Neuroradiol. (2001) 22:1901–14.
PubMed Abstract | Google Scholar
21. Bartynski WS, Boardman JF, Zeigler ZR, Shadduck RK, Lister J., Posterior reversible encephalopathy syndrome in infection, sepsis, and shock. Am J Neuroradiol. (2006) 27:2179–90.
PubMed Abstract | Google Scholar
22. Mayama M, Uno K, Tano S, Yoshihara M, Ukai M, Kishigami Y, et al. Incidence of posterior reversible encephalopathy syndrome in eclamptic and patients with preeclampsia with neurologic symptoms. Am J Obstet Gynecol. (2016) 215:239.e1–e5. doi: 10.1016/j.ajog.2016.02.,039
PubMed Abstract | CrossRef Full Text | Google Scholar
23. McKinney AM, Short J, Truwit CL, McKinney ZJ, Kozak OS, SantaCruz KS, et al. Posterior reversible encephalopathy syndrome: incidence of atypical regions of involvement and imaging findings. Am J Roentgenol. (2007) 189:904–12. doi: 10.2214/AJR.07.2024
PubMed Abstract | CrossRef Full Text | Google Scholar
24., de Havenon A, Joos Z, Longenecker L, Shah L, Ansari S, Digre K. Posterior reversible encephalopathy syndrome with spinal cord involvement. Neurology. (2014) 83:2002–6. doi: 10.1212/WNL.0000000000001026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Dandoy CE, Linscott LL, Davies SM, Leach JL, Myers KC, El-Bietar J, et al., Clinical utility of computed tomography and magnetic resonance imaging for diagnosis of posterior reversible encephalopathy syndrome after stem cell transplantation in children and adolescents. Biol Blood Marrow Transplant. (2015) 21:2028–32. doi: 10.1016/j.bbmt.2015.07.023
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Noda K, Fukae J, Fujishima K, Mori K, Urabe T, Hattori N, et al., Reversible cerebral vasoconstriction syndrome presenting as subarachnoid hemorrhage, reversible posterior leukoencephalopathy, and cerebral infarction. Intern Med. (2011) 50:1227–33. doi: 10.2169/internalmedicine.50.4812
CrossRef Full Text | Google Scholar
31. Doelken M, Lanz S, Rennert J, Alibek S, Richter G, Doerfler A, et al. Differentiation of cytotoxic and vasogenic edema in a patient with reversible posterior leukoencephalopathy syndrome using diffusion-weighted MRI. Diagn Interv Radiol., (2007) 13:125–8.
Google Scholar
32. Wartenberg KE, Parra A. CT and CT-perfusion findings of reversible leukoencephalopathy during triple-H therapy for symptomatic subarachnoid hemorrhage-related vasospasm. J Neuroimaging. (2006) 16:170–5. doi: 10.1111/j.1552-6569.2006.00031.x
CrossRef Full Text | Google Scholar
33. Vanacker P, Matias G, Hagmann P, Michel P., Cerebral hypoperfusion in posterior reversible encephalopathy syndrome is different from transient ischemic attack on CT perfusion. J Neuroimaging. (2015) 25:643–6. doi: 10.1111/jon.12158
CrossRef Full Text | Google Scholar
34. Lee SY, Kim SH, Lee SH, Baek HJ, Shon HS, Kim SS. Serial MR spectroscopy in relapsing reversible posterior leukoencephalopathy syndrome. Neurologist. (2009) 15:338–41. doi: 10.1097/NRL.,0b013e3181914af6
PubMed Abstract | CrossRef Full Text | Google Scholar
35. McKinney AM, Sarikaya B, Gustafson C, Truwit CL. Detection of microhemorrhage in posterior reversible encephalopathy syndrome using susceptibility-weighted imaging. Am J Neuroradiol. (2012) 33:896–903. doi: 10.3174/ajnr.A2886
PubMed Abstract | CrossRef Full Text | Google Scholar
38., Il sito utilizza cookie tecnici e di terze parti per migliorare la tua esperienza di navigazione. Criteri diagnostici PML: dichiarazione di consenso dalla sezione di malattia neuroinfettiva AAN. Neurologia. (2013) 80:1430-8. doi: 10.1212 / WNL.0b013e31828c2fa1
PubMed Abstract | CrossRef Full Text/Google Scholar
39. Aracki-Trenkić E, Stojanov D, Trenkić M, Radovanovic Z, Ignjatovic J, Ristic S, et al., Atypical presentation of posterior reversible encephalopathy syndrome: clinical and radiological characteristics in eclamptic patients. Bosn J Basic Med Sci. (2016) 16:180–6. doi: 10.17305/bjbms.2016.1201
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Bartynski WS, Boardman JF. Distinct imaging patterns and lesion distribution in posterior reversible encephalopathy syndrome. Am J Neuroradiol. (2007) 28:1320–7. doi: 10.3174/ajnr.,A0549
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Brickman AM, Reitz C, Luchsinger JA, Manly JJ, Schupf N, Muraskin J, et al. Long-term blood pressure fluctuation and cerebrovascular disease in an elderly cohort. Arch Neurol. (2010) 67:564–9. doi: 10.1001/archneurol.2010.70
PubMed Abstract | CrossRef Full Text | Google Scholar
47., Cozzolino M, Bianchi C, Mariani G, Marchi L, Fambrini M, Mecacci F. Therapy and differential diagnosis of posterior reversible encephalopathy syndrome (PRES) during pregnancy and postpartum. Arch Gynecol Obstet. (2015) 292:1217–23. doi: 10.1007/s00404-015-3800-4
PubMed Abstract | CrossRef Full Text | Google Scholar
48. Masetti R, Cordelli DM, Zama D, Vendemini F, Biagi C, Franzoni E, et al. PRES in children undergoing hematopoietic stem cell or solid organ transplantation. Pediatrics., (2015) 135:890–901. doi: 10.1542/peds.2014-2325
CrossRef Full Text | Google Scholar