Introduzione
stafilococchi Coagulasi-negativi (CoNS), i membri del stafilococchi gruppo, sono caratterizzate da cocchi Gram-positivi, presentato come cellule singole o irregolare disposizione, e sono immobili, non sporigeni, catalasi-positivo, principalmente anaerobi facoltativi, e la mancanza dell’enzima coagulasi.,1 CONTRO fanno parte del microbiota umano, considerati patogeni opportunisti, causando infezioni soprattutto nei bambini prematuri e nei pazienti immunocompromessi e protesici.2
L’aumento della resistenza antimicrobica negli ultimi anni ha avuto un grande impatto sulle infezioni ospedaliere causate da CONS. L’oxacillina è una penicillina semisintetica utilizzata nel test di suscettibilità per la rilevazione della resistenza alla meticillina e il trattamento delle infezioni da stafilococco. Tuttavia, tassi da 66% a 95% di resistenza all’oxacillina sono stati osservati in isolati clinici CoNS.,2 La resistenza all’oxacillina è spesso mediata dal gene mecA, che codifica una proteina supplementare legante la penicillina (PBP2a) con bassa affinità alle penicilline semisintetiche.3 Il gene mecA si trova su un elemento genetico mobile noto come Cromosoma a cassetta stafilococcico mec (SCCmec) che contiene il complesso mec, composto dal gene mecA e dai suoi geni regolatori mecI e mecRI, il complesso ccr, responsabile dell’integrazione e dell’escissione del SCCmec, e la regione J, che non è essenziale per la formazione del SCCmec, ma può trasportare geni di resistenza non β-lattamici.,4 Ad oggi sono stati descritti 13 tipi SCCmec, basati sulla combinazione di tipi complessi di geni ccr e classi complesse di geni mec. I sottotipi sono stati definiti da polimorfismi della regione J nella stessa combinazione di complessi mec e ccr.5
L’emergere di isolati resistenti all’oxacillina ha portato all’uso finale di antimicrobici alternativi per il trattamento delle infezioni da CoNS, come il glicopeptide vancomicina. Nel frattempo, negli ultimi decenni sono state riportate descrizioni di ridotta suscettibilità e resistenza alla vancomicina.,6 La ridotta suscettibilità alla vancomicina può essere correlata a modificazioni metaboliche come l’accelerazione nella sintesi dei peptidoglicani, con conseguente ispessimento della parete cellulare. In questo processo, la vancomicina non è in grado di inibire la sintesi del peptidoglicano, poiché è esaurita a causa della maggiore disponibilità di siti di D-alanil-D-alanina.,7
Data la recrudescenza delle infezioni ospedaliere causate da CoNS, questo studio mirava a caratterizzare i ceppi resistenti all’oxacillina e determinare la suscettibilità antimicrobica di una raccolta di 20 anni di emocolture CoNS isolati da pazienti ricoverati nell’ospedale di Botucatu das Clínicas.
Materiale e metoditreni
Trecento ceppi di CONS sono stati isolati da emocolture da pazienti ricoverati dell’Ospedale di Botucatu das Clínicas-Paulista State University (UNESP)., Gli isolati sono stati raccolti dal 1990 al 2009 e conservati nel Laboratorio di raccolta delle colture del Dipartimento di microbiologia e Immunologia dell’Istituto di Bioscienze Botucatu – UNESP. I criteri di selezione hanno considerato una prevalenza media degli eventi del 35%, con un margine di errore del 5% e un intervallo di confidenza del 95%.
I ceppi sono stati isolati secondo Koneman et al.8 Isolati di agar-sangue sono stati sottoposti a macchia di gram per l’osservazione della morfologia delle colonie e il test di catalasi è stato eseguito per la conferma del genere Staphylococcus., I ceppi di stafilococco sono stati sottoposti al test della coagulasi per la differenziazione dei gruppi coagulasi-negativi e coagulasi-positivi. Gli isolati coagulasi-negativi sono stati sottoposti a test biochimici per l’identificazione fenotipica delle specie. L’identificazione genotipica è stata eseguita utilizzando primer disegnati su sequenze conservate adiacenti ai geni 16S e 23S, mediante ITS-PCR (internal transcribed spacer–polymerase chain reaction), descritto da Couto et al.9 L’efficienza di amplificazione è stata monitorata mediante elettroforesi in agarosio metaforico al 3% e macchiata con SYBR Safe., The following lineages of international reference were used: S. auricularis ATCC 33753, S. capitis subsp. capitis ATCC 27843, S. capitis subsp. urealyticus ATCC 49325, S. caprae ATCC 35538, S. cohnii ATCC 49330, S. cohnii subsp. cohnii ATCC 29974, S. epidermidis ATCC 12228, S. epidermidis ATCC 35983, S. hemolyticus ATCC 29970, S. hominis ATCC 27844, S. hominis subsp. novobiosepticus ATCC 700237, S. lentus ATCC 700403, S. lugdunensis ATCC 700328, S. saprophyticus ATCC 15305, S. schleiferi subsp. schleiferi ATCC 43808, S. sciuri subsp. sciuri ATCC 29062, S. simulans ATCC 27851, S., xylosus ATCC 29979, e S. warneri ATCC 10209.
Estrazione del DNA
Il kit Illustra (GE Healthcare) è stato utilizzato per l’estrazione del DNA. I passaggi includevano una digestione iniziale di cellule stafilococciche con lisozima (10 mg/mL) e proteinasi K (20 mg/mL). Successivamente, 500µL del tampone di estrazione sono stati aggiunti alla miscela, che è stata centrifugata a 10.000 x g per 4 minuti. Il surnatante è stato trasferito su una colonna e centrifugato a 5.000 g per 1 minuto. Il fluido è stato scartato e 500µL di tampone di estrazione sono stati aggiunti alla colonna., Dopo la centrifugazione e lo scarto del fluido raccolto, 500µL di tampone di lavaggio sono stati aggiunti alla colonna, che è stata sottoposta a centrifugazione a 20.000 g per 3 minuti. Successivamente la colonna è stata trasferita in un tubo da 1,5 ml e l’eluizione è stata eseguita utilizzando 200µL di acqua MilliQ riscaldata a 70°C.
La PCR di rilevamento del gene mecA
è stata eseguita per la rilevazione del gene mecA. Le reazioni sono state eseguite utilizzando un protocollo descritto da Murakami et al.10 L’efficienza di amplificazione è stata monitorata mediante elettroforesi in un gel di agarosio al 2% macchiato con SYBR Safe.,
Determinazione di SCCmec
Il tipo di SCCmec è stato determinato su ceppi mecA-positivi. Le reazioni sono state eseguite utilizzando un protocollo descritto da Oliveira et al.11 e modificato da Machado et al.12
La PCR multiplex è stata eseguita in 50µL di volume di reazione con 1X tampone enzimatico, 1.,25 U Taq polymerase DNA, 200 μM dNTP Mix, and the following primers: 10pmol of RIF2 F2 (TTCGAGTTGCTGATGAAGAAGG) and CIF2 R2 (ATTTACCACAAGGACTACCAGC), 6pmol of KDP F1 (AATCATCTGCCATTGGTGATGC) and KDP R1 (CGAATGAAGTGAAAGAAAGTGG), 5pmol of DCS F2 (CATCCTATGATAGCTTGGTC) and DSC R1 (CTAAATCATAGCCATGACCG), 5pmol of RIF4 F3 (GTGATTGTTCGAGATATGTGG), and RIF4 R9 (CGCTTTATCTGTATCTATCGC). For each reaction, 10μL DNA was added. The cycle sequencing reactions were performed at 92°C for 3min, followed by 30 cycles of 92°C for 1min, 56°C for 1min, and 72°C for 1min and 30s., L’efficienza di amplificazione è stata monitorata mediante elettroforesi in un gel di agarosio al 2% colorato con SYBR Safe.
Determinazione della concentrazione inibitoria minima (MIC) mediante E-test
La suscettibilità in vitro dei ceppi CoNS è stata testata per i seguenti antimicrobici: Oxacillina, Vancomicina, Daptomicina, Linezolid, Quinupristina/Dalfopristina e Tigeciclina. Il MIC di questi farmaci è stato determinato dall’E-test. I criteri utilizzati per la classificazione di suscettibilità erano: Oxacillina
µg / mL (suscettibile) per CONTRO, eccetto S., lugdunensis (suscettibili ≤2µg/mL e resistente ≥4µg/mL), Vancomicina µg/mL (suscettibili), 8–16µg/mL (intermedio resistente), e >32µg/mL (resistente); Linezolid ≤4µg/mL (sensibili); Daptomicina ≤1µg/mL; Quinupristin/Dalfopristina ≤1µg/mL (suscettibili), 2µg/mL (intermedio), e ≥4µg/mL (resistente); La tigeciclina ≤0.5 µg/mL.,13Screening test per la rilevazione di ridotta suscettibilità alla vancomicina
Al fine di rilevare una ridotta suscettibilità alla vancomicina, è stato utilizzato un test di screening agar preparato con Brain Heart Infusion (BHI) Agar e 4µg/mL, 6µg/mL, 8µg/mL e 16µg/mL di vancomicina. Il ceppo di riferimento S. aureus ATCC 29213, suscettibile alla vancomicina, è stato utilizzato come controllo negativo e il ceppo E. faecalis ATCC 51299, resistente alla vancomicina, come controllo positivo. Macchie di un 2.,0 McFarland inoculum sono stati aggiunti alla piastra di Agar e incubati a 35°C per 24h, e la crescita di almeno una colonia è stata considerata un risultato positivo.
Analisi dello spessore della parete cellulare
I ceppi CoNS che presentavano una ridotta suscettibilità alla vancomicina sono stati sottoposti alla microscopia elettronica a trasmissione per l’analisi dello spessore della parete cellulare. I ceppi sono stati coltivati in brodo BHI e incubati a 37° C per 24h. In un microtubo, 1000µL di un brodo di coltura CoNS sono stati centrifugati per un minuto a 12.000 giri / min. Dopo aver scartato il surnatante, i ceppi sono stati fissati in una soluzione di Karnovsky (2.,5% glutaraldeide in tampone fosfato 0,1 M) per quattro ore. I campioni sono stati rimossi dal fissatore e lavati tre volte per cinque minuti in acqua distillata. Successivamente i campioni sono stati immersi in tetrossido di osmio allo 0,5% per 40 minuti, prima di essere lavati tre volte per 10 minuti in acqua distillata. I campioni sono stati disidratati usando concentrazioni crescenti di alcol: due volte per 10min in 7.,alcool di 5%; due volte per 10min in alcool di 15%; due volte per 10min in alcool di 30%; due volte per 10min in alcool di 50%; tre volte per 15min in alcool di 70%; due volte per 15min in alcool di 90%; due volte per 10min in alcool di 100%. Dopo la disidratazione gli stub sono stati montati e i campioni metallizzati. Le analisi sono state eseguite in una microscopia elettronica Tecnai Spirit Fei Company e le immagini sono state ottenute con un ingrandimento di 30000×.,
risultatidentificazione di isolati
La Tabella 1 presenta la fonte degli isolati di specie CoNS, nonché i dati demografici dei pazienti con batteriemia.
Rilevamento del gene mecA e caratterizzazione di SCCmec Determinazione della concentrazione inibitoria minima (MIC)
I MIC degli antimicrobici utilizzati per il trattamento delle infezioni da CoNS sono stati determinati dall’E-test. La resistenza all’oxacillina è stata riscontrata in 206 ceppi CONTRO (68,7%) e in 25 ceppi resistenti alla tigeciclina (8,3%). La resistenza alla tigeciclina è stata rilevata nel 4,5% di S. epidermidis, nel 13,8% di S. hemolyticus, nel 13% di S., hominis, e l ‘ 11,1% di S. lugdunensis. Per la quinupristina/dalfopristina, un isolato di S. epidermidis ha presentato una resistenza intermedia con un MIC di 2µg/mL e uno S. epidermidis e uno S. hemolyticus con MICROFONI di 3µg / mL. La sensibilità e la specificità del MIC oxacillin dall’E-test rispetto alla presenza di mecA erano, rispettivamente, 87.4% e 82.3%.
Per quanto riguarda le specie CoNS, la distribuzione dei parametri di MIC50 e MIC90 ha rivelato alti tassi di resistenza all’oxacillina in S. hemolyticus., Questa era l’unica specie CONTRO per la quale la concentrazione minima per inibire il 50% degli isolati era >256µg/mL, riflettendo l’alto tasso di resistenza di S. hemolyticus all’oxacillina (Tabella 3).
La gamma MIC di ciascun antimicrobico è stata confrontata con il tipo SCCmec. Gli isolati tipizzati come SCCmecI presentavano MICROFONI tigeciclina più alti e quelli classificati come SCCmecII presentavano i MICROFONI oxacillin più alti. I ceppi SCCmecIV hanno mostrato i più alti valori MIC per vancomicina, linezolid, daptomicina e quinupristina/dalfopristina (Tabella 4).
Determination of the MIC range according to SCCmec.
| MIC range (μg/ml) | ||||
|---|---|---|---|---|
| Antimicrobial | SCCmec I | SCCmec II | SCCmec III | SCCmec IV |
| Oxacillin | 0.094≥256 | 6≥256 | 0.,125≥256 | 0.125≥256 |
| Vancomycin | 0.25–2 | 0.38–2 | 0.125–2 | 0.75–2 |
| Linezolid | 0.064–1 | 0.19–0.5 | 0.047–0.75 | 0.064–1 |
| Daptomycin | 0.016–025 | 0.016–0.094 | 0.019–0.5 | 0.047–0.75 |
| Quinupristin/Dalfopristin | 0.025–1.5 | 0.094–0.5 | 0.064–1 | 0.125–2 |
| Tigecycline | 0.016–2 | 0.023–0.75 | 0.016–0.75 | 0.,032-1 |
MIC, Concentrazione inibitoria minima.
È stata eseguita una valutazione dei MIC di oxacillina e vancomicina per un periodo di 20 anni, suddivisi in tre periodi di tempo in base alla distribuzione degli intervalli MIC di oxacillina e vancomicina. Per l’oxacillina, nel primo periodo (1990-2001), sono stati osservati valori più elevati di MIC, ma che indicano ancora la suscettibilità., Negli altri periodi (2002-2006 e 2007-2009), è stata osservata una diminuzione dei valori MIC, che indica ancora la suscettibilità, nonché un aumento dei tassi di resistenza. Per quanto riguarda la vancomicina, la stessa valutazione ha dimostrato differenze significative nei tre periodi tra ceppi con MIC da 0,047 µg/mL a 0,38 µg/mL e da 0,5 µg/mL a 2,0 µg/mL (Fig. 1).
Determinazione della ridotta suscettibilità alla vancomicina
È stata osservata una crescita di 214 (71,3%) ceppi sulla piastra BHI con 4µg/mL di vancomicina, 89 (29,7%) sulla piastra con 6µg/mL di vancomicina e 8 (2.,6%) isolati sulla piastra di vancomicina da 8µg/mL. Nessuno degli isolati è cresciuto nel mezzo con 16µg / mL di vancomicina. Non ci sono state differenze significative nelle MIC tra i ceppi che non presentavano crescita sulla piastra integrata con vancomicina e quelli che crescevano sulla piastra di vancomicina da 4µg/mL. Tra quelli che hanno mostrato una crescita sul mezzo con 6µg / mL di vancomicina, la gamma MIC era 0.5–2µg/mL. Tra quelli che sono cresciuti su 8µg / mL di vancomicina, la gamma MIC era 0.75–24µg/mL. I ceppi coltivati su 8µg / mL di vancomicina erano quattro S. epidermidis, uno S. hemolyticus, due S. hominis e uno S., capitis, tutti resistenti all’oxacillina, e S. epidermidis e S. capitis sono portatori di SCCmec III, S. hominis di SCCmec I e S. hemolyticus con SCCmec non tipizzato.
Analisi dello spessore della parete cellulare di ceppi con ridotta suscettibilità alla vancomicina
Lo spessore della parete cellulare sotto divisione cellulare è stato misurato in otto ceppi (i valori sono presentati in nanometri, media±SD). I quattro ceppi di S. epidermidis presentavano valori medi di 21.66±1.4, 20.12±0.9, 24.24±1.3, e 14,20±1,3 nm. L’isolato di S. hemolyticus ha mostrato uno spessore della parete cellulare di 24,88±1,7 nm. Per la S., isolato capitis, lo spessore della parete cellulare era 19,33±1,8, e per i due isolati di S. hominis i valori erano 17,68±2,1 e 24,92±1,5. Per confronto, i ceppi di riferimento utilizzati S. epidermidis ATCC 12228 e S. hemolyticus ATCC29970 hanno mostrato spessori della parete cellulare rispettivamente di 14,61±1,2 e 14,73±0,7 nm. Il confronto dei ceppi studiati con i controlli ha mostrato valori più elevati, che vanno da 17nm a 24,92 nm, ad eccezione di un isolato di S. epidermidis, che presentava un valore inferiore rispetto ai controlli (Fig. 2).,
Contro batteriemia evolution
La possibile evoluzione della batteriemia ad altre infezioni, come sepsi, polmonite, infezioni del tratto urinario, meningite, peritonite, enterocolite necrotizzante, onfalite e ascesso cerebrale, è stata seguita in 52 pazienti ricoverati nei reparti neonatali. Di questi, in 25 (46,3%) pazienti gli stessi CONS isolati dalla emocoltura sono stati confermati come l’agente eziologico dell’infezione. In sei (11,1%), i CONTRO erano il possibile agente di infezione e in 23 (42,6%) i CONTRO non erano correlati all’infezione del paziente (Fig. 3).,
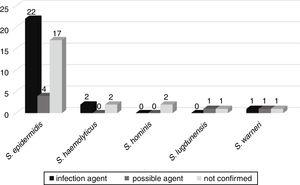
Correlazione dei CoNS isolati dalle emocolture come possibili agenti eziologici delle infezioni causate nei pazienti dell’unità neonatale.
Il gene mecA è stato rilevato in 33 (61,1%) di questi CONTRO, con 20 (60,6%) CONTRO associati a infezioni più gravi o possibili agenti di queste infezioni.
Discussione
I CONTRO sono considerati una delle principali cause di batteriemia., L’importanza di questi batteri è aumentata nell’ambiente ospedaliero negli ultimi anni, principalmente a causa della resistenza antimicrobica. Nel presente lavoro, sono stati studiati 300 ceppi contro isolati da emocolture di pazienti ricoverati presso l’ospedale di cliniche di Botucatu, per un periodo di 20 anni. Questi isolati sono stati caratterizzati per quanto riguarda la loro suscettibilità antimicrobica.
Il rilevamento mecA ha determinato la resistenza all’oxacillina nel 78,5% dei CONTRO e il valore MIC50 (2µg / mL) era indicativo di resistenza a questo farmaco, confermando la bassa suscettibilità di questi batteri agli agenti β–lattamici., Lavori precedenti hanno dimostrato che dal 1970 gli isolati CONTRO hanno presentato tassi di resistenza all’oxacillina più elevati rispetto a S. aureus.14,15 È stato dimostrato che i tassi di resistenza al β-lattamico variano dal 65% al 95% negli ospedali in Brasile e in altri paesi.2,16,17 I più alti tassi di resistenza all’oxacillina sono stati trovati in S. epidermidis, seguito da S. hemolyticus, S. hominis e S. capitis. Risultati simili sono stati descritti in studi precedenti, che hanno mostrato resistenza all’oxacillina nel 97% di S. epidermidis tra il 1999 e il 2001 in un’unità di terapia intensiva neonatale (NICU),18 nel 96% di S., hemolyticus isolato in Brasile, 19 e nel 100% di S. hominis isolato in una NICU dalla Spagna.20 Per quanto riguarda S. capitis, risultati discrepanti sono stati trovati negli studi condotti da Caierão et al.21
Sebbene a una frequenza inferiore, il gene mecA è stato rilevato in S. warneri e S. lugdunensis. S. warneri è stato descritto con tassi di 33.3% di resistenza all’oxacillina in NICUs,22 e la prima descrizione di mecA in S. lugdunensis è stata nello studio condotto da Kawaguchi et al.23 Nonostante i bassi tassi di resistenza, 24 determinazione della suscettibilità antimicrobica di S., lugdunensis è importante, non solo per le sue implicazioni cliniche, poiché questa specie è la più aggressiva dei CONTRO, ma anche per l’istituzione di un trattamento precoce con antimicrobici adeguati e buoni risultati clinici.25
La caratterizzazione del SCCmec ha mostrato la presenza di tipi I-IV negli isolati, con SCCmecIII che è il più frequentemente rilevato nei ceppi studiati, principalmente in S. epidermidis, l’unica specie che ha portato il tipo IV., SCCmec tipo III è il più grande di tutti, codifica per diversi geni associati alla resistenza ed è il CONTRO più comunemente isolato da campioni ospedalieri. S. epidermidis è il principale colonizzatore della pelle umana e il più comunemente rilevato nei siti di infezione. La pressione selettiva nell’ambiente ospedaliero porta alla diffusione di ceppi SCCmec III, che sono associati a gravi infezioni.26 SCCmec tipo IV è stato correlato con Staphylococcus spp associato in comunità., ed è stato descritto per la prima volta in un ceppo di S. epidermidis, un fatto che implica il suo transfert da S., epidermidis a S. aureus. Un trasferimento di costo ridotto di SCCmec IV a causa delle sue piccole dimensioni porterebbe probabilmente ad una maggiore incidenza di infezioni causate da portatori di SCCmec IV.12,27 SCCmecII ha presentato un’associazione con S. hemolyticus, simile ai risultati di Machado et al., 12 il cui lavoro ha rilevato solo il tipo II in questa specie.
L’alternativa per il trattamento degli stafilococchi resistenti all’oxacillina è la vancomicina, un glicopeptide usato per la prima volta nel 1958 nelle infezioni invasive. Ci sono, tuttavia, descrizioni di resistenza e ridotta suscettibilità a questo farmaco,6 anche se instabile.,28 I risultati del lavoro attuale hanno mostrato che, ad eccezione dell’oxacillina, la vancomicina era il farmaco con i valori più alti di MIC50 e MIC90. Nonostante la piena suscettibilità della raccolta, i valori MIC sono stati i più alti nel periodo di 20 anni e una ridotta suscettibilità è stata rilevata in alcuni ceppi di S. epidermidis, S. hemolyticus, S. hominis e S. capitis. Negli studi condotti da Natoli et al., 29 ridotta suscettibilità alla vancomicina è stata rilevata con una frequenza del 5,4% tra gli isolati CoNS, nelle specie S. epidermidis e S. hemolyticus., Secondo gli stessi autori, le colonie di Staphylococcus coltivate su vancomicina agar possono portare a eteroresistenza glicopeptidica, che può essere un precursore della resistenza glicopeptidica, causando infezioni complicate e fallimento del trattamento. Questo dovrebbe essere preso in considerazione nelle decisioni terapeutiche.30
L’aumento della percentuale di CONTRO resistenti all’oxacillina e la diminuzione della loro suscettibilità alla vancomicina sottolineano l’importanza degli studi che coinvolgono altre scelte terapeutiche., Tigeciclina, una glicilciclina semisintetica ad ampio spettro gram-positiva e negativa, è considerata un farmaco con un’eccellente attività contro i CONTRO sensibili e resistenti all’oxacillina,14,29 nonostante i nostri dati mostrino tassi di 8,3% di resistenza, più spesso in S. hemolyticus, seguito da S. hominis, S. lugdunensis e S. epidermidis. Risultati MIC90 simili sono stati descritti per tigeciclina, senza alcuna differenza tra CONTRO resistenti all’oxacillina e sensibili.31 Negli studi condotti da Natoli et al.29 tigeciclina ha dimostrato una buona attività contro i CONTRO., Secondo questi autori, la tigeciclina non è raccomandata per il trattamento della batteriemia e il suo uso dovrebbe essere limitato al fine di preservare l’attività contro i batteri Gram-negativi multi-resistenti. Le mutazioni nel gene ribosomiale S10 e nei geni rpsJ e mepA sembrano essere associate alla resistenza alla tigeciclina.32,33
La quinupristina / dalfopristina è una streptogramina appartenente al gruppo macrolide-lincosamide-streptogramina., La combinazione di quinupristina e dalfopristina è sinergica e di solito battericida quando questi agenti vengono confrontati singolarmente o confrontati con antimicrobici macrolidici simili.34 In questo lavoro, pur presentando un’eccellente efficacia nella maggior parte dei CONTRO studiati, la resistenza intermedia a questo farmaco è stata rilevata in due S. epidermidis e uno S. hemolyticus. Nello studio condotto da Mendes et al., 35 quinupristin/dalfopristin hanno dimostrato l’efficacia eccellente per CONTRO, i ceppi erano completamente sensibili, con valori MIC90 di 0.38 µg / mL per i ceppi sensibili all’oxacillina e 0.,75µg / mL per i ceppi resistenti all’oxacillina. Inoltre, Venkatesh et al.36 ha descritto una buona efficacia di quinupristin / dalfopristin per ceppi resistenti e sensibili all’oxacillina.
La daptomicina, un antimicrobico studiato per decenni, è stata rimessa in uso nel 2006, per il trattamento della batteriemia e dell’endocardite causata dallo stafilococco.37 Nel presente studio, la daptomicina ha mostrato un’eccellente efficacia per gli isolati CONTRO, con bassi valori di MIC50. Olivares et al.37 ha inoltre verificato la suscettibilità di tutti i CONTRO alla daptomicina, con una bassa variazione dei valori MIC., In un lavoro che studia 1126 CONTRO, condotto da Critchley et al., 38 daptomicina era attiva su un intervallo MIC da 0,015 a 2,0 µg / mL e il MIC90 era 0,5 µg / mL. Secondo questi autori, gli agenti più attivi in queste analisi erano daptomicina e quinupristin / dalfopristin, che sottolinea la rilevanza di questi antimicrobici nel trattamento delle infezioni causate da CONS.
Linezolid, un oxazolidinone sintetico potenzialmente attivo contro diversi batteri, è un altro farmaco che ha dimostrato una buona efficacia contro i CONTRO.,39 Linezolid è diventato importante per il trattamento terapeutico delle infezioni croniche da parte dei CONTRO, nonostante la descrizione della resistenza. In Brasile, il primo caso di resistenza ai linezolidi è stato descritto nel 2006, su un isolato clinico di MRSA40 e, tra i CONTRO, in S. epidermidis, S. hominis e S. hemolyticus.41 Nel lavoro condotto da Olivares et al., 37 nonostante il rilevamento di sette ceppi resistenti linezolid, questo farmaco ha presentato valori MIC efficaci nei ceppi CoNS. D’altra parte, un focolaio di S resistente ai linezolidi., sono stati riportati cloni epidermidis contenenti mutazioni nelle proteine ribosomiali L3 e L4, così come il plasmide cfr, recentemente identificato in Francia.42
S. hemolyticus era la specie che presentava i più alti valori MIC di oxacillina e concentrazioni superiori a 256µg / mL erano necessarie per inibire il 50% degli isolati. Così come per l’oxacillina, questa specie ha presentato valori MIC più elevati per tigeciclina e la maggior parte degli antimicrobici testati. Diversi lavori mostrano alti tassi di resistenza agli antimicrobici utilizzati per il trattamento delle infezioni causate da S., emolitico, in particolare meticillina e glicopeptidi. Alcuni autori descrivono un’alta prevalenza di geni che codificano la resistenza agli agenti β-lattamici e aminoglicosidici,nonché una percentuale significativa di isolati con valori MIC vicini al punto di interruzione della resistenza,43, 44 sottolineando l’importanza di S. hemolyticus come agente patogeno multiresistente.
L’associazione della gamma MIC con i tipi SCCmec ha dimostrato MIC più elevati per vancomicina, linezolid, daptomicina e quinupristina/dalfopristina in S. epidermidis portatori di SCCmecIV., I geni legati alla resistenza a questi antimicrobici sono mediati da plasmidi, trovati principalmente in ceppi resistenti alla meticillina con origine ospedaliera.45 SCCmec IV è caratteristico degli isolati comunitari, soprattutto a causa delle sue dimensioni e del basso costo adattivo. Gli studi suggeriscono che l’acquisizione di geni di resistenza ha origine non clinica ambientale, data l’elevata diversità dei portatori di geni di resistenza nell’ambiente naturale.46,47 Inoltre, SCCmecIV è stato rilevato solo in S. epidermidis, che come la specie più comune nella pelle umana è la più influenzata dalla pressione selettiva., I MIC più alti rispetto ad altri antimicrobici possono anche essere correlati alla pressione selettiva, poiché il livello di esposizione a questi farmaci nell’ambiente ospedaliero pregiudicherebbe la selezione di una ridotta suscettibilità e ceppi resistenti, poiché sono necessari diversi eventi di mutazione, ricombinazione genetica e modifiche nella fisiologia microbica per generare cambiamenti fenotipici.,48
Modifiche metaboliche e fisiologiche relative alla pressione selettiva potrebbero essere osservate in ceppi coltivati su 8µg / mL di vancomicina agar, poiché l’ispessimento della parete cellulare è stato trovato nella maggior parte degli isolati CoNS a causa dell’aumentata sintesi di peptidoglicano. Questo meccanismo è più vantaggioso per i CONTRO rispetto all’acquisizione del van operon, che è un mediatore della resistenza alla vancomicina. L’operone van viene acquisito per trasferimento genico orizzontale e la sua espressione viene stimolata solo in presenza di glicopeptide., Questo stimolo provoca un costo adattativo molto alto in presenza di vancomicina, essendo svantaggioso per i CONTRO in un mezzo di vancomicina.48,49 Per quanto riguarda l’acquisizione di altri geni di resistenza in CoNS, come il gene mecA, il costo adattativo iniziale è ammorbidito da mutazioni aggiuntive compensative per i “costi”di resistenza. Recentemente, mutazioni puntuali in geni come vraR hanno dimostrato di essere associate a una ridotta suscettibilità alla vancomicina e all’ispessimento della parete cellulare negli stafilococchi.,50
Il presente studio ha mostrato un alto tasso di batteriemia causata da CONTRO in unità neonatali e pediatriche, coinvolgendo bambini al di sotto di un anno di età, i principali agenti sono S. epidermidis, S. hemolyticus, S. hominis, S. lugdunensis e S. warneri. S. capitis non sono stati isolati in queste unità, essendo agenti di batteriemia negli adulti ricoverati nel reparto di medicina interna, gastroenterologia, neurologia e pronto soccorso.,
Poiché lo studio ha coinvolto batteriemia causata da stafilococchi isolati per più di 30 anni, gran parte dei dati associati alle cartelle cliniche dei pazienti non è stato possibile recuperare, quindi non è stato possibile associare l’esito dell’infezione di tutti i pazienti, che è una limitazione dello studio attuale. I dati ottenuti da pazienti in unità neonatali hanno indicato l’importanza clinica della batteriemia CONTRO, che può progredire verso malattie che richiedono cure specialistiche.
La conoscenza della resistenza antimicrobica è di grande importanza per il corretto trattamento delle infezioni causate da CONS., Inoltre, i fattori di virulenza di questi batteri e l’immunità dei pazienti sono fattori che contribuiscono alla capacità del microrganismo di causare infezioni più gravi.
I risultati del nostro studio durato 20 anni hanno mostrato un’alta frequenza di resistenza antimicrobica nei CONTRO, che riflette l’uso eccessivo di questi farmaci., Oltre alle modifiche metaboliche e fisiologiche che potrebbero portare a una ridotta suscettibilità agli antimicrobici, la loro condizione di batteri commensali umani li rende trasportatori ideali e un serbatoio efficiente di geni di resistenza, in particolare gli elementi a basso costo, come SCCmec.45 Gli antimicrobici che hanno prodotto i migliori risultati devono essere utilizzati in modo da preservarne l’efficacia e prevenirne la resistenza.,
Conflitti di interesse
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.