13 aprile 2017, dall’NCI Personale
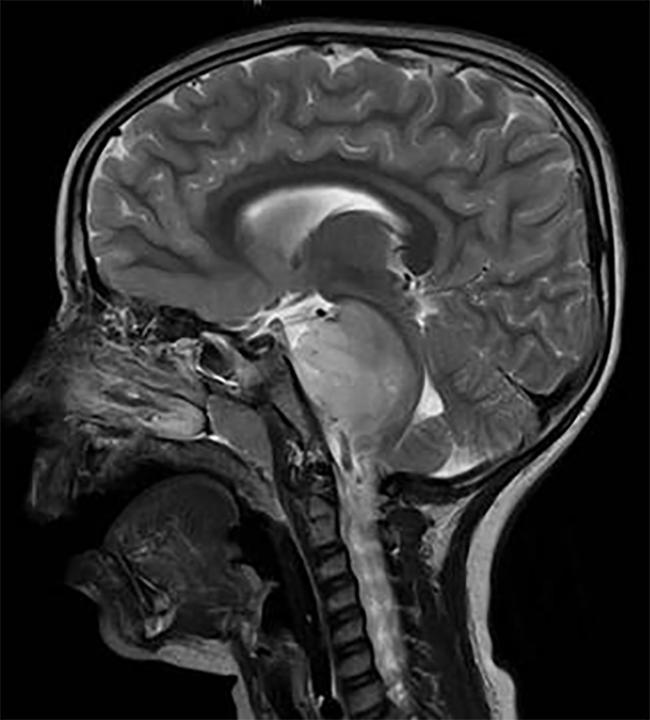
scansione Cerebrale di un bambino con un DIPG tumore, che si trova nel tronco cerebrale.
Due studi separati hanno identificato potenziali bersagli terapeutici in un tumore cerebrale pediatrico inoperabile, glioma pontino intrinseco diffuso (DIPG). Il blocco di questi obiettivi con farmaci sperimentali ha rallentato la crescita tumorale nei modelli animali di DIPG.
DIPG, un tumore che si trova nel tronco cerebrale, è quasi uniformemente fatale.,
“Come neurooncologo pediatrico, è uno dei tumori più devastanti che vediamo”, ha detto Pratiti Bandopadhayay, M. B. B. S., Ph. D., del Dana-Farber / Boston Children’s Cancer and Blood Disorders Center, che non è stato coinvolto negli studi. “Non abbiamo trattamenti curativi per questi tumori.”
Mentre la maggior parte dei tumori DIPG portano una specifica mutazione genetica, in precedenza non era chiaro quale ruolo, se del caso, la proteina mutante gioca nello sviluppo del tumore, e se la sua funzione potrebbe essere mirata da terapie.,
Per entrambi i nuovi studi, i team di ricerca hanno studiato la biologia delle cellule DIPG umane con questa mutazione e identificato caratteristiche che potrebbero renderle vulnerabili al trattamento. Rispetto ai trattamenti di controllo, hanno trovato, farmaci noti come inibitori PRC2 e BET ridotto tumori DIPG in modelli murini e allungato la vita dei topi.
I risultati di entrambi gli studi, uno da un gruppo di ricerca presso la Northwestern University e un altro da un gruppo presso l’Università di Copenaghen in Danimarca, sono stati pubblicati il 27 febbraio su Nature Medicine.,
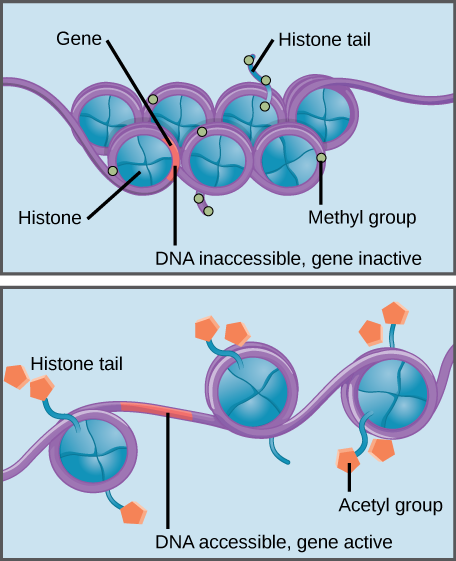
La metilazione dell’istone rafforza l’interazione istone–DNA, rendendo i geni associati inaccessibili all’espressione genica (inattiva). L’acetilazione dell’istone indebolisce l’interazione, rendendo i geni associati accessibili per l’espressione genica (attiva).
Identificare un obiettivo
Circa 5 anni fa, i ricercatori che lavorano sul St., Jude-Washington University Pediatric Cancer Genome Project ha scoperto che quasi l ‘ 80% dei tumori DIPG ha una mutazione specifica nel gene per una proteina chiamata istone H3.
Che una percentuale così alta di tumori abbia questa stessa mutazione è stata una sorpresa per la comunità di ricerca DIPG, ha detto Ali Shilatifard, Ph. D., della Northwestern University Feinberg School of Medicine, ricercatore principale per uno degli studi.
Gli istoni sono una famiglia di proteine che aiutano a confezionare il DNA in strutture compatte., Brevi sezioni di DNA avvolgono le proteine istoniche come filo su una bobina e migliaia di istoni avvolti dal DNA (chiamati nucleosomi) costituiscono ciascun cromosoma.
Modifiche specifiche agli istoni possono promuovere o prevenire l’espressione genica. Ad esempio, l’attaccamento di composti chimici chiamati gruppi acetilici agli istoni indebolisce la loro interazione con il DNA, promuovendo l’espressione genica. D’altra parte, l’aggiunta di gruppi metilici agli istoni di solito fa avvolgere il DNA più strettamente attorno agli istoni, impedendo l’espressione genica.,
Identificare la presenza di una mutazione dell’istone H3 nei pazienti con DIPG è stato il primo passo, ha detto il Dr. Bandopadhayay. “Ma per essere in grado di trattare i tumori con quell’alterazione, devi capire cosa sta facendo la mutazione”, ha aggiunto.
In uno studio precedente, il Dr. Shilatifard ei suoi colleghi hanno usato i moscerini della frutta per studiare la funzione del gene H3 dell’istone mutante. Rispetto alle mosche che avevano proteine istone H3 normali, le mosche con la versione mutante avevano più istoni che erano costellati di gruppi acetilici (acetilati)., A loro volta, questi istoni acetilati erano legati da molecole chiamate proteine contenenti bromodomaina (BRD), che regolano l’espressione genica.
Per il loro studio attuale, che è stato finanziato in parte da NCI, i ricercatori Northwestern volevano determinare se l’istone mutante avesse la stessa funzione nelle cellule umane. Infatti, hanno scoperto che il cancro del colon umano o le cellule tumorali del rene alterate per esprimere il gene H3 dell’istone mutato avevano più istoni acetilati rispetto alle cellule che esprimevano il normale gene H3 dell’istone.
Il primo autore, Andrea Piunti, Ph. D.,, quindi esaminato tutti gli istoni H3 mutanti situati in tutti i genomi delle cellule tumorali DIPG da tre pazienti. La sua analisi ha rivelato che molti nucleosomi che contenevano istoni mutanti erano acetilati e legati dalle proteine BRD.
Ulteriori esperimenti hanno dimostrato che le proteine BRD possono svolgere un ruolo diretto nella crescita del tumore DIPG. Il trattamento delle cellule DIPG umane con farmaci sperimentali che bloccano le proteine BRD, chiamati inibitori della BET, ha rallentato la crescita delle cellule DIPG rispetto a un trattamento di controllo., E in studi su topi con cellule DIPG umane impiantate nei loro steli cerebrali, quelli trattati con inibitori della BET avevano tumori più piccoli e vivevano più a lungo dei topi trattati con il trattamento di controllo.
Questi esperimenti “suggeriscono che gli inibitori della BET forniscono un potenziale approccio terapeutico per DIPG”, ha affermato il dott. Studi preclinici hanno dimostrato che diversi tipi di cancro – tra cui la leucemia e glioblastoma—sono anche sensibili agli inibitori della BET, ha aggiunto.,
Un ulteriore obiettivo
L’analisi del gruppo Northwestern delle cellule tumorali DIPG umane con istone H3 mutante ha anche rivelato che oltre a più acetilazione dell’istone H3, molti istoni sono stati decorati con gruppi metilici (metilati). Inoltre, hanno scoperto che un enzima chiamato PRC2—che attacca i gruppi metilici alle proteine dell’istone H3—era presente vicino a molti di questi istoni.
Questi risultati hanno spinto i ricercatori della Northwestern a esaminare ulteriormente l’attività di PRC2., Hanno scoperto che il blocco dell’attività di PRC2-geneticamente o con un inibitore di PRC2 chiamato tazemetostat-ha ridotto la crescita delle cellule DIPG.
“Inaspettatamente, questi risultati dimostrano un ruolo per la funzione PRC2 nel mantenimento della crescita DIPG”, ha scritto il gruppo Northwestern.
Il gruppo di Copenhagen ha anche trovato prove a sostegno del ruolo di PRC2 nel promuovere la crescita del tumore DIPG. Hanno osservato che tazemetostat e un altro inibitore del PRC2 hanno ridotto la crescita delle cellule cerebrali di topo o delle cellule DIPG umane con istoni mutanti, mentre il trattamento di controllo non lo ha fatto.,
E quando hanno impiantato cellule cerebrali di topo con istoni mutanti nel cervello di topi normali o topi in cui PRC2 era geneticamente bloccato, quelli che mancavano di attività PRC2 vivevano più a lungo.
Al contrario, tuttavia, uno studio separato di un gruppo di ricerca in Germania ha rilevato che le cellule di diversi pazienti con DIPG non erano sensibili al tazemetostato, anche se i loro tumori avevano la mutazione dell’istone H3.
Un passo avanti
Decenni di studi clinici hanno dimostrato che i tumori DIPG sono insensibili alla chemioterapia tradizionale, ha spiegato il Dr. Bandopadhayay., E anche se le radiazioni possono alleviare i sintomi, non è curativo e la maggior parte dei bambini con DIPG muore entro 2 anni dalla diagnosi.
Nel 2015, un consorzio internazionale di ricercatori DIPG si è riunito per studiare tutti i campioni di cellule DIPG disponibili. Il loro studio ha rivelato che le cellule DIPG raccolte da diversi pazienti sono state uccise da un farmaco che modifica l’istone chiamato panobinostat (Farydak®). Panobinostat blocca gli enzimi che aggiungono gruppi acetilici agli istoni., Ora i ricercatori, che fanno parte del Consorzio Pediatric Brain Tumor NCI-supported, stanno testando la sicurezza e la migliore dose di panobinostat per i bambini con DIPG in uno studio clinico di fase I.
Ora i risultati di entrambi gli studi indicano nuove strategie di trattamento potenzialmente promettenti, ha detto il Dr. Shilatifard.
“Vogliamo spostare gli inibitori delle SCOMMESSE in uno studio di fase I per il trattamento del DIPG, ei nostri colleghi dell’Ann& Robert H. Lurie Children’s Hospital di Chicago stanno portando avanti questi studi”, ha affermato.,
Inoltre, diversi studi clinici in corso stanno testando tazemetostat, l’inibitore del PRC2, sia in pazienti adulti che pediatrici con vari tipi di cancro. Tuttavia, nessuno studio attuale sta studiando specificamente tazemetostat nei bambini con DIPG.
Ci sono ancora molte domande senza risposta, ha detto il dottor Bandopadhayay, tra cui se questi farmaci sperimentali hanno la capacità di attraversare la barriera emato–encefalica e raggiungere i tumori cerebrali umani.
Dott., Bandopadhayay ei suoi colleghi stanno anche imparando di più sulla biologia DIPG studiando le cellule tumorali ottenute da biopsie, oltre a quelle ottenute da autopsie. Ottenere campioni bioptici è stato reso possibile solo di recente da importanti miglioramenti nelle tecniche neurochirurgiche, ha spiegato.
“È un momento emozionante”, ha detto. “C”è un sacco di lavoro in corso in questo momento. L’obiettivo finale è quello di essere in grado di trattare questi bambini in modo che abbiano una possibilità di cura con effetti collaterali minimi.”