はじめに
不利な環境を避けるために動くことができる動物とは異なり、固着した植物は複雑な環境条件に高度に発達した適応を示します。 この深い適応性を達成するためには、細胞間のコミュニケーションが必要 植物における細胞間通信は、堅牢な細胞内シグナル伝達処理と複雑な細胞間シグナル伝達ネットワークを含む。, これまで、オーキシン、ブラシノステロイド(BR)、サイトカイニン、ジベレリン(GA)、エチレン、ジャスモン酸(JA)、ストリゴラクトン(SL)、アブシジン酸(ABA)、サリチル酸(SA)などの植物ホルモンと呼ばれる少なくとも九つのシグナル伝達物質が発見されている(Druege et al.,2016;Verma et al., 2016). 遺伝的および生理学的研究は、植物の成長および発達におけるこれらの上記ホルモンの重要な役割および機能メカニズムを明らかにした(Gray、2004)。, これまでの研究に基づいて、オーキシン、BR、GA、SL、およびサイトカイニンは、主に正常な植物の成長および発達の間に機能し、ABA、エチレン、JA、およびSAは、様々な生物および非生物的ストレスに対する植物の成長応答において重要な役割を果たす(Pieterse et al.,2009;Santner et al.,2009;Denance et al., 2013). また、これらのホルモンのいくつかは二重の役割を果たしており、例えば、ABAは種子の発達と休眠においても重要な役割を果たしています(Seo and Kosiba、2002)。, 各ホルモンがある特定の面の優勢な役割を担うが、多くのホルモンは活動を重複し、異なったホルモンの相互作用は内生発達および外生手がかりに応じて多くの発達の面そして成長を制御する。
オーキシンとBRは、成長促進ホルモンの二つの主要なクラスです。, BRは、オーキシン、サイトカイニン、エチレン、GA、JAおよびSAなどの他の植物ホルモンと相互作用し、種子発芽、細胞伸長、血管分化、気孔の形成および運動、開花及び雄の繁殖力を含む植物の成長および発達プロセスの広い範囲を調節することができる植物特specificなステロイドホルモンのグループである(Saini et al., 2015). 興味深いことに、これらのプロセスのそれぞれはまた植物の開発を制御するためにこれら二つのホルモンが相互作用することを, 本レビューでは,最近の進歩に基づいてオーキシンとBRのシグナル伝達を概説し,オーキシンとBRを介した植物の成長と発達の間のクロストークをレビューした。
オーキシンシグナル伝達経路
オーキシンは、重力または光刺激に対する植物の向性におけるその役割のために、最初に植物ホルモンとして認, その後、オーキシンはインドール-3-酢酸として化学的に同定され、胚発生、器官形成、血管分化、根およびシュートの発達、熱帯成長、および果実の発達を含む植物の発達および生理学的プロセスの茄多において重要な役割を果たすことが示された(Estelle、2011)。
シロイヌナズナにおける遺伝子解析を用いて、オーキシンシグナル伝達の基礎となる分子機構をよく研究してきた。 輸送阻害剤RESPONSE1(TIR1)は、最初に同定されたオーキシンの核受容体であった(Ruegger et al.,1998;Dharmasiri et al., 2005)., TIR1は、F-boxタンパク質に属する核タンパク質をSCF E3ユビキチンリガーゼタンパク質複合体のサブユニットとしてコードしている(Gray et al.,1999,2002;Hellmann et al.,2003;Quint et al.,2005)、TIR1に加えて、オーキシン結合活性を示し、シロイヌナズナにおけるオーキシンシグナル伝達を仲介する三つの追加のFボックスタンパク質、すなわちオーキシンシグナル伝達Fボックスタンパク質(AFBs)がある(Badescu and Napier,2006)。 TIR1受容体は、AUX/IAA(オーキシン/インドール-3-酢酸)タンパク質のグループと相互作用することができる(Dharmasiri et al., 2003)., AUX/IAAタンパク質はオーキシンシグナル伝達の負の調節因子であり、シロイヌナズナゲノムにコードされたAUX/IAAの29メンバーがある。 AUX/IAAタンパク質は、オーキシンに対する転写応答を仲介するために、転写調節因子、オーキシン応答因子(ARF)のクラスと相互作用することができる。 高いオーキシンレベルでは、AUX/IAAタンパク質はオーキシンのコレセプターとしてTIR1と相互作用し、SCFtir1複合体によってユビキチン化され、ユビキチン–プロテアソーム経路を介して分解される(Gray et al.,2001;Lanza et al., 2012)., AUX/IAAリプレッサーが破壊されると、23のメンバーシップを含むオーキシン転写調節因子ArfがAUX/IAA抑制から放出され、したがって標的遺伝子の活性化または抑制によってオーキシン応答を媒介することができる(Guilfoyle and Hagen、2007)。 F-boxタンパク質およびAUX/IAAまたはArfsの異なるセットは、オーキシンシグナル伝達中の複雑さを推測する(Goh et al.,2012;Guilfoyle,2015;Salehin et al., 2015).,Aux/IAA転写抑制因子およびARF転写因子の協調作用は、Physcomitrella(Lavy et al., 2016). 最近、SCFのCULLIN1(CUL1)サブユニットがTIR1と相互作用し、TIR1基質安定性およびオーキシンシグナル伝達を調節することが見出された(Wang et al., 2016). TIR1とAux/IAA間の相互作用は、イネ中のシクロフィリンイソメラーゼLRT2によって制御されるAux/IAAsの空間配座によっても影響される(Jing et al., 2015)., 熱ショック因子90(HSP90)とコシャペロンSGT1は、それぞれ、TIR1と相互作用し、したがってTIR1とAux/IAAとオーキシンシグナリングの間の相互作用に影響を与えるTIR1の安定性を調節する(Wang et al., 2016).
TIR1依存カノニカルオーキシンシグナル伝達経路に加えて、オーキシンは最近、非カノニカルオーキシンシグナル伝達機構を介して発達応答の多様な範囲を引き出すことが報告されている。, この非正準オーキシンセンシングプロセスでは、ARF3/ETTINは、プロセス固有の転写因子との相互作用を介して遺伝子発現を制御し、オーキシンを介した植物の発育多様性を高める(Simonini et al., 2016, 2017).
BRシグナル伝達経路
ブラシノステロイドは、最初の細胞伸長を促進する能力のために花粉で発見されました。 その後、BRは植物の成長面の広い範囲で役割を果たし、生物的および非生物的ストレスに応答することができることが判明した。, 今日では、BRシグナル伝達経路は、分子遺伝学、生化学、プロテオミクス、ゲノミクスなど、さまざまな方法の組み合わせによって大きく解明されています。 細胞表面キナーゼBRASSINOSTEROID INSENSITIVE1(BRI1)は、BRI1の細胞外ドメインに結合し、そのキナーゼ活性を活性化し、転写を調節するためのシグナルカスケードをオンにすることができるBRの受容体として同定された(Li and Chory,1997;Wang et al.,2001;Kinoshita et al.,2005;Kim and Wang,2010;Clouse,2011;Hothorn et al.,2011;She et al.,2011;Oh et al., 2012)., BRが認識されると、BRI1は共受容体BRI1関連キナーゼ1(BAK1)およびその相同体細胞胚発生シスレセプターキナーゼ(Serk)と相互作用して、より活性なBR受容体複,2002;Nam and Li,2002;Wang et al.,2005;Tang et al.,2008;Gou et al., 2012). 活性化されたBRI1は、原形質膜アンカー受容体様細胞質キナーゼの二つの基質をリン酸化する:ブラシノステロイドシグナル伝達キナーゼ1(BSK1)と構成的差動成長1(CDG1)(Tang et al.,2008;Kim et al.,,2011)は、PP1型ホスファターゼBRI1-SUPPRESSOR1(BSU1)をリン酸化してBSU1を活性化し、BSU1を脱リン酸化し、GSK3様キナーゼブラシノステロイド非感受性2(BIN2)を不活性化する。 BIN2のキナーゼ活性はまた、ヒストン脱アセチル化酵素HDA6によって阻害され、BIN2のK189で相互作用し、脱アセチル化する。, BRレベルが低い場合、BRI1はその負の調節因子であるBRI1キナーゼ阻害剤1(BKI1)およびタンパク質ホスファターゼ2A(PP2A)のために静止し、BIN2はbr相同転写因子であるBRASSINAZOLE RESISTANT1(BZR1)およびBZR2(BR1-EMS-SUPPRESSOR1に対してBES1とも命名される)をリン酸化する(He et al.,2002;Wang et al.,2002;Yin et al.,2002;Mora-Garcia et al.,2004;Kim et al.,2009,2011;Kim and Wang,2010). BRレベルが高い場合、BIN2は不活性化され、BZR1およびBZR2はPP2Aによって脱リン酸化され、核内に移動して数千のBR応答遺伝子の発現を変化させる(He et al.,,2005;Yin et al.,2005;Sun et al.,2010;Tang et al.,2011;Yu et al., 2011).
BRとオーキシンシグナル伝達間の相乗効果
オーキシンとBRシグナル経路は、多様な役割を果たしているが、彼らはまた、発達プロセスの広い範囲で相乗的かつ相互依存的な相互作用を示した。 例えば、オーキシンおよびBRシグナルの両方が細胞拡張を促進することができ、相乗的に相互作用してはい軸伸長を促進することができる(Nemhauser et al., 2004)., はい軸伸長を促進する二つの経路の一方の応答は、他方の機能およびBRおよびオーキシン経路の間の相互依存性を必要とする(Nemhauser et al., 2004). オーキシンは、野生型植物ではなく、BR非感受性変異bri1-116でははい軸の長さを増加させ、bri1-116のこのオーキシン非感受性表現型は、brまたはアクティブBZR1がはい軸伸長のオーキシン促進のために必要とされることを示す、支配的な機能利得変異bzr1-1Dによって抑制された。, BRシグナル伝達は、フィトクロムB4-3(SOB3)のサプレッサーと収束し、オーキシン誘導小さなオーキシンアップRNA19(SAUR19)発現の調節を介して細胞伸長とはい軸, 2017). 一方、オーキシン調節された転写因子SMALL ORGAN SIZE1(SMOS1)は、最近、米のBRシグナル伝達に積極的な役割を果たす転写共調節因子のGRASファミリーのメンバーであるSMOS2/DLTとの直接相互作用を介して細胞拡張を制御することが見出されている(Kim et al.,2009;Tong et al.,2012;Hirano et al., 2017)., このようなiaa3とarf6/arf8などのオーキシン関連変異体は、はい軸伸長のための野生型だったよりもBRに敏感ではなかったし、オーキシンにbzr1-1Dの過敏症を廃止し、はい軸伸長のBRとBZR1プロモーションがARF6/8を必要とすることを示唆している。 ゲノムワイドChIP-Seq解析により、ARF6はBZR1および光/温度調節転写因子PIF4と膨大な数のゲノム標的(約50%)を共有することが明らかになった(Oh et al., 2014)., BZR1およびPIF4はARF6と相互作用し、はい軸伸長中に共有標的遺伝子に協調的に結合することによって共有標的遺伝子を活性化する(Oh et al. 2014年)およびこれらの多くの重複遺伝子を標的遺伝子をコード化細胞の細胞壁に関わるタンパク質の細胞。ブラシノステロイドおよびオーキシンはまた、根頂部分裂組織(RAM)の維持において重要な役割を果たす(Durbak et al., 2012). RAMは、静止中心(QC)として知られているめったに分裂しない細胞の小さなグループで構成され、様々なtoot組織タイプを生じさせる幹細胞に囲まれています。, 根幹細胞集団の維持は、WUSCHEL関連ホメオボックス5(WOX5)によって調節される(Sarkar et al., 2007). WOX5は、オーキシンシグナル伝達によってQCに制限され、PLT遺伝子の適切な発現を容易にする(Aida et al.,2004;Ding and Friml,2010). BR受容体遺伝子BRASSINOSTEROID INSENSITIVE1(BRI1)の変異は、RAMに異常な細胞周期の進行をもたらし、より小さなRAMsを引き起こす(Gonzalez-Garcia et al.,2011;Hacham et al., 2011). オーキシンは、BRの生合成を刺激することが知られている(Chung et al.,,2011)、しかし、BRの活性はPIN遺伝子の発現に影響しない(Hacham et al., 2011). BR変異体の根先端表現型は、オーキシン変異体と同じものを示さない(Gonzalez-Garcia et al.,2011)、BRがオーキシンとは独立してRAMに作用することを示す。ブラシノステロイドおよびオーキシンシグナルもまた、血管束の放射状パターン形成において相乗的に必要とされる(Ibanes et al., 2009)., 数学的モデリングと生物学的実験の組み合わせにより,非対称オーキシン極性輸送によって確立されるが,オーキシンレベルの変化はないオーキシン最大値は維管束の位置決めに重要である。 BRシグナルは,オーキシン最大値と一致する血管前リング内の細胞数の促進シグナルとして機能することが示された。 したがって、シュートにおける維管束の周期的な配置の確立は、これら二つの植物ホルモンの協調作用の下にある(Ibanes et al., 2009)., 両方のシグナルはまた、植物の根の発達に関与しており、BRおよびオーキシンの相互作用は、このプロセス中にBREVIS基数(BRX)によって媒介される。 BRXはBRの律速生合成のために重要であり、BR外因性アプリケーションはbrx変異欠陥を救出することができます。 さらに、brx変異体ではオーキシン応答性遺伝子発現が世界的に障害されており、BRXの発現はオーキシンによって強く誘導され、BRによって抑制されており、BR生合成とオーキシンシグナル伝達は、根の発生中にBRXを含むフィードバックループを介して接続されていることを意味する(Mouchel et al., 2006).,
ブラシノステロイドおよびオーキシンはまた側根の開発の間に互いに作用し合う役割を担います。 BRsは主に側根原基開始時に機能するが、オーキシンは側根形成の開始段階および出現段階の両方に必要である(Casimiro et al.,2001;Bhalerao et al.,2002;Benkova et al.,2003;Bao et al., 2004). これらのプロセスの間、BRsは、根におけるacropetalオーキシン輸送を促進することによってLRP開始を増加させるが、内因性IAAレベルに影響を与えることによって, 2004)., これらの報告はすべて,BRとオーキシンの間のクロストークが植物の成長と発達の調節に重要な役割を果たすことを示唆している。
BRはオーキシンシグナル伝達を調節します
植物発育中のオーキシンとBRシグナルの相互依存性と協力に加えて、BRは複数のレベルでオーキシンシグナル経路を仲介することができます。 BZR1はARFタンパク質と相互作用して、AUX/IAA、PINs、TIR1、ARFsなどの輸送やシグナル伝達など、オーキシン代謝に関与する複数のオーキシンシグナル伝達成分や遺伝子を直接ターゲットとする。 (Sun et al., 2010)., Aux/IAAタンパク質がBR応答に関与しており、iaa7/axr2-1およびiaa17/axr3-3変異体は、臓器依存的に異常なBR感受性および異常なBR誘導遺伝子発現を示したことが分かった(Nakamura et al., 2006). 外因性のブラシノリド(BL)の処置はIAA5、IAA19、IAA17、等のようなオーキシン応答性の遺伝子の表現を引き起こすことができます。 また、BR生合成変異体de-etiolated2(det2)では上記遺伝子の発現がダウンレギュレートされており、これはオーキシン依存性遺伝子発現に機能的なBR生合成が一,,2003;Kim et al., 2006). さらに、BRはまた、PIN4およびPIN7のようなオーキシン輸出業者の発現を調節することによってオーキシンの流れに影響を与える(Nakamura et al., 2004). 植物重力屈性応答の間に、BRsは、根分裂組織ゾーンにおけるオーキシン輸出PIN2の極性蓄積を高めることができ、したがって、伸長帯に向かって根先端からオーキシンの再分布に影響を与え、植物重力屈性を誘導するために根の上側と下側の両方におけるIAAレベルの差をもたらす。, このプロセスの間に、BR活性化ROP2は、F-アクチンの組み立て/再組み立ての調節を通じてPIN2の機能的局在を調節する上で重要な役割を果たしている(Li et al., 2005). さらなる研究により、BLの知覚および/または濃度の低下は、トリプトファンをインドール-3-アセトアルドキシムに変換する酵素をコードする遺伝子CYP79B2を誘導し、したがって分布に影響を及ぼすことが示された(Kim et al., 2007).
また、BR信号は、その負のレギュレータGSK3キナーゼBIN2によってオーキシンシグナル出力を調節することができることがわかった。, オーキシン応答因子ARF2は、酵母ツーハイブリッドスクリーンとキナーゼアッセイでBIN2相互作用タンパク質として同定されたBIN2はARF2をリン酸化すること ARF2のリン酸化は、そのDNA結合能の喪失および標的遺伝子の抑制活性をもたらす(Vert et al., 2008). ARF2はBZR1標的遺伝子であり、その発現はBR処理により低減される(Sun et al., 2010)., さらに、BIN2はARF7およびARF19をリン酸化してAUX/IAAsとの相互作用を抑制し、それによってそれらの標的遺伝子の側方臓器境界-DOMAIN16(LBD16)およびLBD29に対する転写活性を増強して側方根臓器形成を調節することができる(Cho et al., 2014). しかし、BRはこのプロセスの間にマイナーな役割を果たし、BIN2は気管要素分化阻害因子(TDIF)–TDIF受容体(TDR)モジュールの制御下にある(Cho et al., 2014). とBR調整できるオーキシンの反響働きかけを通じて異なるオーキシンシグナル伝達す。,
オーキシンはBRシグナル伝達を調節する
一方、オーキシンはまた、特定の態様でBRシグナル経路を調節することができる。 DWARF4、内因性BRレベルを制御するためにBR生合成のための重要なヒドロキシラーゼの発現は、オーキシン依存である。 オーキシン処理はDWARF4の発現を著しく刺激することができ、オーキシンはBZR1のDWARF4のプロモーターへの結合を阻害することができる。 オーキシンによるDWARF4の誘導は、オーキシンシグナル伝達経路を必要とするが、BRシグナル伝達経路を必要としない(Chung et al.,2011;Yoshimitsu et al., 2011)., BRのC-3酸化を触媒するCPDは、オーキシンシグナル伝達の下流に作用する推定転写因子であるBRXによって活性化された(Mouchel et al., 2006). イネにおけるさらなる研究は、外因性オーキシンがBR受容体遺伝子OsBRI1の転写発現レベルを高めることを示し、オーキシンがBR受容体の調節を介してBRシグナル伝達を高めることを示唆している(Sakamoto et al., 2013). さらに、OsBRI1のプロモーターは、ARF転写因子によって標的とされる上流のオーキシン応答要素(AuxRE)モチーフを持っています。, さらに、変異研究は、オーキシンの変異により、オーキシンによるOsBRI1の発現誘導が廃止され、Arf変異体でもOsBRI1の発現がダウンレギュレートされることを示している(Sakamoto et al., 2013). OsARF19はOsBRI1のプロモーターに結合し、その発現を積極的に調節し、次いでBRシグナル伝達を活性化することが報告されている(Zhang et al., 2015). BES1は、小さなオーキシンアップRNA15(SAUR15)のプロモーターに結合し、シロイヌナズナにおけるBR早期応答遺伝子を仲介することができ、この結合は、オーキシン処理によって増強することができる(Walcher and Nemhauser、2012)。, まとめると、オーキシンはまた、BR応答とBR規制植物の成長と開発に影響を与えることができます。
結論と将来の展望
過去約四十年の間に、オーキシン-BR経路の相互作用に関する研究は、より多くの研究者の関心を集めています。 生理学的、分子的、遺伝的、および生化学的ツールのアプライアンスは、この問題の理解を大幅に深めました。, これまでの研究に基づいて、BRとオーキシンは、はい軸伸長、維管束の発達、根の発達および向性など、複数の植物発達プロセスに相乗的に関与している。 オーキシンとBRの相互依存性と協調は複雑であり、同じ標的遺伝子を共有し、複数のレベルで互いに調節することによって、分子レベルで多くのプロセスを伴う(図1)。
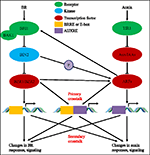
図1. オーキシン-ブラシノステロイド(BR)クロストークのモデル。, シロイヌナズナでは、BRおよびオーキシンシグナルの認識は、それぞれBRI1およびTIR1受容体によって認識される。 BRはBRI1の細胞外ドメインに結合し、それが共同受容体BAK1と相互作用してより活性なBR受容体複合体を形成し、それがBIN2の脱リン酸化および不活性化につながることを促進する。 BIN2の不活性化は、二つのBR相同転写因子BZR1とBZR2の脱リン酸化につながり、それらのプロモーター領域にBRREまたはE-boxを含む遺伝子の転写を活性化するために核に移動する。, BIN2はまた、ARF7およびARF19をリン酸化してAUX/IAAsとの相互作用を抑制し、それによってそれらの標的遺伝子の転写活性を増強することができる。 TIR1はオーキシンシグナル伝達を受け取り、オーキシンの共受容体としてAUX/IAAタンパク質と相互作用する。 その後、AUX/IAAはユビキチン–プロテアソーム経路を介して分解され、オーキシン転写調節因子オーキシン応答因子(Arf)はAUX/IAA抑制から解放され、その調節領域におけるオーキシン応答要素(AUXRE)を有する遺伝子の転写を活性化する。, いくつかのArfはまた、BRI1のプロモーターに結合し、積極的にBRシグナル伝達を活性化するその発現を調節することができる。 プライマリクロストークは、両方のシグナル伝達経路が直接転写を調節することができ、それらのプロモーター領域にBRRE/E-boxとAUXREの両方を含む遺伝子の活性化 二次クロストークは、オーキシンまたはBR応答性のいずれかである遺伝子の発現を介して発生しますが、その活性は、他のホルモンの応答およびシグナル伝達を調節する遺伝子の発現を制御します。,
リン酸化調節はBRシグナル伝達経路において重要な役割を果たし、特に知覚プロセス中にBRはBRI1キナーゼ受容体およびBAK1キナーゼ共受容体を介して知覚され、最終的にはBES1/BZR1活性などの下流の転写因子に影響を与えることによってBR調節された遺伝子発現を制御する(He et al.,2005;Yin et al.,2005;Sun et al.,2010;Tang et al.,2011;Yu et al., 2011). しかし、ユビキチン化規制のように必須のオーキシンシグナル伝達., オーキシンがユビキチンE3-リガーゼとして作用するTIR1受容体に結合すると、活性化されたTIR1E3-リガーゼはAUX/IAAタンパク質をユビキチン化し、これらのリプレッサーの分解とARF転写因子の脱抑制をもたらし、最終的にオーキシン制御された遺伝子発現パターンの変化と成長応答を引き起こす(Gray et al.,1999,2002;Hellmann et al.,2003;Quint et al., 2005). BRシグナル伝達においてよく知られているBIN2キナーゼは、ARF2およびARF7などのArfの活性をリン酸化および増強することができることが見出されている(Vert et al.,2008;Cho et al.,,2014)、BRシグナル伝達に関与しているBIN2のようなキナーゼが、TIR1受容体やAUX/IAAリプレッサーなどの他のオーキシンシグナル伝達成分と相互作用し、TIR1E3-リガーゼ活性やAUX/IAAタンパク質安定性に影響を与えるかどうかをテストすることは興味深いでしょう。 一方、BRシグナル伝達におけるユビキチン化の役割はまた、TIR1E3リガーゼが直接BRシグナル伝達成分と相互作用し、そのタンパク質安定性を調節することができる場合は特に、対処する必要があります。,
さらに、オーキシン応答DR5および他のオーキシンレポーターを用いて、オーキシンは組織または細胞依存的に植物の成長および発達を調節することが観察 細胞および環境の文脈に依存する多様な転写出力(Clark et al.,2014;Etchells et al.,2016;Lavy et al., 2016)., 時空間的なBRシグナル伝達は、オーキシンとの拮抗作用によって根の成長を制御することが示されている(Chaiwanon and Wang、2015)が、pBZR1:BZR1-YFPによって視覚化できる組織 さらに、蛍光活性化細胞選別またはhigh解能遺伝子発現解析と組み合わせたレーザーマイクロダイセクションを用いて、オーキシンおよびBR分布の詳細な組織またはセラーマップの生成が現在可能である。, これは最終的にオーキシンが組織または細胞の方法でBRとクロストークするとアドレスにつながります。
著者の貢献
すべての著者がこのレビュー原稿の執筆に関与していました。 原作者を構成するもののより多くの情報のために、私達の著者の指針を参照しなさい。,
資金調達
この作品は、中国国家自然科学財団(プロジェクト31500229および31770305)、主要な基礎研究プログラムの山東省自然科学財団(2017C03)、著名な若い学者のための山東省基金(2014JQ201408)からの助成金によってサポートされています。
利益相反声明
著者らは、この研究が潜在的な利益相反と解釈され得る商業的または財務的関係がない場合に行われたと宣言している。
Clouse,S.D.(2011)., ブラシノステロイドシグナル伝達:受容体キナーゼ活性化から植物の発達を調節する転写ネットワークへ。 植物細胞23、1219-1230。 土井:10.1105/tpc.111.084475
PubMed Abstract|CrossRef Full Text|Google Scholar
Estelle,M.(2011). オーキシンシグナリング:合成からシステム生物学へ。 コールド-スプリング-ハーバー-ラボラトリー-プレス
Google Scholar
Guilfoyle,T.J.(2015)., The PB1 domain in auxin response factor and Aux/IAA proteins: a versatile protein interaction module in the auxin response. Plant Cell 27, 33–43. doi: 10.1105/tpc.114.132753
PubMed Abstract | CrossRef Full Text | Google Scholar