はじめに
子豚の死亡率は、ブタの繁殖における主要な選択形質の一つであり、雌豚、子豚、および環境によって影響される。 したがって、子豚の死亡率は複雑な表現型であり、雌豚がその子孫を育てる能力に依存するが、出生体重、管理、および選択の関数でもある(Knol et al., 2002)., しかしながら、単遺伝性劣性欠損もまた、子豚の死亡率に寄与するが、過去にはほんの数例しか報告されていない(Murgano et al.,2012;Matika et al., 2019). 変異の影響が激しい場合であっても、このような変異に対して効率よく選択することは、低頻度によって妨げられる。 多くの重度の欠陥において、接合体は妊娠の非常に早い時期に死亡し、集団全体にホモ接合体が存在しないこと以外の痕跡を残さない(Derks et al., 2019).,
市販のブタ集団における近親交配効果は、通常、母性能力および子豚の生存率の両方を改善することによって、子豚の死亡率の減少について、選択的育種によってチェックされている(Olijslagers、2018)。 しかしながら、劣性単遺伝性欠損の根底にある変異体は、繁殖値内では十分に捕捉されず、激しい選択の結果として潜在的により高い頻度に漂流する(Georges et al., 2019). さらに、これらの変異体は、ヘテロ接合状態における相関性のある正の効果に対する選択のバランスをとる結果として維持することもできる(Derks et al., 2018).,劣性欠損は、子豚全体の死亡率にわずかに寄与するだけである(Alonso-Spilsbury et al., 2007). しかし、異の影響悲死亡率の重要性が異に直接影響を与える生産ならびに動物福祉(Baxter et al.,2013;Rutherford et al., 2013). しかしながら、動物の集団管理において、欠陥の低頻度の発生は、通常、不十分に文書化され(しばしば非常に一般的な用語が使用される)、症候群は、高頻度に達した後にのみ認識されることが多い。, これは、非常に明確な表現型につながらない症候群に特に関連している。 したがって、商業繁殖集団であっても、特定の症候群についてはほとんど追跡が行われず、特定の低周波症候群に対して効果的に選択するためには、新しいアプローチが必要である。
この作品では、我々は組み合わせた中密度SNPアレイと全ゲノムシークエンシング(WGS)に基づく調査を通じて、商業豚集団における高度に衰弱させる症候群, 調査は、ホモ接合体における予測された明確な表現型の結果と、SPTBN4遺伝子における16bpフレームシフト欠失の同定につながった。 キャリア周波数は調査中の人口の約9%であり、人口の約0.81%に影響を及ぼしている。 この頻度は、遺伝的根拠を有することが不明であるほど十分に低く、特定の症候群としてはまったく認識されていないことさえ事実上知られてい 調査を実施すると、ある妊娠した雌豚がキャリアイノシシによって播種されたことが確認された。, 影響を受けた子豚はミオパチーに苦しんでおり、歩くことができず、通常は出生後数時間以内に死亡し、同様のヒトおよびマウスの症例と比較して予
材料と方法
動物、遺伝子型、および前処理
データセットは、大きな白い背景を持つ合成イノシシラインから31,839動物で構成されています。 ラインはTopigs Norsvin nucleusの農場で維持され、繁殖し、主に生産および健康の特性で選ぶ。, これらの動物をIllumina GeneSeek custom50K SNPチップ(Lincoln,NE,USA)上で遺伝子型を決定した。 欠損遺伝子型の頻度>0.15を有する動物を除去した。 0.85の最小コールレート、マイナー対立遺伝子頻度>0.01、およびハーディ-ワインバーグプロポーション正確なテストp値p<10-12。 また、sscrofa11.1ゲノムビルド上の未知の場所を持つマーカーは、フィルタリング後に41,573マーカーを残して、破棄されました。, 全ての工程をPlink v1.90b3.30で行った(Purcell et al., 2007).
ハプロタイプフェージングとSSC6ハプロタイプの同定
Beagle5.0における欠損部位のハプロタイプフェージングと代入を行い、有効集団サイズのパラメータを100に設定し、他の設定はデフォルトであった(Browning et al., 2018). 予想されるホモ接合体は、Hardy-Weinberg原理を用いて、ハプロタイプ頻度に基づいて推定された。 正確な二項検定を適用して、観察されたホモ接合体の数と期待されるホモ接合体の数を検定した。, ハプロタイプは、p<5×10-3の場合に有意に枯渇したと考えられていた。
Ssc6ハプロタイプに関連付けられている表現型効果
我々は、ssc6ハプロタイプの総生まれ数、数死産、ミイラ化子豚、分娩生存、および授乳生存(年齢の約21日までの生存)9,666 我々は、すべてのCxCのためのこれらの表現型をリストし、CxNリッターが同定された。 我々はCxCリッターからの表現型がCxNリッターから有意に異なるかどうかを評価するためにウェルチのt検定を使用しました。 P値<0。,05は重要と考えられていた。
全ゲノム配列解析と候補バリアント同定
データセットは、研究中の集団から71の全ゲノム配列決定された個人で構成されています。 すべての71サンプルはまた、31,839動物のデータセットに存在していました50k.The71サンプルは、1.93Tbpの総容積を有します(テラ塩基対)から14.16億150bpペアエンド読み取り(表S3). サンプルはIllumina HiSeq2000で配列決定されました。 我々は、bwa-MEMバージョン0.7を使用してsscrofa11.1ゲノムビルドに配列を整列させました。,15(Li and Durbin,2009)の平均マッピング可能性は98.9%で、サンプルカバレッジは8.8から14.8X(平均10.9X)の範囲です。 SamblasterはPCR重複を除去するために使用された(Faust and Hall、2014)。 Samtoolsは、bamファイルのソート、マージ、およびインデックス作成に使用されました(Li et al., 2009). マッピングおよび品質統計量は、Qualimapを使用して生成された(Okonechnikov et al., 2016). Freebayes v1.1.0では、以下の設定でバリアント呼び出しが実行されました:–min-base-quality10–min-alternate-fraction0.2–haplotype-length0–min-alternate-count2(Garrison and Marth、2012)。, Phred品質スコア<20を有する変異体を廃棄した(Li et al., 2009). 変異体は、Ensembl変異効果予測子(VEP,release96)を用いて注釈を付けた(Mclaren et al., 2016). ミスセンス変異体の影響は、耐性性から不寛容性を選別すること(SIFT)を用いて予測した(Kumar et al., 2009). LD分析は、Plink v1.90b3.30を用いて行った(Purcell et al.、2007)以下の設定で–chr-set18、–r2、ld-window-r2 0.8。
SPTBN4タンパク質アライメント
野生型タンパク質と突然変異体タンパク質との間のタンパク質アライメントは、ClustalOを用いて行った(Madeira et al.,、2019)およびESPript3(Robert and Gouet、2014)を使用して視覚化されました。 さらなる可視化および検証は、JBrowse genome viewerバージョン1.12.1を用いて行った(Skinner et al., 2009).
原因16bp SPTBN4欠失の検証
PCRは、60ngのゲノムDNA、各プライマー0.4μm、1.8mM MgCl2、および25単位/ml OneTaq®DNA Polymerase(OneTaq®2X Master Mix with Standard Buffer,New England Biolabs)を用いて、製造元のPCRバッファー中の最終体積12μlで行った。, 1分間の95°Cでの初期変性は、35サイクルの95°Cが30秒、55°Cが45秒、72°Cが90秒、5分間の延長72°Cが続いた。SPTBN4のPCRプライマーはTCAAGGGTGCAGGCTCTTTTCフォワードとGGTAGGAAGCTCGAAGTGGGリバースである。 前方プライマーを6-FAMのいずれかで色素標識し、ABI3730DNAシーケンサー(Applied Biosystems)で検出可能な蛍光標識PCR産物を生成した。 断片サイズは、ABIからのGeneMapperソフトウェア5を用いて決定した。,
病理組織学的検査
1週間未満の二つの影響を受けた子豚は、検査のためにロイヤルアニマルヘルス(Deventer)の病理学部門に送られました。 肉眼的には,全ての観察は正常範囲内であった。 両動物の前肢の骨格筋、背筋および後肢の骨格筋を、ルーチンH&E染色およびPTAH染色のためにサンプリングした。 筋肉組織を別々のジャーに保存し、ホルムアルデヒド溶液4%に固定し、緩衝化した(=ホルマリン溶液10%、緩衝化した)。, その後、組織をパラフィンに埋め込み、標準操作手順(SOP RAH)に従って2μmにスライスした。 その後、スライドを脱ラフィン化し、自動カラーマシンにおいてヘマトキシリンおよびエオシン(H&E)について日常的に染色した。 同時に、筋肉組織の2μmの追加のスライドと筋肉組織の陽性対照スライドを、PTAHと略される”リンタングステン酸ヘマトキシリン”による手動染色のた この染色は、骨格筋の交差線条を示すために好ましい。,
繁殖値と関連分析
本研究では、繁殖プログラムで使用される63の形質を評価しました。 研究中の各形質に対する応答変数として、減少推定育種値(DEBV)を使用した。 評価されたすべての形質の推定育種値(EBV)は、Garrickらによって記載された方法論を用いて脱退された。 (2009). 各動物のEBVは、動物モデルを用いた商業的育種プログラム(Topigs Norsvin)によるルーチンの遺伝的評価から得られた。, 脱退の目的のための動物あたりの信頼性は、Tier and Meyer(2004)の方法論に基づく遺伝的評価から抽出された。 また,ルーチンの遺伝的評価から,退行に用いた遺伝性率を抽出した。 最後に,DEBVの推定信頼性に基づく重み付け係数もGarrickらに従って推定した。 (2009)の値を使用して0.5スカラーcのために.DEBVの品質を確保するために,重み付け係数がゼロより大きく、DEBVの信頼性が0より大きい動物のみ.,20は、関連分析に使用されました。 DEBVの信頼性もGarrickらに従って得られた。 (2009).関連分析は、ソフトウェアASREMLを用いて行った(Gilmour et al.,,2009)以下の線形混合動物モデルを適用します。
ここで、DEBVijは動物jの観測されたDEBV、wは残差の重み係数、μは集団の全体的DEBV平均、Riは4変異iのキャリア状態(有害な対立遺伝子の数)、ajは血統ベースの平均関係行列を用いて推定された加法的遺伝的効果、および残差誤差である。 −Log10(P値)より大きい関連付けは有意として宣言されました。
結果
A1.,5Mb染色体6のセグメントは、ブタの授乳生存に影響を与えます
我々は31,638匹の単一の純血種のイノシシライン(大きな白い背景を持つ合成ライン)から、ブタ50K SNPチップ(Sscrofa11.1ビルド)に遺伝子型を分析した(Warr et al., 2019). 分析は1.5Mbセグメント染色体6(SSC6:48.75–50.25)減少授乳生存に関連付けられているホモ接合性の赤字を示す明らかにした(表1および2)。 ハプロタイプは、研究中の集団において4.5%(9.0%キャリア周波数)の中等度の対立遺伝子頻度で分離している。, ハプロタイプの頻度は、最後の十年にわたって変動しているが、最後の3年間で減少している(図S1)。 周波数がヘテロ接合性利点効果によって駆動されるかどうかをテストした。 しかし、我々は、ロースの深さと妊娠の長さ(表3)を除いて、重要な選択形質とほとんど負の関連を発見し、頻度は純粋に遺伝的ドリフトの結果であることを

テーブル1SSC6ハプロタイプ特性。,

表2キャリアごとのリッターは、キャリアごとの非キャリアリッターと比較して授乳生存率が24%減少していることを示しています。 重要な結果は太字で示されています。

表3SPTBN4欠失のヘテロ接合体キャリアに有意に関連する形質。
52キャリアバイキャリア(CxC)リッターは、生まれた動物や生きている動物の総数に有意な減少を示していません。, しかし、cxcリッターでは、キャリアバイノンキャリア(CxN)交配に比べて授乳生存率が約24%低下し、ホモ接合子豚が授乳期間内に死亡することを示している(表2)。 次に,Cxcリッターの時間と死亡原因についての留意点を検討した。 これは、出生後最初の24時間以内に死亡したほとんどの子豚を明らかにした。 これらの子豚の大半は、主に農家によって”出生時の弱い子豚”として記述されていました。,”
全ゲノム配列解析は、16bpフレームシフト欠失Sptbn4可能性が高い原因バリアントとして明らかに
原因変異を識別するために、我々は研究中の集団から71 リンケージ不均衡(LD)分析は267SNPとindelバリアント高LD(r2>0.8)SSC6ハプロタイプ(表S1)、大部分は完全なLD(247変異体)であることを明らかにした。, 三つのミスセンス、一つのフレームシフト、一つのスプライスアクセプタ)のみがコード配列に影響を与える可能性がある。 三つのミスセンス変異体は、SIFTによって許容されると予測されている(score>0.18、表S1)、スプライス-アクセプター変異体は、原因である可能性は低い、未知の機能の28bpペプチドをコードする遺伝子に影響を与える。 しかし、ハプロタイプを持つ完全なLD(r2=1)の一つの変異体は、高い影響を有すると予測された;16bpフレームシフト欠失エクソン26SPTBN4遺伝子(6:g.48801280delGACGGTGTACGCCGGT)(図1A、B)。, フレームシフト欠失(ENSSSCP00000031537:P.Arg1902fs)は、30の新規アミノ酸と早期停止コドンを導入し、障害と切り捨てられたスペクトリンベータ非赤血球性4タンパク質(SPTBN4) 変異体は、膜へのタンパク質輸送に必要なプレックストリン相同性(PH)ドメインを含む野生型タンパク質の最終的な662アミノ酸を欠いている(図1C)(Wang et al., 2018). SPTBN4タンパク質はβ-スペクトリンタンパク質のメンバーであり、細胞膜をアクチン細胞骨格にリンクするアクチンである。, SPTBN4変異は、有髄神経におけるイオンチャネルの適切な局在を制御する細胞骨格機構を破壊し、運動神経障害を引き起こす(Parkinson et al.,2001;Wang et al., 2018).

図1(A)SPTBN4遺伝子モデル。 影響を受けた26番目のエクソンの位置は赤で示されています。 (B)16-bp削除の図。 図は野生型および突然変異体エクソンを示す。 (C)突然変異体(Mt)および野生型(Wt)SPTBN4タンパク質配列のアライメント。 突然変異は30の新しいアミノ酸および早期停止コドンを引き起こします。,
ジェノタイピングファイブCxCリッターは、可能性の高い犯人としてSPTBN4削除を確認します
我々は、少なくとも二つの子豚(範囲2-6)を持っていた16bp 五つの同腹は53の子豚を生産し、そのうち19は16bpの欠失のためにホモ接合であった(表4)。 すべての19ホモ接合子豚は、出生後48時間以内に死亡した(18時間以内24時間)。 34の残りの子豚(8野生型、および26キャリア)から、唯一の1は、おそらく他の(環境)要因によって引き起こされる48時間以内に死亡しました。,

表4キャリアごとのリッターにおける16bp SPTBN4フレームシフト削除のジェノタイピング。 遺伝子型クラスあたりの合計は太字で示されています。
SPTBN4欠失のホモ接合子豚は、ミオパチーと後肢麻痺に苦しんでいます
私たちは、最近のCxCリター(分娩日:April28th2019)を監視し、健康な二つの影響を受けた(サンプル:9912、9916)(図2A)、, 我々は、二つの影響を受けた子豚のホモ接合SPTBN4欠失状態を確認した(表S2)。 さらに,健常人の間で四つのヘテロ接合体キャリアと二つのホモ接合野生型子豚を観察した。 死産子豚の一つ(サンプル:9921)はまた、欠失のためにホモ接合であり、他の二つはヘテロ接合であった。 罹患した子豚は、極度の筋力低下(図2B、C)、後肢の麻痺、および振戦(S1ビデオ)に苦しんでいる。 したがって、子豚は歩くことも飲むこともできなかった。,
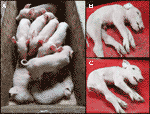
図2(A)二つの影響を受けた子豚(生きている)六つの健康な同腹子と一緒に。 子豚は28日に産まれたCxCの交配から派生しますApril2019。 (B)影響を受けた雄の子豚9912。 (C)影響を受けた雌の子豚9916。
影響を受けた子豚は、背側および後肢骨格筋における交差線条を欠いています
病理組織学的検査は、両方の子豚における筋線維の散在変性、および子豚(ID=9912)のいずれかにおける背側筋における焦点壊死および血管炎を明らかにした。, さらに、リンタングステン酸ヘマトキシリン(PTAH)染色は、骨格筋線維の発散着色を示し、特に影響を受けた動物の背側および後肢の筋肉における交差線条の減少を示す(図3B)が、前脚は影響を受けないように見える(図3A)。 交差線条の減少は、異常な着色および筋線維の体積の一般的な損失によって示される(図3B)。 病理組織学的に観察された後肢および背側筋の変化は筋ジストロフィーの指標である。,

図3(A)前脚からの骨格筋の断面図。 黒い矢印は、交差線条の存在を示す筋繊維の正常な着色(暗い)を示す。 PTAHバー=50μm。 (B)後肢からの骨格筋の断面図。 黒い矢印は、交差線条の欠如を示す筋線維の異常な着色(ピンク)を示す。 黄色の矢印は、通常の着色および交差線の存在を示す。 PTAHバー=50μm。,
ディスカッション
この作品では、16bpフレームシフト欠失SPTBN4遺伝子のために可能性が高い子豚死亡を引き起こす新規先天性欠損を報告します。 子豚は極度の筋力低下(ミオパチー)に苦しみ、出生後数時間以内に死亡する。 この欠失は、スペクトリンβ、非赤血球性4タンパク質の完全な機能喪失を与えることが期待される。 SPTBN4はスペクトリン遺伝子のファミリーのメンバーであり、Ranvierのノードでのイオンチャネルクラスタリングに必要であり、活動電位に影響を与える(Devaux、2010)。, 突然変異は、主に軸索初期セグメント(AIS)およびRanvierの節において、イオンチャネルの適切な局在および軸索ドメインの機能を制御する細胞骨格機構を乱す(Wang et al., 2018). 具体的には、SPTBN4の影響を受けるC末端ドメインは、Kcnq2チャネルトラフィックとRanvier(Devaux、2010)のノードでの興奮性のために重要です。
その後の追跡調査により、ヒトおよびマウスの症例が特定され、その後の症候群は直ちに致死的ではなく、むしろ重度のミオパチーを与える可能性があることが示された。, 繁殖集団のすべての動物に利用可能な中密度SNP遺伝子型データ(N=31,839)によって、キャリアを同定することができた。 これらのキャリアの中には、同じくキャリアであったイノシシによって播種された、識別時に妊娠中期のほぼ中期の雌豚がありました。 繁殖農場は、出生時にごみを文書化するように通知されました。 影響を受けた子豚(ミオパチー、後肢麻痺、振戦)の観察された表現型は、SPTBN4遺伝子(OMIM:606214)におけるホモ接合性機能喪失または化合物ヘテロ接合変異を有するヒト患者において観察されたものと完全に一致していた。, 二つのヒト患者は、PHドメイン内で機能喪失の突然変異を有する(Wang et al.,2018)、ブタにおけるPHドメインの喪失は、SPTBN4タンパク質の完全な機能喪失につながる可能性が高いことを支持している。 ヒトにおいて、同様の突然変異は、筋肉i型線維、神経障害、および難聴の欠如によって引き起こされる重度の先天性ミオパチーをもたらす(Knierim et al.,2017;Wang et al., 2018). Wangら。 (2018)はまた、先天性低緊張、重度の衰弱、および幼児期による深部腱反射の喪失を特徴とするいくつかの患者において、運動軸索神経障害を観察した。, また、神経生検は、神経系機能不全を引き起こす分子病理を明らかにし、減少結節Na+チャネルとノー結節KCNQ2K+チャネルを明らかにしました。 したがって、我々は、このフレームシフトバリアントは、集団におけるホモ接合遺伝子型の観察された表現型および枯渇につながる可能性が高い原因変異であると結論している。 今後の研究は、ブタにおけるSPTBN4遺伝子のin vivoノックアウトを行い、症候群および関連する表現型をより詳細に研究することに焦点を当てること,
前肢の筋線維の変性は観察されなかったが、背側および後肢の筋線維は明らかに影響を受けた。 この観察は、後肢麻痺を部分的に説明することができるが、前肢は影響を受けない。 前肢筋線維と後肢筋線維の間の不一致は、SPTBN4損失機能変異が運動神経障害、後肢麻痺、振戦、および中枢性難聴を引き起こす震えマウスにも記載されている(Parkinson et al.,2001;駒田とソリアーノ,2002). Parkinson et al., (2001)は、末梢後肢神経障害を引き起こす震え対立遺伝子を有するマウスの坐骨神経における神経伝導速度の低下を記述する。 マウスにおけるSPTBN4の発現は脳、脊髄、坐骨神経に制限され、骨格筋には観察されないので、この疾患は主に神経欠損である。 全体的には、どのメカニズムが前肢に症状がない原因となるのかは不明のままである。 ブタは通常、げっ歯類種と比較してヒト疾患を研究するためのより良いモデルであるため、ブタにおけるこの”自然ノックアウト”は、ヒト疾患を研究するのに有用な資源となり得る。, さらに、SPTBN4関数の損失の結果をより詳細に研究することができる。
研究中の品種の有効集団サイズ(Ne)は約100と推定されている(Hidalgo et al., 2016). 動物育種では、低いNeは有害な対立遺伝子が偶然に頻度で上昇するリスクを増加させる。 さらに、以前の研究では、劣性致死対立遺伝子は、ヘテロ接合体における有利な効果によって駆動され得ることが示されている(Derks et al.,2018;Matika et al., 2019). Matika et al., 2019年、ヘテロ接合体における筋肉の深さの大きな増加に関連するMSTN遺伝子の劣性停止得られた突然変異を発見した。 しかし、我々は我々の研究で任意のヘテロ接合性利点の証拠を見つけることはありません。 現在のゲノム技術では、我々は今、より高い周波数に漂って有害な対立遺伝子を識別し、より効果的なパージを可能にする、正確に新規有害対立遺伝子の出 さらに、このタイプの研究の結果は、ブリーダーと農家の両方のレベルで”隠された”遺伝的欠陥の意識を大幅に改善するでしょう。, 事前の情報がなければ、まれな先天性欠損症はしばしば”弱い子豚”として記録される。”そして、特定の症候群のさらなる区別がなければ、さらなる行動は不可能である。 ほとんどの場合、遺伝的根拠があるかどうか、または他の交絡効果がある可能性があるかどうかは不明です。 以前のゲノム情報を使用すると、症候群を同定することができ、他の症例と比較して、およびキャリアを同定し、実用的な情報につながる。
子豚の死亡率は、経済的および動物福祉の重要性が高い。, したがって、SPTBN4突然変異の発見は、キャリアごとの交配の頻度を最小限に抑えるために繁殖プログラムに即時に実装することにつながっている。 これは影響を受けた個人の生れを避けることを可能にしそれにより動物福祉を改善し、経済的損失を減らす。
結論
本研究では、豚のSPTBN4遺伝子における劣性フレームシフト欠失によって引き起こされる可能性の高い新規先天性欠損を報告します。 この知見は、ヒトおよびマウスにおけるSPTBN4関連症候性表現型との顕著な類似点によって支持されている。, この研究は、集団から有害な対立遺伝子を監視し、パージすることを可能にする。 キャリアごとの交配を防止し、影響を受けた個体を排除し、それによって経済的損失を減少させ、動物福祉を改善することができる。 最後に、育種産業で得られたこれらの”自然なノックアウト”は、ヒト疾患のモデルを提供し、哺乳類のクレード内の遺伝子機能の理解を高め、ヒト疾患の潜在的なモデルを提供することができる。,
Data Availability Statement
Ethics Statement
この研究で使用されたデータはTopigs Norsvin繁殖プログラムからの日常的なデータ収集の一部として得られており、特にこのプロジェクトの目的ではないため、動物実験には倫理的なレビューと承認は必要ありませんでした。 したがって、倫理委員会の承認は必須ではなかった。 サンプル収集およびデータ記録は、オランダの動物保護および福祉に関する法律(Gezondheids-en welzijnswet voor dieren)に従って厳密に実施された。, この研究への動物の参加について、所有者から書面によるインフォームドコンセントが得られた。
著者の貢献
MG、H-JM、およびMDがこの研究を考案し、設計しました。 BHは、Topigs Norsvinと農民との一般的な組織とコミュニケーションを担当しました。 MDおよびMLはデータ解析を行った。 BDおよびKLは実験室の仕事を行った。 SG-Vは病理学的解析を行った。 MDは原稿を書いた。 H-JM、MG、BH、SG-V、BD、KL、およびMLは、有用なコメントや提案を提供し、原稿を起草するのに役立ちました。 表現型データをMLにより分析した。, すべての著者は、最終的な原稿を読んで承認しました。
資金調達
この研究は、STW-Breed4Foodパートナーシップ、プロジェクト番号14283によって資金を供給されました:シーケンスから表現型へ:機能の予測による有害 この研究は、NWO-TTWとBreed4FoodパートナーのCobb Europe、CRV、Hendrix Genetics、Topigs Norsvinによって財政的に支援されました。 さらに、この研究は画像プロジェクト(Horizon2020、No.677353)によって支援されました。 資金提供者は、研究デザイン、データ収集と分析、出版の決定、または原稿の準備には何の役割も持っていませんでした。, HPCクラスターの使用はCATAgroFood(共有研究施設Wageningen UR)によって可能になりました。
免責事項
この研究で使用されたデータは、Topigs Norsvin繁殖プログラムからの日常的なデータ収集の一環として得られたものであり、特にこのプロジェクトの目的のためではありません。 したがって、倫理委員会の承認は必須ではなかった。 サンプル収集およびデータ記録は、オランダの動物保護および福祉に関する法律(Gezondheids-en welzijnswet voor dieren)に従って厳密に実施された。,
利益相反
MLとBHは、資金提供者の一人(Topigs Norsvin)と密接に関連する研究所であるTopigs Norsvin Research Centerの従業員です。
残りのすべての著者は、研究が潜在的な利益相反と解釈され得る商業的または財政的関係がない場合に行われたと宣言しています。
他のBreed4Foodパートナー Cobb Europe、CRV、Hendrix Geneticsは、この研究のための競合する利益を持っていないと宣言しています。,
謝辞
著者は、農場とのコミュニケーションを組織するためのFrank van HaarenとToon Janssenに感謝します。 私たちは、病理学的検査への彼女の貢献のためのマノンHoubenに感謝します。 私たちは、出生後の影響を受け、健康な子豚のビデオや写真を撮ってくれたMout Villerに感謝します。 私たちは、ハンドオーバー後の子豚の世話をするためのユルゲンHarliziusに感謝します。 私達はサンプルコレクションのためのGerda van Eldikに感謝する。 私たちは、Topigs-Norsvinからの一般的なサポートと指導のためのEgbert KnolとEgiel Hanenbergに感謝します。,
補足資料
ビデオS1|出生後の両方の影響を受けた個人を示すビデオ。
表S1|Ssc6ハプロタイプを有する高LDにおけるゲノム変異。
表S2|影響を受けた個体を含むCxCリターのジェノタイピング(分娩日:April28th2019)。 表は、二つの影響を受けた子豚9912,9916のホモ接合del/delステータスを示しています。
表S3|WGSサンプルからのマッピングおよびカバレッジ統計。
図S1/SPTBN4削除キャリア周波数2007年から2019年。