はじめに
Hincheyらによって最初に記載された後可逆性脳症症候群(PRES)。 1996年には、様々な臨床プレゼンテーションと血管原性浮腫の頭頂部-後頭部優勢パターンの典型的な画像所見を有する神経障害を表している(1、2)。 PRESの多数の文書化された原因が、最初に高い動脈圧の設定で記述されていてケースがあります。, PRESが見られる臨床シナリオの例としては、高血圧緊急症、(pre)子癇、腎疾患、自己免疫疾患、および細胞傷害性薬物などが挙げられる(3、4)(表1)。 PRESは、任意の年齢層で発生し、女性患者(で高い発生率を有することができる7、8)。 現在の文献は成人集団と比較して比較的疎であるが、小児患者におけるPRESについては特に言及すべきである。, 小児患者は、成人集団と同様の臨床症状を有し、高血圧、発作、および精神状態の変化が一般的な疾患症状である(9)。 腫瘍学患者、特に幹細胞移植後の患者(10、11)で報告されている小児PRESのほとんどの症例にもかかわらず、Guptaらによる研究。 (12)腎疾患は、おそらく小児患者のPRESの最も一般的な原因であることがわかった。 彼らの研究では、小児患者は、前頭葉の関与(62.5%)を含むより非定型の画像所見(56%)を有する傾向があった。,
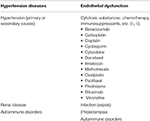
テーブル1. PRESに関連付けられている主要な疾患状態。
臨床症状は急性から亜急性であり、頭痛および視覚障害からより重篤な症例における意識レベルの変化および発作までの範囲である(1)。 治療は、一般的に根本的な原因を標的とすることを目的としており、ほとんどの場合、一般的に可逆的な症状および画像所見を有する(8)。, 結果は適切な管理と一般に好ましいが、悪い臨床結果は脳梁の既存の糖尿病および介入と関連付けられた;しかし、予後のための他の信頼できるイメージングバイオマーカーは現在欠けている(13)。 神経放射線イメージングは、最高の磁気共鳴イメージング(MRI)(上で理解される典型的なイメージング機能とPRESの診断における基本的な役割を果たしている2)。
病態生理
PRESの背後にある正確な病態生理学的メカニズム(複数可)はまだ完全に解明されておらず、議論の余地がある(3)。, 現在、PRESの病態生理には二つの主要なメカニズムが提案されています(図1)。 最初の理論は、主な要因(として増加した動脈圧を提案している8)。 血圧の急速な上昇は、最終的に血管漏出および結果として生じる血管形成性浮腫(引き起こす脳血管系の自己調節能力を克服する14)。 タイトジャンクション(通過するタンパク質と最終的な血液脳関門(BBB)機能不全があります15)。, 後部循環によって供給される領域(椎骨動脈、脳底動脈、および後大脳動脈)は、脳底動脈の血管系のsympathetic神経緊張の欠如のために、前部循環(内頸動脈、中大脳動脈、および前大脳動脈)に比べて例外的なリスクがある(8)。, いくつかによって提案された関連理論は、免疫抑制剤シクロスポリンAおよびFK-506(16)で治療されている患者で観察されたように、極端な高血圧は血管攣縮およびBBBの故障および結果として生じる血管形成浮腫を引き起こす局所虚血をもたらすと仮定している。 BBBの破壊は、血管原性浮腫対細胞傷害性浮腫の典型的な所見を引き起こす(急性梗塞の設定で見られ、細胞死の設定における通常の浸透圧勾配の損失による細胞内水分量の増加を表す17)。,
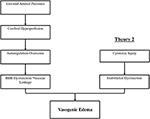
図1. PRESの病態生理の二つの主要な理論。 理論1は高血圧および大脳のhyperperfusion理論および理論2はendothelial機能障害の理論です。
第二の主要な理論は、PRES患者の最大30%が脳血管系の自己調節制御を超えるために必要な上昇した動脈圧を示さないという事実に対処する(18、19)。, この理論は、内皮機能不全が様々な内因性または外因性の毒素(によって引き起こされる可能性がある主な原因であることを提案している20)。 この理論は、免疫抑制薬および/または化学療法を受けている患者および敗血症(また、それらの患者に見られるPRESの所見を説明することができる21、22)。 このモデルでは、循環毒素は血管損傷を引き起こし、結果として血管形成性浮腫が発生する。 内皮損傷は、血管収縮剤および免疫原剤のさらなる放出を引き起こし、これは、血管攣縮および/または血管透過性の増加を引き起こし得る。, 最終的に、血管漏出および血管形成浮腫を可能にする内皮機能不全は、一次脳血管系異常(動脈性高血圧の場合)または循環毒素に続発するにもかかわらず、PRESの背後にある駆動要因である。 これら二つの理論の概要、ならびに以前に報告された化学療法剤および他の免疫抑制剤のリストを図2に示す。
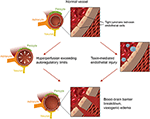
図2. PRESの基礎となる病態生理の二つの主要な理論のイラスト。, 謝辞:キャロラインO”Driscoll、MAの礼儀(彼女は彼女自身でこれを説明し、私たちの大学の従業員です)。
臨床症状は、脳の関与する領域に依存し、したがって、提示は広範であり得る。 例えば、後頭葉の一次関与は、視覚障害/幻覚をもたらす可能性がある。 焦点病変の位置に対応する焦点神経学的欠損は、PRES患者の-5-15%で起こる(23)。, まれに、脊髄の関与は、脊髄症または麻痺(の臨床徴候および症状をもたらすことがあります24)。
イメージング
その名前が示すように、PRESは、典型的には、後部優勢白質血管原性浮腫としてイメージング研究に現れる。 頭頂葉および後頭葉はほぼ普遍的に関与しており、所見は典型的に対称および両側である(1)。 特に上前頭溝に隣接する前頭葉の関与も一般的に見られる。, 血管形成性浮腫は、脳灰白質を含むことができるが、皮質下白質中ではしばしばより容易に認められる。 CT検査は、急性神経症状の設定における初期画像検査であることが多く、患部に白質低下を示すことがある(25)(図3:PRESのCT)。 全体として、所見は、CT(26)と比較して感度が高く、解剖学的特性評価が良好であるMRIによって最もよく描かれる。 さらに、MRIは、PRESと同様に臨床的に現れる可能性のある他の病理学的状態を区別するのに役立ち得る。, 特にT2重み付けおよびT2FLAIR(流体減衰反転回復)配列は、MRI上の血管形成性浮腫を検出するのに最も有用である(図4:PRESのMR;図5:PRESコロナのMR)。
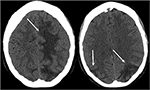
図3. 全身性エリテマトーデスおよび発作を呈する急速に進行する糸球体腎炎を有する患者。 頭部の非造影CT画像は、両側頭頂葉および後頭葉における血管形成性浮腫を示し、右よりも左に大きく、ならびに左前頭葉への拡張を示す。,
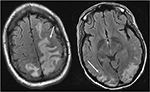
図4. 全身性エリテマトーデスおよび発作を呈する急速に進行する糸球体腎炎を有する患者。 頭部のT2-FLAIR画像は、両側頭頂葉および後頭葉における血管形成性浮腫を示し、右よりも左に大きく、ならびに左前頭葉への拡張を示す。 浮腫の血管形成性パターンでは、皮質に信号異常の温存があることに注意してください。
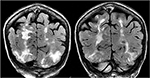
図5., 初めての捕捉と示すTacrolimusの原発性骨髄線維症そして骨髄の移植の歴史の患者。 冠状のT2-FLAIRシーケンスはPRESと典型的であるように両側の後頭部および頭頂葉の広範な信号の異常を示します。
PRESの鑑別診断は広範であり、類似の合流性T2白質高インテンシティを有する実体を含む。, 例としては、虚血/梗塞(特に後部循環)、脱髄疾患、感染病因(髄膜炎、脳炎)、進行性多巣性白質脳症(PML)、血管炎、および様々な代謝障害(27)が挙げられる。 可逆性脳血管収縮症候群(RCVS)と呼ばれる臨床的に関連する実体は、血管収縮をもたらす脳血管緊張の変化によって引き起こされると考えられている。, RCVSは再発雷鳴の頭痛、捕捉、打撃および臨床基礎のPRESと誤解されることができる非動脈瘤のくも膜下出血(28)として明示します。 この実体は、典型的には、産後の期間に、またはアドレナリン作動性薬物またはセロトニン作動性薬物への曝露後に生じる。 RCVは、典型的には、脳動脈を含む狭窄の多巣領域を示す血管造影研究と診断することができる(29)。 この診断はRCVSおよびPRESが頻繁に付随して起こるという事実と混同することができます、神経放射線学者は誤診を避けるために知っておくべきです(30)。,PRESは、典型的には、急性虚血と区別することができるが、これは、後者が常に細胞傷害性浮腫および拡散制限を示すからである。 急性虚血における制限された拡散は、拡散重み付けイメージング(DWI)および見かけの拡散係数(ADC)で、ADC上の対応する減少したシグナルを持つDWI上のハイパーインテンスシグナルとして容易に検出することができる(細胞内水分子の比較的減少した動きによる)。, 一方、PRESの設定における血管形成性浮腫は、ADC(31)上の対応する減少した信号を伴わないDWI上の高インテンス信号を示すことがある。 さらに、急性虚血は、片側性であり、特異な血管領域内にある傾向がある。 虚血性異常からPRESを区別するための拡散制限を評価することは一般的に信頼できるが、より古典的に見られる孤立した血管形成浮腫の領域に重ね合わせた拡散制限の領域に関連する可能性があるPRESのまれなケースがある。,
PRESにおける”高度な”イメージング技術は、最近、困難またはあいまいな場合に補助ツールとして記述されている。 これらの高度なイメージング技術には、CT/MR灌流、MR分光法(MRS)、磁化率重み付けイメージング(SWI)、および放射線トレーサーを変化させる単一光子放出断層撮影(SPECT)および陽電子放出断層撮影(PET)を含む核医学技術が含まれる。 完全な議論はこのレビューの範囲を超えていますが、PRESの診断を示唆するのに役立つこれらの高度な技術では、さまざまな画像所見が見られます。, 過灌流は、低灌流の症例が報告されているが、灌流までの時間および平均通過時間(32)を伴う脳血流および血液量の増加によって示されるCT/MR灌流研究で見られることがある(33)。 MRSでは、n-アセチルアスパラギン酸(NAA)/クレアチン(Cr)およびNAA/コリン(Chol)比の減少が一般的にあり、正常なシナプスおよび神経軸索機能の破壊を示唆している(34)。 SWIはGREイメージングより高い感受性のPRESの出血の存在を、識別するのを助けることができます(35)。, SPECT/PETイメージングは、典型的には、FDG-PET(36)による低代謝を有する過灌流または低灌流(CT/MR灌流研究と同様)のいずれかを示す。
さらに、PRESは、急性播種性脳脊髄炎(ADEM)の設定において、自己免疫性脳炎などの他の状態と、前者のびまん性両側性で非対称性血管原性浮腫(37)によって区別, PMLは、PARIETO-occipital優位性を有するPRESと比較した場合、同様の外観を有することができるが、そのより一方的または非対称的な関与だけでなく、皮質下の白質(のための好みによって区別することができる38)。
非定型イメージング機能
PRESの非定型機能には、コントラスト強調、出血、または拡散制限の領域が含まれる(39)。, 頭頂葉および後頭葉が一般的に関与しているが、脳幹、小脳、脳梁および他の脳領域を含む非定型の関与の領域が見られ、前頭葉(最大68%に見られる)および下側頭葉(最大40%)(23、40)(図6:小脳、図7:脳幹)を含むより一般的な領域が見られることがある。
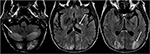
図6. 6週間前に肝移植を受けた患者。 肝移植後にタクロリムス投与を開始した。, 脳のT2-FLAIR画像は、後頭葉における信号異常を示す。 また、両側小脳半球および視床内に見られる広範な信号異常がある。 これらの所見はタクロリムスを中止した後すぐに解決した。
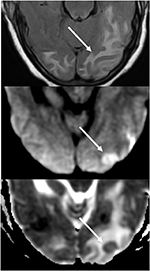
図7. 精神状態の変化と示す制御されていない高血圧の患者。 T2-FLAIR(上)画像は、後頭葉の浮腫を示しています。, DWI(中央)およびADCマップ(下)の画像は、DWI上のハイパーインテンス信号とADCマップ上の対応する低強度を持つ、制限された拡散の小さな矢印を示しています。
さらに、典型的な頭頂後頭浮腫に先行する可能性のあるPRESの早期発見には、中川らによって記載されているように、ポストコントラストT1重み付け画像における軽度のsulcal FLAIR高インテンシティおよびleptomeningeal増強が含まれる。 (41). Benziada-Boudour et al., (42)制限された拡散(図8:拡散制限)で、その結果、細胞傷害性浮腫の同時発生について説明しました。 疾患プロセスの名前に固有の、PRESに関連する所見は通常可逆的であり、扇動する問題が治療されると臨床所見および画像所見の正常化が行われる。 しかし、いくつかのケースでは、制限された拡散の領域は、最終的に脳実質に永久的な損傷をもたらす可能性があります(図9:層流壊死)。, 出血はPRESではあまり一般的に見られず、症例の5-30%に起こるが、PRESの適切な臨床設定においてこの所見を別の病理学的実体と間違えないように認められるべきである(39)。 出血における画像所見には、限局性血腫、点状回出血、および/またはくも膜下出血(43)が含まれ得る(図10:出血)。
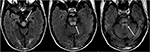
図8. タクロリムスで二週間前に肝移植の病歴を有する患者。, T2-FLAIR画像は、中脳、橋、および上小脳脚内の信号異常を示しています。
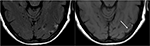
図9. 制御されていない高血圧の患者におけるT2-FLAIR(左)画像およびPRESを示す前の画像(図6参照)は、現在制御され、6週間後に、以前に見られた浮腫の解決を示 傷害による神経膠症の小さい区域は左の側頭葉で見られます。 軸方向非コントラストT1は、PRESに関連する前の傷害に関連する曲線状皮質層流壊死を示す。, PRESは一般的に完全に可逆的ですが、状況によっては永久的な傷害を引き起こす可能性があります。
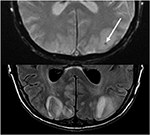
図10. タクロリムスの前のレバー移植を用いる患者。 T2グラデーションリコールエコー(上)は、左後頭葉の血管形成浮腫内の出血の焦点領域を示しています。 T2-FLAIRは、両側後頭葉における信号異常を伴うPRESに関連するより典型的な所見を示している。,
治療
PRESの治療は、典型的には、PRES(44)を引き起こす一次病因を制御することを目的としている。 例えば、動脈圧が上昇した場合、治療は、高血圧の緊急性/緊急性(のアプローチと同様に、制御された環境での血圧の上昇を修正することを目的としている45)。 典型的には、急激な血圧低下の結果として虚血性脳疾患を引き起こすリスクを回避するために、血圧の非急速な低下が求められる(46)。, 場合によっては、抗けいれん薬が補助療法として使用されることがありますが、最適な薬剤、タイミング、治療期間は議論の余地があります(4)(図11:前と後)。
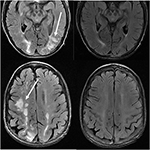
図11. タクロリムスの原発性骨髄線維症および骨髄移植の病歴を有する患者。 軸方向T2-FLAIR画像は、頭頂葉および後頭葉、および右前頭葉(左画像)における信号異常の領域を示す。, タクロリムスを停止し、フォローアップ画像(右の画像)は、最初の画像の6週間後に得られた。
(前)子癇の場合、治療は胎児の適時の送達、ならびに発作予防のための血圧管理および硫酸マグネシウムを目的としている(47)。 化学療法または他の免疫抑制剤によって誘導されるPRESの設定では、薬物の先細りまたは絶対中止は、臨床的および放射線学的改善の両方を示している(48)(図12:子癇)。, 低マグネシウム血症は、PRESにおける一般的な所見であり、病因の可能性がある。 したがって、著者らは、マグネシウム補給がPRES管理に有用な補助剤である可能性があることを示唆している(49)。
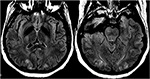
図12. 子癇の患者および発作を呈する患者。 軸T2-FLAIR画像は、両側後頭葉における対称信号異常を示す。,
結論
PRESは、無数の十分に文書化された原因に加えて、特徴的な臨床的および神経放射線学的所見を持つユニークなエンティティです。 PRESの背後にある正確な病態生理学的機構はまだ解明されていない(実際には相互に関連するプロセスの組み合わせによるものかもしれない)が、一般, イメージング機能は、最高の多くの非定型イメージング機能が見ることができ、挑戦的なケースを評価するときに心に留めておく必要がありますが、頭頂-後頭優勢白質T2高インテンシティを明らかに流体感受性MRシーケンスで評価されます。 さまざまな高度イメージ投射用具は困難でか曖昧な場合で助けて利用できる。 治療は、血圧モニタリングと発作予防の可能性に特に注意を払って根本的な原因を管理することを目的としています。,
著者の貢献
利益相反
著者は、この研究が潜在的な利益相反と解釈され得る商業的または財政的関係がない場合に行われたこと
1. バルティンスキー-ウィリアムズ 後可逆性脳症症候群、パート1:基本的なイメージングと臨床的特徴。 アムジェラジオール (2008) 29:1036–42. ドイ:10.3174/ajnr.,A0928
CrossRef Full Text | Google Scholar
3. Bartynski WS. Posterior reversible encephalopathy syndrome, Part 2: controversies surrounding pathophysiology of vasogenic edema. Am J Neuroradiol. (2008) 29:1043–9. doi: 10.3174/ajnr.A0929
CrossRef Full Text | Google Scholar
5. Singer S, Grommes C, Reiner AS, Rosenblum MK, DeAngelis LM. Posterior reversible encephalopathy syndrome in patients with cancer., Oncologist. (2015) 20:806–11. doi: 10.1634/theoncologist.2014-0149
PubMed Abstract | CrossRef Full Text | Google Scholar
6. How J, Blattner M, Fowler S, Wang-Gillam A, Schindler SE. Chemotherapy-associated posterior reversible encephalopathy syndrome: a case report and review of the literature. Neurologist. (2016) 21:112–7. doi: 10.1097/NRL.,0000000000000105
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Habetz K, Ramakrishnaiah R, Raina SK, Fitzgerald RT, Hinduja A. Posterior reversible encephalopathy syndrome: a comparative study of pediatric versus adult patients. Pediatr Neurol. (2016) 65:45–51. doi: 10.1016/j.pediatrneurol.2016.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Fugate JE, Rabinstein AA., Posterior reversible encephalopathy syndrome: clinical and radiological manifestations, pathophysiology, and outstanding questions. Lancet Neurol. (2015) 14:914–25. doi: 10.1016/S1474-4422(15)00111-8
CrossRef Full Text | Google Scholar
9. Zama, D, Gasperini P, Berger M, Petris M, De Pasquale MD, et al. A survey on hematology-oncology pediatric AIEOP centres: the challenge of posterior reversible encephalopathy syndrome. Eur J Haematol. (2018) 100:75–82. doi: 10.1111/ejh.,12984
CrossRef Full Text | Google Scholar
12. Gupta V, Bhatia V, Khandelwal N, Singh P, Singhi P. Imaging findings in pediatric posterior reversible encephalopathy syndrome (PRES): 5 years of experience from a tertiary care center in India. J Child Neurol. (2016) 31:1166–73. doi: 10.1177/0883073816643409
PubMed Abstract | CrossRef Full Text | Google Scholar
13., ヒンドゥージャA,Habetz K,Raina S,Ramakrishnaiah R,フィッツジェラルドRT.後部可逆性脳症症候群の患者における悪い転帰の予測因子. イント-ジャパン所属。 (2017) 127:134–44. doi:10.3109/00207454.2016.1152966
PubMed Abstract|CrossRef Full Text|Google Scholar
15. マッケンジーら、ストランドガードS、グラハム-ディ、ジョーンズJV、ハーパー-アム、ファラー-JK。 ネコにおける急性誘発性高血圧症のpial細動脈の口径,局所脳血流および血液脳関門に及ぼす影響。 サークル-レジスタンス, (1976) 39:33–41. doi: 10.1161/01.RES.39.1.33
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bartynski WS, Zeigler Z, Spearman MP, Lin L, Shadduck RK, Lister J. Etiology of cortical and white matter lesions in Cyclosporin-A and FK-506 neurotoxicity. Am J Neuroradiol. (2001) 22:1901–14.
PubMed Abstract | Google Scholar
21. Bartynski WS, Boardman JF, Zeigler ZR, Shadduck RK, Lister J., Posterior reversible encephalopathy syndrome in infection, sepsis, and shock. Am J Neuroradiol. (2006) 27:2179–90.
PubMed Abstract | Google Scholar
22. Mayama M, Uno K, Tano S, Yoshihara M, Ukai M, Kishigami Y, et al. Incidence of posterior reversible encephalopathy syndrome in eclamptic and patients with preeclampsia with neurologic symptoms. Am J Obstet Gynecol. (2016) 215:239.e1–e5. doi: 10.1016/j.ajog.2016.02.,039
PubMed Abstract | CrossRef Full Text | Google Scholar
23. McKinney AM, Short J, Truwit CL, McKinney ZJ, Kozak OS, SantaCruz KS, et al. Posterior reversible encephalopathy syndrome: incidence of atypical regions of involvement and imaging findings. Am J Roentgenol. (2007) 189:904–12. doi: 10.2214/AJR.07.2024
PubMed Abstract | CrossRef Full Text | Google Scholar
24., de Havenon A, Joos Z, Longenecker L, Shah L, Ansari S, Digre K. Posterior reversible encephalopathy syndrome with spinal cord involvement. Neurology. (2014) 83:2002–6. doi: 10.1212/WNL.0000000000001026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Dandoy CE, Linscott LL, Davies SM, Leach JL, Myers KC, El-Bietar J, et al., Clinical utility of computed tomography and magnetic resonance imaging for diagnosis of posterior reversible encephalopathy syndrome after stem cell transplantation in children and adolescents. Biol Blood Marrow Transplant. (2015) 21:2028–32. doi: 10.1016/j.bbmt.2015.07.023
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Noda K, Fukae J, Fujishima K, Mori K, Urabe T, Hattori N, et al., Reversible cerebral vasoconstriction syndrome presenting as subarachnoid hemorrhage, reversible posterior leukoencephalopathy, and cerebral infarction. Intern Med. (2011) 50:1227–33. doi: 10.2169/internalmedicine.50.4812
CrossRef Full Text | Google Scholar
31. Doelken M, Lanz S, Rennert J, Alibek S, Richter G, Doerfler A, et al. Differentiation of cytotoxic and vasogenic edema in a patient with reversible posterior leukoencephalopathy syndrome using diffusion-weighted MRI. Diagn Interv Radiol., (2007) 13:125–8.
Google Scholar
32. Wartenberg KE, Parra A. CT and CT-perfusion findings of reversible leukoencephalopathy during triple-H therapy for symptomatic subarachnoid hemorrhage-related vasospasm. J Neuroimaging. (2006) 16:170–5. doi: 10.1111/j.1552-6569.2006.00031.x
CrossRef Full Text | Google Scholar
33. Vanacker P, Matias G, Hagmann P, Michel P., Cerebral hypoperfusion in posterior reversible encephalopathy syndrome is different from transient ischemic attack on CT perfusion. J Neuroimaging. (2015) 25:643–6. doi: 10.1111/jon.12158
CrossRef Full Text | Google Scholar
34. Lee SY, Kim SH, Lee SH, Baek HJ, Shon HS, Kim SS. Serial MR spectroscopy in relapsing reversible posterior leukoencephalopathy syndrome. Neurologist. (2009) 15:338–41. doi: 10.1097/NRL.,0b013e3181914af6
PubMed Abstract | CrossRef Full Text | Google Scholar
35. McKinney AM, Sarikaya B, Gustafson C, Truwit CL. Detection of microhemorrhage in posterior reversible encephalopathy syndrome using susceptibility-weighted imaging. Am J Neuroradiol. (2012) 33:896–903. doi: 10.3174/ajnr.A2886
PubMed Abstract | CrossRef Full Text | Google Scholar
38., Berger JR,Aksamit AJ,Clifford DB,Davis L,Koralnik IJ,Sejvar JJ,et al. PML診断基準:aan neuroinfectious diseaseセクションからのコンセンサスステートメント。 神経内科 (2013) 80:1430-8. 土井:10.1212/0b013e31828c2fa1
PubMed Abstract|CrossRef Full Text|Google Scholar
39. Aracki-Trenkićおよび、Stojanov D、Trenkić M、Radovanovic Z、Ignjatovic J、Ristic S、et al。, Atypical presentation of posterior reversible encephalopathy syndrome: clinical and radiological characteristics in eclamptic patients. Bosn J Basic Med Sci. (2016) 16:180–6. doi: 10.17305/bjbms.2016.1201
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Bartynski WS, Boardman JF. Distinct imaging patterns and lesion distribution in posterior reversible encephalopathy syndrome. Am J Neuroradiol. (2007) 28:1320–7. doi: 10.3174/ajnr.,A0549
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Brickman AM, Reitz C, Luchsinger JA, Manly JJ, Schupf N, Muraskin J, et al. Long-term blood pressure fluctuation and cerebrovascular disease in an elderly cohort. Arch Neurol. (2010) 67:564–9. doi: 10.1001/archneurol.2010.70
PubMed Abstract | CrossRef Full Text | Google Scholar
47., Cozzolino M, Bianchi C, Mariani G, Marchi L, Fambrini M, Mecacci F. Therapy and differential diagnosis of posterior reversible encephalopathy syndrome (PRES) during pregnancy and postpartum. Arch Gynecol Obstet. (2015) 292:1217–23. doi: 10.1007/s00404-015-3800-4
PubMed Abstract | CrossRef Full Text | Google Scholar
48. Masetti R, Cordelli DM, Zama D, Vendemini F, Biagi C, Franzoni E, et al. PRES in children undergoing hematopoietic stem cell or solid organ transplantation. Pediatrics., (2015) 135:890–901. doi: 10.1542/peds.2014-2325
CrossRef Full Text | Google Scholar