April13,2017,nciスタッフによって
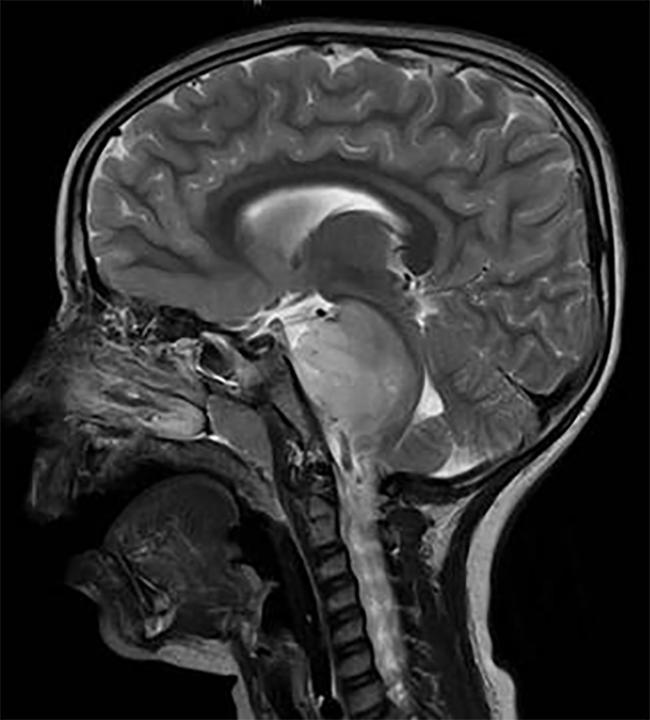
脳幹に位置するDIPG腫瘍を有する子供の脳スキャン。
二つの別々の研究は、手術不能小児脳腫瘍、びまん性内因性橋神経膠腫(DIPG) ブロックこれらの目標と治験薬が腫瘍の成長モデル動物を用いたDIPG.
脳幹に位置する腫瘍であるDIPGは、ほぼ均一に致命的である。,
“小児神経腫瘍学者として、それは私たちが見る最も壊滅的な腫瘍の一つです”と、Dana-Farber/Boston Childrenの癌および血液障害センターのPratiti Bandopadhayayay、M.B.B.S.、Ph.D.は言いました。 ない”治療の治療ではこれらを標的とすることを見いだした。”
DIPG腫瘍の大部分は特定の遺伝子変異を持っていますが、変異タンパク質が腫瘍発生にどのような役割を果たしているのか、そしてその機能が治療法によって標的とされるのかどうかは以前は不明でした。,
両方の新しい研究について、研究チームは、この突然変異を有するヒトDIPG細胞の生物学を調査し、それらを治療に対して脆弱にする可能性のある特 彼らは、対照治療と比較して、PRC2およびBET阻害剤として知られている薬物が、マウスモデルのDIPG腫瘍を縮小し、マウスの寿命を延ばすことを見出した。
両方の研究の結果は、ノースウェスタン大学の研究グループとデンマークのコペンハーゲン大学のグループからのもので、27日にNature Medicineに掲載されました。,
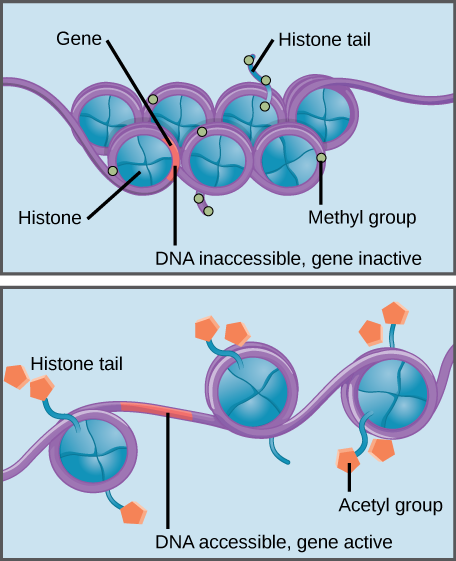
ヒストンメチル化は、ヒストン–DNA相互作用を強化し、関連遺伝子を遺伝子発現にアクセスできなくする(非アクティブ)。 ヒストンアセチル化は相互作用を弱め、関連する遺伝子を遺伝子発現にアクセスできるようにする(アクティブ)。
ターゲットを特定する
約5年前、研究者はStに取り組んでいます。, ジュード-ワシントン大学小児がんゲノムプロジェクトは、DIPG腫瘍の約80%がヒストンH3と呼ばれるタンパク質の遺伝子に特異的な変異を有すること
このような高い割合の腫瘍がこの同じ突然変異を有することは、DIPG研究コミュニティにとって驚きであった、とノースウェスタン大学ファインバーグ医科大学のAli Shilatifard博士は述べている。
ヒストンは、DNAをコンパクトな構造にパッケージするのに役立つタンパク質のファミリーで, DNAの短いセクションはスプールの糸のようなヒストン蛋白質のまわりで巻き、たくさんのDNA包まれたヒストン(ヌクレオソームと呼ばれる)は各染色体を
ヒストンに対する特異的修飾は、遺伝子発現を促進または防止することができる。 例えば、アセチル基と呼ばれる化合物がヒストンに結合すると、DNAとの相互作用が弱くなり、遺伝子発現が促進されます。 一方、ヒストンへのメチル基の付加は通常DNAをヒストンのまわりでより堅く巻かせ、遺伝子発現を防ぎます。,
DIPG患者におけるヒストンH3変異の存在を特定することが最初のステップであった、とBandopadhayay博士は述べた。 “しかし、その変化で腫瘍を治療できるようにするには、突然変異が何をしているのかを理解する必要があります”と彼女は付け加えました。
以前の研究では、Shilatifard博士と彼の同僚は、変異ヒストンH3遺伝子の機能を研究するためにショウジョウバエを使用しました。 正常なヒストンH3タンパク質を持っていたハエと比較して、変異体バージョンを持つハエは、アセチル基(アセチル化)をちりばめたより多くのヒスト, 次に、これらのアセチル化ヒストンは、遺伝子発現を調節するブロモドメイン含有(BRD)タンパク質と呼ばれる分子によって結合された。
nciによって部分的に資金提供された彼らの現在の研究のために、ノースウェスタンの研究者は、変異体ヒストンがヒト細胞において同じ機能を有 実際、彼らは、変異したヒストンH3遺伝子を発現するように改変されたヒト結腸癌または腎臓癌細胞は、正常なヒストンH3遺伝子を発現する細胞よりも多くのアセチル化ヒストンを有することを見出した。
最初の著者、Andrea Piunti、Ph.D., その後、三つの患者からDIPG腫瘍細胞のゲノム全体に位置するすべての変異H3ヒストンを調べた。 彼の分析の結果多くのヌクレオソームに含まれる変異型ヒストンがアセチル化および拘束されBRDタンパク質
追加の実験は、BRDタンパク質がDIPG腫瘍増殖に直接役割を果たす可能性があることを示した。 BET阻害剤と呼ばれるBRDタンパク質をブロックする治験薬でヒトDIPG細胞を治療すると、対照治療と比較してDIPG細胞の成長が遅くなりました。, そして、ヒトDIPG細胞を脳幹に移植したマウスの研究では、BET阻害剤で治療されたマウスは、対照治療で治療されたマウスよりも小さな腫瘍を有し、長
これらの実験は、”BET阻害剤がDIPGの潜在的な治療的アプローチを提供することを示唆している”とShilatifard博士は述べた。 前臨床研究では、白血病や神経膠芽細胞腫を含むいくつかの異なる癌タイプもBET阻害剤に感受性であることが示されている、と彼は付け加えた。,
追加のターゲット
変異ヒストンH3を有するヒトDIPG腫瘍細胞の北西グループの分析はまた、より多くのヒストンH3アセチル化に加えて、多くのヒストンがメチル基(メチル化)で装飾されたことを明らかにした。 さらに、ヒストンH3タンパク質にメチル基を結合させるPRC2と呼ばれる酵素が、これらのヒストンの多くの近くに存在することを発見した。
これらの結果は、北西部の研究者がPRC2の活動をさらに調べるよう促しました。, 彼らは、遺伝的にまたはタゼメトスタットと呼ばれるPRC2阻害剤のいずれかでPRC2活性を遮断すると、DIPG細胞の増殖が減少することを発見した。
“意外にも、これらの結果は、DIPGの成長の維持におけるPRC2機能の役割を示している”とNorthwestern groupは書いている。
Copenhagenグループはまた、DIPG腫瘍増殖を促進するPRC2の役割を支持する証拠を発見した。 彼らは、タゼメトスタットおよび別のPRC2阻害剤が変異ヒストンを有するマウス脳細胞またはヒトDIPG細胞の増殖を減少させたが、対照治療はしなかったことを観察した。,
そして、彼らはprc2が遺伝的にブロックされた正常マウスまたはマウスの脳に変異ヒストンを有するマウスの脳細胞を移植したとき、PRC2活性を欠いていたものはより長く生存した。
対照的に、しかし、ドイツの研究グループによる別の研究では、DIPGを有する異なる患者の細胞は、腫瘍がヒストンH3変異を有していたとしても、タゼメトスタットに感受性ではないことが分かった。
一歩前進
数十年にわたる臨床試験で、DIPG腫瘍は伝統的な化学療法に対して感受性がないことが示されている、とBandopadhayay博士は説明する。, また、放射線は症状を緩和することができますが、治癒的ではなく、DIPGのほとんどの子供は診断から2年以内に死亡します。
2015年、DIPG研究者の国際コンソーシアムは、利用可能なすべてのDIPG細胞サンプルを研究するために一緒にバンド。 彼らの研究は、いくつかの異なる患者から収集されたDIPG細胞がpanobinostat(Farydak®)と呼ばれるヒストン修飾薬によって殺されたことを明らかにした。 パノビノスタットは、ヒストンにアセチル基を付加する酵素をブロックする。, 現在、nciが支援する小児脳腫瘍コンソーシアムの一員である研究者は、第I相臨床試験において、DIPGの小児に対するパノビノスタットの安全性および最
現在、両方の研究からの結果は、潜在的に有望な新しい治療戦略を指している、とShilatifard博士は述べています。
“私たちは、DIPGの治療のためのフェーズI研究にBET阻害剤を移動したい、とAnn&シカゴのロバート-H-ルーリー小児病院で私たちの同僚は、これらの研究を進めている”と彼は言いました。,
さらに、いくつかの進行中の臨床研究は、様々な癌を有する成人および小児患者の両方において、PRC2阻害剤であるタゼメトスタットを試験している。 しかし、現在の研究では、特にDIPGの小児におけるtazemetostatを調査していません。
これらの治験薬が血液脳関門を通過してヒト脳腫瘍に到達する能力を有するかどうかを含む、Bandopadhayay博士はまだ多くの未回答の質問があると述べた。
博士, Bandopadhayayと彼女の同僚はまた、剖検から得られたものに加えて、生検から得られた腫瘍細胞を研究することによって、DIPG生物学についてもっと学んでいる。 生検サンプルの取得は、神経外科技術の大幅な改善によってごく最近になって可能になった、と彼女は説明した。
“それはエキサイティングな時間です”と彼女は言いました。 “今、進行中の作業がたくさんあります。 究極の目標は、これらの子供たちを治療できるようにすることです。”