はじめに
コアグラーゼ陰性ブドウ球菌(CoNS)、ブドウ球菌グループのメンバーは、グラム陽性球菌として特徴付けられ、単一細胞としてまたは不規則な処分を有する、不動、非胞子形成、カタラーゼ陽性、主に通性嫌気性菌であり、グラム陽性球菌として特徴付けられる。酵素コアグラーゼを欠いている。,1CoNSは、日和見病原体と考えられるヒト微生物叢の一部であり、主に未熟児および免疫不全および補綴患者に感染を引き起こす。2
近年の抗菌耐性の上昇は、CoNSによる院内感染に大きな影響を与えています。 Oxacillinはmethicillinの抵抗の検出およびぶどう状球菌の伝染の処置に感受性テストで使用する半合成のペニシリンです。 ただし、66%からのoxacillinの抵抗の95%への率はCoNSの臨床分離株で観察されました。,2オキサシリン耐性は、しばしば半合成ペニシリンに対する親和性が低い補足的なペニシリン結合タンパク質(PBP2a)をコードするmecA遺伝子によって媒介される。3mecA遺伝子は、ブドウ球菌カセット染色体mec(SCCmec)として知られる移動性遺伝要素上に位置し、Mec遺伝子とその調節遺伝子mecIおよびmecRIからなるmec複合体、SCCmecの統合および切除を担うccr複合体、およびSCCmec形成に必須ではないが非β-ラクタム耐性遺伝子を運ぶ可能性があるJ領域を含む。,4これまでに、ccr遺伝子複合体タイプとmec遺伝子複合体クラスの組み合わせに基づいて、13のSCCmecタイプが記載されている。 サブタイプは、mecおよびccr複合体の同じ組み合わせにおけるJ領域多型によって定義された。5
オキサシリン耐性分離株の出現は、グリコペプチドバンコマイシンなどのCoNS感染の治療のための代替抗菌剤の究極の使用につながっています。 一方、バンコマイシンに対する感受性および耐性の低下の記述は、ここ数十年で報告されている。,6バンコマイシンに対する感受性の低下は、ペプチドグリカン合成の促進などの代謝修飾に関連しており、細胞壁の肥厚をもたらす可能性がある。 このプロセスでは、バンコマイシンは、D-アラニル-D-アラニン部位の高い可用性のために枯渇するので、ペプチドグリカン合成を阻害することがで,7
CoNSによって引き起こされる院内感染の盛り上がりを考えると、本研究は、オキサシリン耐性株を特徴付け、Botucatu病院das Clínicas入院患者から血液培養CoNS分離株の20年
材料と方法ひずみ
三から百CoNS株は、Botucatu病院ダスClínicas-パウリスタ州立大学(UNESP)の入院患者からの血液培養から単離されました。, 分離株は1990年から2009年にかけて収集され、Botucatu Biosciences Institute-UNESPの微生物学および免疫学部門の培養収集研究所に保管された。 選択基準では、イベントの平均有病率が35%、誤差のマージンが5%、信頼区間が95%であると考えられていました。これらの株をKonemanらに従って単離した。8血液寒天分離株は、コロニー形態の観察のためにグラム染色を行い、ブドウ球菌属の確認のためにカタラーゼ試験を行った。, ブドウ球菌株をコアグラーゼ陰性およびコアグラーゼ陽性群の鑑別のためにコアグラーゼ試験に提出した。 コアグラーゼ陰性分離株を種の表現型同定のための生化学的試験に供した。 遺伝子型同定は、Coutoらによって記載されたITS-PCR(internal transcribed spacer–polymerase chain reaction)によって、16Sおよび23S遺伝子に隣接する保存された配列にわたって引き出されたプライマー9増幅効率は3%メタファーアガロースで電気泳動によって監視され、SYBR Safeで染色された。, The following lineages of international reference were used: S. auricularis ATCC 33753, S. capitis subsp. capitis ATCC 27843, S. capitis subsp. urealyticus ATCC 49325, S. caprae ATCC 35538, S. cohnii ATCC 49330, S. cohnii subsp. cohnii ATCC 29974, S. epidermidis ATCC 12228, S. epidermidis ATCC 35983, S. hemolyticus ATCC 29970, S. hominis ATCC 27844, S. hominis subsp. novobiosepticus ATCC 700237, S. lentus ATCC 700403, S. lugdunensis ATCC 700328, S. saprophyticus ATCC 15305, S. schleiferi subsp. schleiferi ATCC 43808, S. sciuri subsp. sciuri ATCC 29062, S. simulans ATCC 27851, S., xylosus ATCC29979、およびS.warneri ATCC10209。Dna抽出Dna抽出には、Illastraキット(GE Healthcare)を使用した。 このステップには、リゾチーム(10mg/mL)およびプロテイナーゼK(20mg/mL)によるブドウ球菌細胞の初期消化が含まれていた。 次に、500μlの抽出緩衝液を混合物に加え、これを10,000x gで4分間遠心分離した。 上清をカラムに移し、5,000gで1分間遠心分離した。 この流体を廃棄し、500μlの抽出緩衝液をカラムに加えた。, 遠心分離および回収された流体の廃棄の後、500μlの洗浄緩衝液をカラムに加え、これを20,000gで3分間遠心分離するために提出した。 次にカラムを1.5mlチューブに移し、200μlの温められたMilliQ水を用いて70℃で溶出を行った。
mecA遺伝子検出
MECA遺伝子の検出のためにPCRを行った。 反応は、Murakiami et al.10増幅効率は、SYBR Safeで染色した2%アガロースゲル中で電気泳動によって監視した。,
SCCmecの決定
SCCmecタイプをmecA陽性株について決定した。 反応は、Oliveair et al.11およびMachadoらによって修正された。12
マルチプレックスPCRは、50μlの反応容積で1X酵素緩衝液、1で行った。,25 U Taq polymerase DNA, 200 μM dNTP Mix, and the following primers: 10pmol of RIF2 F2 (TTCGAGTTGCTGATGAAGAAGG) and CIF2 R2 (ATTTACCACAAGGACTACCAGC), 6pmol of KDP F1 (AATCATCTGCCATTGGTGATGC) and KDP R1 (CGAATGAAGTGAAAGAAAGTGG), 5pmol of DCS F2 (CATCCTATGATAGCTTGGTC) and DSC R1 (CTAAATCATAGCCATGACCG), 5pmol of RIF4 F3 (GTGATTGTTCGAGATATGTGG), and RIF4 R9 (CGCTTTATCTGTATCTATCGC). For each reaction, 10μL DNA was added. The cycle sequencing reactions were performed at 92°C for 3min, followed by 30 cycles of 92°C for 1min, 56°C for 1min, and 72°C for 1min and 30s., 増幅効率は、SYBR Safeで染色した2%アガロースゲル中の電気泳動によって監視した。オキサシリン,バンコマイシン,ダプトマイシン,リネゾリド,キヌプリスチン/ダルフォプリスチンおよびチゲサイクリンについて,Cos株のinvitro感受性を試験した。 これらの薬物のMICは、E試験によって決定された。 感受性分類に使用された基準は、Sを除くCoNSに対するオキサシリン
μg/mL(感受性)であった。, lugdunensis(響≤2µg/mLおよび耐≥4µg/mL)、バンコマイシンµg/mL(響)、8日–16µg/mL(中間耐)、>32µg/mL(耐);Linezolid≤4µg/mL(く);Daptomycin≤1µg/mL;Quinupristin/Dalfopristin≤1µg/mL(響),2µg/mL(中級)、≥4µg/mL(耐); Tigecycline≤0.5μg/mLでした。,13バンコマイシンに対する感受性の低下の検出のためのスクリーニング試験
バンコマイシンに対する感受性の低下を検出するために、脳心注入(BHI)寒天と4μg/mL、6μg/mL、8μg/mL、および16μg/mLのバンコマイシンを用いたスクリーニング寒天試験を用いた。 参照ひずみ黄色ブドウ球菌ATCC29213、バンコマイシンの影響を受けやすい、陰性対照として使用され、株E.faecalis ATCC51299、バンコマイシンに耐性、陽性対照として。 2のスポット。,0マクファーランド接種物を寒天プレートに添加し、35℃で24時間インキュベートし、少なくとも一つのコロニーの成長は肯定的な結果と考えられた。
細胞壁の厚さの分析
バンコマイシンに対する感受性の低下を示したCoNS株は、細胞壁の厚さ分析のために透過型電子顕微鏡に提出された。 株をBHIブロスで培養し、37℃で24時間インキュベートした。マイクロチューブで、1000μlのCoNS培養液を12,000rpmで遠心分離した。 上清を廃棄した後、株をカルノフスキー溶液に固定した(2.,リン酸緩衝液中の5%グルタルアルデヒド0.1m)を四時間放置する。 試料を定着液から除去し、蒸留水で五分間三回洗浄した。 次に、サンプルを0.5%四酸化オスミウムに40分間浸漬し、蒸留水で10分間三回洗浄した。 サンプルは、アルコールの濃度を増加させることを用いて脱水した:10分で7回。,5%アルコール;10分で15%アルコール;10分で30%アルコール;10分で50%アルコール;15分で70%アルコール;15分で90%アルコール;10分で100%アルコール。 脱水の後で切株は金属で処理され、サンプル取付けられました。 分析は電子顕微鏡Tecnai Spirit Fei Companyで行われ、画像は30000×の倍率で得られた。,
結果分離株の同定
表1は、CoNS種分離株のソースだけでなく、菌血症を有する患者の人口統計データを提示します。
Meca遺伝子の検出およびSCCmecの特徴付け最小阻害濃度(MIC)の決定
CoNS感染の治療に使用される抗菌剤のMicをEテストによって決定した。 オキサシリン耐性は206(68.7%)CoNS株で発見され、25はチゲサイクリン耐性(8.3%)であった。 チゲサイクリンに対する耐性は、s.epidermidisの4.5%、S.hemolyticusの13.8%、S.の13%で検出された。, ホミニス、およびS.lugdunensisの11.1%。 キヌプリスチン/ダルフォプリスチンの場合、一つのs.epidermidis分離は2μg/mLのMICで中間抵抗を示し、一つのS.epidermidisと3μg/mLのMicで一つのS.hemolyticusを示した。 MecAの存在と比較したEテストによるオキサシリンMICの感度および特異性は、それぞれ87.4%および82.3%であった。
CoNS種に関しては、MIC50とMIC90のパラメータ分布は、S.hemolyticusにおけるオキサシリン耐性の高い割合を明らかにした。, これは、分離株の50%を阻害するための最小濃度が>256μg/mLであった唯一のCoNS種であり、オキサシリンに対するs.hemolyticusの高い抵抗率を反映していた(表3)。各抗菌薬のMIC範囲をSCCmecタイプと比較した。 Sccmeciとしてタイプされた分離株はより高いチゲサイクリンMicを示し,Sccmeciiとして分類された分離株は最も高いオキサシリンMicを示した。 SCCmecIV株は、バンコマイシン、リネゾリド、ダプトマイシン、およびキヌプリスチン/ダルフォプリスチンのための最高のMIC値を示した(表4)。
Determination of the MIC range according to SCCmec.
| MIC range (μg/ml) | ||||
|---|---|---|---|---|
| Antimicrobial | SCCmec I | SCCmec II | SCCmec III | SCCmec IV |
| Oxacillin | 0.094≥256 | 6≥256 | 0.,125≥256 | 0.125≥256 |
| Vancomycin | 0.25–2 | 0.38–2 | 0.125–2 | 0.75–2 |
| Linezolid | 0.064–1 | 0.19–0.5 | 0.047–0.75 | 0.064–1 |
| Daptomycin | 0.016–025 | 0.016–0.094 | 0.019–0.5 | 0.047–0.75 |
| Quinupristin/Dalfopristin | 0.025–1.5 | 0.094–0.5 | 0.064–1 | 0.125–2 |
| Tigecycline | 0.016–2 | 0.023–0.75 | 0.016–0.75 | 0.,032-1 |
MIC、最小阻害濃度。
評価は、オキサシリンおよびバンコマイシンMIC範囲の分布に応じて三つの期間に分けて、20年間にわたってオキサシリンおよびバンコマイシンMicの オキサシリンの場合、最初の期間(1990-2001)では、MICのより高い値が観察されたが、依然として感受性を示している。, 他の期間(2002年-2006年および2007年-2009年)では、MIC値の減少が観察され、依然として感受性および抵抗率の増加を示した。 バンコマイシンに関しては、同じ評価で、0.047μg/mLから0.38μg/mL、0.5μg/mLから2.0μg/mLまでのMicを有する株間で有意な差が示された(Fig。 1).
バンコマイシンに対する感受性の低下の決定
214(71.3%)株の成長は、バンコマイシンの4μg/mL、89(29.7%)バンコマイシンの6μg/mL、および8(2)とプレート上のBHIプレート,6%)8μg/mLバンコマイシンプレート上の分離株。 分離株のいずれもバンコマイシンの16μg/mLと培地中で成長しませんでした。 バンコマイシンで補完されたプレート上に成長を示さなかった株と4μg/mLバンコマイシンプレート上に成長した株との間にMICsに有意差はなかった。 バンコマイシンの6μg/mLの培地上で増殖を示したもののうち、MIC範囲は0.5–2μg/mLであった。 バンコマイシンの8μg/mLで成長したもののうち、MIC範囲は0.75–24μg/mLであった。 バンコマイシンの8μg/mLで生育した株は、四つのs.epidermidis、一つのS.hemolyticus、二つのS.hominis、および一つのS.であった。, オキサシリンに耐性のあるカピティス,Sccmeciiiのキャリアであるs.epidermidisとS.capitis,SccmeciのS.hominis,および非型Sccmecを有するS.hemolyticusであった。
バンコマイシンに対する感受性が低下した株の細胞壁厚の分析
細胞分裂下の細胞壁厚を八株で測定した(値はナノメートル、平均±SDで示されている)。 四つのs.epidermidis株は、の平均値を提示しました21.66±1.4, 20.12±0.9, 24.24±1.3, そして14.20±1.3nm。 S.hemolyticus分離は24.88±1.7nmの細胞壁の厚さを示した。 Sのために。, カピティス分離、細胞壁の厚さは19.33±1.8であり、二つのS.hominis分離株の値は17.68±2.1と24.92±1.5であった。 比較のために、使用される参照株S.epidermidis ATCC12228とS.hemolyticus ATCC29970は、それぞれ、14.61±1.2と14.73±0.7nmの細胞壁の厚さを示した。 対照に対する研究株の比較は、対照と比較して低い値を示した一つのs.epidermidis分離株を除いて、17nmから24.92nmの範囲で高い値を示した(図。 2).,
CoNS菌血症の進化
敗血症、肺炎、尿路感染症、髄膜炎、腹膜炎、壊死性腸炎、腹膜炎、脳膿瘍などの他の感染症への菌血症の進化の可能性は、新生児病棟に入院した52人の患者においてフォローアップされた。 これらのうち、25(46.3%)の患者において、血液培養から単離された同じCoNSが感染の病因であることが確認された。 11.1%ではCoNSが感染の可能性があり、23(42.6%)ではCoNSが患者の感染に関連していなかった(Fig. 3).,
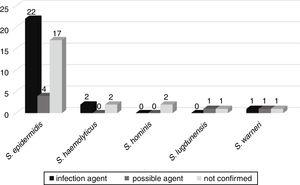
新生児ユニット患者において引き起こされる感染症の可能な病因として血液培養から単離されたCoNSの相関。
mecA遺伝子は、これらのCoNSの33(61.1%)で検出され、20(60.6%)CoNSは、より重篤な感染症またはこれらの感染症の可能性のある薬剤に関連付けられていた。
ディスカッション
短所は菌血症の主な原因の一つと考えられています。, これらの細菌の重要性は、主に抗菌耐性のために、近年病院環境で増加している。 本研究では、ボツカツの診療所の病院で入院患者の血液培養から単離された300のCoNS株を、20年の期間にわたって研究した。 これらの分離株は抗菌感受性に関して特徴付けられた。
mecA検出は、CoNSの78.5%におけるオキサシリン耐性を決定し、MIC50値(2μg/mL)は、β–ラクタム剤に対するこれらの細菌の低感受性を確認し、この薬剤に対する耐性, 以前の研究では、1970年代以降、CoNS分離株が黄色ブドウ球菌よりも高いオキサシリン耐性率を示していることが実証されている。14,15β–ラクタム抵抗率は、ブラジルおよびその他の国の病院で65%から95%の範囲で示されている。2,16,17オキサシリン耐性の最高率は、s.hemolyticus、S.hominis、およびS.capitisに続いて、S.epidermidisで発見された。 同様の結果は、s.epidermidisの97%におけるオキサシリン耐性を示した以前の研究で記載されていた1999年から2001年の間に新生児集中治療室(NICU)、18Sの96%において, ブラジル、19およびスペインからNICUで隔離されるS.hominisの100%で隔離されるhemolyticus。20S.capitisに関しては、Caierão et alによって行われた研究で矛盾した結果が見つかった。21
より低い頻度ではあるが、mecA遺伝子はS.warneriおよびS.lugdunensisで検出された。 S.warneriはNICUsにおけるオキサシリン耐性の33.3%の割合で記載されており、22およびS.lugdunensisにおけるmecAの最初の記述はKawaguchiらによって行われた研究であった。23低い抵抗率にもかかわらず、Sの抗菌感受性の24の決定, lugdunensisは、この種が短所の中で最も積極的であるだけでなく、適切な抗菌剤および良好な臨床結果による早期治療の確立のために、その臨床的意味のためだけでなく、重要である。25
SCCmecのキャラクタリゼーションは、sccmeciiiは、主にS.epidermidis、IV型を運んだ唯一の種で、研究株で最も頻繁に検出されていると、分離株におけるタイプI-IVの存在を示した。, SCCmecタイプIIIは、それらのすべての中で最大であり、いくつかの抵抗性関連遺伝子を体系化し、病院標本から最も一般的に単離されたCoNSである。 S.epidermidisは、ヒトの皮膚の主要な植民者であり、感染部位で最も一般的に検出される。 病院環境における選択圧は、重篤な感染症に関連するSCCmec III株の普及をもたらす。26SCCmecタイプIVは、コミュニティ関連ブドウ球菌sppと関連しています。 s.epidermidis株において初めて記載され、S.からの移行を意味することを意味する事実である。, s.aureusへのepidermidis。 SCCmec IVのサイズが小さいため、SCCmec IVのコスト移転が減少すると、SCCmec IVキャリアによって引き起こされる感染症の発生率が高くなる可能性があります。12,27SCCmecIIは、Machadoらの知見と同様に、s.hemolyticusとの関連を提示した。、12その作業は、この種でII型のみを検出しました。
oxacillinの抵抗力があるぶどう状球菌の処置のための代わりはバンコマイシン、最初に侵略的な伝染で1958年に使用される糖ペプチドです。 しかしながら、この薬物に対する耐性および感受性の低下の記述があり、不安定であるが6つがある。,28現在の研究の結果は、オキサシリンを除いて、バンコマイシンがMIC50およびMIC90の最高値を有する薬物であることを示した。 コレクションの完全な感受性にもかかわらず、MIC値は20年の期間で最も高く、いくつかのs.epidermidis、S.hemolyticus、S.hominis、およびS.capitis株で感受性の低下が検出された。 Natoliらによって行われた研究において。、29バンコマイシンに対する感受性の低下は、S.epidermidisおよびS.hemolyticus種において、CoNS分離株の間で5.4%の頻度で検出された。, 同じ著者によると、バンコマイシン寒天上で増殖したブドウ球菌コロニーは、糖ペプチド耐性の前駆体となり得る糖ペプチドヘテロ抵抗性につながり、複雑な感染および治療障害を引き起こす可能性がある。 これは治療上の決定の考慮に入れられるべきです。30
オキサシリン耐性CoNSの割合の増加およびバンコマイシンに対する感受性の低下は、他の治療選択を含む研究の重要性を強調する。, チゲサイクリン、グラム陽性および負の広いスペクトル半合成グリシルサイクリンは、オキサシリン感受性および耐性CoNS、14、29抵抗性の8.3%の率を示す私たちのデータにもかかわらず、s.hominis、S.lugdunensis、およびs.epidermidisに続いて、最も頻繁にs.hemolyticusで優れた活性を有する薬物と考えられている。 同様のMIC90の結果は、オキサシリン耐性と感受性の短所の違いなしで、チゲサイクリンのために記載されていました。Natoli et al.によって行われた研究では31。29ティゲサイクリンはCoNSに対して良好な活性を示した。, これらの著者によると、チゲサイクリンは菌血症の治療には推奨されておらず、多抵抗性グラム陰性細菌に対する活性を維持するためにその使用 リボソーム遺伝子S10およびrpsJおよびmepA遺伝子の変異は、チゲサイクリン耐性と関連しているようである。32,33
キヌプリスチン/ダルフォプリスチンは、マクロライド-リンコサミド-ストレプトグラミン群に属するストレプトグラミンである。, キヌプリスチンおよびダルフォプリスチンの組み合わせは、これらの薬剤を単独で比較するか、または類似のマクロライド系抗菌剤と比較すると、相乗的であり、通常殺bacterである。34この研究では、研究されたCoNSの大部分で優れた有効性を示しているにもかかわらず、この薬剤に対する中間耐性は、二つのs.epidermidisおよび一つのS.hemolyticusで検 Mendesらによって実施された研究では。、35キヌプリスチン/ダルフォプリスチンはCoNSのための優れた有効性を示し、株はMIC90値0.38μg/mLのオキサシリン感受性株と0で、完全に感受性であった。,Oxacillinの抵抗力がある緊張のための75μg/mL。 さらに、Venkatesh et al.36オキサシリン耐性および感受性株に対するキヌプリスチン/ダルフォプリスチンの良好な有効性を説明した。
数十年にわたって研究された抗菌剤であるダプトマイシンは、ブドウ球菌によって引き起こされる菌血症および心内膜炎の治療のために2006年に使用されるようになった。37本研究では、ダプトマイシンは低MIC50値で、CoNS分離株のための優れた有効性を示した。 Olivares et al.37はまたMICの価値の低い変化のdaptomycinへのすべてのCoNSの感受性を、確認しました。, Critchleyらによって行われた1126CoNSを研究する研究では。、38ダプトマイシンは0.015から2.0μg/mLまでのMIC範囲で活性であり、MIC90は0.5μg/mLであった。 これらの著者らによると、これらの分析における最も活性な薬剤は、ダプトマイシンおよびキヌプリスチン/ダルフォプリスチンであり、CoNSによって引き起こされる感染症の治療におけるこれらの抗菌剤の関連性を強調している。
Linezolidは、いくつかの細菌に対して潜在的に活性な合成オキサゾリジノンであり、CoNSに対して良好な有効性を示した別の薬剤である。,39リネゾリドは、抵抗性の記述にもかかわらず、短所による慢性感染症の治療的治療にとって重要となっている。 ブラジルでは、linezolid抵抗の最初のケースは2006年に、MRSA40の臨床分離物で、そして、短所の中で、S.epidermidis、S.hominis、およびS.hemolyticusで記述されていました。Olivaresらによって行われた研究では41。、37七つのlinezolid耐性株の検出にもかかわらず、この薬剤はCoNS株における有効なMIC値を提示した。 一方、リネゾリド耐性Sの発生。, リボソームタンパク質L3およびL4の変異だけでなく、最近フランスで同定されたcfrプラスミドを含む表皮クローンが報告されている。42
S.hemolyticusは、最高のオキサシリンMIC値を提示する種であり、256μg/mLよりも高い濃度は、分離株の50%を阻害するために必要であった。 オキサシリンと同様に,この種はチゲサイクリンおよび試験したほとんどの抗菌剤に対してより高いMIC値を示した。 いくつかの研究は、Sによって引き起こされる感染症の治療に使用される抗菌剤に対する高い抵抗率を示す。, 溶血、特にメチシリンおよびグリコペプチド。 いくつかの著者は、β-ラクタムおよびアミノグリコシド剤に対する耐性をコードする遺伝子の高い有病率、ならびに抵抗性ブレークポイントに近いMIC値を有する分離株のかなりの割合を記述し、43、44は、多抵抗性病原体としてのs.hemolyticusの重要性を強調している。MIC範囲とSccmec型との関連は,Sccmecivを有するs.epidermidisにおいて,バンコマイシン,リネゾリド,ダプトマイシンおよびキヌプリスチン/ダルフォプリスチンに対して高いMicを示した。, これらの抗菌薬に対する耐性に関連する遺伝子は、主に病院起源のメチシリン耐性株に見られるプラスミドによって媒介される。45SCCmec IVは、特にそのサイズと低適応コストのために、コミュニティ分離株の特徴である。 研究は、耐性遺伝子の獲得は、自然環境における耐性遺伝子キャリアの高い多様性を考えると、環境非臨床起源を持っていることを示唆しています。46,47さらに、SCCmecIVは、ヒトの皮膚における最も一般的な種として選択圧の影響を最も受けるs.epidermidisでのみ検出された。, 他の抗菌剤と比較して高いMicも選択圧に関連している可能性があります,病院環境でこれらの薬剤への曝露のレベルは、減少した感受性と耐性株の選択をバイアスするだろうとして,いくつかの変異イベント,遺伝子組換え,および微生物生理の変更は、表現型の変化を生成するために必要とされているため.,48
選択圧に関連する代謝および生理学的修飾は、細胞壁の肥厚が増加したペプチドグリカン合成によるほとんどのCoNS分離株で発見されたように、8μg/mLのバンコマイシン寒天上で成長した株で観察することができた。 このメカニズムは、バンコマイシン耐性のメディエーターであるヴァンオペロンの獲得よりもCoNSにとって有利である。 Vanオペロンは水平遺伝子導入によって獲得され,その発現はグリコペプチドの存在下でのみ刺激される。, この刺激はバンコマイシン存在下では非常に高い適応コストを引き起こし,バンコマイシン培地ではCoNSにとって不利である。48,49Meca遺伝子などのCoNSにおける他の耐性遺伝子の獲得に関しては、初期適応コストは、抵抗性”コスト”に対する代償的追加変異によって軟化される。 最近、vraRのような遺伝子の時間厳守の突然変異はぶどう球菌のバンコマイシンそして細胞壁肥厚への減らされた感受性と関連付けられるために示,50
本研究では、s.epidermidis、S.hemolyticus、S.hominis、S.lugdunensis、およびS.warneriである主なエージェントを含む新生児および小児ユニットにおけるCoNSによって引き起こされる菌血症の高い率を示した。 これらのユニットではs.capitisは分離されず,内科病棟,消化器病棟,神経科,緊急治療室に入院した成人における菌血症の薬剤であった。,
この研究は30年以上にわたって単離されたブドウ球菌によって引き起こされる菌血症を含んでいたため、患者の医療記録に関連するデータの多くは取得できなかったため、現在の研究の限界であるすべての患者の感染転帰を関連付けることはできなかった。 新生児単位の患者から得られたデータは、CoNS菌血症の臨床的重importanceを示し、専門的なケアを必要とする疾患に進行する可能性がある。
抗菌耐性に関する知識は、CoNSによって引き起こされる感染症の正しい治療にとって非常に重要である。, さらに、これらの細菌の病原性因子および患者の免疫は、微生物がより重篤な感染症を引き起こす能力に寄与する因子である。
20年にわたる私たちの研究の結果は、これらの薬物の過剰使用を反映したCoNSにおける抗菌耐性の高い頻度を示した。, 抗菌薬に対する感受性の低下につながる可能性のある代謝および生理学的修飾に加えて、ヒト共生細菌としてのそれらの状態は、それらに理想的なトランスポーターおよび耐性遺伝子、特にSCCmecのような低コストの要素の効率的な貯蔵庫を作る。45最良の結果をもたらした抗菌剤は、その有効性を維持し、抵抗性を防止するような方法で使用されるべきである。,
利益相反
著者らは、この研究は、潜在的な利益相反と解釈され得る商業的または財政的関係がない場合に行われたと宣言している。