13 kwietnia 2017 r.przez personel NCI
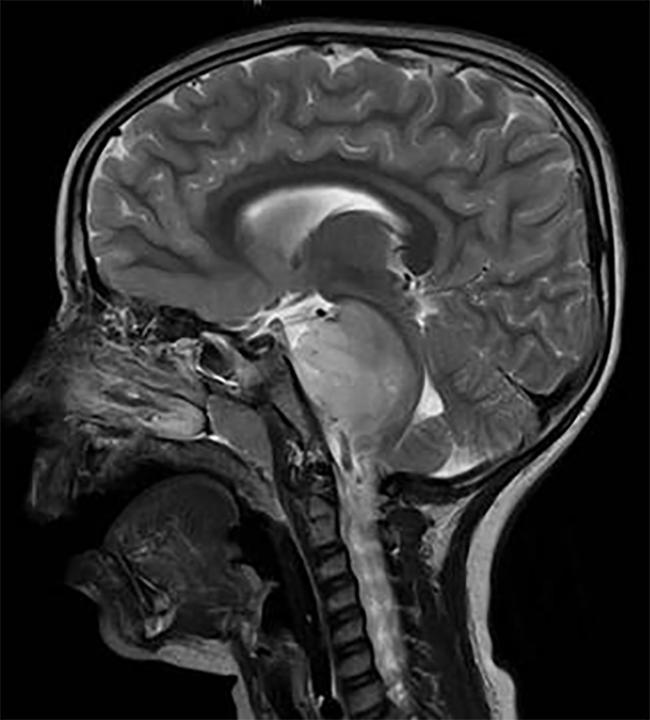
skan mózgu dziecka z guz Dipg, zlokalizowany w pniu mózgu.
dwa oddzielne badania zidentyfikowały potencjalne cele terapeutyczne w nieoperacyjnym dziecięcym guzie mózgu, rozproszonym wewnętrznym glejaku pontinowym (DIPG). Blokowanie tych celów lekami badawczymi spowolniło wzrost guza w zwierzęcych modelach DIPG.
DIPG, guz, który znajduje się w pniu mózgu, jest prawie jednolicie śmiertelny.,
„jako neuroonkolog dziecięcy, jest to jeden z najbardziej niszczycielskich guzów, które widzimy”, powiedział Pratiti Bandopadhayay, M. B. B. S., Ph.d., z Centrum Chorób Nowotworowych i krwi Dla Dzieci Dana-Farber/Boston, który nie brał udziału w badaniach. „Nie mamy żadnych zabiegów leczniczych na te guzy.”
podczas gdy większość guzów DIPG ma specyficzną mutację genetyczną, wcześniej nie było jasne, jaką rolę, jeśli w ogóle, zmutowane białko odgrywa w rozwoju guza i czy jego funkcja może być ukierunkowana na terapie.,
w obu nowych badaniach zespoły badawcze badały biologię ludzkich komórek DIPG z tą mutacją i zidentyfikowały cechy, które mogą uczynić je podatnymi na leczenie. W porównaniu z leczeniem kontrolnym stwierdzono, że leki znane jako inhibitory PRC2 I bet skurczyły guzy DIPG w modelach myszy i wydłużyły życie myszy.
wyniki obu badań, jednego z grupy badawczej na Northwestern University, a drugiego z grupy na Uniwersytecie Kopenhaskim w Danii, zostały opublikowane 27 lutego w Nature Medicine.,
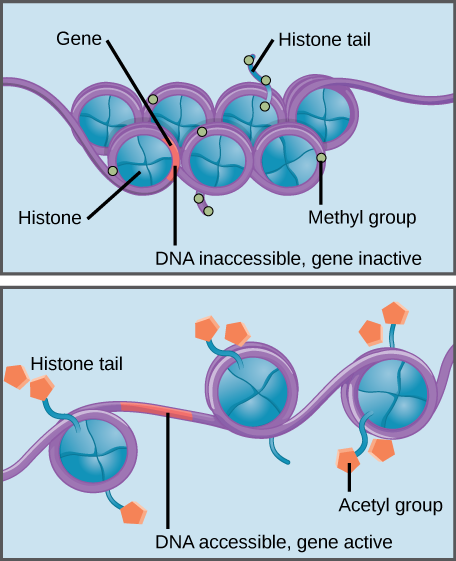
metylacja histonu wzmacnia interakcję Histon–DNA, czyniąc powiązane geny niedostępnymi dla ekspresji genów (nieaktywnymi). Acetylacja histonu osłabia interakcję, czyniąc związane z nią geny dostępnymi do ekspresji genów (aktywnymi).
Identyfikacja celu
około 5 lat temu naukowcy pracujący nad St., Jude-Washington University Pediatric Cancer Genome Project odkrył, że prawie 80% guzów DIPG ma specyficzną mutację w genie białka zwanego histonem H3.
to, że tak wysoki odsetek guzów ma tę samą mutację, było zaskoczeniem dla społeczności badawczej DIPG, powiedział dr Ali Shilatifard z Northwestern University Feinberg School Of Medicine, główny badacz jednego z badań.
histony są rodziną białek, które pomagają w pakowaniu DNA w zwarte struktury., Krótkie odcinki DNA wiją się wokół białek histonowych, jak nici na szpuli, a tysiące histonów owiniętych DNA (zwanych nukleosomami) tworzą każdy chromosom.
specyficzne modyfikacje histonów mogą promować lub zapobiegać ekspresji genów. Na przykład przyłączenie związków chemicznych zwanych grupami acetylowymi do histonów osłabia ich interakcję z DNA, promując ekspresję genów. Z drugiej strony, dodanie grup metylowych do histonów zwykle powoduje, że DNA wije się mocniej wokół histonów, zapobiegając ekspresji genów.,
Identyfikacja obecności mutacji histonu H3 u pacjentów z DIPG była pierwszym krokiem, powiedział dr Bandopadhayay. „Ale aby móc leczyć guzy z tą zmianą, musisz zrozumieć, co robi mutacja” – dodała.
we wcześniejszym badaniu dr Shilatifard i jego współpracownicy wykorzystali muszki owocowe do badania funkcji zmutowanego genu histonu H3. W porównaniu z muchami, które miały normalne białka histonowe H3, muchy z zmutowaną wersją miały więcej histonów, które były osadzone w grupach acetylowych (acetylowanych)., Z kolei te acetylowane histony były wiązane przez cząsteczki zwane białkami zawierającymi bromodomainę (BRD), które regulują ekspresję genów.
dla ich obecnego badania, który był finansowany w części przez NCI, Northwestern badacze chcieli ustalić, czy zmutowany Histon ma tę samą funkcję w komórkach ludzkich. Rzeczywiście, odkryli, że ludzkie komórki raka jelita grubego lub raka nerki zmienione w celu ekspresji zmutowanego genu histonu H3 miały więcej acetylowanych histonów niż komórki, które wyrażały normalny gen histonu H3.
pierwszy autor, dr Andrea Piunti., następnie zbadano wszystkie zmutowane histony H3 znajdujące się w genomach komórek nowotworowych DIPG od trzech pacjentów. Jego analiza wykazała, że wiele nukleosomów zawierających zmutowane histony było acetylowanych i wiązanych przez białka BRD.
dodatkowe eksperymenty wykazały, że białka BRD mogą odgrywać bezpośrednią rolę w rozwoju guza DIPG. Leczenie ludzkich komórek DIPG badanymi lekami blokującymi białka BRD, zwanymi inhibitorami BET, spowolniło wzrost komórek DIPG w porównaniu z leczeniem kontrolnym., W badaniach na myszach z ludzkimi komórkami DIPG wszczepionymi do pnia mózgu, osoby leczone inhibitorami BET miały mniejsze guzy i żyły dłużej niż myszy leczone leczeniem kontrolnym.
te eksperymenty „sugerują, że inhibitory BET zapewniają potencjalne podejście terapeutyczne dla DIPG”, powiedział dr Shilatifard. Badania przedkliniczne wykazały, że kilka różnych typów nowotworów—w tym białaczka i glejak—są również wrażliwe na inhibitory BET, dodał.,
dodatkowy cel
Analiza grupy północno-zachodniej ludzkich komórek nowotworowych DIPG ze zmutowanym histonem H3 wykazała również, że oprócz większej ilości acetylacji histonu H3, wiele histonów zostało ozdobionych grupami metylowymi (metylowanymi). Ponadto odkryli, że enzym zwany PRC2-który przyłącza grupy metylowe do białek histonu H3 – był obecny w pobliżu wielu z tych histonów.
te wyniki skłoniły badaczy Północno-Zachodnich do dalszego przyjrzenia się aktywności PRC2., Stwierdzono, że blokowanie aktywności PRC2—albo genetycznie, albo z inhibitorem PRC2 o nazwie tazemetostat-zmniejsza wzrost komórek DIPG.
„
Grupa kopenhaska znalazła również dowody potwierdzające rolę PRC2 w promowaniu wzrostu guza DIPG. Zaobserwowano, że tazemetostat i inny inhibitor PRC2 zmniejszają wzrost komórek mózgowych myszy lub ludzkich komórek DIPG ze zmutowanymi histonami, podczas gdy leczenie kontrolne nie.,
a kiedy wszczepiano komórki mózgowe myszy zmutowanymi histonami do mózgów normalnych myszy lub myszy, u których PRC2 był genetycznie zablokowany, te, które nie miały aktywności PRC2, żyły dłużej.
natomiast osobne badanie przeprowadzone przez grupę badawczą w Niemczech wykazało, że komórki różnych pacjentów z DIPG nie były wrażliwe na tazemetostat, mimo że ich guzy miały mutację histonu H3.
krok do przodu
dekady badań klinicznych wykazały, że guzy DIPG są niewrażliwe na tradycyjną chemioterapię, wyjaśnił dr Bandopadhayay., I chociaż promieniowanie może złagodzić objawy, nie jest lecznicza, a większość dzieci z DIPG umiera w ciągu 2 lat od diagnozy.
w 2015 roku międzynarodowe konsorcjum badaczy DIPG połączyło siły, aby zbadać wszystkie dostępne próbki komórek DIPG. Ich badanie wykazało, że komórki DIPG zebrane od kilku różnych pacjentów zostały zabite przez lek modyfikujący histony o nazwie panobinostat (Farydak®). Panobinostat blokuje enzymy, które dodają grupy acetylowe do histonów., Obecnie naukowcy, którzy są częścią konsorcjum Pediatric Brain Tumor Consortium wspieranego przez NCI, testują Bezpieczeństwo i najlepszą dawkę panobinostatu dla dzieci z DIPG w badaniu klinicznym fazy I.
Teraz wyniki obu badań wskazują na potencjalnie obiecujące nowe strategie leczenia, powiedział dr Shilatifard.
„chcemy przenieść inhibitory BET do badania fazy I w leczeniu DIPG, a nasi koledzy z Ann& Robert H. Lurie Children 's Hospital Of Chicago pchają do przodu z tymi badaniami”, powiedział.,
ponadto, kilka trwających badań klinicznych testuje tazemetostat, inhibitor PRC2, zarówno u dorosłych, jak i dzieci z różnymi nowotworami. Jednak żadne aktualne badanie nie prowadzi do szczegółowego badania tazemetostatu u dzieci z DIPG.
wciąż jest wiele pytań bez odpowiedzi, powiedział dr Bandopadhayay, w tym, czy te eksperymentalne leki mają zdolność do przekraczania bariery krew-mózg i docierania do ludzkich guzów mózgu.
Dr., Bandopadhayay i jej współpracownicy uczą się również więcej o biologii DIPG, badając komórki nowotworowe uzyskane z biopsji, oprócz tych uzyskanych z autopsji. Uzyskanie próbek biopsji stało się możliwe dopiero niedawno dzięki znacznej poprawie technik neurochirurgicznych-wyjaśniła.
„Jest teraz dużo pracy. Ostatecznym celem jest, aby móc leczyć te dzieci tak, że mają szansę wyleczyć z minimalnymi skutkami ubocznymi.”