wprowadzenie
zespół tylnej odwracalnej encefalopatii (PRES), po raz pierwszy opisany przez Hinchey i in. w 1996 r. stwierdzono zaburzenia neurologiczne o zróżnicowanej prezentacji klinicznej i typowych badaniach obrazowych z dominującym wzorem ciemieniowo-potylicznym obrzęku naczyniowego (1, 2). Istnieje wiele udokumentowanych przyczyn PRES, z przypadków po raz pierwszy opisane w ustawieniu podwyższonego ciśnienia tętniczego., Przykłady scenariuszy klinicznych, w których PRES mogą być postrzegane m.in.: nadciśnienie tętnicze, (pre)rzucawka, choroby nerek, choroby autoimmunologiczne i leki cytotoksyczne (3, 4) (Tabela 1). PRES może wystąpić w każdej grupie wiekowej i ma wyższy wskaźnik występowania u kobiet (7, 8). Chociaż obecna literatura jest stosunkowo rzadka w porównaniu z populacjami dorosłymi, szczególną uwagę należy zwrócić na PRES u pacjenta pediatrycznego., Pacjenci pediatryczni mają podobną prezentację kliniczną jak dorośli, z nadciśnieniem tętniczym, napadami drgawkowymi i zmienionym stanem psychicznym będącymi częstymi objawami choroby (9). Pomimo większości przypadków PRES u pacjentów onkologicznych, zwłaszcza pacjentów po przeszczepieniu komórek macierzystych (10, 11), badanie przeprowadzone przez Gupta i wsp. (12) stwierdzono, że choroba nerek była prawdopodobnie najczęstszą przyczyną PRES u pacjenta pediatrycznego. W ich badaniu u pacjentów pediatrycznych stwierdzono częściej nietypowe wyniki obrazowania (62,5%), w tym zajęcie płata czołowego (56%).,
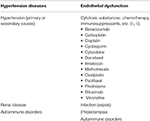
Tabela 1. Główne stany chorobowe związane z PRES.
objawy kliniczne są ostre do podostrych i wahają się od Bólu Głowy i zaburzeń widzenia do zmienionych poziomów świadomości i drgawek w cięższych przypadkach (1). Leczenie ma na ogół na celu ukierunkowanie przyczyny podstawowej, z ogólnie odwracalnymi objawami i wynikami obrazowania w większości przypadków (8)., Chociaż wyniki są na ogół korzystne przy odpowiednim zarządzaniu, słabe wyniki kliniczne były związane z istniejącą wcześniej cukrzycą i zaangażowaniem ciałka modzelowatego; jednak obecnie brakuje innych wiarygodnych biomarkerów obrazowania do prognostyki (13). Obrazowanie neuroradiologiczne odgrywa zasadniczą rolę w diagnostyce PRES z typowymi cechami obrazowania najlepiej docenianymi w obrazowaniu metodą rezonansu magnetycznego (MRI) (2).
Patofizjologia
dokładny mechanizm patofizjologiczny leżący u podstaw PRES nie został jeszcze w pełni wyjaśniony i pozostaje kontrowersyjny(3)., Obecnie istnieją dwa główne proponowane mechanizmy patofizjologii PRES (Rysunek 1). Pierwsza teoria proponuje zwiększone ciśnienie tętnicze jako czynnik podstawowy (8). Szybki wzrost ciśnienia krwi ostatecznie pokonuje możliwości autoregulacyjne naczyń mózgowych, powodując wyciek naczyniowy i wynikający z niego obrzęk naczynioruchowy (14). Istnieje ewentualna dysfunkcja bariery krew-mózg (BBB) z białkami przechodzącymi przez tight-junction (15)., Obszary dostarczane przez krążenie tylne (tętnice kręgowe, tętnica bazalna i tętnice mózgowe tylne) są wyjątkowo zagrożone w porównaniu z krążeniem przednim (tętnice szyjne wewnętrzne, tętnice mózgowe środkowe i tętnice mózgowe przednie) ze względu na brak współczulnego tonu unaczynienia tętnicy bazalnej (8)., Powiązana teoria zaproponowana przez niektórych postulatów, że skrajne nadciśnienie powoduje skurcz naczyń i miejscowe niedokrwienie, które powoduje rozpad BBB i wynikający z niego obrzęk naczynioruchowy, jak obserwowano u pacjentów leczonych lekami immunosupresyjnymi cyklosporyną a i FK-506 (16). Zaburzenia w BBB powodują typowe wyniki obrzęku wazogennego w porównaniu do obrzęku cytotoksycznego (co może być widoczne w przypadku ostrego zawału i reprezentuje zwiększoną wewnątrzkomórkową zawartość wody z powodu utraty zwykłego gradientu osmotycznego w przypadku śmierci komórki (17).,
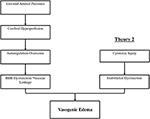
Rysunek 1. Dwie główne teorie patofizjologii PRES. Teoria 1 to teoria hiperperfuzji nadciśnieniowej i mózgowej, a teoria 2 to teoria dysfunkcji śródbłonka.
druga główna teoria dotyczy faktu, że do 30% pacjentów z PRES nie wykazują podwyższone ciśnienie tętnicze niezbędne do przekroczenia autoregulacyjnej kontroli naczyń mózgowych (18, 19)., Teoria ta sugeruje, że dysfunkcja śródbłonka jest głównym winowajcą, który może być spowodowany przez różne endogenne lub egzogenne toksyny (20). Teoria ta może wyjaśnić wyniki PRES obserwowane u pacjentów otrzymujących leki immunosupresyjne i / lub chemioterapię, a także u pacjentów z sepsą (21, 22). W tym modelu krążące toksyny powodują uszkodzenie naczyń z wynikiem rozwoju obrzęku naczyniowego. Uszkodzenie śródbłonka powoduje dalsze uwalnianie czynników zwężających naczynia i immunogennych, które mogą powodować skurcz naczyń i (lub) zwiększoną przepuszczalność naczyń., Ostatecznie, dysfunkcja śródbłonka pozwalająca na wyciek naczyniowy i obrzęk naczynioruchowy jest czynnikiem napędzającym PRES, niezależnie od pierwotnych nieprawidłowości naczyń mózgowych (w przypadku nadciśnienia tętniczego) lub wtórnych do krążących toksyn. Streszczenie tych dwóch teorii, jak również wykaz wcześniej zgłoszonych leków chemioterapeutycznych i innych leków immunosupresyjnych przedstawiono na rysunku 2.
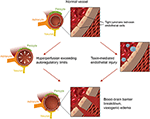
Rysunek 2. Ilustracja dwóch głównych teorii leżących u podstaw patofizjologii PRES., Podziękowanie: dzięki uprzejmości Caroline O ” Driscoll, MA (zilustrowała to sama i jest pracownikiem naszej uczelni).
objawy kliniczne zależą od danego regionu (- ów) mózgu; dlatego prezentacja może być szeroka. Na przykład, pierwotne zaangażowanie płatów potylicznych może powodować zaburzenia widzenia / halucynacje. Ogniskowe deficyty neurologiczne odpowiadające lokalizacji zmian ogniskowych występują u ~5-15% pacjentów z PRES (23)., Rzadko, zajęcie rdzenia kręgowego może prowadzić do klinicznych objawów mielopatii lub paraliżu (24).
obrazowanie
jak sama nazwa wskazuje, PRES zwykle objawia się w badaniach obrazowych jako obrzęk naczynioruchowy z przewagą substancji białej. Płaty ciemieniowe i potyliczne są prawie powszechnie zaangażowane i są zazwyczaj symetryczne i obustronne (1). Często obserwuje się również zajęcie płatów czołowych, szczególnie przylegających do górnego odcinka przedniego., Obrzęk naczynioruchowy, chociaż może obejmować mózgową substancję szarą, jest często łatwiej doceniany w podkorowej istocie białej. Badanie CT jest często wstępnym badaniem obrazowym w ustalaniu ostrych objawów neurologicznych i może wykazywać hipoattenuation istoty białej w dotkniętych regionach (25) (Rysunek 3: CT PRES). Ogólnie wyniki najlepiej przedstawia MRI, który wykazuje zwiększoną czułość i lepszą charakterystykę anatomiczną w porównaniu do CT (26). Dodatkowo, MRI może pomóc w rozróżnieniu innych stanów patologicznych, które mogą objawiać się klinicznie podobnie jak PRES., W szczególności sekwencje T2-weighted i T2 FLAIR (fluid-atenuated inversion recovery) są najbardziej przydatne do wykrywania obrzęków naczyniowych w MRI (ryc. 4: MR PRES; ryc. 5: MR Pres Coronal).
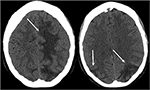
Rysunek 3. Pacjent z toczniem rumieniowatym układowym i szybko postępującym kłębuszkowym zapaleniem nerek z napadem drgawkowym. Bezkontrastowe obrazy CT głowy wykazują obrzęk naczynioruchowy w obustronnych płatach ciemieniowych i potylicznych, lewy większy niż Prawy, a także rozszerzenie w lewy płat czołowy.,
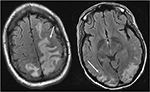
Rysunek 4. Pacjent z toczniem rumieniowatym układowym i szybko postępującym kłębuszkowym zapaleniem nerek z napadem drgawkowym. Obrazy T2-FLAIR głowy wykazują obrzęk naczynioruchowy w obustronnych płatach ciemieniowych i potylicznych, lewy większy niż Prawy, a także rozszerzenie w lewy płat czołowy. Zauważ, że przy wzorze naczynioruchowym obrzęku, w korze mózgowej występuje zaburzenie sygnałowe.
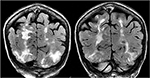
Rysunek 5., Pacjent z pierwotnym zwłóknieniem szpiku i przeszczepem szpiku kostnego w wywiadzie, przyjmujący takrolimus z napadem padaczkowym po raz pierwszy. Koronalne sekwencje T2-FLAIR wykazują rozległe nieprawidłowości sygnałowe w obustronnych płatach potylicznych i ciemieniowych, co jest typowe dla PRES.
diagnostyka różnicowa PRES jest szeroka i obejmuje obiekty o podobnej hiperintensywności materii białej T2., Przykłady obejmują: niedokrwienie/zawał (zwłaszcza krążenie tylne), choroby demielinizacyjne, etiologie zakaźne (zapalenie opon mózgowych, zapalenie mózgu), postępującą wieloogniskową leukoencefalopatię (PML), zapalenie naczyń i różne zaburzenia metaboliczne (27). Uważa się, że zespół odwracalnego skurczu naczyń mózgowych (ang. reversible cerebral vasoconstriction syndrome, RCVS) jest związany z zaburzeniami napięcia naczyń mózgowych, które prowadzą do skurczu naczyń., RCVS przejawia się jako nawracające bóle głowy, napady drgawkowe, udar i nie-tętniakowy krwotok podpajęczynówkowy (28), które mogą być mylone z PRES na podstawie klinicznej. Podmiot ten zazwyczaj występuje w okresie poporodowym lub po ekspozycji na leki adrenergiczne lub serotoninergiczne. RCVS można zazwyczaj zdiagnozować w badaniach angiograficznych wykazujących wieloogniskowe obszary zwężenia obejmujące tętnice mózgowe (29). Diagnoza ta może być mylona z faktem, że RCVS i PRES często występują jednocześnie, o czym neuroradiolog powinien być świadomy, aby uniknąć błędnej diagnozy (30).,
PRES można zazwyczaj odróżnić od ostrego niedokrwienia, ponieważ ten ostatni niezmiennie wykazuje obrzęk cytotoksyczny i ograniczenie dyfuzji. Ograniczona dyfuzja w ostrym niedokrwieniu może być łatwo wykryta na obrazowaniu ważonym dyfuzją (DWI) i pozornym współczynniku dyfuzji (ADC) jako sygnał hiperintensywny na DWI z odpowiednim zmniejszonym sygnałem na ADC (ze względu na stosunkowo zmniejszony ruch wewnątrzkomórkowych cząsteczek wody)., Z drugiej strony obrzęk naczynioruchowy w ustawieniu PRES może wykazywać sygnał hiperintensywny na DWI, któremu nie towarzyszy odpowiadający mu zmniejszony sygnał na ADC (31). Ponadto ostre niedokrwienie ma tendencję do jednostronnego i w obrębie pojedynczego obszaru naczyniowego. Chociaż ocena ograniczenia dyfuzji w celu odróżnienia Pres od nieprawidłowości niedokrwiennej jest ogólnie wiarygodna, istnieją rzadkie przypadki PRES, które mogą być związane z obszarami ograniczenia dyfuzji nałożonymi na obszary bardziej klasycznie postrzeganego izolowanego obrzęku naczyniowego.,
„zaawansowane” techniki obrazowania w PRES zostały ostatnio opisane jako narzędzie wspomagające w trudnych lub niejednoznacznych przypadkach. Te zaawansowane techniki obrazowania obejmują: perfuzja CT / MR, Spektroskopia MR (MRS), obrazowanie ważone podatnością (SWI) i techniki medycyny nuklearnej, w tym tomografia emisyjna pojedynczego fotonu (SPECT) i pozytonowa tomografia emisyjna (PET) z różnymi radioznacznikami. Chociaż pełna dyskusja wykracza poza zakres tego przeglądu, różne wyniki obrazowania można zobaczyć na tych zaawansowanych technik, aby pomóc zasugerować diagnozę PRES., Hiperperfuzję można zaobserwować w badaniach perfuzji CT/MR, wykazujących zwiększony przepływ krwi w mózgu i objętość krwi ze skróconym czasem do perfuzji i średnim czasem TRANZYTU (32), chociaż zgłaszano przypadki hipoperfuzji (33). W przypadku MRS zazwyczaj występuje zmniejszenie stosunku N-Acetyloasparaginianu (Naa)/kreatyny (Cr) i NAA / choliny( Chol), co sugeruje zakłócenie prawidłowych synaps i funkcji neuroaksonalnej (34). SWI może pomóc w identyfikacji obecności krwotoku w PRES, z większą czułością niż obrazowanie GRE (35)., Obrazowanie SPECT / PET zazwyczaj wykazuje hiperperfuzję lub hipoperfuzję (podobną do badań perfuzji CT/MR) z niskim metabolizmem przez FDG-PET (36).
dodatkowo PRES można odróżnić od innych schorzeń, takich jak autoimmunologiczne zapalenie mózgu w przebiegu ostrego rozsianego zapalenia mózgu i rdzenia (ADEM) przez rozlany obustronny, ale asymetryczny obrzęk naczynioruchowy (37)., PML może mieć podobny wygląd w porównaniu z PRES, z przewagą ciemieniowo-potyliczną, ale może być wyróżniany bardziej jednostronnym lub asymetrycznym zaangażowaniem, a także skłonnością do podkorowej istoty białej (38).
nietypowe cechy obrazowania
nietypowe cechy PRES obejmują obszary wzmocnienia kontrastu, krwotoku lub ograniczenia dyfuzji (39)., Chociaż płaty ciemieniowe i potyliczne są ogólnie zaangażowane, mogą być widoczne nietypowe obszary zaangażowania, w tym: pnia mózgu, móżdżku, ciałka modzelowatego i innych obszarów mózgu, z bardziej powszechnymi obszarami, w tym płaty czołowe (obserwowane w do 68%) i dolne płaty skroniowe (do 40%) (23, 40) (ryc. 6: móżdżek; ryc. 7: pnia mózgu).
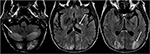
Rysunek 6. Pacjent po przeszczepieniu wątroby 6 tygodni wcześniej. Po przeszczepieniu wątroby pacjentowi podawano takrolimus., Obrazy T2-FLAIR mózgu wykazują nieprawidłowości sygnałowe w płatach potylicznych. Istnieje również rozległa anomalia sygnałowa widoczna w obustronnych półkulach móżdżku i w obrębie talami. Objawy te szybko ustąpiły po odstawieniu takrolimusu.
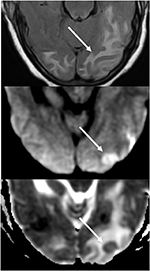
Rysunek 7. Pacjent z niekontrolowanym nadciśnieniem tętniczym ze zmianą stanu psychicznego. T2-FLAIR (top) obraz pokazuje obrzęk w płatach potylicznych., Obrazy DWI (środkowy) i ADC map (dolny) pokazują małą strzałkę ograniczonej dyfuzji, z sygnałem hiperintensywnym na DWI i odpowiadającą hipointensywnością na mapie ADC.
dodatkowo wczesne stwierdzenie PRES, które może poprzedzać typowy obrzęk ciemieniowo-potyliczny, obejmuje łagodną hiperintensywność i leptomeningeal na obrazach ważonych T1 po kontraście, jak opisano przez Nakagawa et al. (41). Benziada-Boudour et al., (42) opisał równoczesny rozwój obrzęku cytotoksycznego, powodujący ograniczoną dyfuzję (ryc. 8: ograniczenie dyfuzji). Nieodłącznie związane z nazwą procesu chorobowego, ustalenia związane z PRES są zwykle odwracalne, z normalizacji wyników klinicznych i obrazowania po podżegania problem jest traktowany. Jednak w niektórych przypadkach obszary ograniczonej dyfuzji mogą ostatecznie spowodować trwałe uszkodzenie miąższu mózgu (Rysunek 9: martwica laminarna)., Krwotok jest rzadziej spotykany w PRES, występującym w 5-30% przypadków, ale należy uznać, że nie należy mylić tego stwierdzenia z innym podmiotem patologicznym w odpowiednim ustawieniu klinicznym PRES (39). Wyniki obrazowania krwotoku mogą obejmować: ogniskowy krwiak, wybroczynowy krwotok żylny i / lub krwotok podpajęczynówkowy (43) (Rysunek 10: krwotok).
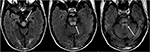
Rysunek 8. Pacjent z przeszczepem wątroby w wywiadzie dwa tygodnie wcześniej przyjmował takrolimus., Obrazy T2-FLAIR pokazują anomalię sygnału w obrębie śródmózgowia, pons i wyższych szypułek móżdżku.
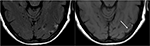
Rysunek 9. Obraz T2-FLAIR (po lewej) u pacjenta z niekontrolowanym nadciśnieniem tętniczym i wcześniejsze obrazowanie wskazujące PRES( patrz rysunek 6), obecnie kontrolowany i 6 tygodni później, pokazuje ustąpienie wcześniej zaobserwowanego obrzęku. Małe obszary glejozy z powodu urazu są widoczne w lewym płacie skroniowym. Axial non-contrast T1 wykazuje krzywoliniową martwicę laminarną korową związaną z wcześniejszym urazem związanym z PRES., Podczas gdy PRES na ogół jest w pełni odwracalny, może to spowodować trwałe obrażenia w niektórych sytuacjach.
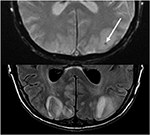
Rysunek 10. Pacjent po przeszczepieniu wątroby za pomocą takrolimusu. Gradient T2 (Góra) wykazuje ogniskowy obszar krwotoku w obrębie obrzęku naczyniowego w lewym płacie potylicznym. T2-FLAIR wykazuje bardziej typowe znalezisko związane z PRES z nieprawidłowościami sygnałowymi w obustronnych płatach potylicznych.,
leczenie
leczenie PRES ma zazwyczaj na celu kontrolowanie pierwotnej etiologii powodującej PRES (44). Na przykład, w przypadkach podwyższonego ciśnienia tętniczego, leczenie ma na celu skorygowanie podwyższonego ciśnienia krwi w kontrolowanym środowisku, podobnie jak podejście do nadciśnieniowego parcia naglącego/ nagłego wypadku (45). Zazwyczaj dąży się do nieszybkiego obniżenia ciśnienia krwi, aby uniknąć ryzyka wywołania choroby niedokrwiennej mózgu w wyniku drastycznego obniżenia ciśnienia krwi (46)., Czasami leki przeciwdrgawkowe są stosowane jako terapia wspomagająca, chociaż optymalny środek(y), czas i długość leczenia pozostają kontrowersyjne (4) (Rysunek 11: przed i po).
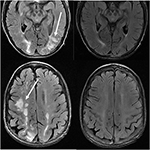
Rysunek 11. Pacjent z pierwotnym zwłóknieniem szpiku i przeszczepem szpiku kostnego w wywiadzie, przyjmujący takrolimus. Obrazy osiowe T2-FLAIR pokazują obszary nieprawidłowości sygnału w płatach ciemieniowych i potylicznych oraz prawym płacie czołowym (obrazy lewe)., Takrolimus został przerwany, a obrazy kontrolne (prawe obrazy) uzyskano 6 tygodni po pierwszych obrazach.
w przypadkach (przed)rzucawki leczenie ma na celu terminowe dostarczenie płodu, a także zarządzanie ciśnieniem krwi i siarczan magnezu w profilaktyce napadów padaczkowych (47). W leczeniu PRES wywołanym chemioterapeutykami lub innymi lekami immunosupresyjnymi, stopniowe lub bezwzględne odstawienie leku wykazało zarówno poprawę kliniczną, jak i radiologiczną (48) (ryc. 12: rzucawka)., Hipomagnezemia jest częstym stwierdzeniem w PRES i możliwym czynnikiem etiologicznym. Dlatego autorzy zasugerowali, że suplementacja magnezu może być przydatnym dodatkiem w zarządzaniu PRES (49).
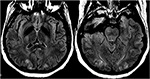
Rysunek 12. Pacjent z rzucawką i z napadem padaczkowym. Obrazy osiowe T2-FLAIR wykazują symetryczne zaburzenia sygnału w obustronnych płatach potylicznych.,
wnioski
PRES jest unikalną jednostką z charakterystycznymi wynikami klinicznymi i neuroradiologicznymi, oprócz niezliczonych dobrze udokumentowanych przyczyn. Chociaż dokładny mechanizm patofizjologiczny za PRES nie został jeszcze wyjaśniony (i rzeczywiście może być spowodowany kombinacją powiązanych ze sobą procesów), ogólnie przyjętym mechanizmem jest dysfunkcja bariery krew-mózg powodująca obrzęk naczyniowy z przewagą krążenia tylnego., Obrazowanie cechy najlepiej oceniać na fluid-sensitive MR sekwencje które ujawniać ciemieniowo-potyliczny przewaga Biała Materia T2 hyperintensities, chociaż wiele atypowych obrazowanie cechy mogą widzieć i powinien pamiętać przy Oceniać trudnych przypadki. Różne zaawansowane narzędzia obrazowania są dostępne, aby pomóc w trudnych lub niejednoznacznych przypadkach. Leczenie ma na celu leczenie podstawowej przyczyny ze szczególnym uwzględnieniem monitorowania ciśnienia krwi i możliwej profilaktyki napadów padaczkowych.,
wkład autora
konflikt interesów
autorzy oświadczają, że badanie zostało przeprowadzone w przypadku braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
1. Bartyński WS. Zespół tylnej odwracalnej encefalopatii, Część 1: Podstawowe obrazowanie i cechy kliniczne. / Align = „Left” / (2008) 29:1036–42. podoba mi się! do obserwowanych nr: 103174,A0928
CrossRef Full Text | Google Scholar
3. Bartynski WS. Posterior reversible encephalopathy syndrome, Part 2: controversies surrounding pathophysiology of vasogenic edema. Am J Neuroradiol. (2008) 29:1043–9. doi: 10.3174/ajnr.A0929
CrossRef Full Text | Google Scholar
5. Singer S, Grommes C, Reiner AS, Rosenblum MK, DeAngelis LM. Posterior reversible encephalopathy syndrome in patients with cancer., Oncologist. (2015) 20:806–11. doi: 10.1634/theoncologist.2014-0149
PubMed Abstract | CrossRef Full Text | Google Scholar
6. How J, Blattner M, Fowler S, Wang-Gillam A, Schindler SE. Chemotherapy-associated posterior reversible encephalopathy syndrome: a case report and review of the literature. Neurologist. (2016) 21:112–7. doi: 10.1097/NRL.,0000000000000105
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Habetz K, Ramakrishnaiah R, Raina SK, Fitzgerald RT, Hinduja A. Posterior reversible encephalopathy syndrome: a comparative study of pediatric versus adult patients. Pediatr Neurol. (2016) 65:45–51. doi: 10.1016/j.pediatrneurol.2016.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Fugate JE, Rabinstein AA., Posterior reversible encephalopathy syndrome: clinical and radiological manifestations, pathophysiology, and outstanding questions. Lancet Neurol. (2015) 14:914–25. doi: 10.1016/S1474-4422(15)00111-8
CrossRef Full Text | Google Scholar
9. Zama, D, Gasperini P, Berger M, Petris M, De Pasquale MD, et al. A survey on hematology-oncology pediatric AIEOP centres: the challenge of posterior reversible encephalopathy syndrome. Eur J Haematol. (2018) 100:75–82. doi: 10.1111/ejh.,12984
CrossRef Full Text | Google Scholar
12. Gupta V, Bhatia V, Khandelwal N, Singh P, Singhi P. Imaging findings in pediatric posterior reversible encephalopathy syndrome (PRES): 5 years of experience from a tertiary care center in India. J Child Neurol. (2016) 31:1166–73. doi: 10.1177/0883073816643409
PubMed Abstract | CrossRef Full Text | Google Scholar
13., Hinduja A, Habetz K, Raina S, Ramakrishnaiah R, Fitzgerald RT. Predictors of poor outcome in patients with posterior reversible encefalopatia syndrome. Int J Neurosci. (2017) 127:134–44. doi: 10.3109/00207454.2016.1152966
PubMed Abstract | CrossRef Full Text | Google Scholar
15. MacKenzie ET, Strandgaard S, Graham DI, Jones JV, Harper AM, Farrar JK. Wpływ ostrego nadciśnienia tętniczego u kotów na tętnicę tętniczą, lokalny mózgowy przepływ krwi i barierę krew-mózg. Circ Res., (1976) 39:33–41. doi: 10.1161/01.RES.39.1.33
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bartynski WS, Zeigler Z, Spearman MP, Lin L, Shadduck RK, Lister J. Etiology of cortical and white matter lesions in Cyclosporin-A and FK-506 neurotoxicity. Am J Neuroradiol. (2001) 22:1901–14.
PubMed Abstract | Google Scholar
21. Bartynski WS, Boardman JF, Zeigler ZR, Shadduck RK, Lister J., Posterior reversible encephalopathy syndrome in infection, sepsis, and shock. Am J Neuroradiol. (2006) 27:2179–90.
PubMed Abstract | Google Scholar
22. Mayama M, Uno K, Tano S, Yoshihara M, Ukai M, Kishigami Y, et al. Incidence of posterior reversible encephalopathy syndrome in eclamptic and patients with preeclampsia with neurologic symptoms. Am J Obstet Gynecol. (2016) 215:239.e1–e5. doi: 10.1016/j.ajog.2016.02.,039
PubMed Abstract | CrossRef Full Text | Google Scholar
23. McKinney AM, Short J, Truwit CL, McKinney ZJ, Kozak OS, SantaCruz KS, et al. Posterior reversible encephalopathy syndrome: incidence of atypical regions of involvement and imaging findings. Am J Roentgenol. (2007) 189:904–12. doi: 10.2214/AJR.07.2024
PubMed Abstract | CrossRef Full Text | Google Scholar
24., de Havenon A, Joos Z, Longenecker L, Shah L, Ansari S, Digre K. Posterior reversible encephalopathy syndrome with spinal cord involvement. Neurology. (2014) 83:2002–6. doi: 10.1212/WNL.0000000000001026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Dandoy CE, Linscott LL, Davies SM, Leach JL, Myers KC, El-Bietar J, et al., Clinical utility of computed tomography and magnetic resonance imaging for diagnosis of posterior reversible encephalopathy syndrome after stem cell transplantation in children and adolescents. Biol Blood Marrow Transplant. (2015) 21:2028–32. doi: 10.1016/j.bbmt.2015.07.023
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Noda K, Fukae J, Fujishima K, Mori K, Urabe T, Hattori N, et al., Reversible cerebral vasoconstriction syndrome presenting as subarachnoid hemorrhage, reversible posterior leukoencephalopathy, and cerebral infarction. Intern Med. (2011) 50:1227–33. doi: 10.2169/internalmedicine.50.4812
CrossRef Full Text | Google Scholar
31. Doelken M, Lanz S, Rennert J, Alibek S, Richter G, Doerfler A, et al. Differentiation of cytotoxic and vasogenic edema in a patient with reversible posterior leukoencephalopathy syndrome using diffusion-weighted MRI. Diagn Interv Radiol., (2007) 13:125–8.
Google Scholar
32. Wartenberg KE, Parra A. CT and CT-perfusion findings of reversible leukoencephalopathy during triple-H therapy for symptomatic subarachnoid hemorrhage-related vasospasm. J Neuroimaging. (2006) 16:170–5. doi: 10.1111/j.1552-6569.2006.00031.x
CrossRef Full Text | Google Scholar
33. Vanacker P, Matias G, Hagmann P, Michel P., Cerebral hypoperfusion in posterior reversible encephalopathy syndrome is different from transient ischemic attack on CT perfusion. J Neuroimaging. (2015) 25:643–6. doi: 10.1111/jon.12158
CrossRef Full Text | Google Scholar
34. Lee SY, Kim SH, Lee SH, Baek HJ, Shon HS, Kim SS. Serial MR spectroscopy in relapsing reversible posterior leukoencephalopathy syndrome. Neurologist. (2009) 15:338–41. doi: 10.1097/NRL.,0b013e3181914af6
PubMed Abstract | CrossRef Full Text | Google Scholar
35. McKinney AM, Sarikaya B, Gustafson C, Truwit CL. Detection of microhemorrhage in posterior reversible encephalopathy syndrome using susceptibility-weighted imaging. Am J Neuroradiol. (2012) 33:896–903. doi: 10.3174/ajnr.A2886
PubMed Abstract | CrossRef Full Text | Google Scholar
38., Kryteria diagnostyczne PML: oświadczenie konsensusowe sekcji chorób neuroinfekcyjnych aan. Neurologia. (2013) 80:1430-8. identyfikator doi: 10.1212 / WNL.0b013e31828c2fa1
, w bazie PubMed Adnotacja / zapomnieć pełny tekst / Akademia Google
39. Aracki-Trenkić i, stojanów D Trenkić m, Radovanovic z Ignjatovic J, Ristić s in., Atypical presentation of posterior reversible encephalopathy syndrome: clinical and radiological characteristics in eclamptic patients. Bosn J Basic Med Sci. (2016) 16:180–6. doi: 10.17305/bjbms.2016.1201
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Bartynski WS, Boardman JF. Distinct imaging patterns and lesion distribution in posterior reversible encephalopathy syndrome. Am J Neuroradiol. (2007) 28:1320–7. doi: 10.3174/ajnr.,A0549
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Brickman AM, Reitz C, Luchsinger JA, Manly JJ, Schupf N, Muraskin J, et al. Long-term blood pressure fluctuation and cerebrovascular disease in an elderly cohort. Arch Neurol. (2010) 67:564–9. doi: 10.1001/archneurol.2010.70
PubMed Abstract | CrossRef Full Text | Google Scholar
47., Cozzolino M, Bianchi C, Mariani G, Marchi L, Fambrini M, Mecacci F. Therapy and differential diagnosis of posterior reversible encephalopathy syndrome (PRES) during pregnancy and postpartum. Arch Gynecol Obstet. (2015) 292:1217–23. doi: 10.1007/s00404-015-3800-4
PubMed Abstract | CrossRef Full Text | Google Scholar
48. Masetti R, Cordelli DM, Zama D, Vendemini F, Biagi C, Franzoni E, et al. PRES in children undergoing hematopoietic stem cell or solid organ transplantation. Pediatrics., (2015) 135:890–901. doi: 10.1542/peds.2014-2325
CrossRef Full Text | Google Scholar