wprowadzenie
gronkowce koagulazo-ujemne (CoNS), członkowie grupy gronkowców, są scharakteryzowane jako Gram-dodatnie cocci, przedstawione jako pojedyncze komórki lub o nieregularnym usposobieniu i są nieruchome, nie-zarodnikowe, katalazo-dodatnie, głównie beztlenowce i brak enzymu koagulazy.,11. W skład mikrobioty ludzkiej wchodzą patogeny oportunistyczne, wywołujące infekcje głównie u wcześniaków oraz pacjentów z obniżoną odpornością i protezą.2
wzrost oporności na środki przeciwdrobnoustrojowe w ostatnich latach miał ogromny wpływ na infekcje szpitalne wywołane przez wady. Oksacylina jest półsyntetyczną penicyliną stosowaną w teście wrażliwości do wykrywania oporności na metycylinę i leczenia zakażeń gronkowcowych. Jednakże w izolatach klinicznych CoNS zaobserwowano od 66% do 95% oporności na oksacylinę.,2 oporność na oksacylinę jest często pośredniczona przez gen mecA, który koduje uzupełniające białko wiążące penicylinę (PBP2a) o niskim powinowactwie do półsyntetycznych penicylin.3 gen mecA znajduje się na ruchomym elemencie genetycznym znanym jako gronkowcowy chromosom kasetowy MEC (SCCmec), który zawiera kompleks mec, składający się z genu mecA i jego genów regulujących mecI i mecRI, kompleks ccr, odpowiedzialny za integrację i wycięcie SCCmec, oraz region J, który nie jest niezbędny do powstawania SCCmec, ale może przenosić geny oporności na β-laktam.,Dotychczas opisano 4 13 typów SCCmec, opartych na kombinacji typów kompleksów genów ccr i klas kompleksów genów mec. Podtypy zostały zdefiniowane przez polimorfizmy regionu J w tej samej kombinacji kompleksów mec i ccr.5
pojawienie się izolatów opornych na oksacylinę doprowadziło do ostatecznego zastosowania alternatywnych środków przeciwdrobnoustrojowych w leczeniu zakażeń CoNS, takich jak glikopeptyd wankomycyna. W międzyczasie w ostatnich dziesięcioleciach opisywano zmniejszoną wrażliwość i oporność na wankomycynę.,Zmniejszona wrażliwość na wankomycynę może być związana z modyfikacjami metabolicznymi, takimi jak przyspieszenie syntezy peptydoglikanu, powodującymi pogrubienie ściany komórkowej. W tym procesie wankomycyna nie jest w stanie hamować syntezy peptydoglikanu, ponieważ jest zubożona z powodu wyższej dostępności miejsc D-alanylo-D-alaniny.,7
biorąc pod uwagę wzrost zakażeń szpitalnych wywołanych przez CoNS, badanie to miało na celu scharakteryzowanie szczepów odpornych na oksacylinę i określenie podatności na środki przeciwdrobnoustrojowe 20-letniej kolekcji posiewu krwi cons izolatów z Botucatu Hospital das Clínicas inpatients.
materiał i metody
trzysta szczepów CoNS wyizolowano z hodowli krwi od pacjentów szpitala Botucatu das Clínicas – Paulista State University (UNESP)., Izolaty zostały zebrane w latach 1990-2009 i przechowywane w laboratorium zbierania kultur zakładu Mikrobiologii i Immunologii Instytutu Biosciences Botucatu-UNESP. Kryteria selekcji uwzględniały średnią częstość występowania zdarzeń wynoszącą 35%, z marginesem błędu wynoszącym 5% I 95% przedziałem ufności.
szczepy zostały wyizolowane zgodnie z Koneman et al.8 wyizolowanych z agaru krwi poddano plamieniom grama w celu obserwacji morfologii Kolonii oraz wykonano test katalazy w celu potwierdzenia rodzaju Staphylococcus., Szczepy gronkowców poddano testowi koagulazy w celu różnicowania grup koagulazo-ujemnych i koagulazo-dodatnich. Izolaty koagulazo-ujemne poddano badaniom biochemicznym w celu fenotypowej identyfikacji gatunków. Identyfikacja genotypowa została przeprowadzona za pomocą primerów rysowanych na zachowanych sekwencjach sąsiadujących z genami 16S i 23s, przez ITS-PCR (wewnętrzną transkrybowaną reakcję łańcuchową spacer–polymerase), opisaną przez Couto i in.9 sprawność wzmacniacza monitorowano elektroforezą w 3% metaforze agarozy i barwiono SYBREM., The following lineages of international reference were used: S. auricularis ATCC 33753, S. capitis subsp. capitis ATCC 27843, S. capitis subsp. urealyticus ATCC 49325, S. caprae ATCC 35538, S. cohnii ATCC 49330, S. cohnii subsp. cohnii ATCC 29974, S. epidermidis ATCC 12228, S. epidermidis ATCC 35983, S. hemolyticus ATCC 29970, S. hominis ATCC 27844, S. hominis subsp. novobiosepticus ATCC 700237, S. lentus ATCC 700403, S. lugdunensis ATCC 700328, S. saprophyticus ATCC 15305, S. schleiferi subsp. schleiferi ATCC 43808, S. sciuri subsp. sciuri ATCC 29062, S. simulans ATCC 27851, S., xylosus ATCC 29979, A S. warneri ATCC 10209.
do ekstrakcji DNA wykorzystano zestaw Illustra (GE Healthcare). Etapy obejmowały początkowe trawienie komórek gronkowca lizozymem (10 mg / mL) i proteinazą K (20 mg/mL). Następnie do mieszaniny dodano 500µl buforu ekstrakcyjnego, który odwirowano w temperaturze 10 000 x g przez 4 minuty. Supernatant został przeniesiony do kolumny i odwirowany w temperaturze 5000 g przez 1 min. Płyn został odrzucony i 500µl buforu ekstrakcyjnego dodano do kolumny., Po odwirowaniu i odrzuceniu zebranego płynu do kolumny dodano 500µl buforu myjącego, który poddano wirowaniu w temperaturze 20 000 g przez 3 minuty. Następnie kolumnę przeniesiono do probówki o pojemności 1,5 mL i przeprowadzono elucję za pomocą 200µl rozgrzanej wody MilliQ w temperaturze 70°C.w celu wykrycia genu mecA wykonano detekcję
PCR. Reakcje przeprowadzono przy użyciu protokołu opisanego przez Murakami et al.10 skuteczność wzmocnienia monitorowano za pomocą elektroforezy w 2% żelu agarozowym barwionym SYBR Safe.,
oznaczanie SCCmec
Typ SCCmec oznaczono na szczepach mecA-dodatnich. Reakcje przeprowadzono przy użyciu protokołu opisanego przez Oliveira et al.11 i zmodyfikowane przez Machado et al.12
multipleks PCR wykonano w 50µl objętości reakcji z 1x buforem enzymatycznym, 1.,25 U Taq polymerase DNA, 200 μM dNTP Mix, and the following primers: 10pmol of RIF2 F2 (TTCGAGTTGCTGATGAAGAAGG) and CIF2 R2 (ATTTACCACAAGGACTACCAGC), 6pmol of KDP F1 (AATCATCTGCCATTGGTGATGC) and KDP R1 (CGAATGAAGTGAAAGAAAGTGG), 5pmol of DCS F2 (CATCCTATGATAGCTTGGTC) and DSC R1 (CTAAATCATAGCCATGACCG), 5pmol of RIF4 F3 (GTGATTGTTCGAGATATGTGG), and RIF4 R9 (CGCTTTATCTGTATCTATCGC). For each reaction, 10μL DNA was added. The cycle sequencing reactions were performed at 92°C for 3min, followed by 30 cycles of 92°C for 1min, 56°C for 1min, and 72°C for 1min and 30s., Skuteczność wzmocnienia monitorowano elektroforezą w 2% żelu agarozowym barwionym SYBR Safe.
oznaczanie minimalnego stężenia hamującego (Mic) za pomocą testu E
wrażliwość in vitro szczepów CoNS badano na następujące środki przeciwdrobnoustrojowe: oksacylinę, wankomycynę, Daptomycynę, Linezolid, Chinuprystynę / Dalfoprystynę i Tygecyklinę. MIC tych leków został określony przez E-test. Kryteria klasyfikacji wrażliwości były następujące: oksacylina
µg / mL (wrażliwa) na przeciw, z wyjątkiem S., lugdunensis (wrażliwy ≤2µg/mL and resistant ≥4µg/mL); Vancomycin µg/ml (wrażliwy), 8–16µg/ml (intermediate resistant), and >32µg/ml (resistant); Linezolid ≤4µg/mL (receptywny); Daptomycin ≤1µg/mL; Quinupristin/Dalfopristin ≤1µg/mL (wrażliwy), 2µg/mL (intermediate), and ≥4µg/mL (resistant); Tigecycline ≤0.5 µg/ml).,Test przesiewowy w celu wykrycia zmniejszonej wrażliwości na wankomycynę
w celu wykrycia zmniejszonej wrażliwości na wankomycynę zastosowano przesiewowy test agarowy przygotowany z agaru Brain Heart Infusion (BHI) i 4µg/mL, 6µg/mL, 8µg/mL i 16µg/mL wankomycyny. Szczep referencyjny S. aureus ATCC 29213, wrażliwy na wankomycynę, został użyty jako kontrola negatywna, a szczep E. faecalis ATCC 51299, oporny na wankomycynę, jako kontrola pozytywna. Miejsca na 2.,0,5 g / m2. inokulum dodawano do płytki agarowej i inkubowano w temperaturze 35°C przez 24h, a wzrost przynajmniej jednej kolonii uznano za wynik pozytywny.
analiza grubości ścianki komórkowej
szczepy CoNS, które wykazywały zmniejszoną wrażliwość na wankomycynę, zostały poddane transmisyjnej mikroskopii elektronicznej do analizy grubości ścianki komórkowej. Szczepy hodowano w bulionie BHI i inkubowano w temperaturze 37° C przez 24 godziny. w mikrotube 1000µl bulionu Kultury CoNS odwirowywano przez jedną minutę przy 12 000 obr. / min. Po odrzuceniu supernatantu, szczepy zostały utrwalone w roztworze Karnowskiego (2.,5% aldehydu glutarowego w buforze fosforanowym 0,1 M) przez cztery godziny. Próbki zostały usunięte z utrwalacza i przemyte trzy razy przez pięć minut w wodzie destylowanej. Następnie próbki zanurzano w 0,5% tetroksydku osmu przez 40 minut, a następnie trzykrotnie przemywano przez 10 minut w wodzie destylowanej. Próbki odwodniono przy użyciu zwiększających się stężeń alkoholu: dwa razy przez 10min w 7.,5% alkoholu; dwa razy na 10min w 15% alkoholu; dwa razy na 10min w 30% alkoholu; dwa razy na 10min w 50% alkoholu; trzy razy na 15min w 70% alkoholu; dwa razy na 15min w 90% alkoholu; dwa razy na 10min w 100% alkoholu. Po odwodnieniu zakładano stuby i metalizowano próbki. Analizy przeprowadzono w mikroskopii elektronicznej Tecnai Spirit Fei Company, a obrazy uzyskano w powiększeniu 30000×.,
Wynikiidentyfikacja izolatów
Tabela 1 przedstawia źródło izolatów gatunków CoNS, a także dane demograficzne pacjentów z bakteriemią.
wykrywanie genu mecA i charakterystyka SCCmec oznaczanie minimalnego stężenia hamującego (Mic)
Mic środków przeciwdrobnoustrojowych stosowanych w leczeniu zakażeń CoNS zostało określone za pomocą testu E. Oporność na oksacylinę stwierdzono u 206 (68,7%) szczepów CoNS, a 25 było opornych na tygecyklinę (8,3%). Oporność na tygecyklinę wykryto u 4,5% S. epidermidis, 13,8% S. hemolyticus, 13% S., hominis i 11,1% S. lugdunensis. W przypadku chinuprystyny/dalfoprystyny, jeden izolat S. epidermidis wykazywał oporność pośrednią o MIC 2µg / mL, a jeden S. epidermidis i jeden S. hemolyticus o Mic 3µg / mL. Czułość i swoistość Mic oksacyliny w teście E w porównaniu z obecnością mecA wynosiły odpowiednio 87,4% i 82,3%.
w odniesieniu do gatunków CoNS, rozkład parametrów MIC50 i MIC90 ujawnił wysokie wskaźniki odporności oksacyliny u S. hemolyticus., Był to jedyny gatunek, dla którego minimalne stężenie hamujące 50% izolatów wynosiło >256µg/mL, co odzwierciedla wysoki współczynnik oporności S. hemolyticus na oksacylinę (Tabela 3).
zakres MIC dla każdego leku przeciwdrobnoustrojowego porównano z typem SCCmec. Izolaty oznaczone jako SCCmecI wykazywały wyższe Miki tygecykliny, a te sklasyfikowane jako SCCmecII wykazywały najwyższe Miki oksacyliny. Szczepy SCCmecIV wykazały najwyższe wartości MIC dla wankomycyny, linezolidu, daptomycyny i chinuprystyny/dalfoprystyny (Tabela 4).
Determination of the MIC range according to SCCmec.
| MIC range (μg/ml) | ||||
|---|---|---|---|---|
| Antimicrobial | SCCmec I | SCCmec II | SCCmec III | SCCmec IV |
| Oxacillin | 0.094≥256 | 6≥256 | 0.,125≥256 | 0.125≥256 |
| Vancomycin | 0.25–2 | 0.38–2 | 0.125–2 | 0.75–2 |
| Linezolid | 0.064–1 | 0.19–0.5 | 0.047–0.75 | 0.064–1 |
| Daptomycin | 0.016–025 | 0.016–0.094 | 0.019–0.5 | 0.047–0.75 |
| Quinupristin/Dalfopristin | 0.025–1.5 | 0.094–0.5 | 0.064–1 | 0.125–2 |
| Tigecycline | 0.016–2 | 0.023–0.75 | 0.016–0.75 | 0.,032-1 |
MIC, minimalne stężenie hamujące.
przeprowadzono ocenę mikrofonów oksacyliny i wankomycyny w okresie 20 lat, podzielonych na trzy okresy w zależności od rozmieszczenia zakresów MIC oksacyliny i wankomycyny. W przypadku oksacyliny w pierwszym okresie (1990-2001) obserwowano wyższe wartości MIC, ale nadal wskazywały na podatność., W pozostałych okresach (2002-2006 i 2007-2009) zaobserwowano spadek wartości MIC, co nadal wskazuje na podatność, a także wzrost wskaźników oporności. W odniesieniu do wankomycyny, ta sama ocena wykazała istotne różnice w trzech okresach pomiędzy szczepami z Mic od 0,047 µg/mL do 0,38 µg / mL i od 0,5 µg/mL do 2,0 µg/mL (rys. 1).
oznaczanie zmniejszonej wrażliwości na wankomycynę
na płytce BHI zaobserwowano wzrost 214 (71,3%) szczepów z 4µg/mL wankomycyny, 89 (29,7%) na płytce z 6µg/mL wankomycyny i 8 (2.,6%) wyizolowane na płytce wankomycyny 8µg/mL. Żaden z izolatów nie rosł w pożywce z 16µg / mL wankomycyny. Nie było znaczących różnic w Mic pomiędzy szczepami, które nie wykazywały wzrostu na płytce uzupełnionej wankomycyną i tymi, które rosły na płytce wankomycyny 4µg/mL. Wśród tych, które wykazały wzrost na pożywce z 6µg / mL wankomycyny, zakres MIC wynosił 0,5-2µg / mL. Wśród tych, które rosły na 8µg / mL wankomycyny, zakres MIC wynosił 0,75-24µg / mL. Szczepy wyhodowane na 8µg / mL wankomycyny to cztery S. epidermidis, jeden S. hemolyticus, dwa S. hominis i jeden S., capitis, wszystkie oporne na oksacylinę, A S. epidermidis i S. capitis są nosicielami SCCmec III, S. hominis SCCmec I I s. hemolyticus z niekryptowanym SCCmec.
analiza grubości ścianki komórkowej szczepów o zmniejszonej wrażliwości na wankomycynę
grubość ścianki komórkowej pod podziałem komórkowym zmierzono w ośmiu szczepach (wartości przedstawiono w nanometrach, średnia±SD). Cztery szczepy S. epidermidis prezentowały średnie wartości 21.66±1.4, 20.12±0.9, 24.24±1.3, i 14,20±1,3 nm. Izolat S. hemolyticus wykazał grubość ściany komórkowej 24,88±1,7 nm. Dla S., izolat capitis, grubość ściany komórkowej wynosiła 19,33±1,8, a dla dwóch izolatów S. hominis wartości wynosiły 17,68±2,1 i 24,92±1,5. Dla porównania, użyte szczepy referencyjne S. epidermidis ATCC 12228 i S. hemolyticus ATCC29970 wykazały grubość ścian komórkowych odpowiednio 14,61±1,2 i 14,73±0,7 nm. Porównanie badanych szczepów z kontrolami wykazało wyższe wartości, od 17 nm do 24,92 nm, z wyjątkiem jednego izolatu S. epidermidis, który prezentował niższą wartość w porównaniu z kontrolami (rys. 2).,
wady bakteriemia ewolucja
możliwa ewolucja bakteriemii do innych zakażeń, takich jak posocznica, zapalenie płuc, zakażenie dróg moczowych, zapalenie opon mózgowych, zapalenie otrzewnej, martwicze zapalenie jelit, zapalenie omphalitis i ropień mózgu, była obserwowana u 52 pacjentów przyjętych na oddziały noworodkowe. U 25 (46,3%) pacjentów potwierdzono, że te same wady wyizolowane z posiewu krwi są czynnikiem etiologicznym zakażenia. U sześciu (11,1%), CoNS był możliwym czynnikiem zakażenia, a u 23 (42,6%) CoNS nie był związany z zakażeniem pacjenta (rys. 3).,
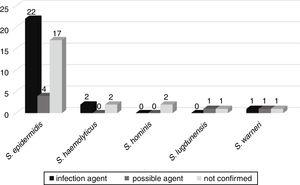
korelacja wad wyizolowanych z posiewów krwi jako możliwych czynników etiologicznych zakażeń wywołanych u noworodków.
Gen mecA wykryto u 33 (61,1%) z tych zakażeń, z czego 20 (60,6%) było związanych z cięższymi zakażeniami lub możliwymi czynnikami tych zakażeń.
dyskusja
wady są uważane za jedną z głównych przyczyn bakteriemii., Znaczenie tych bakterii wzrosło w środowisku szpitalnym w ostatnich latach, głównie ze względu na oporność na środki przeciwdrobnoustrojowe. W niniejszej pracy zbadano 300 szczepów CoNS wyizolowanych z kultur krwi pacjentów przyjmujących lek w szpitalu Klinik Botucatu w okresie 20 lat. Izolaty te charakteryzowały się wrażliwością na środki przeciwdrobnoustrojowe.
wykrywanie mecA określało oporność na oksacylinę w 78,5% CoNS, a wartość MIC50 (2µg / mL) wskazywała na oporność na ten lek, potwierdzając niską wrażliwość tych bakterii na czynniki β–laktamowe., Wcześniejsze prace wykazały, że od lat 70. XX wieku „CoNS” wykazywały wyższe wskaźniki odporności na oksacylinę niż „S. aureus”.Wykazano, że oporność na β–laktam waha się od 65% do 95% w szpitalach w Brazylii i w innych krajach.2,16,17 najwyższe wskaźniki odporności oksacyliny stwierdzono u S. epidermidis, a następnie u S. hemolyticus, S. hominis i S. capitis. Podobne wyniki opisano w poprzednich badaniach, które wykazały oporność oksacyliny u 97% S. epidermidis w latach 1999-2001 na oddziale intensywnej terapii noworodków (NICU),18 w 96% S., hemolyticus wyizolowany w Brazylii, 19 i w 100% S. hominis wyizolowany w OIOM z Hiszpanii.W badaniach przeprowadzonych przez Caierão i wsp.21
chociaż z mniejszą częstotliwością wykryto Gen mecA U S. warneri i S. lugdunensis. S. warneri został opisany ze wskaźnikiem 33,3% odporności na oksacylinę w NICUs, 22, a pierwszy opis mecA u S. lugdunensis był w badaniu przeprowadzonym przez Kawaguchi et al.Pomimo niskiej oporności, 24 oznaczanie wrażliwości na środki przeciwdrobnoustrojowe S., lugdunensis jest ważny, nie tylko ze względu na jego implikacje kliniczne, ponieważ gatunek ten jest najbardziej agresywny z wad, ale także dla ustanowienia wczesnego leczenia odpowiednimi środkami przeciwdrobnoustrojowymi i dobrych wyników klinicznych.25
charakterystyka SCCmec wykazała obecność typów i-IV w izolatach, przy czym SCCmecIII był najczęściej wykrywany w badanych szczepach, głównie w S. epidermidis, jedynym gatunku, który przenosił Typ IV., SCCmec typ III jest największym z nich wszystkich, koduje dla kilku genów związanych z opornością i jest najczęściej izolowanym przeciwnikiem od okazów szpitalnych. S. epidermidis jest głównym kolonizatorem ludzkiej skóry i najczęściej wykrywanym w miejscach infekcji. Presja selektywna w środowisku szpitalnym prowadzi do rozpowszechniania szczepów SCCmec III, które są związane z poważnymi infekcjami.SCCmec typu IV był związany z Staphylococcus spp., i został opisany po raz pierwszy w szczepie „S. epidermidis”, co oznacza jego przeniesienie z „S”., epidermidis do S. aureus. Zmniejszenie kosztów transferu SCCmec IV ze względu na jego niewielkie rozmiary prawdopodobnie doprowadziłoby do większej częstości zakażeń wywołanych przez nosicieli SCCmec IV.12,27 SCCmecII przedstawił związek z S. hemolyticus, podobny do ustaleń Machado et al.,12 którego prace wykryły tylko typ II u tego gatunku.
alternatywą w leczeniu gronkowców opornych na oksacylinę jest wankomycyna, glikopeptyd stosowany po raz pierwszy w 1958 roku w infekcjach inwazyjnych. Istnieją jednak opisy oporności i zmniejszonej podatności na ten lek,6 chociaż niestabilny.,Wyniki obecnych prac wykazały, że z wyjątkiem oksacyliny, wankomycyna była lekiem o najwyższych wartościach MIC50 i MIC90. Pomimo pełnej wrażliwości zbioru, wartości MIC były najwyższe w okresie 20 lat, a zmniejszoną wrażliwość wykryto u niektórych szczepów S. epidermidis, S. hemolyticus, S. hominis i S. capitis. W badaniach przeprowadzonych przez Natoli et al., 29 stwierdzono zmniejszoną wrażliwość na wankomycynę z częstością 5,4% wśród izolatów CoNS, u gatunków S. epidermidis i S. hemolyticus., Według tych samych autorów kolonie gronkowców wyhodowane na agarze wankomycyny mogą prowadzić do heteroresistencji glikopeptydów, która może być prekursorem odporności na glikopeptydy, powodując skomplikowane infekcje i niepowodzenie leczenia. Należy to wziąć pod uwagę przy podejmowaniu decyzji terapeutycznych.30
wzrost odsetka opornych na oksacylinę wad i zmniejszenie ich wrażliwości na wankomycynę podkreślają znaczenie badań obejmujących inne wybory terapeutyczne., Tygecyklina, Gram-dodatnia i ujemna półsyntetyczna glicylocyklina o szerokim spektrum działania, jest uważana za lek o doskonałej aktywności przeciwko oksacylinie podatne i oporne wady,14, 29 pomimo naszych danych pokazujących wskaźniki 8,3% oporności, najczęściej u S. hemolyticus, a następnie S. hominis, S. lugdunensis i S. epidermidis. Podobne wyniki MIC90 opisano dla tygecykliny, bez różnicy między odpornymi na oksacylinę i wrażliwymi wadami.31 w badaniach przeprowadzonych przez Natoli i wsp.Tygecyklina wykazywała dobrą aktywność przeciw wadom., Według tych autorów nie zaleca się stosowania tygecykliny w leczeniu bakteriemii, a jej stosowanie powinno być ograniczone w celu zachowania aktywności wobec opornych na wiele bakterii Gram-ujemnych. Mutacje w genie rybosomalnym S10 oraz genach rpsJ i mepA wydają się być związane z opornością na tygecyklinę.32,33
Chinuprystyna/dalfoprystyna jest streptograminą należącą do grupy makrolidów-linkozamidu-streptograminy., Połączenie chinuprystyny i dalfoprystyny jest synergistyczne i zwykle bakteriobójcze, gdy środki te są porównywane pojedynczo lub w porównaniu z podobnymi makrolidami przeciwdrobnoustrojowymi.W pracy tej, pomimo doskonałej skuteczności w większości badanych przeciw, stwierdzono oporność pośrednią na ten lek u dwóch S. epidermidis i jednego S. hemolyticus. W badaniu przeprowadzonym przez Mendes et al., 35 chinuprystyna/dalfoprystyna wykazywały doskonałą skuteczność przeciw, szczepy były w pełni wrażliwe, z wartościami MIC90 0,38 µg / mL dla szczepów wrażliwych na oksacylinę i 0.,75µg / mL dla szczepów odpornych na oksacylinę. Ponadto Venkatesh et al.Opisano dobrą skuteczność chinuprystyny/dalfoprystyny dla szczepów odpornych na oksacylinę i wrażliwych.
Daptomycyna, lek przeciwdrobnoustrojowy badany przez dziesięciolecia, został ponownie wprowadzony do użytku w 2006 roku, w leczeniu bakteriemii i zapalenia wsierdzia wywołanego przez gronkowce.W niniejszym badaniu daptomycyna wykazała doskonałą skuteczność w przypadku izolatów CoNS, przy niskich wartościach MIC50. Olivares et al.Zweryfikowała również wrażliwość wszystkich Przeciw na daptomycynę, z małą zmiennością wartości MIC., W pracy studiującej 1126 CoNS, prowadzonej przez Critchley et al.DAPTOMYCYNA była aktywna w zakresie MIC od 0, 015 do 2, 0 µg/mL, a MIC90 wynosił 0, 5 µg/mL. Według tych autorów najbardziej aktywnymi czynnikami w tych analizach były daptomycyna i chinuprystyna/dalfoprystyna, co podkreśla znaczenie tych środków przeciwdrobnoustrojowych w leczeniu zakażeń wywołanych przez CoNS.
Linezolid, syntetyczny oksazolidynon potencjalnie aktywny przeciwko kilku bakteriom, jest kolejnym lekiem, który wykazał dobrą skuteczność przeciwko wadom.,Linezolid stał się ważny w leczeniu przewlekłych zakażeń przez wady, pomimo opisu oporności. W Brazylii pierwszy przypadek oporności na linezolid opisano w 2006 roku, na klinicznym izolacie MRSA40, a wśród CoNS, U S. epidermidis, S. hominis i S. hemolyticus.41 w pracy prowadzonej przez Olivares et al., 37 pomimo wykrycia siedmiu szczepów opornych na linezolid, lek ten prezentował skuteczne wartości MIC w szczepach CoNS. Z drugiej strony, ognisko linezolidu odpornego S., opisano klony naskórka zawierające mutacje w białkach rybosomalnych L3 i L4, a także plazmid cfr, niedawno zidentyfikowany we Francji.
S. hemolyticus był gatunkiem, który wykazywał najwyższe wartości MIC oksacyliny, a stężenia wyższe niż 256µg/mL były potrzebne do zahamowania 50% izolatów. Podobnie jak w przypadku oksacyliny, ten gatunek wykazywał wyższe wartości MIC dla tygecykliny i większości badanych środków przeciwdrobnoustrojowych. Kilka prac wykazuje wysoki wskaźnik oporności na środki przeciwdrobnoustrojowe stosowane w leczeniu zakażeń wywołanych przez S., hemolyticus, zwłaszcza metycylina i glikopeptydy. Niektórzy autorzy opisują dużą częstość występowania genów kodujących oporność na leki β-laktamowe i aminoglikozydowe, a także znaczną część izolatów o wartościach Mic zbliżonych do wartości granicznej oporności, 43,44, podkreślając znaczenie S. hemolyticus jako multiresistent patogenu.
skojarzenie zakresu MIC z typami SCCmec wykazało wyższe Mic dla wankomycyny, linezolidu, daptomycyny i chinuprystyny / dalfoprystyny u S. epidermidis noszących SCCmecIV., Geny związane z opornością na te środki przeciwdrobnoustrojowe są pośredniczone przez plazmidy, występujące głównie w szczepach opornych na metycylinę o pochodzeniu szpitalnym.45 SCCmec IV jest charakterystyczny dla izolatów Wspólnoty, szczególnie ze względu na jego rozmiar i niski koszt adaptacyjny. Badania sugerują, że nabywanie genów oporności ma środowiskowe pochodzenie niekliniczne, biorąc pod uwagę dużą różnorodność nośników genów oporności w środowisku naturalnym.46,47 zł, Wyższe Mic w porównaniu do innych środków przeciwdrobnoustrojowych może być również związane z presją selektywną, jako poziom ekspozycji na te leki w środowisku szpitalnym bias wybór zmniejszonej wrażliwości i odpornych szczepów, ponieważ kilka mutacji zdarzeń, rekombinacja genetyczna i modyfikacje w fizjologii drobnoustrojów są potrzebne do generowania zmian fenotypowych.,
zmiany metaboliczne i fizjologiczne związane z ciśnieniem selektywnym można zaobserwować w szczepach hodowanych na agarze wankomycyny 8µg/mL, ponieważ pogrubienie ściany komórkowej stwierdzono w większości izolatów con z powodu zwiększonej syntezy peptydoglikanu. Mechanizm ten jest korzystniejszy dla minusów niż nabycie van Operonu, który jest mediatorem oporności na wankomycynę. Van operon nabywany jest poprzez horyzontalny transfer genów, a jego ekspresja jest stymulowana tylko w obecności glikopeptydu., Bodziec ten powoduje bardzo wysokie koszty adaptacyjne w obecności wankomycyny, będąc niekorzystnym dla wad w środowisku wankomycyny.48,49 w odniesieniu do nabycia innych genów oporności w CoNS, takich jak gen mecA, początkowy koszt adaptacyjny jest łagodzony przez kompensacyjne dodatkowe mutacje dla „kosztów” oporności. Ostatnio wykazano, że mutacje punktowe w genach, takich jak vraR, wiążą się ze zmniejszoną wrażliwością na wankomycynę i zgrubieniem ściany komórkowej u gronkowców.,50
niniejsze badanie wykazało wysoki wskaźnik bakteriemii spowodowanej wadami w oddziałach noworodkowych i pediatrycznych, z udziałem dzieci poniżej jednego roku życia, głównymi czynnikami są S. epidermidis, S. hemolyticus, S. hominis, S. lugdunensis i S. warneri. S. capitis nie były izolowane w tych jednostkach, będąc czynnikami bakteriemii u dorosłych przyjętych na Oddział Chorób Wewnętrznych, gastroenterologii, neurologii i pogotowia ratunkowego.,
ponieważ badanie dotyczyło bakteriemii wywołanej przez gronkowce izolowane przez ponad 30 lat, wiele danych związanych z dokumentacją medyczną pacjentów nie można było odzyskać, więc nie było możliwe powiązanie wyniku zakażenia wszystkich pacjentów, co jest ograniczeniem obecnego badania. Dane uzyskane od pacjentów w oddziałach noworodkowych wskazywały na kliniczne znaczenie bakteriemii, która może przechodzić do chorób wymagających specjalistycznej opieki.
znajomość oporności na środki przeciwdrobnoustrojowe ma ogromne znaczenie dla prawidłowego leczenia zakażeń wywołanych przez wady., Ponadto czynniki zjadliwości tych bakterii i odporność pacjentów są czynnikami, które przyczyniają się do zdolności mikroorganizmu do wywoływania poważniejszych zakażeń.
wyniki naszego badania trwającego 20 lat wykazały wysoką częstość oporności na środki przeciwdrobnoustrojowe w wadach, co odzwierciedla nadmierne stosowanie tych leków., Oprócz metabolicznych i fizjologicznych modyfikacji, które mogą prowadzić do zmniejszonej podatności na środki przeciwdrobnoustrojowe, ich stan jako ludzkich bakterii komensalnych czyni je idealnymi transporterami i wydajnym rezerwuarem genów oporności, zwłaszcza elementów tanich, takich jak SCCmec.Środki przeciwdrobnoustrojowe, które dały najlepsze wyniki, powinny być stosowane w taki sposób, aby zachować ich skuteczność i zapobiegać oporności.,
konflikty interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.