genen p53 upptäcktes först 1979. Ett protein som identifierades i simian virus 40-transformerade musen celler (SV40) av immunoprecipitation med anti-T-serum, detta protein som kallas p53-proteinet . Samma år hittade Kress och andra forskare en ny klass av proteiner med en molekylmassa som sträcker sig från 50-60kDa. Denna typ av protein identifierades sedan som p53 . Proteinet p53 kan också identifieras från olika transformerade cellinjer genom immunoprecipitation., Lane och Linzer fick också ett liknande resultat 1979. Andra bevis för att identifiera p53 är att p53 uttrycktes i alla testade transformerade musceller; dessa tester innefattar kemiskt inducerade sarkomer, transformerade fibroblaster och leukemier, medan p53 i normala celler inte uttrycktes. Dessutom upptäcktes en hög nivå av p53 i de flesta transformerade celler oavsett hur cellerna transformerades, antingen spontant eller icke-spontant ., Det berodde till stor del på den ökade stabiliteten hos p53, men i F9 embryonala karcinoaceller uttryckte den en hög nivå av p53, detta berodde på mängden översatt p53 mRNA .
Efter att proteinet p53 hade upptäckts 1979 blev det populärt att analysera det. Men på den tiden, som det var ett nyupptäckt protein, och det fanns inte ett tidigare namn för det, använde olika institutioner olika namn och publicerade papper med olika namn., För att lösa detta problem, 1983, under den första internationella p53-workshopen som hölls i Oxted, Storbritannien, samlades forskare från olika forskargrupper i olika länder för att diskutera en gemensam nomenklatur för detta nyupptäckta protein. Vid detta möte blir ” p53 ” sitt namn och det har använts sedan dess. Man trodde att anledningen till att forskare kallade proteinet p53 är att molekylmassan för detta protein är 53kDa som bygger på dess migration i SDS gel. Senare visade sig molekylmassan vara fel, och den korrekta molekylmassan ska vara 43.,7kDa eftersom p53 innehåller en prolinrik region, och denna region kan minska migrationen av p53 i SDS gel. Men namnet ” p53 ” kvarstod .
under 1980-talet troddes proteinet p53 vara involverat i cellcykeln, samt spela en roll i DNA-replikation. Senare, 1982 till 1994, fann människor att vissa virala onkoproteiner kunde binda till p53 och bilda ett komplex. I 1982, Sarnow et al. fann att adenovirus e1b (58kDa) kan interagera med ett 54kDa-protein som är närvarande i SV40-transformerade musceller som nämns ovan., Enligt resultaten av immunologiska särdrag hos T-antikroppar och peptidkartorna för 54kDa-proteinet identifieras detta 54kDa-protein som p53 . Samma år fann forskare att om de injicerade p53-antikroppen i Schweiziska 3T3-musceller skulle det hämma celler som kommer in i S-fasen i cellcykeln, dock; under samma situation påverkade p53-antikroppen inte SV40-eller adenovirusinducerad DNA-syntes .,
senare 1984 undersökte forskare effekten av p53 på icke transformerade 3T3 fibroblaster; de analyserade synteshastigheten för proteinet p53 vid olika tidpunkter och fann att i slutet av G1-fasen ökade synteshastigheten och nivån av proteinet p53 och dess relaterade mRNA. Detta resultat tyder på att proteinet p53 hämmar celler som kommer in i delningsfasen från interfaset . Maltzman W et al. gjorde ett annat experiment samma år. De behandlade den icke transformerade muscellen med UV-ljus och UV-mimetisk kemisk cancerframkallande 4nqo, och de upptäckte en hög nivå av p53., Resultatet visade att förhöjt uttryck av p53 inte bara är en symbol som indikerar cellcykeln, men också ännu viktigare en komponent som är involverad i DNA-syntes och cellproliferation . 1987, när man studerar komplexet av T-antigen av simian-virus 40 och DNA-polymeras α, Gannon och andra forskare fann en liknande förändring i antigenet när det är bundet till p53 och polymeras α. De fann också att vid en viss koncentration av de tre komponenterna kan de bilda ett speciellt trimerkomplex som innehåller t-antigen, p53 och DNA-polymeras α., Eftersom T-antigen är involverat i viral DNA-replikation och celltransformation indikerar detta resultat att p53 spelar en roll vid kontrollen av cellcykeln och DNA-replikationen .
som experimentet visade ovan har p53 förmågan att odödliggöra celler. 1984, Eliyahu D et al. fann att p53 och produkten av oncogene myc delade några liknande egenskaper. Båda har förmågan att binda till andra proteiner och är involverade i cellcykeln, och de ackumuleras båda i kärnor av transformerade celler ., Bienz, Pennica och Oren analyserade aminosyrasekvenserna av proteinet p53 och produkten av myc, och de fann att de två proteinerna visar likheter i molekylär struktur och positionen för speciella laddade rester. Då föreslog forskare att p53 kan fungera som en onkogen. Baserat på denna hypotes, Eliyahu d et al. gjorde några experiment. Eftersom de primära embryofibroblasterna kan omvandlas genom involvering av både myc-produkt och ha-ras, kan primära baby råtta njurceller också omvandlas genom samarbete mellan Ha-ras och adenovirus tidig Region 1A , Eliyahu d et al., beslutade att använda denna typ av biologiskt testsystem för att identifiera p53: s onkogena funktion. De behandlade normala embryonala celler med p53 och aktiverade ha-ras. Resultatet visade att målceller möter morfologiska förändringar och producerar höga nivåer av p53, Eliyahu d et al. trodde att omvandlingen av embryonala fibroblaster av p53 och Ha-ras förklarade att genen p53 är en onkogen ., I 1985 föreslog Jenkins att p53-genen kan förlänga cellernas livslängd, förbättra omvandlingens affektivitet genom att omorganisera sin kodningssekvens som kan orsaka produktion av stabila proteiner .
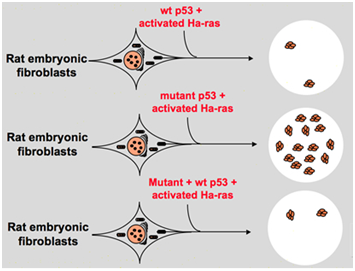
men i slutet av 1980-talet började forskare inse att p53 är en tumörsuppressorgen istället för en onkogen. De observerade att p53 med normal funktion inte kan detekteras i många av tumörerna och fann att det är nödvändigt att förlora uttrycket och funktionen av vildtyp p53-gen under celltransformation., Dessa ökar risken för att p53-genen av vildtyp kan hämma neoplastisk progression . Sedan formulerade de en annan hypotes: klongenen p53 som används i tidigare experiment innehåller dominerande negativa mutationer inom den högt bevarade domänen ibland, vilket leder till motsatta experimentresultat . I 1988, ben och andra forskare upptäckt en stor mängd omarrangerade p53 i Murin erythroleukemia cellinjer — DP20 – 1 och CB3 som härrör från spleens av murin infekterade med vän leukemi virus ., I 1989, Eliyahu, som påpekade att p53 är en onkogen ändrade sig, och han antog att vildtyp p53-gen kan hämma celltransformation. Eliyahu och andra forskare studerade effekten av vildtyp p53-protein kodat av plasmider och mutant p53 på förmågan att framkalla primärhastighet embryo fibroblasttransformation genom olika onkogenkombination in vitro. Till exempel mutant p53 plus ras, och myc plus ras., Resultatet visade att vildtyp p53 leder till en stor minskning av de transformerade foci som orsakas av mutant p53 plus ras; mutant p53 visade ingen hämning på transformerade foci orsakade av myc plus ras, medan myc plus ras-medierad omvandling är mycket känslig för uttrycket av vildtyp p53. Figur 1 visar detta experiment koncist. Det visade att jämfört med mutant p53 uppvisar wild-typ p53 en uppenbarligen hämmande effekt på celltransformationen. Effekten är positivt relaterad till uttrycksnivån för vildtyp p53 och negativt relaterad till uttrycksnivån för mutant p53., Detta experiment föreslog att wild-typ p53 verkligen kan ha en motsatt funktion jämfört med mutant p53 och kan hämma tumorigenes . För närvarande är p53 erkänd som en tumörsuppressorgen. Det uppskattas att ungefär hälften av tumörer orsakas av p53. Det är en av de vanligaste muterade generna hos människor, och den oftast analyserade genen runt om i världen .
under de första åren av 1980-talet var den biokemiska vägen för p53 och effekten av p53-mutationen inte tydlig. 1991 fann Kern och andra forskare att en 33-baspar DNA-sekvens binder specifikt till vildtyp p53 in vitro. De fann också att p53-proteinet innehåller två mutationer som vanligtvis finns i mänskliga tumörer som inte kan binda till denna specifika DNA-region. Så de antog att funktionen av p53 beror på dess förmåga att binda specifika DNA-sekvenser, och denna förmåga förändras av mutationer som finns i mänskliga tumörer., De antar också att denna 33-baspar DNA-sekvens kanske inte är den enda sekvensen som har förmågan att binda specifikt till p53 hos människor; det kan dock hjälpa människor att bättre förstå funktionen av p53 . Senare befanns p53 spela en roll under cellcykeln, DNA-reparation, differentiering, initiering av apoptos och angiogenes. Rotter V et al. fann att p53 upp-reglerar differentiering av celler. Till exempel upptäcktes en hög nivå av p53-protein i flera viktiga steg under b-celldifferentiering. Förhöjd p53 kan också detekteras under spermatogenes., Under tiden kan endast en mycket låg nivå av p53-protein detekteras i vissa organ av vuxna möss .
1990 upptäcktes ett användbart verktyg ibland. Det är en temperaturkänslig mutant av p53, kallad p53val135. Det kan fungera som en riktig vildtyp p53 vid temperaturen 32,5 oC, undertryckande transformation, och det kan också fungera som andra muterade p53 vid temperaturen 37,5 oC eller över 48oC, framkalla transformation. Dessutom, för transformerade celler som uttrycker p53val135, styrs dess proliferation vid den tillåtna temperaturen, och denna typ av kontroll är reversibel., Genom att använda denna p53val135 mutant upptäcktes wild-type p53 för att inducera cellcykelstopp vid antingen G1 eller G2/M . 1991, Elisheva et al. fann att den temperaturkänsliga p53val135 utförde en annan funktion i cellinjen i Murin myeloid leukemi. Efter reaktivering av p53val135 i några dagar Dog alla celler, och denna död uppvisar vissa egenskaper hos apoptos . Ett år senare erhölls ett liknande resultat av Shaw. En vild typ p53 överfördes till en human kolon tumör-härledd cellinje EB., Cellerna undersöktes under ljus-och elektronmikroskop och visade sig uppvisa vissa egenskaper hos apoptos . I 1990, Scheffner et al. och andra forskare fann att E6 som stimulerar förstörelsen av värdcellsreglerande proteiner kodas av de onkogena humana papillomavirustyperna 16 och 18, och det kan bilda ett komplex med vildtyp p53 in vitro, vilket i sin tur orsakar nedbrytningen av protein p53 .
1992 upptäcktes ett nyckelprotein MDM2 eftersom det binder tätt med p53, och det hämmar transaktivering medierad av p53., Den molekylära massan av MDM2 är 90kDa, och det bildar ett komplex med både muterade och vilda typ p53 . Samma år, Livingstone rl et al. studerade om cellen förlorat en eller båda kopiorna av vilda typ p53 alleler och om det var tillräckligt för att orsaka genförstärkning. Genförstärkning detekterades mestadels i transformerade celler men inte i de normala fibroblasterna. Resultatet visade att celler som förlorar en kopia av p53-allelen fungerar som vildtyp p53, medan celler som förlorar båda kopiorna av den vilda typen p53-alleler uppvisar en högre amplifieringsfrekvens . Ett annat experiment som gjorts av Yin Y et al., visade ett liknande resultat .
1993 identifierades en p53-målgen som heter CDKN1A. Det kodar för proteinet P21 som är en cyklinberoende kinashämmare som hämmar cyklin-CDK2 och CDK1 genom att binda till dem. År 1993 fann Szekely att Epstein-Barr-viruset nuclear antigen 5 (EBNA-5) kodas av Epstein-Barr-viruset, och det kan infektera human B lymfoblastoidcell. En 66 aminosyra lång peptid är ansvarig för bildandet av komplexa EBNA-5-p53, punktmutationer av p53 påverkade inte dess bindningsförmåga till EBNA-5., Det hämmar emellertid dess formationer av komplex med andra molekyler . 1994 beskrev Cho och hans medarbetare först kristallstrukturen av komplexa p53-DNA. Denna DNA-bindande domän kallades också kärndomänen. Den innehåller rester 102-292 och består av en beta-smörgås. De visade också den detaljerade strukturen för kärndomänen . Även 1994, Wang XW et al. interaktionen mellan hepatit B-virus X-protein (HBX) och vild-typ p53-protein hos människa., De fann att HBX kan hämma p53: s förmåga att binda till annat sekvensspecifikt DNA efter att det är bundet till p53 och det kan också hämma föreningen av p53 med transkriptionsfaktorer .
1997, Honda R et al. första hypotesen att MDM2 kan utlösa p53 ubiquitylering och leda till nedbrytning av p53 av ett ubiquitin-proteasomsystem. De påpekade att MDM2 binder till N-terminal domän (NTD) av p53 och fungerar som ubiquitin ligase E3 . Även i 1997 upptäcktes två nya familjer av proteiner, p63 och p73 som delar betydande homologi med p53., P73, även kallat tumörprotein 73, kodas av en gen som ligger i 1p36. Platsen raderas ofta i neuroblastom och andra tumörer. p73 kan aktivera p53 målgener och interagerar med p53 . Yang et al. fann att genen p63 ligger i 3q27-29 och det kan detekteras i olika mus-och humanceller. Liksom p73 kan p63 transaktivera p53-målgener signifikant, det kan också inducera apoptos. En egenskap hos p63 är att majoriteten av p63 saknar en N-terminus ., Samma år fann Serrano och medarbetare att primära murina fibroblaster kan omvandlas av ras i frånvaro av p53 eller p16, och inaktiv p53 eller p16 kan underlätta odödlighetsprocessen hos mänskliga celler. Dessa fynd tyder på att p53 spelar en roll i cellulär senescence . Sedan 1997 befanns p53 spela en roll vid initieringen av apoptos. När celler kommer in i proliferationsfasen skulle telomererna i slutet av varje kromosom förkortas efter varje omgång av DNA-replikation på grund av ofullständig replikering av ENSTRÄNGS-DNA i slutet av DNA-stativet ., Aktiverad tumörsuppressorgen p53 begränsar antalet gånger celldelning kan förekomma. Wynford TD fann att med förlusten av funktionen av vildtyp p53, flyr alla fibroblaster från apoptos. Transaktiveringsfunktionen hos p53 kan också slås på genom apoptos . Wynford TD föreslog att det finns tre möjligheter till hur p53 aktiveras. Den första är post-translationell modifiering genom fosforylering, den andra är upp-reglerar transkritionella kofaktorer som p33ing1, den sista är ned-reglerar p53-hämmarna som MDM2 .
I 2000, Brodsky MH et al., studerade transkriptionsmålen för p53 i Drosophila. Det finns bevis för att visa Drosophila ögon visar en svår grov ögonfenotyp under uttrycket av mänsklig p53 som kommer att inducera apoptos av ögon imaginal skivceller, vilket orsakar förlust av pigmentceller, slutligen hämma ögonutveckling av Drosophila, så Drosophila kan vara ett modelldjur för att studera funktionen av p53. Brodsky fann att genen rpr innehåller en konsensus p53 bindande plats som ligger i cis-regulatoriska regionen rpr, och det är också en aktivator av apoptos., Med andra bevis hävdade Brodsky att rpr är ett transkriptionellt mål för p53 . År 2001 fann Derry och medarbetare att C. elegans inte har en p53-gen, men innehåller faktiskt en gen cep-1 som kodar för proteiner som har en liknande sekvens med protein p53. Denna C. elegans gen kodar protein CEP-1 som har förmågan att inducera apoptos genom genotoxisk stress och är en nödvändig komponent under meios .
år 2002 föreslog Tyner och medarbetare att p53 spelar en roll för att reglera åldrandet av organismer., För att studera funktionen hos p53 skapade de genetiskt konstruerade möss med muterad p53 genom att radera exons 1-6 och en uppströmsregion av vildtyp p53-gen (p53+/+), kallad p53+/m. den fungerar som vildtyp p53 och har förbättrat resistens mot spontana tumörer bättre än vildtyp p53. I experimentet övervakade de mössen som innehåller p53+/m, p53+/+och p53+/ -. p53 + / – betyder att mössen förlorar en kopia av den vilda typen p53-genen., Resultaten visade att ingen av mössen med p53 + /m utvecklade livshotande tumörer, men mer än 80% av mössen med p53+/- och mer än 45% av mössen med p53+/+ utvecklade dessa typer av tumörer. När man tittar in i tumörerna observerades lokaliserade tumörskador hos 2 av 35 p53+/M-Möss, däremot hittades olika tumörer som lymfom och osteosarkom i p53+/ – och p53+ / + – möss. Under detta experiment observerade de också att medianåldern för p53+/m var 96 veckor medan medianåldern för p53 + /m var 116 till 118 veckor., Tyner och medarbetare undersökte också möjligheten att den kortare livslängden för p53+/m var förknippad med åldrande. De fann att efter 18 månader började p53+/m-mössen gå ner i vikt och kraft, som för p53+/M-Möss observerades reducerade vikter vid åldern 30-36 månader. p53 + / M Möss uppvisar också lordokyfos. Beroende på röntgenanalys uppvisade p53 + /M-Möss minskad bentäthet i åldern 12 månader, och det blir svårt vid 18 års ålder. Detta är en symbol för osteoporos och osteoporos är en markör för åldrande hos människor och möss . Tyner et al., testade också toleransen av stress, eftersom denna förmåga också är en markör för åldrande . De utförde 3 mm punch biopsier i bakhuden av gamla och unga bedövade p53+/ m och p53+ / + möss. Deras resultat visade att många gamla p53+/m-möss dog efter injicerad standarddos av Avertin, vilket indikerar att gamla p53+/m-möss var mindre toleranta mot stressen .
1991 konstaterades att p53 har förmågan att inducera apoptos, medan 2003; Mihara och andra forskare fann att p53 också har en apoptosroll i mitokondrierna ., Eftersom vissa mitokondriella proteiner har förmågan att aktivera cellulär apoptos antingen genom aktiva caspaser eller neutraliserande cytosoliska hämmare. I exemplet med cytokrom C-inducerat caspas, efter att ha fått apoptossignalen, frigörs cytokrom c från mitokondriens intermembranutrymme, och binder sedan i sin tur till Apf-1 som existerar som en inaktiv monomer, inducerar sin konformationsförändring och ökar dess bindningsaffinitet för dATP/ATP med 10 gånger än Apaf-1 binder dATP / ATP ensam. Då binder komplexet Apaf-1-cytokrom C till dATP / ATP, bildar apoptosomen., Därefter rekryterar caspas rekryteringsdomänen (kort) av Apaf-1 exponerad i apoptosomen, rekryterar procaspas-9 och aktiverar sedan sig själva automatiskt. Det slutliga komplexet klyver sedan och aktiverar andra caspas som caspas-3 som i sin tur klyver viktiga molekyler i cellen, vilket orsakar kromatin kondensation, DNA-fragmentering och slutligen leder till apoptos . Figur 2 visar aktiveringsvägen för cytokrom C-inducerad caspas.
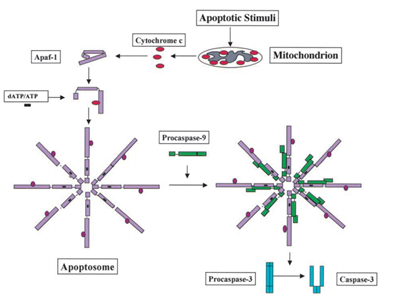
Mihara m et al. forskare fann att den vilda typen p53-genen snabbt kan översättas till mitokondriell yta av tumörceller. I experimentet fann de att något stressinducerat vildtyp p53-protein har förmågan att översätta till mitokondrierna av tymocyter i humana eller musceller efter apoptos på grund av DNA-skada och hypoxi. Därefter inducerar dessa vilda p53-proteiner permeabilisering av mitokondrier och orsakar en serie förändringar som uppträder i mitokondrier som att frigöra cytokrom C genom att bilda komplex med Bcl2 och BclXL .,
som ett bra kliniskt resultat med liten bieffekt är genterapi populär. I slutet av 2005 fanns det 1020 genterapiförsök i databasen av Journal of Gene Medicine. Bland dessa studier genomfördes 66% av genterapierna på cancerpatienter, och 58 studier av detta använde rAd-p53, ett rekombinant adenovirus som kodade den mänskliga p53-genen. I April 2004, ett rekombinant humant adenovirus-p53 injektion (Gendicine) lanserades formellt. Gendicin används för att behandla huvud och hals skivepitelcancer och det godkändes av staten Food and Drug Administration i Kina på okt. 16, 2003., Det blev den första genterapiprodukten i världen som godkändes av den kinesiska regeringen .
genen p53 upptäcktes för att reglera metabolismen 2005. För att överföra från G1 till S-fasen måste cellerna ha tillräckligt med råmaterial för DNA, organeller och proteinsyntes. För att reglera denna process är vissa kontrollpunkter nödvändiga. En av dem är glukosberoende kontrollpunkten vid G1/S. Det regleras av AMP-aktiverat proteinkinas (AMPK). När glukos är uttömd kan AMPK fosforylatprotein p53, vilket i sin tur inducerar cellstopp och undviker celldöd., Celler som stöter på p53-beroende gripandet kommer att återinträda i cellcykeln när glukos är tillräcklig .
det är känt att inaktivering av p53 är nödvändig för bildandet av tumörer. Bykov et al. VJ och Snydel EL et al. påpeka att felaktig funktion av p53 kan leda till spridning av en befintlig tumör . Ventura och hans medarbetare gjorde några experiment för att testa denna hypotes. De återställde funktionen av endogena p53 i primära autoktonösa tumörer för att undersöka konsekvensen av p53-reaktivering., Resultatet visade att p53-reaktivering var ansvarig för regression av autoktona tumörer. Det betyder att inaktiverat p53-protein kan leda till tumörutveckling . Xue och andra forskare gjorde också ett experiment för att testa konsekvensen av att återaktivera p53 på tumörer. De använde reversibel RNA-interferens (RNAi) för att reglera uttrycket av endogen p53 hos möss med levercancer. I experimentet används doxycyklin (Dox) för att återaktivera p53, eftersom uttrycket av p53 är helt undertryckt när Dox saknas och snabbt återställs när Dox läggs till., Vid behandling med Dox stängdes p53 miRNA av vilket i sin tur orsakar ökat uttryck för p53. Resultatet visade att tumörerna i DOX-behandlade möss blir odetekterbara efter 12 dagar, medan tumörer i obehandlade möss växte snabbt. För att testa konsekvensen av övergående reaktivering av p53 behandlade de möss med Dox i 4 dagar och slutade sedan. Resultatet visade att även en två dagars behandling kan orsaka regression av tumörer och 4 dagars behandling kan få tumörerna att helt regressera., De påpekade också att under tumörregression kan transient-reaktiverad p53 utlösa cellulär senescence, inte apoptos. Samma år fann Hu att embryonal implantation hos p53 – / – honmöss regleras av Leukemihämmande faktor (LIF). LIF är en utsöndrad cytokin och är viktig för blastocystimplantation. Genkodningen LIF identifieras som p53-målgenen och p53-bindningsstället ligger i intron 1 hos både människor och möss .