introduktion
Coagulas-negativa stafylokocker (CoNS), medlemmar av staphylococci-gruppen, karakteriseras som Gram-positiva kocker, presenterade som enstaka celler eller med oregelbunden disposition, och är immobila, icke-sporbildande, katalas-positiva, mestadels fakultativa anaerober och saknar kocker.enzymet koagulas.,1 CoNS är en del av Human microbiota, anses opportunistiska patogener, orsakar infektioner främst hos för tidigt födda barn, och immunkompromised och protetiska patienter.2
ökningen av antimikrobiell resistens under de senaste åren har haft stor inverkan på sjukhusinfektioner orsakade av nackdelar. Oxacillin är ett semisyntetiskt penicillin som används i mottaglighetstestet för detektering av meticillinresistens och behandling av stafylokockinfektioner. Emellertid har frekvenser från 66% till 95% av oxacillinresistens observerats i CoNS kliniska isolat.,2 Oxacillinresistens medieras ofta av mecA-genen, som kodar för ett kompletterande penicillinbindande protein (PBP2a) med låg affinitet till semisyntetiska penicilliner.3 mecA-genen är belägen på ett mobilt genetiskt element som kallas Staphylococcal Cassette Chromosome mec (SCCmec) som innehåller mec komplex, som består av mecA-genen och dess regulator gener mecI och mecRI, ccr-komplex, med ansvar för integration och excision av SCCmec, och J regionen, vilket inte är nödvändigt för SCCmec formation, men kan bära icke-β–laktam motstånd gener.,4 hittills har 13 SCCmec-typer beskrivits, baserat på kombinationen av CCR-genkomplextyper och mec-genkomplexklasser. Subtyperna definierades av J-regionens polymorfismer i samma kombination av MEC-och ccr-komplex.5
framväxten av oxacillinresistenta isolat har lett till den slutliga användningen av alternativa antimikrobiella medel för behandling av CoNS infektioner, såsom glykopeptid vankomycin. Under tiden har beskrivningar av minskad känslighet och resistens mot vankomycin rapporterats under de senaste decennierna.,Minskad känslighet för vankomycin kan vara relaterad till metaboliska modifieringar såsom acceleration i peptidoglykansyntes, vilket resulterar i cellväggsförtjockning. I denna process kan vankomycin inte hämma peptidoglykansyntesen, eftersom den är utarmad på grund av den högre tillgängligheten av D-alanyl-d-alaninställen.,7
Med tanke på ökningen av sjukhusinfektioner orsakade av CoNS, syftade denna studie till att karakterisera de oxacillinresistenta stammarna och bestämma den antimikrobiella känsligheten hos en 20-årig samling blodkulturkonsisolat från Botucatu Hospital das Clínicas inpatients.
Material och methodsStrains
Tre hundra Nackdelar stammar som isolerats från blod kulturer från inneliggande patienter av Botucatu Sjukhus das tunnelbanestationerna clínicas – Paulista State University (UNESP)., Isolaten samlades in från 1990 till 2009 och hölls i Kultursamlingslaboratoriet för mikrobiologi-och immunologiska institutionen vid Botucatu Biosciences Institute-UNESP. Urvalskriterierna anses vara en genomsnittlig förekomst av händelser på 35% , med en felmarginal på 5% och ett 95% konfidensintervall.
stammarna isolerades enligt Koneman et al.8 blod – agarisolat utsattes för gramfläck för observation av kolonimorfologi och katalastestet utfördes för bekräftelse av släktet Staphylococcus., Stafylokockstammar lämnades in till koagulastestet för differentiering av koagulasnegativa och koagulaspositiva grupper. Koagulas-negativa isolat utsattes för biokemiska tester för fenotypisk identifiering av arter. Den genotypiska identifieringen utfördes med hjälp av primrar ritade över bevarade sekvenser intill 16S och 23S gener, genom dess-PCR (intern transkriberad spacer–polymeraskedjereaktion), som beskrivs av Couto et al.9 Amplifieringseffektivitet övervakades genom elektrofores i 3% metafor agaros och färgades med SYBR Safe., The following lineages of international reference were used: S. auricularis ATCC 33753, S. capitis subsp. capitis ATCC 27843, S. capitis subsp. urealyticus ATCC 49325, S. caprae ATCC 35538, S. cohnii ATCC 49330, S. cohnii subsp. cohnii ATCC 29974, S. epidermidis ATCC 12228, S. epidermidis ATCC 35983, S. hemolyticus ATCC 29970, S. hominis ATCC 27844, S. hominis subsp. novobiosepticus ATCC 700237, S. lentus ATCC 700403, S. lugdunensis ATCC 700328, S. saprophyticus ATCC 15305, S. schleiferi subsp. schleiferi ATCC 43808, S. sciuri subsp. sciuri ATCC 29062, S. simulans ATCC 27851, S., xylosus ATCC 29979, och S. warneri ATCC 10209.
DNA-extraktion
Illustra kit (GE Healthcare) användes för DNA-extraktion. Stegen inkluderade en initial matsmältning av stafylokockceller med lysozym (10mg / mL) och proteinas K (20mg/mL). Därefter tillsattes 500µL av extraktionsbufferten till blandningen, vilken centrifugerades vid 10,000 x G för 4min. Supernatanten överfördes till en kolumn och centrifugerades vid 5000 g för 1min. Vätskan kasserades och 500 µl extraktionsbuffert tillsattes till kolonnen., Efter centrifugering och kassering av den uppsamlade vätskan tillsattes 500 µl tvättbuffert till kolonnen, som skickades till centrifugering vid 20 000 g för 3min. Därefter överfördes kolonnen till ett 1,5 mL rör och eluering utfördes med användning av 200µL uppvärmt MilliQ-vatten vid 70°C.
Meca-gendetekteringen
PCR utfördes för detektering av mecA-genen. Reaktioner utfördes med användning av ett protokoll som beskrivs av Murakami et al.10 förstärkningseffektiviteten övervakades genom elektrofores i en 2% agarosgel färgad med SYBR Safe.,
bestämning av SCCmec
SCCmec-typen bestämdes på mecA-positiva stammar. Reaktioner utfördes med hjälp av ett protokoll som beskrivs av Oliveira et al.11 och modifierad av Machado et al.12
Multiplex PCR utfördes i 50µL reaktionsvolym med 1x enzymbuffert, 1.,25 U Taq polymerase DNA, 200 μM dNTP Mix, and the following primers: 10pmol of RIF2 F2 (TTCGAGTTGCTGATGAAGAAGG) and CIF2 R2 (ATTTACCACAAGGACTACCAGC), 6pmol of KDP F1 (AATCATCTGCCATTGGTGATGC) and KDP R1 (CGAATGAAGTGAAAGAAAGTGG), 5pmol of DCS F2 (CATCCTATGATAGCTTGGTC) and DSC R1 (CTAAATCATAGCCATGACCG), 5pmol of RIF4 F3 (GTGATTGTTCGAGATATGTGG), and RIF4 R9 (CGCTTTATCTGTATCTATCGC). For each reaction, 10μL DNA was added. The cycle sequencing reactions were performed at 92°C for 3min, followed by 30 cycles of 92°C for 1min, 56°C for 1min, and 72°C for 1min and 30s., Förstärkningseffektiviteten övervakades genom elektrofores i en 2% agarosgel färgad med SYBR Safe.
bestämning av den minsta hämmande koncentrationen (MIC) genom e-testet
in vitro-känsligheten hos CoNS-stammar testades för följande antimikrobiella medel: Oxacillin, vankomycin, Daptomycin, Linezolid, Kinupristin/Dalfopristin och Tigecyklin. MIC av dessa läkemedel bestämdes av e-testet. Kriterierna för klassificering av känslighet var: Oxacillin
µg/mL (mottaglig) för CoNS, utom S., lugdunensis (känslig ≤2µg/mL och resistent ≥4µg/mL), vankomycin µg/mL (mottaglig), 8–16µg/mL (intermediate resistant) och >32µg/mL (resistent); Linezolid ≤4µg/mL (mottaglig); Daptomycin ≤1µg/mL; Kinupristin/Dalfopristin ≤1µg/mL (mottaglig), 2µg/mL (mellanprodukt), och ≥4 µg/ml (resistent); tigecyklin ≤0, 5 µg/ml.,13Screening test for the detection of reduced susceptibility to vancomycin
För att detektera minskad känslighet för vankomycin, användes ett screening agar-test framställt med hjärn hjärtinfusion (BHI) Agar och 4 µg / mL, 6 µg / mL, 8 µg / mL och 16 µg/mL vankomycin. Referensstammen S. aureus ATCC 29213, mottaglig för vankomycin, användes som en negativ kontroll och stam E. faecalis ATCC 51299, resistent mot vankomycin, som en positiv kontroll. Fläckar av en 2.,0 McFarland inokulat sattes till Agar plattan och inkuberades vid 35 ° C under 24h, och odling av minst en koloni ansågs som ett positivt resultat.
analys av cellväggstjockleken
de CoNS-stammar som uppvisade minskad känslighet för vancomycin lämnades in till transmissions elektroniska mikroskopi för cellväggstjocklek analys. Stammar odlades i bhi-buljong och inkuberades vid 37° C för 24h. i en mikrotube centrifugerades 1000µL av en CoNS-kulturbuljong i en minut vid 12 000 rpm. Efter kassering av supernatanten fixerades stammar i en Karnovsky-lösning (2.,5% glutaraldehyd i fosfatbuffert 0,1 m) i fyra timmar. Proverna avlägsnades från fixern och tvättades tre gånger i fem minuter i destillerat vatten. Därefter nedsänktes proverna i 0,5% osmiumtetroxid för 40min, innan de tvättades tre gånger för 10min i destillerat vatten. Proverna dehydrerades med ökande koncentrationer av alkohol: två gånger för 10min i 7.,5% alkohol; två gånger för 10min i 15% alkohol; två gånger för 10min i 30% alkohol; två gånger för 10min i 50% alkohol; tre gånger för 15min i 70% alkohol; två gånger för 15min i 90% alkohol; två gånger för 10min i 100% alkohol. Efter dehydreringen monterades stubbarna och proverna metaliserades. Analyserna utfördes i ett elektroniskt mikroskopi Tecnai Spirit Fei-företag och bilderna erhölls vid en förstoring av 30000×.,
Resultatidentifiering av isolat
tabell 1 presenterar källan till CoNS-arterna isolat, liksom de demografiska uppgifterna för patienterna med bakteriemi.
detektion av mecA-genen och karakterisering av SCCmec bestämning av den minimala hämmande koncentrationen (MIC)
Mic av de antimikrobiella medel som används för behandling av CoNS-infektioner bestämdes genom e-testet. Oxacillinresistens hittades i 206 (68, 7%) CoNS-stammar och 25 var tigecyklinresistenta (8, 3%). Resistens mot tigecyklin detekterades i 4,5% av S. epidermidis, 13,8% av S. hemolyticus, 13% av S., hominis och 11,1% S. lugdunensis. För kinupristin / dalfopristin presenterade ett S. epidermidis-isolat mellanliggande motstånd med en MIC på 2 µg / mL och en S. epidermidis och en S. hemolyticus med MICs på 3 µg/mL. Känsligheten och specificiteten hos oxacillinmicen genom e-testet jämfört med närvaron av mecA var 87,4% respektive 82,3%.
När det gäller CoNS-arter visade parameterfördelningen av MIC50 och MIC90 höga halter av oxacillinresistens i S. hemolyticus., Detta var den enda CoNS-arten för vilken den minsta koncentrationen för att hämma 50% av isolaten var>256µg/mL, vilket återspeglar den höga resistanshastigheten för S. hemolyticus till oxacillin (tabell 3).
MIC-intervallet för varje antimikrobiellt medel jämfördes med SCCmec-typen. Isolaten skrivna som SCCmecI presenterade högre Tigecyklinmik och de klassificerade som SCCmecII presenterade de högsta oxacillinmik. Sccmeciv-stammarna visade de högsta MIC-värdena för vankomycin, linezolid, daptomycin och kinupristin/dalfopristin (Tabell 4).
Determination of the MIC range according to SCCmec.
| MIC range (μg/ml) | ||||
|---|---|---|---|---|
| Antimicrobial | SCCmec I | SCCmec II | SCCmec III | SCCmec IV |
| Oxacillin | 0.094≥256 | 6≥256 | 0.,125≥256 | 0.125≥256 |
| Vancomycin | 0.25–2 | 0.38–2 | 0.125–2 | 0.75–2 |
| Linezolid | 0.064–1 | 0.19–0.5 | 0.047–0.75 | 0.064–1 |
| Daptomycin | 0.016–025 | 0.016–0.094 | 0.019–0.5 | 0.047–0.75 |
| Quinupristin/Dalfopristin | 0.025–1.5 | 0.094–0.5 | 0.064–1 | 0.125–2 |
| Tigecycline | 0.016–2 | 0.023–0.75 | 0.016–0.75 | 0.,032-1 |
MIC, Minimal hämmande koncentration.
en utvärdering utfördes av oxacillin-och vankomycinmiken under en period av 20 år, uppdelad i tre tidsperioder enligt fördelningen av oxacillin-och vankomycinmic-intervall. För oxacillin, under den första perioden (1990-2001) observerades högre värden av MIC, men indikerar fortfarande mottaglighet., Under de andra perioderna (2002-2006 och 2007-2009) observerades en minskning av MIC-värdena, vilket fortfarande indikerar mottaglighet samt en ökning av resistenshastigheterna. När det gäller vankomycin visade samma utvärdering signifikanta skillnader i de tre perioderna mellan stammar med Mic från 0, 047 µg / mL till 0, 38 µg/mL och från 0, 5 µg / mL till 2, 0 µg / mL (Fig. 1).
bestämning av minskad känslighet för vankomycin
en tillväxt på 214 (71, 3%) stammar observerades på bhi-plattan med 4 µg/mL vankomycin, 89 (29, 7%) på plattan med 6 µg/mL vankomycin och 8 (2.,6%) isolat på 8 µg/mL vankomycinplattan. Ingen av isolaten växte i mediet med 16 µg / mL vankomycin. Det fanns inga signifikanta skillnader i Mic mellan stammar som inte uppvisade någon tillväxt på plattan kompletterad med vankomycin och de som växte på 4 µg/mL vankomycinplattan. Bland de som visade tillväxt på mediet med 6 µg/mL vankomycin var MIC-intervallet 0,5-2 µg/mL. Bland de som växte på 8µg / mL vankomycin var MIC-intervallet 0.75-24µg / mL. Stammarna som odlades på 8 µg/mL vankomycin var fyra S. epidermidis, en S. hemolyticus, två S. hominis och en S., capitis, alla som är resistenta mot oxacillin, och S. epidermidis och S. capitis att vara bärare av SCCmec III, S. hominis av SCCmec jag, och S. hemolyticus med icke-skrivit SCCmec.
analys av cellväggstjockleken hos stammar med minskad känslighet för vankomycin
cellväggstjockleken under celldelning mättes i åtta stammar (värden presenteras i nanometer, medelvärde±SD). De fyra S. epidermidis-stammarna presenterade medelvärden för 21.66±1.4, 20.12±0.9, 24.24±1.3, och 14,20±1,3 nm. S. hemolyticus-isolatet visade en cellväggstjocklek på 24,88±1,7 nm. För S., capitis isolat, cellväggstjockleken var 19.33±1.8, och för de två S. hominis-isolaten var värdena 17.68±2.1 och 24.92±1.5. Som jämförelse visade de använda referensstammarna S. epidermidis ATCC 12228 och S. hemolyticus ATCC29970 cellväggtjocklekar av respektive 14.61±1.2 och 14.73±0.7 nm. Jämförelsen av de studerade stammarna mot kontroller visade högre värden, från 17nm till 24.92 nm, med undantag för ett S. epidermidis-isolat, vilket gav ett lägre värde jämfört med kontrollerna (Fig. 2).,
CoNS bacteremia evolution
den möjliga utvecklingen av bakteriemi till andra infektioner, såsom sepsis, lunginflammation, urinvägsinfektion, meningit, peritonit, nekrotiserande enterokolit, omfalit och hjärnabscess, följdes upp hos 52 patienter som togs in i neonatala avdelningar. Av dessa, i 25 (46,3%) patienter samma nackdelar isolerade från blododling bekräftades vara det etiologiska medlet för infektion. I sex (11,1%) var CoNS det möjliga smittämnet, och i 23 (42,6%) var CoNS inte relaterat till patientens infektion (Fig. 3).,
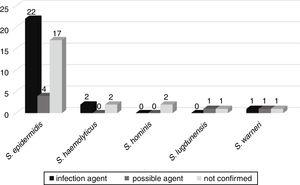
korrelation av nackdelar isolerade från blododlingar som möjligt etiologiska medel för infektioner orsakade hos patienter med neonatal enhet.
mecA-genen detekterades i 33 (61,1%) av dessa nackdelar, med 20 (60,6%) nackdelar associerade med allvarligare infektioner eller möjliga medel för dessa infektioner.
diskussion
nackdelarna anses vara en av de främsta orsakerna till bakteriemi., Betydelsen av dessa bakterier har ökat i sjukhusmiljön under de senaste åren, främst på grund av antimikrobiell resistens. I det nuvarande arbetet studerades 300 CoNS-stammar isolerade från blodkulturer av inpatienter på sjukhuset i Botucatu kliniker under en period av 20 år. Dessa isolat karakteriserades avseende deras antimikrobiella mottaglighet.
detektionen av mecA bestämdes oxacillinresistens i 78,5% av CoNS, och MIC50-värdet (2µg / mL) var en indikation på resistens mot detta läkemedel, vilket bekräftar den låga mottagligheten hos dessa bakterier mot β–laktammedel., Tidigare arbeten har visat att sedan 1970-talet har CoNS-isolaten presenterat högre oxacillinresistens än S. aureus.14,15 β-laktam-resistensfrekvensen har visat sig sträcka sig från 65% till 95% på sjukhus i Brasilien och i andra länder.2,16,17 de högsta nivåerna av oxacillinresistens hittades i S. epidermidis, följt av S. hemolyticus, S. hominis och S. capitis. Liknande resultat beskrevs i tidigare studier, som visade oxacillinresistens i 97% av S. epidermidis mellan 1999 och 2001 i en neonatal intensivvårdsavdelning (NICU),18 i 96% av S., hemolyticus isolerade i Brasilien,19 och i 100% av S. hominis som är isolerade i en NICU från Spanien.När det gäller S. capitis hittades diskrepanta resultat i de studier som utförts av Caierão et al.21
även om mecA-genen vid en lägre frekvens detekterades i S. warneri och S. lugdunensis. S. warneri har beskrivits med hastigheter på 33,3% av oxacillinresistens i NICUs,22 och den första beskrivningen av mecA i S. lugdunensis var i studien utförd av Kawaguchi et al.Trots de låga resistensfrekvenserna, 24 bestämning av antimikrobiell mottaglighet för S., lugdunensis är viktigt, inte bara på grund av dess kliniska konsekvenser, eftersom denna art är den mest aggressiva av nackdelarna, men också för inrättandet av tidig behandling med adekvata antimikrobiella medel och goda kliniska resultat.25
karakteriseringen av SCCmec visade närvaron av typ I-IV i isolaten, med SCCmecIII som den vanligast detekterade i de studerade stammarna, främst i S. epidermidis, den enda arten som bar typ IV., SCCmec typ III är den största av dem alla, kodifierar för flera resistensassocierade gener och är de vanligaste isolerade nackdelarna från sjukhusprover. S. epidermidis är den huvudsakliga kolonisatören av den mänskliga huden och den vanligaste upptäckten i infektionsställen. Det selektiva trycket i sjukhusmiljön leder till spridning av SCCmec III-stammar, som är förknippade med allvarliga infektioner.26 SCCmec typ IV har relaterats till Samhällsassocierade Staphylococcus spp., och beskrevs för första gången i en S. epidermidis-stam, ett faktum som innebär överföring från S., epidermidis till S. aureus. En minskad kostnadsöverföring av SCCmec IV på grund av sin ringa storlek skulle förmodligen leda till en högre förekomst av infektioner orsakade av SCCmec IV-bärare.12,27 SCCmecII fram en association med S. hemolyticus, liknar resultatet av Machado et al., 12 vars arbete endast detekterade typ II i denna art.
alternativet för behandling av oxacillinresistenta stafylokocker är vankomycin, en glykopeptid som först användes 1958 vid invasiva infektioner. Det finns emellertid beskrivningar av resistens och minskad mottaglighet för detta läkemedel,6 även om det är instabilt.,28 resultaten av det aktuella arbetet visade att vankomycin, med undantag för oxacillin, var läkemedlet med de högsta värdena MIC50 och MIC90. Trots samlingens fulla mottaglighet var MIC-värdena högst under perioden 20 år och minskad mottaglighet detekterades hos vissa S. epidermidis, S. hemolyticus, S. hominis och S. capitis-stammar. I de studier som utförts av Natoli et al., 29 minskad känslighet för vankomycin detekterades med en frekvens av 5,4% bland CoNS isolat, i S. epidermidis och S. hemolyticus arter., Enligt samma författare, Staphylococcus kolonier odlas på vancomycin agar kan leda till glykopeptid heteroresistance, som kan vara en föregångare till glykopeptid motstånd, orsakar komplicerade infektioner och behandlingssvikt. Detta bör beaktas vid terapeutiska beslut.30
ökningen av andelen oxacillinresistenta nackdelar och minskning av deras mottaglighet för vancomycin betonar vikten av studier som involverar andra terapeutiska val., Tigecyklin, en grampositiv och negativ bredspektrum semisyntetisk glycylcyklin, anses vara ett läkemedel med utmärkt aktivitet mot oxacillin känsliga och resistenta nackdelar, 14, 29 trots våra data visar priser på 8,3% av resistens, oftast i S. hemolyticus, följt av S. hominis, S. lugdunensis, och S. epidermidis. Liknande mic90-resultat beskrevs för tigecyklin, utan skillnad mellan oxacillinresistenta och mottagliga nackdelar.31 i de studier som utförts av Natoli et al.29 tigecyklin visade god aktivitet mot nackdelar., Enligt dessa författare rekommenderas tigecyklin inte för behandling av bakteriemi och dess användning bör begränsas för att bevara aktiviteten mot multiresistenta gramnegativa bakterier. Mutationer i generna ribosomal S10 och rpsJ och mepA verkar vara associerade med tigecyklinresistens.32,33
Quinupristin / dalfopristin är ett streptogramin som tillhör makrolid-linkosamid-streptogramingruppen., Kombinationen av kinupristin och dalfopristin är synergistisk och vanligtvis baktericid när dessa medel jämförs enskilt eller jämfört med liknande makrolid antimikrobiella medel.34 i detta arbete, trots att presentera utmärkt effekt i majoriteten av de studerade nackdelarna, upptäcktes mellanliggande resistens mot detta läkemedel i två S. epidermidis och en S. hemolyticus. I studien utförd av Mendes et al., 35 quinupristin / dalfopristin visade utmärkt effektivitet för CoNS, stammarna var fullt mottagliga, med MIC90-värden på 0, 38 µg / mL för oxacillinkänsliga stammar och 0.,75 µg / mL för oxacillinresistenta stammar. Dessutom Venkatesh et al.36 beskrivs god effektivitet av quinupristin / dalfopristin för oxacillinresistenta och känsliga stammar.
Daptomycin, en antimikrobiell studerad i årtionden, togs tillbaka i bruk 2006, för behandling av bakteriemi och endokardit orsakad av stafylokocker.I denna studie visade daptomycin utmärkt effekt för CoNS-isolat, med låga MIC50-värden. Olivares et al.37 verifierade också känsligheten hos alla CoNS till daptomycin, med låg variation i MIC-värdena., I ett arbete som studerar 1126 nackdelar, utförd av Critchley et al., 38 daptomycin var aktivt i MIC-intervallet från 0, 015 till 2, 0 µg / mL och MIC90 var 0, 5 µg/mL. Enligt dessa författare var de mest aktiva agenterna i dessa analyser daptomycin och quinupristin/dalfopristin, vilket betonar relevansen av dessa antimikrobiella medel vid behandling av infektioner orsakade av nackdelar.
Linezolid, en syntetisk oxazolidinon potentiellt aktiv mot flera bakterier, är ett annat läkemedel som har visat god effekt mot nackdelar.,Linezolid har blivit viktigt för terapeutisk behandling av kroniska infektioner av CoNS, trots beskrivningen av resistens. I Brasilien beskrevs det första fallet av linezolidresistens 2006, på ett kliniskt isolat av MRSA40 och bland nackdelarna i S. epidermidis, S. hominis och S. hemolyticus.41 i det arbete som utförts av Olivares et al., 37 trots detektion av sju linezolid resistenta stammar, presenterade detta läkemedel effektiva MIC-värden I CoNS-stammar. Å andra sidan, ett utbrott av linezolid resistent S., epidermidis-kloner som innehåller mutationer i ribosomalproteiner L3 och L4, liksom cfr-plasmiden, som nyligen identifierats i Frankrike, har rapporterats.42
S. hemolyticus var den art som presenterade de högsta oxacillinmicvärdena, och koncentrationer högre än 256 µg/mL behövdes för att hämma 50% av isolaten. Liksom för oxacillin presenterade denna art högre MIC-värden för tigecyklin och de flesta av de testade antimikrobiella ämnena. Flera verk visar hög resistens mot de antimikrobiella medel som används för behandling av infektioner orsakade av S., hemolyticus, särskilt meticillin och glykopeptider. Vissa författare beskriver en hög prevalens av gener som kodar för resistens mot β-laktam och aminoglykosidmedel, liksom en betydande andel av isolat med MIC-värden nära Resistance breakpoint, 43, 44 betonar vikten av S. hemolyticus som en multiresistent patogen.
sammankopplingen av MIC-intervallet med SCCmec-typerna visade högre Mic för vankomycin, linezolid, daptomycin och quinupristin/dalfopristin i S. epidermidis med SCCmecIV., Generna relaterade till resistens mot dessa antimikrobiella medel medieras av plasmider, som oftast finns i meticillinresistenta stammar med sjukhusursprung.45 SCCmec IV är karakteristisk för samhällsisolat, särskilt på grund av dess storlek och låg adaptiv kostnad. Studier tyder på att förvärvet av resistensgener har miljömässigt icke-kliniskt ursprung, med tanke på den höga mångfalden av resistensgenbärare i den naturliga miljön.46,47 dessutom upptäcktes SCCmecIV endast i S. epidermidis, som som den vanligaste arten i mänsklig hud är mest påverkad av selektivt tryck., De högre Mic jämfört med andra antimikrobiella medel kan också relateras till det selektiva trycket, eftersom exponeringsnivån för dessa läkemedel i sjukhusmiljön skulle snedvrida valet av minskad känslighet och resistenta stammar, eftersom flera mutationshändelser, genetisk rekombination och modifieringar i den mikrobiella fysiologin behövs för att generera fenotypiska förändringar.,48
metaboliska och fysiologiska modifieringar relaterade till selektivt tryck kunde observeras i stammar som odlas på 8 µg/mL vankomycin agar, eftersom cellväggsförtjockningen hittades i de flesta CoNS-isolat på grund av ökad peptidoglykansyntes. Denna mekanism är mer fördelaktig för nackdelar än förvärvet av van operon, som är en mediator av vankomycinresistens. Van operon förvärvas genom horisontell genöverföring och dess uttryck stimuleras endast i närvaro av glykopeptid., Denna stimulans orsakar en mycket hög adaptiv kostnad i närvaro av vankomycin, som är ofördelaktig för nackdelarna i ett vankomycinmedium.48,49 när det gäller förvärv av andra resistensgener I CoNS, såsom Meca-genen, mjukas den initiala adaptiva kostnaden genom kompensations ytterligare mutationer för resistansen ”kostnader”. Nyligen har punktliga mutationer i gener som vraR visat sig vara associerade med minskad känslighet för vankomycin och cellväggsförtjockning i stafylokocker.,50
den nuvarande studien visade en hög grad av bakteriemi orsakad av nackdelar hos neonatala och pediatriska enheter, som involverar barn under ett år, de viktigaste agenterna är S. epidermidis, S. hemolyticus, S. hominis, S. lugdunensis och S. warneri. S. capit isolerades inte i dessa enheter, som är medel för bakteriemi hos vuxna som är upptagna till internmedicinsavdelningen, gastroenterologi, neurologi och akutrum.,
eftersom studien involverade bakteriemi orsakad av stafylokocker isolerade över mer än 30 år, kunde mycket av data som hör samman med patienternas journaler inte hämtas, så det var inte möjligt att associera infektionsresultatet hos alla patienter, vilket är en begränsning av den nuvarande studien. Data som erhållits från patienter i neonatala enheter indikerade den kliniska betydelsen av CoNS bakteriemi, som kan utvecklas till sjukdomar som kräver specialiserad vård.
kunskap om antimikrobiell resistens är av stor betydelse för korrekt behandling av infektioner orsakade av nackdelar., Vidare är virulensfaktorerna för dessa bakterier och patienternas immunitet faktorer som bidrar till mikroorganismernas förmåga att orsaka allvarligare infektioner.
resultaten av vår studie som spänner över 20 år visade en hög frekvens av antimikrobiell resistens hos CoNS, vilket återspeglar överdriven användning av dessa läkemedel., Förutom de metaboliska och fysiologiska modifieringarna som kan leda till minskad mottaglighet för antimikrobiella medel, gör deras tillstånd som mänskliga kommensala bakterier dem idealiska transportörer och en effektiv reservoar av motståndsgener, särskilt de billiga elementen, såsom SCCmec.45 de antimikrobiella medel som gav de bästa resultaten bör användas på ett sådant sätt att deras effektivitet bevaras och resistens förhindras.,
intressekonflikter
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.