introduktion
Grisdödlighet är en av de viktigaste urvalsegenskaperna hos grisuppfödning och påverkas av suggan, grisarna och miljön. Därför är dödligheten hos grisar en komplex fenotyp och beror på suggans förmåga att höja sin avkomma, men är också en funktion av födelsevikt, ledning och urval (Knol et al., 2002)., Men även monogena recessiva defekter bidrar till piglet dödlighet, även om endast några exempel har rapporterats tidigare (Murgiano et al., 2012; Matika et al., 2019). Även i de fall där mutationseffekten är svår, hindras valet effektivt mot en sådan mutation av den låga frekvensen. I många allvarliga defekter dör zygoter mycket tidigt i graviditeten och lämnar inget annat spår än frånvaron av homozygoter i befolkningen i stort (Derks et al., 2019).,
Inavelseffekter i kommersiella grispopulationer hålls vanligtvis i kontroll genom selektiv avel för minskad dödlighet hos smågrisar genom att förbättra både mothering förmågor och Piglet livskraft (Olijslagers, 2018). Varianter som ligger till grund för recessiva monogena defekter fångas emellertid inte väl inom avelsvärdena, och går eventuellt till högre frekvenser som ett resultat av intensivt urval (Georges et al., 2019). Dessutom kan dessa varianter också bibehållas som ett resultat av balanseringsval för en korrelerad positiv effekt i heterozygot tillstånd (Derks et al., 2018).,
recessiva defekter bidrar endast marginellt till den totala piglet mortaliteten (Alonso-Spilsbury et al., 2007). Varianter som påverkar dödligheten hos grisar är dock av stor betydelse eftersom dessa varianter direkt påverkar produktion och djurskydd (Baxter et al., 2013; Rutherford et al., 2013). I djurpopulationshanteringen är emellertid den låga frekvensen av defekter vanligtvis dåligt dokumenterad (ofta mycket allmänna termer används), och syndrom erkänns ofta bara när de har nått en hög frekvens., Detta är särskilt relevant för syndrom som inte leder till mycket tydliga fenotyper. Därför, även i kommersiella avelspopulationer liten spårning kan göras på specifika syndrom, och att effektivt välja mot specifika lågfrekventa syndrom kräver därför nya metoder.
i detta arbete beskriver vi upptäckten av ett mycket försvagande syndrom hos en kommersiell grispopulation genom en undersökning baserad på en kombinerad SNP-arrays med medeldensitet och helgenomsekvensering (WGS)., Undersökningen ledde till identifieringen av en 16-bp frameshift-radering i SPTBN4-genen, med förutsagda tydliga fenotypiska konsekvenser i homozygoter. Bärfrekvensen är cirka 9% i den undersökta populationen, vilket påverkar cirka 0,81% av befolkningen kullar. Frekvensen var tillräckligt låg för att vara okänd för att ha en genetisk grund, och till och med effektivt vara okänd som ett specifikt syndrom alls. Vid genomförandet av undersökningen identifierades en gravid sugga av en bärarboar., De drabbade grisarna lider av myopati och kan inte gå, vilket vanligtvis resulterar i döden inom några timmar efter födseln, helt i linje med förutsagd patologi i jämförelse med liknande mänskliga och musfall.
Material och metoder
djur, genotyper och förbehandling
datauppsättningen består av 31 839 djur från en syntetisk vildsvinlinje med stor vit bakgrund. Linjen upprätthålls och odlas i Topigs Norsvin nucleus farms, främst välja på produktion och hälsa drag., Djuren genotypades på Illumina GeneSeek custom 50K SNP chip (Lincoln, NE, USA). Djur med en frekvens av saknade genotyper > 0,15 togs bort. Vi kasserade markörer som inte uppfyllde följande filtreringskriterier: en minsta anropsfrekvens på 0,85, en mindre allelfrekvens >0,01, och en Hardy-Weinberg proportioner exakt test p-värde under P< 10-12. Dessutom kasserades markörer med okänd plats på Sscrofa11.1 genombyggnad, vilket gav 41,573 markörer efter filtrering., Alla steg utfördes i Plink v1. 90b3. 30 (Purcell et al., 2007).
Haplotypfasning och identifiering av Ssc6 Haplotype
Vi utförde haplotypfasning och imputation av saknade platser i Beagle5.0 med parameter för effektiv befolkningsstorlek inställd på 100, andra inställningar var standard (Browning et al., 2018). Förväntade homozygoter uppskattades baserat på haplotypfrekvens, med hjälp av Hardy-Weinberg-principen. Ett exakt binomialtest användes för att testa antalet observerade homozygoter med antalet förväntade homozygoter., Haplotypen ansågs signifikant utarmad om P< 5 × 10-3.
fenotypiska effekter associerade med Ssc6-Haplotypen
vi undersökte ssc6-haplotypen för uppgifter om det totala antalet födda, antalet dödfödda, mumifierade smågrisar, grisande överlevnad och laktationsöverlevnad (överlevnad upp till cirka 21 dagars ålder) av totalt 9 666-kullar. Vi listade dessa fenotyper för alla CXC och cxn kullar identifierade. Vi använde en Welchs t-test för att bedöma om fenotyperna från CXC kullar skiljer sig avsevärt från cxn kullar. Ett p-värde < 0.,05 ansågs signifikant.
Helgenomsekvensanalys och identifiering av Kandidatvarianter
datauppsättningen består av 71 helgenomsekvenserade individer från den undersökta populationen. Alla 71 prover var också närvarande i vår dataset av 31 839 djur genotypade på 50K. 71 proverna har en total volym på 1.93 Tbp (tera baspar) från 14.16 miljarder 150-bp Parade slutläsningar (tabell S3). Proverna sekvenserades på Illumina HiSeq 2000. Vi inriktade sekvenserna till Sscrofa11. 1 genomet bygga med BWA-MEM version 0.7.,15 (Li och Durbin, 2009) med en genomsnittlig mappabilitet på 98,9% och en provtäckning som sträcker sig från 8,8 till 14,8 X (10,9 X genomsnitt). Samblaster användes för att ta bort PCR dubbletter (Faust och Hall, 2014). Samtools användes för att sortera, sammanfoga och index Bam-filer (Li et al., 2009). Kartläggning och kvalitetsstatistik genererades med hjälp av Qualimap (Okonechnikov et al., 2016). Variant calling utfördes med Freebayes v1.1. 0 med följande inställningar:-min-bas –kvalitet 10-min-alternativ –fraktion 0,2-haplotype –längd 0-min-alternativ-räkna 2 (Garrison och Marth, 2012)., Varianter med Phred kvalitetsresultat < 20 förkastades (Li et al., 2009). Varianter var uppmärkta med Ensembl variant effekt prediktor (VEP, släpp 96) (Mclaren et al., 2016). Effekten av missense-varianter förutspåddes med hjälp av sorteringsintolerant från tolerant (SIFT) (Kumar et al., 2009). LD-analys utfördes med Plink v1. 90b3. 30 (Purcell et al., 2007) med följande inställningar-chr-set 18, – r2, ld-window-R2 0.8.
SPTBN4 Proteininriktning
proteininriktning mellan vildtyp och mutantprotein utfördes med ClustalO (Madeira et al.,, 2019) och visualiseras med hjälp av ESPript 3 (Robert och Gouet, 2014). Ytterligare visualisering och validering utfördes med hjälp av JBrowse genomet viewer version 1.12.1 (Skinner et al., 2009).
Validering av Kausala 16 bp SPTBN4 Radering
PCR utfördes med hjälp av 60 ng genomiskt DNA, med 0,4 µm av varje primer, 1,8 mM MgCl2, och 25 enheter/ml OneTaq® – DNA-Polymeras (OneTaq® 2X Master Mix med Standard Buffert, New England Biolabs) i tillverkarens PCR-buffert i en slutlig volym på 12 µl., Första denaturering för 1 min vid 95°C följt av 35 cykler av 95°C i 30 s, 55°C i 45 s, 72°C 90 s, följt av en 5 min förlängning 72°C. PCR-primrar för SPTBN4 är TCAAGGGTGCAGGCTCTTTC framåt och GGTAGGAAGCTCGAAGTGGG omvänd. Den främre primern var färgmärkt med antingen 6-FAM för att producera en fluorescent märkt PCR-produkt detekterbar på ABI 3730 DNA-sequencer (Applied Biosystems). Fragmentstorlekar bestämdes med hjälp av GeneMapper software 5 från ABI.,
histopatologisk undersökning
två drabbade grisar mindre än 1 vecka gamla skickades till patologiavdelningen för Royal Animal Health (Deventer) för undersökning. Makroskopiskt var alla observationer inom normala gränser. Skelettmuskel i foreleg, dorsalmuskeln och baksidan av båda djuren samplades för rutin h&e-färgning och Ptah-färgning. Muskelvävnaden förvarades i separata burkar och fixerades i formaldehydlösning 4%, buffrad (=formalinlösning 10%, buffrad)., Därefter var vävnaden inbäddad i paraffin och skivad i 2 µm enligt standardoperationsproceduren (SOP RAH). Därefter var bilderna deparaffiniserade och rutinmässigt färgade för hematoxylin och eosin (H&E) i en automatisk färgmaskin. Samtidigt framställdes ytterligare glidbanor av 2 µm av muskelvävnaden samt en positiv kontrollglid av muskelvävnad för manuell färgning med ”fosfotungstinsyra hematoxylin”, förkortad som PTAH. Denna färgning föredras för att visa tvärstrimmor av skelettmuskel.,
avelsvärden och Föreningsanalys
i denna studie utvärderade vi 63 egenskaper som användes i avelsprogrammet. Avreglerade uppskattade avelsvärden (DEBV) användes som svarsvariabel för varje egenskap som studerades. Det uppskattade avelsvärdet (EBV) för alla utvärderade egenskaper avreglerades med hjälp av den metod som beskrivs av Garrick et al. (2009). EBV för varje djur erhölls från den rutinmässiga genetiska utvärderingen av ett kommersiellt avelsprogram (Topigs Norsvin) med hjälp av en djurmodell., Reliabiliteterna per djur för avregression extraherades från den genetiska utvärderingen baserat på Tier och Meyer-metoden (2004). De heritabilities som användes för avregressionen extraherades också från den rutinmässiga genetiska utvärderingen. Slutligen uppskattades viktningsfaktorer baserade på den uppskattade tillförlitligheten hos DEBV också enligt Garrick et al. (2009) med hjälp av ett värde på 0,5 för skalären C. för att säkerställa kvaliteten på DEBV, endast djur med en viktningsfaktor större än noll och en tillförlitlighet av DEBV större än 0.,20 användes i föreningsanalyserna. Tillförlitligheten hos DEBV erhölls också enligt Garrick et al. (2009).
Associeringsanalyser utfördes med hjälp av programvaran ASREML (Gilmour et al.,, 2009) med tillämpning av följande linjära blandade djurmodell:
där debvij är den observerade DEBV för djuret j, w är viktningsfaktor för resterande, µ är befolkningens totala DEBV-medelvärde, ri är bärarstatusen (räkning av den skadliga allelen) för 4-mutationen i, aj är den additiva genetiska effekten som uppskattas med hjälp av en stamtavla baserad Genomsnittlig relationsmatris och restfel. Föreningar med A-log10(p-värde) större än fem förklarades vara signifikanta.
resultat
A 1.,5 Mb Segment på kromosom 6 påverkar Laktationsöverlevnad hos grisar
vi analyserade 31 638 djur från en enda renrasig vildsvin linje (syntetisk linje med stor vit bakgrund), genotypad på svin 50K SNP chip (Sscrofa11.1 build) (Warr et al., 2019). Analysen avslöjade ett 1.5 Mb-segment på kromosom 6 (ssc6:48.75–50.25) som visade ett underskott i homozygositet i samband med minskad laktationsöverlevnad (tabellerna 1 och 2). Haplotypen segregerar med en måttlig allelfrekvens på 4, 5% (9, 0% bärarfrekvens) i den undersökta populationen., Haplotypfrekvensen har fluktuerat under det senaste decenniet, men minskat under de senaste 3 åren (figur S1). Vi testade om frekvensen drevs av en heterozygot fördel effekt. Vi fann dock mestadels negativa föreningar med viktiga urvalsdrag förutom länddjup och dräktighetslängd (tabell 3), vilket tyder på att frekvensen är rent resultatet av genetisk drift.

tabell 1 haplotypegenskaper för ssc6.,

tabell 2 bärar-för-bärar litters visar 24% minskning av laktationsöverlevnaden jämfört med bärar-av icke-bärar litters. Betydande resultat anges i fetstil.

tabell 3 egenskaper som är signifikant förknippade med heterozygota bärare av sptbn4-raderingen.
de 52 bärar-för-bäraren (CxC) kullar visar ingen signifikant minskning av det totala antalet födda eller levande födda djur., Laktationsöverlevnaden reduceras dock med cirka 24% i CXC-kullar jämfört med matningar för Carre-by-noncarrier (CxN), vilket indikerar att homozygota smågrisar dör under laktationsperioden (Tabell 2). Därefter undersökte vi kommentarerna för tid och orsak till dödligheten hos CXC kullar. Detta avslöjade att de flesta smågrisar som dog inom de första 24 h efter födseln. Majoriteten av dessa smågrisar beskrevs mestadels av jordbrukare som ” svag gris vid födseln.,”
Helgenomsekvensanalys avslöjar en 16-bp-Frameshift-radering i SPTBN4 som den sannolika Orsaksvarianten
för att identifiera orsaksmutationen undersökte vi helgenomsekvensdata från 71 djur från den undersökta populationen och identifierade fem bärardjur. Linkage disequilibrium (LD) analys avslöjade 267 SNP och indel varianter i hög LD (R2 > 0.8) med ssc6 haplotype (tabell S1), majoriteten är i perfekt LD (247 varianter)., Endast fem varianter påverkar potentiellt kodningssekvensen (tre missense, en frameshift, en splice-acceptor). De tre missense-varianterna förväntas tolereras av SIFT (score > 0.18, tabell S1), medan splice-acceptor-varianten påverkar en gen som kodar för en 28 bp-peptid med okänd funktion, sannolikt inte orsakssamband. Det är dock en variant i komplett LD (r2 = 1) med den haplotypen var väntat att ha hög effekt, en 16-bp frameshift radering i exon 26 av SPTBN4 gen (6:g.48801280delGACGGTGTACGCCGGT) (figur 1A, B)., Rameshift deletion (enssscp00000031537:p.Arg1902fs) introducerar 30 nya aminosyror och en för tidig stoppkodon, som producerar ett nedsatt och stympat spektrin beta icke-erytrocytiskt 4-protein (SPTBN4). Mutanter saknar de slutliga 662 aminosyrorna i wild type-proteinet (figur 1C), inklusive pleckstrin homology (PH) – domänen som krävs för proteintransport till membran (Wang et al., 2018). Sptbn4-proteinet är en medlem av beta-spektrinproteinerna och är ett aktin som länkar cellmembranet till aktincytoskelettet., SPTBN4-mutationer stör cytoskeletala maskiner som kontrollerar korrekt lokalisering av jonkanaler i myelinerade nerver som orsakar motoriska neuropatier (Parkinson et al., 2001; Wang et al., 2018).

Figur 1 (A) genmodell för sptbn4. Placeringen av den drabbade 26: e exon anges i rött. B) Illustration av raderingen på 16 bp. Figuren visar vild typ och mutant exon. C) anpassning av SPTBN4-proteinsekvensen för mutant (Mt) och wild type (WT). Mutationen inducerar 30 nya aminosyror och en för tidig stoppkodon.,
genotypning fem CXC kullar bekräftar SPTBN4 Deletion som den sannolika Boven
vi genotypade fem CXC kullar för 16-bp radering som hade minst två smågrisar (intervall 2-6) som dog inom de första 48 h efter födseln. De fem kullar producerade 53 smågrisar varav 19 var homozygot för 16 bp deletion (Tabell 4). Alla 19 homozygota smågrisar dog inom 48 h efter födseln (18 inom 24 h). Av de 34 återstående smågrisarna (8 vilda djur och 26 bärare) dog endast 1 inom 48 timmar, troligen orsakad av andra (miljömässiga) faktorer.,

tabell 4 genotypning av den troliga orsakssambandet 16-bp SPTBN4 rameshift radering i fem bärare för bärare kullar. Summan per genotyp anges med fetstil.
smågrisar homozygot för Sptbn4-raderingen lider av myopati och Bakbensförlamning
vi övervakade en nyligen CxC-kull (farrowing date: 28 April 2019) som producerade sex friska, två drabbade (prover: 9912, 9916) (figur 2a) och tre dödfödda smågrisar., Vi bekräftat homozygot SPTBN4 radering status för de två drabbade smågrisar (Tabell S2). Dessutom observerade vi fyra heterozygota bärare och två homozygota vilda grisar bland de friska individerna. En av de dödfödda smågrisarna (prov: 9921) var också homozygot för raderingen, medan de andra två var heterozygot. De drabbade grisarna lider av extrem muskelsvaghet (figurerna 2B, C), förlamning av bakbenen och tremor (S1 Video). Därför kunde smågrisarna inte gå eller dricka.,
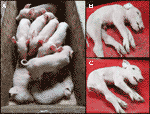
Figur 2 (A) två drabbade smågrisar (levande) tillsammans med sex friska kullar. Smågrisarna härrör från en CXC parning farrowed den 28 April 2019. B) berörd manlig gris 9912. C) drabbat hongris 9916.
drabbade smågrisar saknar Tvärstrimningar i dorsala och bakben skelettmuskler
histopatologisk undersökning avslöjade spridd degenerering av muskelfibrer i båda smågrisarna och focally nekros och vaskulit i dorsala muskeln hos en av smågrisarna (ID = 9912)., Dessutom fosfotungstinsyra hematoxylin (Ptah) färgning visar divergerande färgning av skelettmuskelfibrer, vilket indikerar minskning av tvärstrimningar, särskilt i musklerna i dorsala och bakbenen hos de drabbade djuren (figur 3b), medan frambenen verkar opåverkad (figur 3A). Minskningen av tvärstrimmor indikeras av onormal färgning och allmän förlust i volymen av muskelfibrer (figur 3b). De histopatologiskt observerade förändringarna i bakbenen och i dorsala musklerna är indikativa för muskeldystrofi.,

Figur 3 (a) tvärsnittsbild av en skelettmuskel från frambenet. Den svarta pilen indikerar normal färgning (Mörk) av muskelfibrer som indikerar förekomst av tvärstrimningar. PTAH Bar = 50 µm. B) tvärsnittsbild av en skelettmuskel från bakbenet. Den svarta pilen indikerar onormal färgning (rosa) av muskelfibrer som indikerar brist på tvärstrimmor. Den gula pilen indikerar normal färgning och närvaro av tvärstrimmor. PTAH Bar = 50 µm.,
diskussion
i detta arbete rapporterar vi en ny medfödd defekt som orsakar piglet dödlighet sannolikt på grund av en 16 bp frameshift radering i SPTBN4 genen. Grisarna lider av extrem muskelsvaghet (myopati) och dör inom några timmar efter födseln. Raderingen förväntas ge en fullständig förlust av funktion av spektrin beta, icke-erytrocytiskt 4-protein. SPTBN4 är en medlem av familjen av spektringener och krävs för jonkanalklustering vid Ranviers noder, vilket påverkar aktionspotentialen (Devaux, 2010)., Mutationer stör cytoskeletala maskiner som styr korrekt lokalisering av jonkanaler och funktion av axonala domäner huvudsakligen vid axon initiala segment (AIS) och noderna i Ranvier (Wang et al., 2018). Mer specifikt är den drabbade C-terminaldomänen för SPTBN4 avgörande för KCNQ2-kanalhandel och excitabilitet vid Ranviers noder (Devaux, 2010).
efterföljande uppföljningsforskning identifierade human-och musfall som indikerade att det efterföljande syndromet sannolikt inte skulle visa sig vara omedelbart dödligt, utan snarare ge allvarlig myopati., Genom data om SNP-genotyp med medeltäthet, tillgängliga för alla djur i avelspopulationen (n = 31 839), kunde bärare identifieras. Bland dessa bärare var en såg som var ungefär halvtid under graviditeten vid tidpunkten för identifiering, sired av en vildsvin som också var bärare. Uppfödningsanläggningen anmäldes för att dokumentera kullen vid födseln. Den observerade fenotypen av de drabbade smågrisarna (myopati, hindbensförlamning, tremor) var helt kongruent med vad som observerades hos humana patienter med homozygot funktionsförlust eller förening heterozygota mutationer i SPTBN4-genen (omim: 606214)., Två av de mänskliga patienterna har funktionsdugliga mutationer inom PH-domänen (Wang et al., 2018), som stöder att en förlust av PH-domänen hos grisar sannolikt skulle leda till en fullständig förlust av funktionen hos SPTBN4-proteinet. Hos människor leder liknande mutationer till svår medfödd myopati orsakad av frånvaro av muskelfibrer av typ i, neuropati och dövhet (Knierim et al., 2017; Wang et al., 2018). Wang et al. (2018) observerade också motor axonal neuropati hos flera patienter som kännetecknas av medfödd hypotoni, djup svaghet och förlust av djupa senreflexer vid tidig barndom., Dessutom avslöjade nervbiopsier reducerade nodala Na + – kanaler och inga nodala KCNQ2 k+-kanaler, vilket avslöjade den molekylära patologin som orsakade nervsystemet dysfunktion. Därför drar vi slutsatsen att denna frameshiftvariant är den troliga orsaksmutationen som leder till den observerade fenotypen och utarmningen av den homozygotiska genotypen i befolkningen. Framtida studier kan fokusera på att göra en in vivo knockout av SPTBN4-genen i gris, för att studera syndromet och tillhörande fenotyp mer detaljerat.,
Vi observerade inte degenerering av muskelfibrer i frambenen, medan rygg-och bakbensmuskelfibrerna tydligt påverkades. Denna observation kan delvis förklara bakbensförlamningen, medan frambenen inte påverkas. Skillnaden mellan fram-och bakbenen muskelfibrer har också beskrivits i skälvande möss, där SPTBN4 förlust-off-funktion mutationer orsakar motorisk neuropati, bakben förlamning, darrningar och central dövhet (Parkinson et al., 2001; Komada och Soriano, 2002). Parkinson et al., (2001) beskriv reducerade nervledningshastigheter i sciatic nerver hos möss med darrande alleler som orsakar perifer bakbensneuropati. Uttryck av SPTBN4 hos möss är begränsad till hjärnan, ryggmärgen och sciatic nerver och inte observerats i skelettmuskulaturen, så denna sjukdom är främst en neuronal defekt. Sammantaget är det fortfarande oklart vilken mekanism som orsakar frånvaron av symtom i frambenen. Denna ”naturliga knockout” hos grisar kan vara en användbar resurs för att studera den mänskliga sjukdomen, eftersom grisar vanligtvis är en bättre modell för att studera mänskliga sjukdomar jämfört med gnagare., Dessutom kan konsekvensen av förlusten av SPTBN4-funktionen studeras mer detaljerat.
den effektiva populationsstorleken (Ne) hos den ras som studeras uppskattas till omkring 100 (Hidalgo m.fl., 2016). Vid djuruppfödning ökar låga Ne risken för att skadliga alleler ökar i frekvens av en slump. Dessutom har tidigare studier visat att recessiva dödliga alleler kan drivas av fördelaktiga effekter i heterozygoter (Derks et al., År 2018. Matika et al., 2019). Matika et al.,, 2019 hittade en recessiv stoppvunnen mutation i mstn-genen associerad med en stor ökning av muskeldjupet i heterozygoter. Men vi hittar inga bevis för någon heterozygot fördel i vår studie. Med de nuvarande genomiska teknikerna kan vi nu identifiera skadliga alleler som driver till högre frekvenser och övervaka framväxten av nya skadliga alleler exakt, vilket möjliggör effektivare rening. Dessutom kommer resultatet av denna typ av studie att förbättra medvetandet om ”dolda” genetiska defekter på både uppfödare och bondenivå., Utan någon tidigare information registreras sällsynta fosterskador ofta som ” svag gris.”Och utan ytterligare distinktion av specifika syndrom är ytterligare åtgärder inte möjliga. I de flesta fall är det okänt om det finns en genetisk grund, eller att det kan finnas andra förvirrande effekter. Med tidigare genomisk information kan syndromet identifieras, jämfört med andra fall, och bärare identifieras, vilket leder till angripbar information.dödligheten hos smågrisar är av stor ekonomisk och djurskyddsmässig betydelse., Därför har upptäckten av SPTBN4-mutationen lett till omedelbar implementering i avelsprogrammet för att minimera frekvensen av bärare för bärare. Detta gör det möjligt att undvika att drabbade individer föds, vilket förbättrar djurens välbefinnande och minskar ekonomiska förluster.
slutsats
i denna studie rapporterar vi en ny medfödd defekt som sannolikt orsakas av en recessiv frameshift-radering i SPTBN4-genen hos grisar. Resultaten stöds av slående likheter med SPTBN4 associerade syndromiska fenotyper hos människor och möss., Studien gör det möjligt att övervaka och rensa den skadliga allelen från befolkningen. Transportör-för-bärare kors kan förebyggas, utesluter drabbade individer, vilket minskar ekonomiska förluster och förbättrar djurens välbefinnande. Slutligen kan dessa ”naturliga knockouts” som erhållits i avelsindustrin ge en modell för mänsklig sjukdom och öka vår förståelse av genfunktion inom däggdjursklade och ge en potentiell modell för mänsklig sjukdom.,
datatillgänglighet uttalande
etik uttalande
etisk granskning och godkännande krävdes inte för djurstudien eftersom de data som används i denna studie har erhållits som en del av rutinmässig datainsamling från Topigs Norsvin avelsprogram, och inte specifikt för syftet med detta projekt. Därför var godkännande av en etikkommitté inte obligatoriskt. Provtagning och datainsamling genomfördes strikt enligt den nederländska lagen om djurskydd och djurens välfärd (Gezondheids – sv welzijnswet voor dieren)., Skriftligt informerat samtycke erhölls från ägarna för deras djurs deltagande i denna studie.
författare bidrag
MG, H-JM, och MD tänkt och utformat studien. BH var ansvarig för allmänna organisation och kommunikation med Topigs Norsvin och jordbrukare. MD och ML utförde dataanalysen. BD och KL utförde labbarbete. SG-V utförde den patologiska analysen. MD skrev manuskriptet. H-JM, MG, BH, SG-V, BD, KL och ML gav användbara kommentarer och förslag och hjälpte till att utarbeta manuskriptet. Fenotypiska data analyserades med ML., Alla författare läste och godkände det slutliga manuskriptet.
finansiering
denna forskning finansierades av STW-Breed4Food-partnerskapet, projektnummer 14283: från sekvens till fenotyp: detektering av skadlig variation genom förutsägelse av funktionalitet. Den här studien har fått finansiellt stöd av NWO-KURS och Breed4Food partner Cobb Europa, CRV, Hendrix Genetik och Topigs Norsvin. Dessutom stöddes denna studie av BILDPROJEKTET (Horisont 2020, nr 677353). Finansiärerna hade ingen roll i studiedesign, datainsamling och analys, beslut att publicera eller förberedelse av manuskriptet., Användningen av HPC-klustret möjliggjordes av CATAgroFood (delade forskningsanläggningar Wageningen UR).
Disclaimer
de data som används i denna studie har erhållits som en del av rutinmässig datainsamling från Topigs Norsvin avelsprogram, och inte specifikt för syftet med detta projekt. Därför var godkännande av en etikkommitté inte obligatoriskt. Provtagning och datainsamling genomfördes strikt enligt den nederländska lagen om djurskydd och djurens välfärd (Gezondheids – sv welzijnswet voor dieren).,
intressekonflikter
ML och BH är anställda av Topigs Norsvin Research Center, ett forskningsinstitut som är nära släkt med en av finansiärerna (Topigs Norsvin).
alla återstående författare förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
de andra Breed4Food-partnerna Cobb Europe, CRV, Hendrix Genetics, förklarar att de inte har några konkurrerande intressen för denna studie.,
bekräftelser
författarna tackar Frank van Haaren och Toon Janssen för att organisera kommunikation med gården. Vi tackar Manon Houben för hennes bidrag till de patologiska undersökningarna. Vi tackar Mout Viller för att ta video och bilder av de drabbade och friska grisarna efter födseln. Vi tackar Jürgen Harlizius för att ha tagit hand om smågrisarna efter överlämnandet. Vi tackar Gerda van Eldik för provtagning. Vi tackar Egbert Knol och Egiel Hanenberg för allmänt stöd och vägledning från Topigs-Norsvin.,
kompletterande Material
Video S1 / Video som visar båda drabbade individer efter födseln.
tabell S1 / genomisk variation i hög LD med ssc6 haplotypen.
tabell s2 / genotypning av CXC-kullen inklusive två drabbade individer (farrowing date: 28 April 2019). Tabellen visar homozygot Del / del status för de två drabbade smågrisar 9912,9916.
tabell S3 / kartläggning och täckning statistik från WGS prover.
figur S1 / SPTBN4 deletionsbärarfrekvens från 2007-2019.