introduktion
Posterior reversible encephalopathy syndrome (PRES), först beskriven av Hinchey et al. i 1996, representerar en neurologisk sjukdom med varierande klinisk presentation och typiska imaging fynd av parieto-occipital dominerande mönster av vasogent ödem (1, 2). Det finns många dokumenterade orsaker till PRES, med fall som först beskrivs i inställningen av förhöjt arteriellt tryck., Exempel på kliniska scenarier där PRES kan ses är: hypertensiv nödsituation, (pre) eklampsi, njursjukdom, autoimmuna sjukdomar och cytotoxiska läkemedel, bland annat (3, 4) (Tabell 1). PRES kan förekomma i alla åldersgrupper och har en högre förekomst hos kvinnliga patienter (7, 8). Även om aktuell litteratur är relativt gles jämfört med vuxna populationer, särskilt bör nämnas PRES hos den pediatriska patienten., Pediatriska patienter har en liknande klinisk presentation som den vuxna befolkningen, med högt blodtryck, kramper och förändrad mental status är vanliga sjukdoms manifestationer (9). Trots att de flesta fall av pediatriska PRES rapporteras hos onkologipatienter, särskilt efter stamcellstransplantationspatienter (10, 11), En studie av Gupta et al. (12) fann att njursjukdom var kanske den vanligaste orsaken till PRES hos den pediatriska patienten. I sin studie tenderade pediatriska patienter att ha mer atypiska avbildningsfynd (62, 5%), inklusive frontallobsengagemang (56%).,
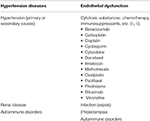
tabell 1. Större sjukdomstillstånd associerade med PRES.
kliniska manifestationer är akuta till subakut och sträcker sig från huvudvärk och synstörningar till förändrade nivåer av medvetande och beslag i allvarligare fall (1). Behandlingen syftar i allmänhet till att rikta den bakomliggande orsaken, med generellt reversibla symtom och bildtagningsfynd i de flesta fall (8)., Även om resultaten i allmänhet är gynnsamma med korrekt hantering har dåliga kliniska resultat associerats med redan existerande diabetes mellitus och involvering av corpus callosum; men andra tillförlitliga avbildningsbiomarkörer för prognostisering saknas för närvarande (13). Neuroradiologisk avbildning spelar en grundläggande roll vid diagnos av PRES med de typiska imaging funktioner som bäst uppskattas på magnetisk resonanstomografi (MRI) (2).
patofysiologi
den exakta patofysiologiska mekanismen bakom PRES har ännu inte blivit fullständigt klarlagd och förblir kontroversiell(3)., Det finns för närvarande två viktiga föreslagna mekanismer för Pres patofysiologi (Figur 1). Den första teorin föreslår ökat arteriellt tryck som den primära faktorn (8). Snabb ökning av blodtrycket övervinner så småningom de autoregulatoriska egenskaperna hos den cerebrala vaskulaturen som orsakar vaskulär läckage och resulterande vasogent ödem (14). Det finns eventuell blod-hjärnbarriär (BBB) dysfunktion med proteiner som passerar genom den snäva korsningen (15)., De områden som levereras av den bakre cirkulationen (vertebrala artärer, basilarartären och bakre cerebrala artärer) har exceptionell risk jämfört med den främre cirkulationen (inre halspulsåder, Mellersta cerebrala artärer och främre cerebrala artärer) på grund av bristen på sympatisk ton i basilarartären vaskulatur (8)., En relaterad teori som föreslagits av vissa postulat att Extrem hypertoni resulterar i vasospasm och lokal ischemi som orsakar BBB-uppdelning och resulterande vasogent ödem, vilket observerades hos patienter som behandlades med immunosuppressiva medel cyklosporin A och FK-506 (16). Störningen i BBB orsakar de typiska resultaten av vasogent ödem vs. cytotoxiskt ödem (vilket kan ses vid akut infarkt och representerar ökat intracellulärt vatteninnehåll på grund av förlust av den vanliga osmotiska gradienten i inställningen av celldöd (17).,
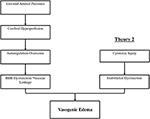
Figur 1. Två stora teorier om Pres patofysiologi. Teori 1 är hypertensiv och cerebral hyperperfusionsteori och teori 2 är endoteldysfunktionsteorin.
den andra huvudteorin behandlar det faktum att upp till 30% av patienterna med PRES inte uppvisar det förhöjda arteriella trycket som är nödvändigt för att överskrida den autoregulatoriska kontrollen av den cerebrala vaskulaturen (18, 19)., Denna teori föreslår att endoteldysfunktion är den primära skyldige, som kan orsakas av olika endogena eller exogena toxiner (20). Denna teori kan förklara resultaten av PRES ses hos patienter som får immunosuppressiva läkemedel och / eller kemoterapi och även de patienter med sepsis (21, 22). I denna modell orsakar cirkulerande toxiner vaskulär skada med resulterande utveckling av vasogent ödem. Endotelskada orsakar ytterligare frisättning av kärlsammandragande och immunogena medel, vilket kan orsaka vasospasm och / eller ökad vaskulär permeabilitet., Slutligen endoteldysfunktion som möjliggör vaskulär läckage och vasogent ödem är den drivande faktorn bakom PRES, oavsett den primära cerebrala vaskulära abnormiteten (vid arteriell hypertension) eller sekundär till cirkulerande toxiner. En sammanfattning av dessa två teorier samt en förteckning över tidigare rapporterade kemoterapeutika och andra immunosuppressiva medel visas i Figur 2.
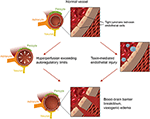
Figur 2. Illustration av de två stora teorierna om PRES underliggande patofysiologi., Bekräftelse: artighet av Caroline O”Driscoll, MA (hon illustrerade detta på egen hand och är anställd vid vårt universitet).
kliniska manifestationer beror på hjärnans involverade region(er); således kan presentationen vara bred. Till exempel kan primär inblandning av occipitala lober resultera i synstörningar/hallucinationer. Fokala neurologiska underskott som motsvarar placeringen av fokala lesioner uppträder hos ~5-15% av patienterna med PRES (23)., I sällsynta fall kan ryggmärgsengagemang resultera i kliniska tecken och symtom på myelopati eller förlamning (24).
Imaging
som namnet antyder manifesterar PRES vanligtvis på bildtagningsstudier som bakre övervägande vit substans vasogent ödem. Parietala och occipitala lober är nästan universellt involverade och fynd är typiskt symmetriska och bilaterala (1). Inblandning av frontalloberna, särskilt intill överlägsen frontal sulci, ses också ofta., Vasogent ödem, även om det kan involvera den cerebrala gråa substansen, uppskattas ofta lättare i den subkortiska vita substansen. CT-undersökning är ofta det första avbildningstestet vid inställning av akuta neurologiska symtom och kan visa vit materia hypoattenuation i drabbade regioner (25) (Figur 3: CT av PRES). Sammantaget avbildas resultaten bäst av MR som uppvisar ökad känslighet och bättre anatomisk karakterisering jämfört med CT (26). Dessutom kan MR hjälpa till att skilja andra patologiska tillstånd som kan manifestera kliniskt på samma sätt som PRES., T2-viktade och T2-FLAIR (fluid-dämpad inversion recovery) sekvenser, i synnerhet, är mest användbara för att detektera vasogent ödem på Mr (Figur 4: MR av PRES; Figur 5: MR av PRES Coronal).
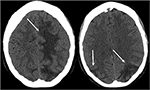
Figur 3. Patient med systemisk lupus erythematosus och snabbt progressiv glomerulonefrit presentera med beslag. Icke-kontrast CT-bilder av huvudet visar vasogent ödem i de bilaterala parietala och occipitala loberna, vänster större än höger, samt förlängning i vänster frontallob.,
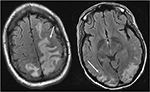
Figur 4. Patient med systemisk lupus erythematosus och snabbt progressiv glomerulonefrit presentera med beslag. T2-FLAIR bilder av huvudet visar vasogent ödem i de bilaterala parietala och occipitala loberna, vänster större än höger, samt förlängning i vänster frontallob. Observera att med det vasogena mönstret av ödem är det sparsamt av signalavvikelse i cortexen.
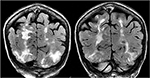
Figur 5., Patienter med anamnes på primär myelofibros och benmärgstransplantation på takrolimus som fick första gången kramper. Coronal T2-FLAIR-sekvenser visar omfattande signalavvikelse i de bilaterala occipitala och parietala loberna, vilket är typiskt för PRES.
differentialdiagnosen för PRES är bred och innehåller enheter med liknande sammanflödet T2 vit materia hyperintensitet., Exempel inkluderar: ischemi/infarkt (särskilt bakre cirkulation), demyeliniserande sjukdomar, infektiösa etiologier (meningit, encefalit), Progressiv Multifokal Leukoencefalopati (PML), vaskulit och olika metaboliska störningar (27). En kliniskt relaterad enhet som kallas reversibelt cerebralt vasokonstriktionssyndrom (RCV) tros orsakas av förändringar i cerebral vaskulär ton vilket resulterar i vasokonstriktion., RCVS manifesteras som återkommande thunderclap huvudvärk, kramper, stroke, och icke-aneurysmal subaraknoidalblödning (28), som kan misstas för PRES på klinisk basis. Denna enhet uppträder vanligtvis i postpartumperioden eller efter exponering för adrenerga eller serotonerga läkemedel. RCVS kan typiskt diagnostiseras med angiografiska studier som visar multifokala områden av förträngning som involverar cerebrala artärer (29). Denna diagnos kan förväxlas med det faktum att RCVS och PRES ofta förekommer samtidigt, vilket neuroradiologen bör vara medveten om för att undvika feldiagnos (30).,
PRES kan typiskt särskiljas från akut ischemi eftersom den senare alltid visar cytotoxiskt ödem och diffusionsbegränsning. Begränsad diffusion vid akut ischemi kan lätt detekteras på diffusionsvägd bildbehandling (DWI) och skenbar diffusionskoefficient (ADC) som en hyperintenssignal på DWI med motsvarande minskad signal på ADC (på grund av den relativt minskade rörelsen av intracellulära vattenmolekyler)., Vasogent ödem i inställningen av PRES kan å andra sidan Visa hyperintenssignal på DWI som inte åtföljs av en motsvarande minskad signal på ADC (31). Dessutom tenderar akut ischemi att vara ensidig och inom ett singulärt kärlområde. Medan bedömning för diffusionsbegränsning för att differentiera PRES från ischemisk abnormitet är generellt tillförlitlig, finns det sällsynta fall av PRES som kan associeras med områden med diffusionsbegränsning överlagrad på områden av det mer klassiskt sett isolerade vasogena ödemet.,
”avancerade” avbildningstekniker i PRES har nyligen beskrivits som ett tilläggsverktyg i svåra eller tvetydiga fall. Dessa avancerade avbildningstekniker är: CT/MR perfusion, MR Spektroskopi (MRS), Känslighet weighted imaging (SWI), och nukleärmedicinska tekniker, inklusive single-photon emission tomography (SPECT) och positronemissionstomografi (PET) med varierande radiotracers. Även om en fullständig diskussion ligger utanför ramen för denna översyn, kan en mängd avbildningsresultat ses på dessa avancerade tekniker för att föreslå en diagnos av PRES., Hyperperfusion kan ses på CT / MR perfusionsstudier visat genom ökat cerebralt blodflöde och blodvolym med minskad tid till perfusion och genomsnittlig transiteringstid (32) även om fall av hypoperfusion har rapporterats (33). På MRS finns det i allmänhet en minskning av n-Acetylaspartat (NAA)/kreatin (Cr) och NAA/Kolin (Chol) – förhållandet, vilket tyder på en störning av normala synapser och neuroaxonal funktion (34). SWI kan hjälpa till att identifiera förekomsten av blödning i PRES, med högre känslighet än gre-avbildning (35)., SPECT / PET imaging visar vanligtvis antingen hyperperfusion eller hypoperfusion (liknande CT/MR perfusionsstudier) med låg metabolism av FDG-PET (36).
dessutom kan PRES särskiljas från andra tillstånd som autoimmun encefalit vid fastställandet av akut disseminerad encefalomyelit (ADEM) av det tidigare diffusa bilaterala men asymmetriska vasogena ödemet (37)., PML kan ha ett liknande utseende jämfört med PRES, som har en parieto-occipital dominans, men kan särskiljas genom dess mer ensidiga eller asymmetriska engagemang, liksom förkärlek för subkortikal vit substans (38).
atypiska Avbildningsfunktioner
atypiska egenskaper hos PRES inkluderar områden av kontrastförstärkning, blödning eller diffusionsbegränsning (39)., Även om parietala och occipitala lober är allmänt involverade, kan atypiska områden av engagemang ses, inklusive: hjärnstammen, cerebellum, corpus callosum och andra cerebrala områden, med mer vanliga områden inklusive frontalloberna (sett i upp till 68%) och sämre temporala lober (upp till 40%) (23, 40) (Figur 6: Cerebellum; Figur 7: hjärnstammen).
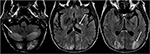
Figur 6. Patient med levertransplantation 6 veckor tidigare. Patienten inleddes med takrolimus efter levertransplantation., T2-FLAIR bilder av hjärnan visar signal abnormitet i occipitala lober. Det finns också omfattande signal abnormitet ses i de bilaterala cerebellära halvkloten och inom thalami. Dessa fynd löstes snabbt efter avslutad takrolimus.
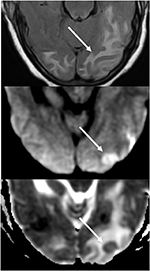
Figur 7. Patienter med okontrollerad hypertoni som uppvisar förändringar av mental status. T2-FLAIR (top) bilden visar ödem i occipitala lober., DWI (mitten) och ADC karta (botten) bilder visar en liten pil av begränsad diffusion, med hyperintense signal på DWI och motsvarande hypointensitet på ADC kartan.
dessutom en tidig upptäckt av PRES, som kan föregå den typiska parieto-occipital ödem inkluderar mild sulcal FLAIR hyperintensity och leptomeningeal förbättring på post-contrast T1 vägda bilder, såsom beskrivs av Nakagawa et al. (41). Benziada-Boudour et al., (42) beskrev en samtidig utveckling av cytotoxiskt ödem, vilket resulterade i begränsad diffusion (figur 8: Diffusionsbegränsning). Inneboende i namnet på sjukdomsprocessen är resultaten relaterade till PRES vanligtvis reversibla, med normalisering av kliniska och avbildningsfynd när uppviglingsproblemet behandlas. I vissa fall kan områden med begränsad diffusion i slutändan leda till permanent skada på hjärnparenkymen (Figur 9: laminär nekros)., Blödning är mindre vanligt i PRES, förekommer i 5-30% av fallen, men bör erkännas att inte förväxla detta fynd för en annan patologisk enhet i lämplig klinisk inställning av PRES (39). Imaging fynd i blödning kan omfatta: fokal hematom, petekiala gyral blödning, och / eller subaraknoidalblödning (43) (Figur 10: blödning).
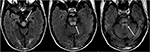
figur 8. Patient med tidigare levertransplantation två veckor tidigare på takrolimus., T2-FLAIR bilder visar signal abnormitet inom mitthjärnan, pons och överlägsen cerebellära peduncles.
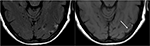
Figur 9. T2-känsla (vänster) bild hos en patient med okontrollerad hypertoni och tidigare bildbehandling som indikerar PRES (se Figur 6), Nu kontrollerad och 6 veckor senare, visar upplösning av det tidigare sedda ödemet. Små områden av glios på grund av skada ses i vänster temporal lob. Axiell icke-kontrast T1 visar krökt kortikal laminär nekros relaterad till den tidigare skadan relaterad till PRES., Medan PRES i allmänhet är helt reversibel, kan det leda till permanent skada i vissa situationer.
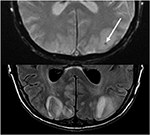
Figur 10. Patient med tidigare levertransplantation på takrolimus. T2 gradient återkallade echo (topp) visar ett brännområde av blödning inom vasogent ödem i vänster occipital lob. T2-FLAIR visar det mer typiska fyndet relaterat till PRES med signal abnormitet i de bilaterala occipitala loberna.,
behandling
behandling av PRES syftar vanligtvis till att kontrollera den primära etiologin som orsakar PRES (44). Till exempel, i fall av förhöjt arteriellt tryck, är behandling som syftar till att korrigera förhöjt blodtryck i en kontrollerad miljö, liknande tillvägagångssättet för hypertensiv brådskande / akut (45). Vanligtvis försöker en icke-snabb minskning av blodtrycket för att undvika risken att orsaka ischemisk cerebral sjukdom som ett resultat av drastisk blodtryckssänkning (46)., Ibland används antikonvulsiva läkemedel som tilläggsbehandling, även om det optimala medlet, tidpunkten och behandlingstiden förblir kontroversiella (4) (Figur 11: före och efter).
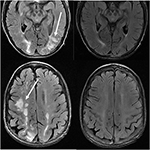
Figur 11. Patienter med anamnes på primär myelofibros och benmärgstransplantation vid takrolimus. Axial T2-FLAIR bilder visar de områden av signal abnormitet i parietala och occipital lober, och höger frontalloben (vänster bilder)., Takrolimus stoppades och uppföljningsbilderna (rätt bilder) erhölls 6 veckor efter de första bilderna.
i fall av (pre)eklampsi syftar behandlingen till tidig leverans av fostret samt blodtryckshantering och magnesiumsulfat för anfallsprofylax (47). Vid fastställandet av PRES inducerad av kemoterapeutiska eller andra immunosuppressiva medel, avsmalnande eller absolut utsättande av läkemedlet har visat både klinisk och radiologisk förbättring (48) (Figur 12: eklampsi)., Hypomagnesemi är ett vanligt fynd i PRES och en möjlig etiologisk faktor. Därför har författare föreslagit att magnesiumtillskott kan vara ett användbart tillägg i PRES management (49).
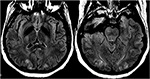
Figur 12. Patient med eklampsi och presentera med anfall. Axial T2-FLAIR-bilder visar symmetrisk signalavvikelse i de bilaterala occipitala loberna.,
slutsats
PRES är en unik enhet med karakteristiska kliniska och Neuroradiologiska fynd, förutom myriad väldokumenterade orsaker. Även om den exakta patofysiologiska mekanismen(erna) bakom PRES ännu inte har klarlagts (och faktiskt kan bero på en kombination av inbördes relaterade processer), är den allmänt accepterade mekanismen dysfunktion av blod-hjärnbarriären vilket resulterar i vasogent ödem med bakre cirkulationsprevalens., Avbildningsfunktioner utvärderas bäst på fluidkänsliga MR-sekvenser som avslöjar parieto-occipital övervägande vit materia T2 hyperintensiteter, även om många atypiska avbildningsfunktioner kan ses och bör hållas i åtanke när man utvärderar utmanande fall. Olika avancerade bildverktyg finns tillgängliga för att hjälpa till i svåra eller tvetydiga fall. Behandlingen syftar till att hantera den bakomliggande orsaken med särskild uppmärksamhet på blodtrycksövervakning och eventuell anfallsprofylax.,
författarens bidrag
intressekonflikt
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
1. Bartynski WS. Posterior reversibelt encefalopatisyndrom, Del 1: Grundläggande bildbehandling och kliniska egenskaper. Jag Heter J Neuroradiol. (2008) 29:1036–42. doi: 10.3174/ajnr.,A0928
CrossRef Full Text | Google Scholar
3. Bartynski WS. Posterior reversible encephalopathy syndrome, Part 2: controversies surrounding pathophysiology of vasogenic edema. Am J Neuroradiol. (2008) 29:1043–9. doi: 10.3174/ajnr.A0929
CrossRef Full Text | Google Scholar
5. Singer S, Grommes C, Reiner AS, Rosenblum MK, DeAngelis LM. Posterior reversible encephalopathy syndrome in patients with cancer., Oncologist. (2015) 20:806–11. doi: 10.1634/theoncologist.2014-0149
PubMed Abstract | CrossRef Full Text | Google Scholar
6. How J, Blattner M, Fowler S, Wang-Gillam A, Schindler SE. Chemotherapy-associated posterior reversible encephalopathy syndrome: a case report and review of the literature. Neurologist. (2016) 21:112–7. doi: 10.1097/NRL.,0000000000000105
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Habetz K, Ramakrishnaiah R, Raina SK, Fitzgerald RT, Hinduja A. Posterior reversible encephalopathy syndrome: a comparative study of pediatric versus adult patients. Pediatr Neurol. (2016) 65:45–51. doi: 10.1016/j.pediatrneurol.2016.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Fugate JE, Rabinstein AA., Posterior reversible encephalopathy syndrome: clinical and radiological manifestations, pathophysiology, and outstanding questions. Lancet Neurol. (2015) 14:914–25. doi: 10.1016/S1474-4422(15)00111-8
CrossRef Full Text | Google Scholar
9. Zama, D, Gasperini P, Berger M, Petris M, De Pasquale MD, et al. A survey on hematology-oncology pediatric AIEOP centres: the challenge of posterior reversible encephalopathy syndrome. Eur J Haematol. (2018) 100:75–82. doi: 10.1111/ejh.,12984
CrossRef Full Text | Google Scholar
12. Gupta V, Bhatia V, Khandelwal N, Singh P, Singhi P. Imaging findings in pediatric posterior reversible encephalopathy syndrome (PRES): 5 years of experience from a tertiary care center in India. J Child Neurol. (2016) 31:1166–73. doi: 10.1177/0883073816643409
PubMed Abstract | CrossRef Full Text | Google Scholar
13., Hinduja a, Habetz K, Raina s, Ramakrishnaiah R, Fitzgerald RT. prediktorer för dåligt resultat hos patienter med bakre reversibelt encefalopatisyndrom. Int J Neurosci. (2017) 127:134–44. doi: 10.3109/00207454.2016.1152966
PubMed Abstract | CrossRef Full Text | Google Scholar
15. MacKenzie ET, Strandgaard S, Graham DI, Jones JV, Harper ÄR, Farrar JK. Effekter av akut inducerad hypertoni hos katter på pial arteriolär kaliber, lokalt cerebralt blodflöde och blodhjärnbarriären. Cirk Res., (1976) 39:33–41. doi: 10.1161/01.RES.39.1.33
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bartynski WS, Zeigler Z, Spearman MP, Lin L, Shadduck RK, Lister J. Etiology of cortical and white matter lesions in Cyclosporin-A and FK-506 neurotoxicity. Am J Neuroradiol. (2001) 22:1901–14.
PubMed Abstract | Google Scholar
21. Bartynski WS, Boardman JF, Zeigler ZR, Shadduck RK, Lister J., Posterior reversible encephalopathy syndrome in infection, sepsis, and shock. Am J Neuroradiol. (2006) 27:2179–90.
PubMed Abstract | Google Scholar
22. Mayama M, Uno K, Tano S, Yoshihara M, Ukai M, Kishigami Y, et al. Incidence of posterior reversible encephalopathy syndrome in eclamptic and patients with preeclampsia with neurologic symptoms. Am J Obstet Gynecol. (2016) 215:239.e1–e5. doi: 10.1016/j.ajog.2016.02.,039
PubMed Abstract | CrossRef Full Text | Google Scholar
23. McKinney AM, Short J, Truwit CL, McKinney ZJ, Kozak OS, SantaCruz KS, et al. Posterior reversible encephalopathy syndrome: incidence of atypical regions of involvement and imaging findings. Am J Roentgenol. (2007) 189:904–12. doi: 10.2214/AJR.07.2024
PubMed Abstract | CrossRef Full Text | Google Scholar
24., de Havenon A, Joos Z, Longenecker L, Shah L, Ansari S, Digre K. Posterior reversible encephalopathy syndrome with spinal cord involvement. Neurology. (2014) 83:2002–6. doi: 10.1212/WNL.0000000000001026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Dandoy CE, Linscott LL, Davies SM, Leach JL, Myers KC, El-Bietar J, et al., Clinical utility of computed tomography and magnetic resonance imaging for diagnosis of posterior reversible encephalopathy syndrome after stem cell transplantation in children and adolescents. Biol Blood Marrow Transplant. (2015) 21:2028–32. doi: 10.1016/j.bbmt.2015.07.023
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Noda K, Fukae J, Fujishima K, Mori K, Urabe T, Hattori N, et al., Reversible cerebral vasoconstriction syndrome presenting as subarachnoid hemorrhage, reversible posterior leukoencephalopathy, and cerebral infarction. Intern Med. (2011) 50:1227–33. doi: 10.2169/internalmedicine.50.4812
CrossRef Full Text | Google Scholar
31. Doelken M, Lanz S, Rennert J, Alibek S, Richter G, Doerfler A, et al. Differentiation of cytotoxic and vasogenic edema in a patient with reversible posterior leukoencephalopathy syndrome using diffusion-weighted MRI. Diagn Interv Radiol., (2007) 13:125–8.
Google Scholar
32. Wartenberg KE, Parra A. CT and CT-perfusion findings of reversible leukoencephalopathy during triple-H therapy for symptomatic subarachnoid hemorrhage-related vasospasm. J Neuroimaging. (2006) 16:170–5. doi: 10.1111/j.1552-6569.2006.00031.x
CrossRef Full Text | Google Scholar
33. Vanacker P, Matias G, Hagmann P, Michel P., Cerebral hypoperfusion in posterior reversible encephalopathy syndrome is different from transient ischemic attack on CT perfusion. J Neuroimaging. (2015) 25:643–6. doi: 10.1111/jon.12158
CrossRef Full Text | Google Scholar
34. Lee SY, Kim SH, Lee SH, Baek HJ, Shon HS, Kim SS. Serial MR spectroscopy in relapsing reversible posterior leukoencephalopathy syndrome. Neurologist. (2009) 15:338–41. doi: 10.1097/NRL.,0b013e3181914af6
PubMed Abstract | CrossRef Full Text | Google Scholar
35. McKinney AM, Sarikaya B, Gustafson C, Truwit CL. Detection of microhemorrhage in posterior reversible encephalopathy syndrome using susceptibility-weighted imaging. Am J Neuroradiol. (2012) 33:896–903. doi: 10.3174/ajnr.A2886
PubMed Abstract | CrossRef Full Text | Google Scholar
38., Berger JR, Aksamit AJ, Clifford DB, Davis L, Koralnik IJ, Sejvar JJ, et al. PML diagnostiska kriterier: konsensus uttalande från aan neuroinfectious disease avsnitt. Neurology. (2013) 80:1430-8. doi: 10.1212/WNL.0b013e31828c2fa1
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Aracki-Trenkić Och Stojanov D, Trenkić M, Radovanovic Z, Ignjatovic J, Ristic S, et al., Atypical presentation of posterior reversible encephalopathy syndrome: clinical and radiological characteristics in eclamptic patients. Bosn J Basic Med Sci. (2016) 16:180–6. doi: 10.17305/bjbms.2016.1201
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Bartynski WS, Boardman JF. Distinct imaging patterns and lesion distribution in posterior reversible encephalopathy syndrome. Am J Neuroradiol. (2007) 28:1320–7. doi: 10.3174/ajnr.,A0549
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Brickman AM, Reitz C, Luchsinger JA, Manly JJ, Schupf N, Muraskin J, et al. Long-term blood pressure fluctuation and cerebrovascular disease in an elderly cohort. Arch Neurol. (2010) 67:564–9. doi: 10.1001/archneurol.2010.70
PubMed Abstract | CrossRef Full Text | Google Scholar
47., Cozzolino M, Bianchi C, Mariani G, Marchi L, Fambrini M, Mecacci F. Therapy and differential diagnosis of posterior reversible encephalopathy syndrome (PRES) during pregnancy and postpartum. Arch Gynecol Obstet. (2015) 292:1217–23. doi: 10.1007/s00404-015-3800-4
PubMed Abstract | CrossRef Full Text | Google Scholar
48. Masetti R, Cordelli DM, Zama D, Vendemini F, Biagi C, Franzoni E, et al. PRES in children undergoing hematopoietic stem cell or solid organ transplantation. Pediatrics., (2015) 135:890–901. doi: 10.1542/peds.2014-2325
CrossRef Full Text | Google Scholar