april 13, 2017, av NCI personal
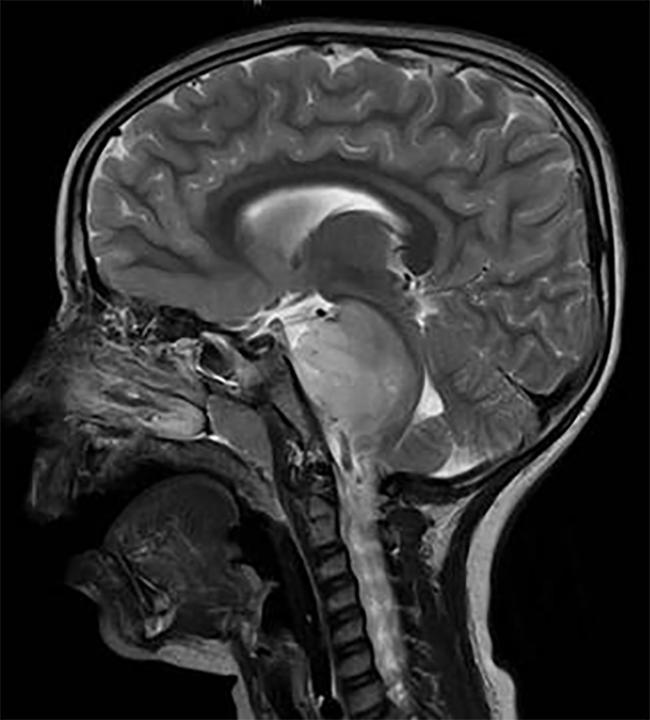
hjärnskanning av ett barn med en DIPG-tumör, som ligger i hjärnstammen.
Kredit: Rishi Lulla, M. D.,, Northwestern University Feinberg School of Medicine och Lurie Children ’ s Hospital of Chicago
två separata studier har identifierat potentiella terapeutiska mål i en inoperabel pediatrisk hjärntumör, diffus inneboende Pontin gliom (DIPG). Blockering av dessa mål med undersökande läkemedel saktade tumörtillväxt i djurmodeller av DIPG.
DIPG, en tumör som ligger i hjärnstammen, är nästan likformigt dödlig.,
”Som en pediatrisk neurooncologist, det är en av de mest förödande tumörer vi se,” sade Pratiti Bandopadhayay, M. B. B. S., Ph D., av Dana-Farber/Boston Children”s Cancer och blodsjukdomar Center, som inte var involverade i studierna. ”Vi har inga läkande behandlingar alls för dessa tumörer.”
medan majoriteten av DIPG-tumörer bär en specifik genetisk mutation, var det tidigare oklart vilken roll, om någon, det mutanta proteinet spelar i tumörutveckling och huruvida dess funktion kan riktas mot terapier.,
för båda nya studier undersökte forskargrupperna biologin hos mänskliga DIPG-celler med denna mutation och identifierade egenskaper som kan göra dem sårbara för behandling. Jämfört med kontrollbehandlingar fann de, läkemedel som kallas PRC2 och BET-hämmare krympte DIPG-tumörer i musmodeller och förlängde mössens liv.
resultaten av båda studierna, en från en forskargrupp vid Northwestern University och en annan från en grupp vid Köpenhamns universitet i Danmark, publicerades 27 februari i naturmedicin.,
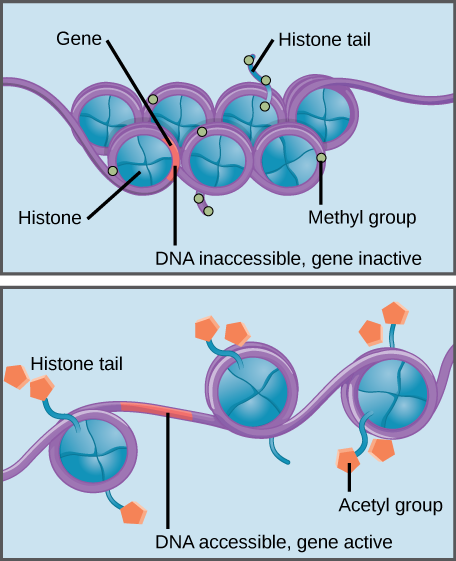
Histonmetylation stärker Histon–DNA-interaktionen, vilket gör associerade gener otillgängliga för genuttryck (inaktiv). Histonacetylation försvagar interaktionen, vilket gör associerade gener tillgängliga för genuttryck (aktiv).
identifiera ett mål
cirka 5 år sedan, forskare som arbetar på St., Jude–Washington University Barn Cancer Genome Project upptäckte att nästan 80% av DIPG tumörer har en viss mutation i genen för ett protein som kallas histon H3.
Att en så hög andel av tumörer har samma mutation kom som en överraskning för DIPG forskning, säger Ali Shilatifard, Ph D., från Northwestern University Feinberg School of Medicine, leda utredare för en av studierna.
histoner är en familj av proteiner som hjälper till att paketera DNA i kompakta strukturer., Korta delar av DNA vind runt histonproteiner som tråd på en spole, och tusentals DNA-inslagna histoner (kallas nukleosomer) utgör varje kromosom.
specifika modifieringar av histoner kan främja eller förhindra genuttryck. Till exempel försvagar bindningen av kemiska föreningar som kallas acetylgrupper till histoner deras interaktion med DNA, vilket främjar genuttryck. Å andra sidan gör tillsatsen av metylgrupper till histoner vanligtvis DNA-vind tätare runt histoner, vilket förhindrar genuttryck.,
identifiera förekomsten av en Histon H3 mutation hos patienter med DIPG var det första steget, sade Dr.Bandopadhayay. ”Men för att kunna behandla tumörer med den förändringen måste du förstå vad mutationen gör”, tillade hon.
i en tidigare studie använde Dr. Shilatifard och hans kollegor fruktflugor för att studera funktionen hos mutanthistone H3-genen. Jämfört med flugor som hade normal Histon H3 proteiner, flugor med den mutanta versionen hade fler histoner som var översållad med acetylgrupper (acetylerade)., I sin tur var dessa acetylerade histoner bundna av molekyler som kallas bromodomain-innehållande (BRD) proteiner, som reglerar genuttryck.
för sin nuvarande studie, som delvis finansierades av NCI, ville de nordvästra forskarna bestämma om mutanthistonen hade samma funktion i mänskliga celler. Faktum är att de fann att Human tjocktarmscancer eller njurcancerceller förändrade för att uttrycka den muterade Histon H3-genen hade mer acetylerade histoner än celler som uttryckte den normala Histon H3-genen.
Den första författaren, Andrea Piunti, Ph D., sedan undersökte alla mutant H3 histoner ligger hela arvsmassan hos DIPG tumörceller från tre patienter. Hans analys visade att många nukleosomer som innehöll mutanthistoner var acetylerade och bundna av BRD-proteiner.
Ytterligare experiment visade att BRD proteiner kan spela en direkt roll i DIPG tumör tillväxt. Behandling av humana DIPG-celler med undersökande läkemedel som blockerar BRD-proteiner, kallade BET-hämmare, saktade DIPG-celltillväxt jämfört med en kontrollbehandling., Och i studier av möss med humana DIPG-celler implanterade i deras hjärnstammar hade de som behandlades med BET-hämmare mindre tumörer och levde längre än möss som behandlades med kontrollbehandlingen.
dessa experiment ”tyder på att BET-hämmare ger ett potentiellt terapeutiskt tillvägagångssätt för DIPG”, säger Dr.Shilatifard. Prekliniska studier har visat att flera olika cancertyper—inklusive leukemi och glioblastom-också är känsliga för BET-hämmare, tillade han.,
ett ytterligare mål
den nordvästra gruppen”s analys av humana DIPG tumörceller med mutant Histon H3 visade också att förutom mer Histon H3 acetylering, många histoner var dekorerad med metylgrupper (metylerad). Dessutom fann de att ett enzym som kallas PRC2—som fäster metylgrupper till histon H3 proteiner—var närvarande nära många av dessa histoner.
dessa resultat fick de nordvästra forskarna att undersöka PRC2-aktiviteten ytterligare., De fann att blockera PRC2 aktivitet—antingen genetiskt eller med en PRC2 hämmare som kallas tazemetostat—minskad DIPG celltillväxt.
”oväntat visar dessa resultat en roll för PRC2-funktionen vid upprätthållandet av DIPG-tillväxt”, skrev den nordvästra gruppen.
Köpenhamnsgruppen fann också bevis som stödde PRC2: s roll för att främja DIPG-tumörtillväxt. De observerade att tazemetostat och en annan PRC2-hämmare minskade tillväxten av mushjärnceller eller humana DIPG-celler med mutanthistoner, medan kontrollbehandlingen inte gjorde det.,
och när de implanterade mushjärnceller med mutanthistoner i hjärnan hos normala möss eller möss där PRC2 var genetiskt blockerad, levde de som saknade PRC2-aktivitet längre.
däremot fann en separat studie av en forskargrupp i Tyskland att celler från olika patienter med DIPG inte var känsliga för tazemetostat, även om deras tumörer hade Histon H3-mutationen.
ett steg framåt
årtionden av kliniska prövningar har visat att DIPG-tumörer är okänsliga för traditionell kemoterapi, förklarade Dr.Bandopadhayay., Och även om strålning kan lindra symtom, är det inte botande, och de flesta barn med DIPG dör inom 2 års diagnos.
i 2015 bandade ett internationellt konsortium av DIPG-forskare tillsammans för att studera alla tillgängliga DIPG-cellprover. Deras studie visade att DIPG celler som samlats in från flera olika patienter dödades av en histon-bromsmedicin kallas panobinostat (Farydak®). Panobinostat blockerar enzymer som tillför acetylgrupper till histoner., Nu testar forskare, som ingår i NCI-stödda pediatriska Hjärntumörkonsortiet, säkerheten och bästa dosen av panobinostat för barn med DIPG i en klinisk fas I-studie.
Nu resultat från båda studierna pekar på potentiellt lovande nya behandlingsstrategier, sa Dr. Shilatifard.
”vi vill flytta BET-hämmare till en fas I-studie för behandling av DIPG, och våra kollegor på Ann & Robert H. Lurie Children” s Hospital of Chicago driver framåt med dessa studier, ” sa han.,
dessutom testar flera pågående kliniska studier tazemetostat, PRC2-hämmaren, hos både vuxna och barn med olika cancerformer. Ingen aktuell studie undersöker emellertid specifikt tazemetostat hos barn med DIPG.
det finns fortfarande många obesvarade frågor, säger Dr. Bandopadhayay, inklusive om dessa prövningsläkemedel har förmågan att korsa blod–hjärnbarriären och nå mänskliga hjärntumörer.
dr., Bandopadhayay och hennes kollegor lär sig också mer om DIPG-biologi genom att studera tumörceller erhållna från biopsier, förutom de som erhållits från obduktioner. Att få biopsiprover har möjliggjorts först nyligen genom stora förbättringar i neurokirurgiska tekniker, förklarade hon.
”det är en spännande tid”, sa hon. Det pågår mycket arbete just nu. Det slutliga målet är att kunna behandla dessa barn så att de har en chans att bota med minimala biverkningar.”